
Svara på frågorna: 1. Hur många atomer består varje inert gasmolekyl av? 2. Tänk på etymologin för namnet "inerta gaser". 3. Vad är deras andra namn? 4. Vilken är bäst lämpad för inerta gaser? från läroboken



Att använda neon Neon är den mest effektiva typen av utomhusreklam. Neonskyltar och ljuslådor är populära över hela världen. Ett glasrör fyllt med neon eller argon, inbyggt i ljuslådorna och används i kombination med ett tecken eller bokstav, gör den upplysta annonsen mer synlig, effektiv och effektiv.


Allotropi är förmågan hos vissa CE: er att bilda flera enkla ämnen som skiljer sig åt i struktur och egenskaper. C - diamant, grafit, fulleren. O - syre, ozon. S - rombisk, monoklinisk, plast. P - vit, röd, svart. Fenomenet allotropi orsakas av två skäl: 1) ett annat antal atomer i en molekyl, till exempel syre O2 och ozon O3. 2) bildandet av olika kristallina former, såsom diamant och grafit.



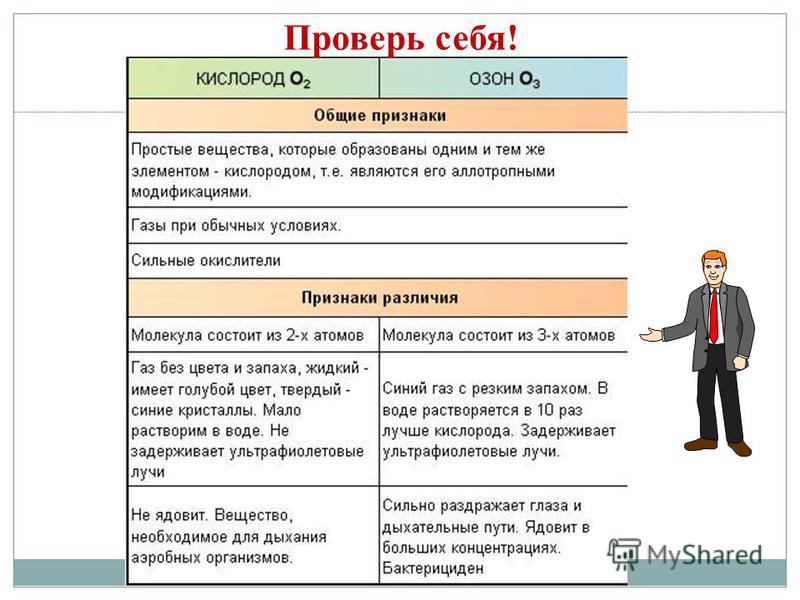






I listan väljer du de egenskaper som är karaktäristiska för diamant och grafit: 1. transparent kristallint ämne 2. leder värme och ström 3. har en mycket stark lyster 4. mörkgrå, oljig vid beröring kristallin substans 5. den hårdaste av alla naturliga ämnen 6. leder inte värme och ström 7. exfolierar i flingor 8. har en metallisk glans
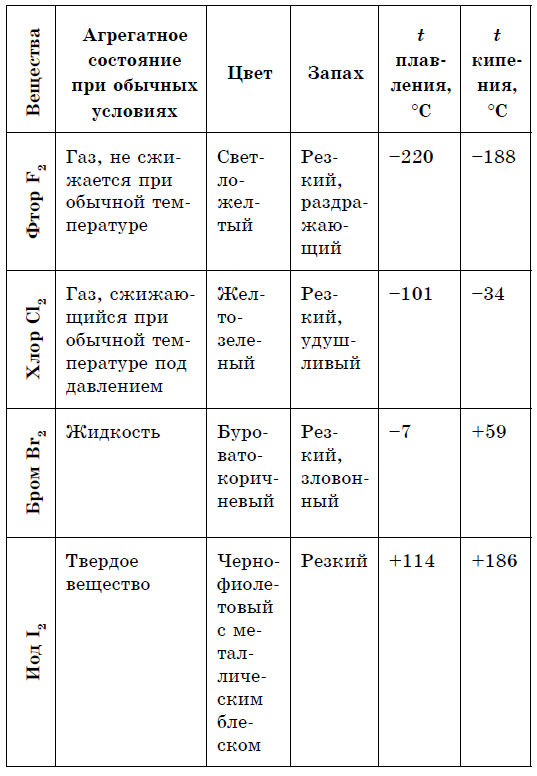
 Metaller Icke-metaller 1. Torrsubstanser (utom kvicksilver Hg) 1, fast (svavel S, fosforröd och fosforvit P4, jod I2, diamant och grafit C), gasformiga ämnen (syre O 2, ozon O 3, kväve N 2 , väte H2, klor C2, fluor F2, ädelgaser) och vätska (brom Br2) 2. De har en metallisk glans 2. De har ingen metallisk glans (undantaget är jod I 2, grafit C) 3. Elektriskt och värmeledande 3. De flesta leder inte elektrisk ström (ledare är till exempel kisel, grafit) 4. Duktilt, duktilt, visköst 4. I fast tillstånd, sprött Enkla ämnen:
Metaller Icke-metaller 1. Torrsubstanser (utom kvicksilver Hg) 1, fast (svavel S, fosforröd och fosforvit P4, jod I2, diamant och grafit C), gasformiga ämnen (syre O 2, ozon O 3, kväve N 2 , väte H2, klor C2, fluor F2, ädelgaser) och vätska (brom Br2) 2. De har en metallisk glans 2. De har ingen metallisk glans (undantaget är jod I 2, grafit C) 3. Elektriskt och värmeledande 3. De flesta leder inte elektrisk ström (ledare är till exempel kisel, grafit) 4. Duktilt, duktilt, visköst 4. I fast tillstånd, sprött Enkla ämnen:
![]()
Svara på frågorna Vad är allotropi? Ge en definition av allotropa modifieringar. Vad orsakade fenomenet allotropi? Vad är en av anledningarna till ämnens mångfald? Varför är det poetiska uttrycket "Luften luktade som en åskväder" kemiskt felaktigt? Varför är indelningen i metaller och icke-metaller relativ? Varför är indelningen i metaller och icke-metaller relativ?


Kemiska element - icke-metaller
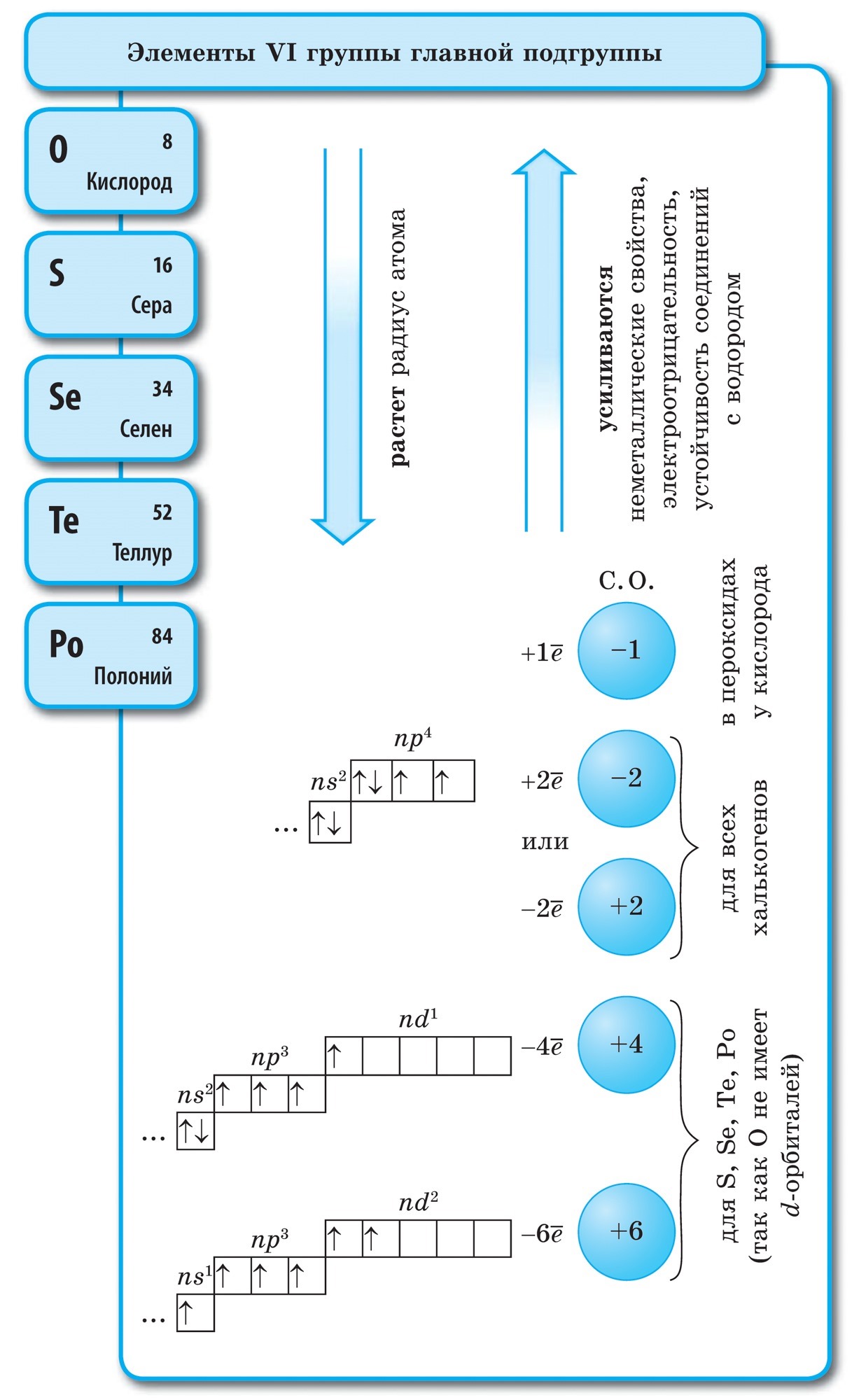
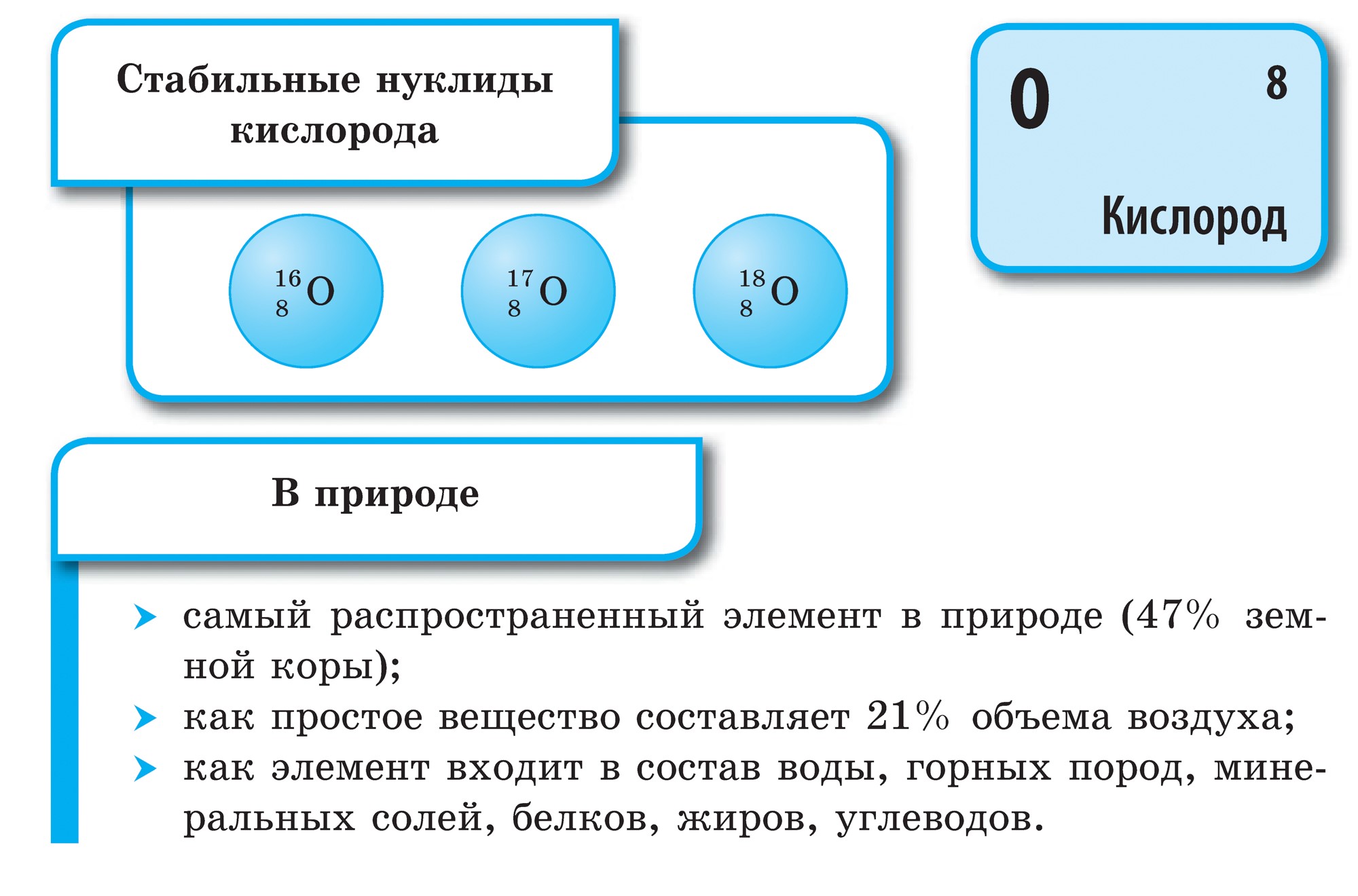
Det finns bara 16 icke-metalliska kemiska element, men två av dem, syre och kisel, utgör 76% av massan av jordskorpan. Icke-metaller utgör 98,5% av växternas massa och 97,6% av människans massa. Alla de viktigaste organiska ämnena är gjorda av kol, väte, syre, svavel, fosfor och kväve, de är livets element. Väte och helium är huvudelementen i universum, alla rymdobjekt, inklusive vår sol, är gjorda av dem. Det är omöjligt att föreställa oss vårt liv utan föreningar av icke-metaller, särskilt om vi kommer ihåg att det är viktigt kemisk förening - vatten - består av väte och syre.
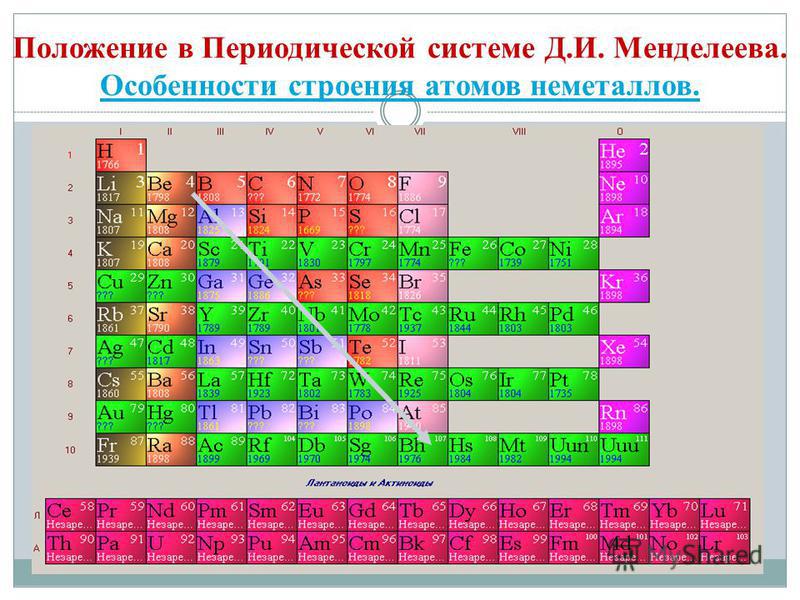
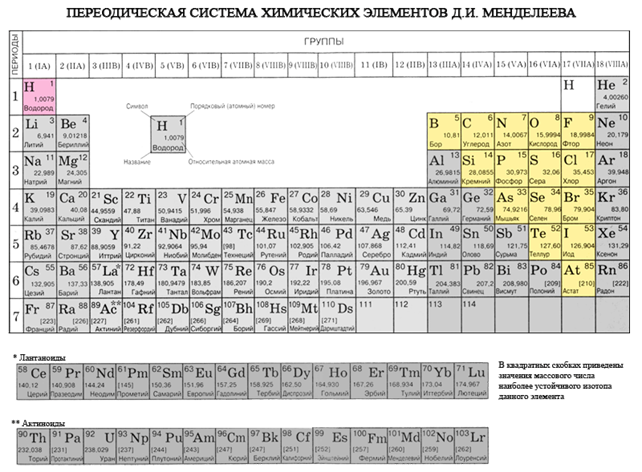
Om vi \u200b\u200bi det periodiska systemet ritar en diagonal från beryllium till astatin, kommer höger uppåt längs diagonalen att finnas icke-metalliska element och längst ner till vänster - metaller, dessa inkluderar också element i alla sidoundergrupper, lantanider och aktinider. Element som ligger nära diagonalen, till exempel beryllium, aluminium, titan, germanium, antimon, har en dubbel karaktär och tillhör metalloider. Icke-metalliska element: s-element - väte; p-element i grupp 13 - bor; 14 grupper - kol och kisel; 15 grupper - kväve, fosfor och arsenik, 16 grupper - syre, svavel, selen och tellur och alla delar av grupp 17 - fluor, klor, brom, jod och astatin... Element i grupp 18 - inerta gaser, intar en speciell position, de har ett fullständigt färdigt yttre elektronskikt och intar en mellanposition mellan metaller och icke-metaller. De kallas ibland icke-metaller, men formellt enligt fysiska egenskaper.
Icke-metaller - det här kemiska elementvars atomer accepterar elektroner för att slutföra den externa energinivån, samtidigt som de bildar negativt laddade joner.
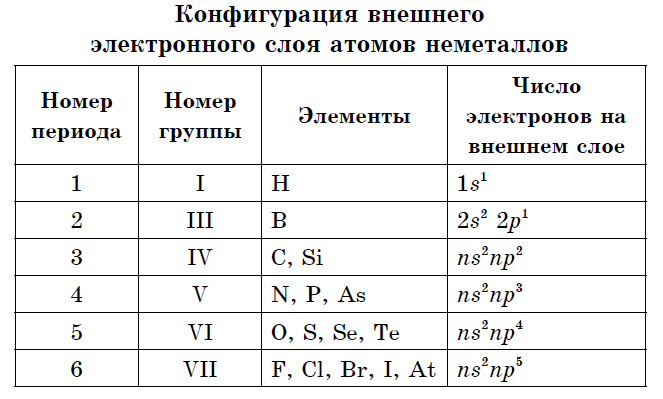
Det yttre elektronskiktet av icke-metallatomer innehåller från tre till åtta elektroner.
Nästan alla icke-metaller har relativt små radier och ett stort antal elektroner vid den externa energinivån från 4 till 7; de kännetecknas av höga värden för elektronegativitet och oxiderande egenskaper. Därför, i jämförelse med metallatomer, kännetecknas icke-metaller av:
· Mindre atomradie;
· Fyra eller flera elektroner på den externa energinivån;
Följaktligen är en sådan viktig egenskap hos icke-metalliska atomer tendensen att acceptera saknade upp till 8 elektroner, d.v.s. oxiderande egenskaper. En kvalitativ egenskap hos icke-metalliska atomer, dvs. Elektronegativitet kan fungera som ett slags mått på deras icke-metallicitet, dvs. egenskapen hos atomer av kemiska element för att polarisera en kemisk bindning, för att dra bort vanliga elektronpar;
Den allra första vetenskapliga klassificeringen av kemiska element var deras uppdelning i metaller och icke-metaller. Denna klassificering har för närvarande inte tappat sin betydelse. Icke-metaller är kemiska element vars atomer kännetecknas av förmågan att acceptera elektroner tills det yttre skiktet är färdigt på grund av närvaron som regel av fyra eller flera elektroner på det yttre elektronskiktet och den lilla radien av atomer jämfört med metallatomer.
Denna definition lämnar elementen i grupp VIII i huvudundergruppen åt sidan - inerta eller ädla gaser vars atomer har ett fullständigt yttre elektronskikt. Den elektroniska konfigurationen av dessa elementers atomer är sådan att de inte kan tillskrivas vare sig metaller eller icke-metaller. De är föremålen som separerar elementen i metaller och icke-metaller och upptar en gränsposition mellan dem. Inerta eller ädla gaser ("adel" uttrycks i tröghet) kallas ibland icke-metaller, men endast formellt enligt fysiska egenskaper. Dessa ämnen förblir gasformiga till mycket låga temperaturer. Så helium förvandlas inte till flytande tillstånd vid t ° \u003d -268,9 ° C.
De kemiska trögheten hos dessa element är relativt. För xenon och krypton är föreningar med fluor och syre kända: KrF2, XeF2, XeF4, etc. Utan tvekan spelade inerta gaser rollen som reduktionsmedel vid bildandet av dessa föreningar. Från definitionen av icke-metaller följer att deras atomer kännetecknas av höga värden för elektronegativitet. Det varierar från 2 till 4. Icke-metaller är element i huvudundergrupperna, främst p-element, med undantag av väte - s-element.
Alla icke-metalliska element (utom väte) upptar det övre högra hörnet i det periodiska systemet för kemiska element av D. I. Mendeleev och bildar en triangel vars topp är fluor F och basen är diagonalen B - At. Men särskild uppmärksamhet bör ägnas vätens dubbla position i det periodiska systemet: i huvudundergrupperna av grupperna I och VII. Detta är ingen slump. Å ena sidan har en väteatom, som alkalimetallatomer, en elektron (1s 1 elektronisk konfiguration) på det yttre (och endast för det) elektronskiktet, som det kan donera, och uppvisar egenskaperna hos ett reduktionsmedel.
I de flesta av dess föreningar uppvisar väte, som alkalimetaller, ett oxidationstillstånd på +1. Men retur av en elektron av en väteatom är svårare än för alkalimetallatomer. Å andra sidan saknar väteatomen, som halogenatomer, en elektron för att komplettera det yttre elektronskiktet, så väteatomen kan acceptera en elektron och uppvisar egenskaperna hos ett oxidationsmedel och oxidationstillståndet som är karaktäristiskt för halogen -1 i hydrider (föreningar med metaller, som metallföreningar med halogener - halider). Men fästningen av en elektron till en väteatom är svårare än med halogener.
När normala förhållanden väte H2 - gas. Dess molekyl, liksom halogener, är diatomisk. Atomer av icke-metaller domineras av oxiderande egenskaper, det vill säga förmågan att fästa elektroner. Denna förmåga kännetecknas av värdet av elektronegativitet, som regelbundet förändras i perioder och undergrupper. Fluor är det mest kraftfulla oxidationsmedlet, dess atomer i kemiska reaktioner kan inte donera elektroner, det vill säga uppvisa reducerande egenskaper. Andra icke-metaller kan uppvisa reducerande egenskaper, om än i mycket svagare grad än metaller; i perioder och undergrupper förändras deras reduktionsförmåga i omvänd ordning jämfört med den oxidativa.
- Icke-metalliska element finns i huvudundergrupperna III - VIII i grupperna PS D.I. Mendeleev, upptar sitt övre högra hörn.
- På det yttre elektronskiktet av atomer av icke-metalliska element finns det från 3 till 8 elektroner.
- Elementens icke-metalliska egenskaper ökar i perioder och försvagas i undergrupper med en ökning av elementets ordinarie antal.
- Högre syreföreningar av icke-metaller är sura (sura oxider och hydroxider).
- Atomer av icke-metalliska element kan både acceptera elektroner, uppvisa oxidativa funktioner och ge bort dem, uppvisa reduktiva funktioner.
Struktur och fysikaliska egenskaper hos icke-metaller
I enkla ämnen är atomerna för icke-metaller bundna kovalent icke-polär bindning... Som ett resultat bildas ett mer stabilt elektroniskt system än hos isolerade atomer. I detta fall bildas enkla (till exempel i vätemolekyler H2, halogener F2, Br2, I2), dubbla (till exempel i svavelmolekyler S2), tredubbla (till exempel i kvävemolekyler N2).
- Ingen smidighet
- Ingen glans
- Värmeledningsförmåga (endast grafit)
- Varierad färg: gul, gulgrön, rödbrun.
- Elektrisk ledningsförmåga (endast grafit och svart fosfor.)
Aggregationstillstånd:
- vätska - Br2;
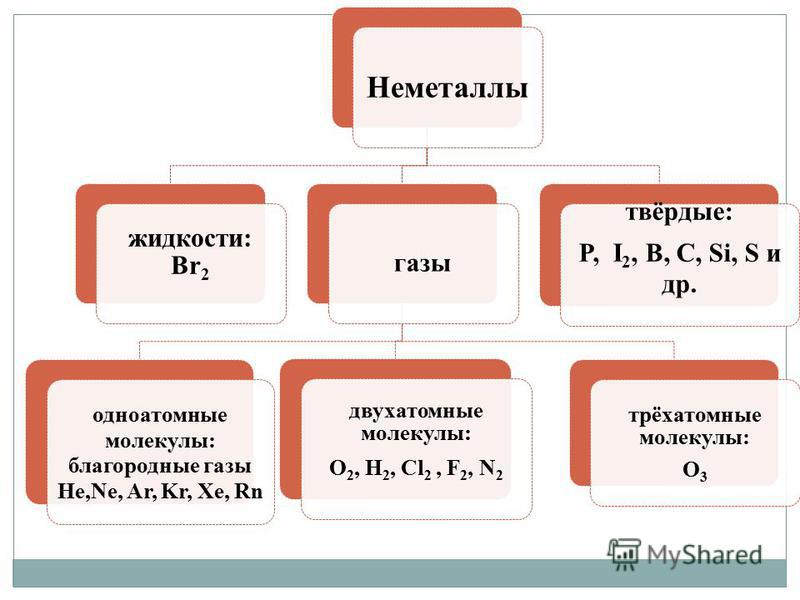
Till skillnad från metaller, icke-metaller - enkla ämnen, kännetecknas av en mängd olika egenskaper. Icke-metaller har ett annat tillstånd av aggregering under normala förhållanden:
- gaser - H2, O2, O3, N2, F2, Cl2;
- vätska - Br2;
- fasta ämnen - modifieringar av svavel, fosfor, kisel, kol, etc.
Färgspektrumet är mycket rikare på icke-metaller: röd - i fosfor, rödbrun - i brom, gul - i svavel, gulgrön - i klor, violett - i jodånga. Element - icke-metaller är mer kapabla för allotropi jämfört med metaller.
Atoms förmåga hos ett kemiskt element att bilda flera enkla ämnen kallas allotropi, och dessa enkla ämnen kallas allotropa modifieringar.
Enkla ämnen - icke-metaller kan ha:
1. Molekylär struktur. Under normala förhållanden är de flesta av dessa ämnen gaser (H2, N2, O2, F2, Cl2, O3) eller fasta ämnen (I2, P4, S8) och endast en enda brom (Br 2) är flytande. Alla dessa ämnen har en molekylär struktur, därför är de flyktiga. I fast tillstånd är de smältbara på grund av den svaga intermolekylära interaktionen som håller deras molekyler i kristallen och kan sublimera.
2. Atomstruktur.Dessa ämnen bildas av långa kedjor av atomer (Cn, Bn, Sin, Sen, Ten). På grund av den höga hållfastheten hos kovalenta bindningar har de som regel en hög hårdhet och alla förändringar associerade med förstörelsen av den kovalenta bindningen i deras kristaller (smältning, avdunstning) utförs med stora energikostnader. Många av dessa ämnen har höga smält- och kokpunkter, och deras flyktighet är mycket låg.
Många icke-metalliska element bildar flera enkla ämnen - allotropa modifieringar... Denna egenskap hos atomer kallas allotropi. Allotropi kan associeras med en annan sammansättning av molekyler (O 2, O 3) och med en annan struktur av kristaller. Allotropa modifieringar av kol är grafit, diamant, karbyne, fulleren. För att identifiera egenskaper som är karakteristiska för alla icke-metaller måste man vara uppmärksam på deras placering i det periodiska elementet och bestämma konfigurationen för det yttre elektronskiktet.
Under perioden:
- kärnkraftsladdningen ökar;
- atomens radie minskar;
- antalet elektroner i det yttre lagret ökar;
- elektronegativiteten ökar;
- oxiderande egenskaper förbättras;
- icke-metalliska egenskaper förbättras.
I huvudundergruppen:
- kärnkraftsladdningen ökar;
- atomens radie ökar;
- antalet elektroner på det yttre lagret ändras inte;
- elektronegativitet minskar;
- oxiderande egenskaper försvagas;
- icke-metalliska egenskaper försvagas.
För de flesta metaller, med sällsynta undantag (guld, koppar och andra), är en silvervit färg karakteristisk. Men för enkla ämnen - icke-metaller, är utbudet av färger mycket mer varierande: P, Se - gul; B - brun; 02 (g) - blå; Si, As (met) - grå; P 4 - blekgul; I - violett-svart med en metallisk glans; Br 2 (g) - brun vätska; C1 2 (g) - gulgrön; F 2 (r) - ljusgrön; S 8 (TV) - gul. Kristaller av icke-metaller är icke-plastiska, och eventuell deformation orsakar förstörelse av kovalenta bindningar. De flesta icke-metaller har ingen metallisk glans.

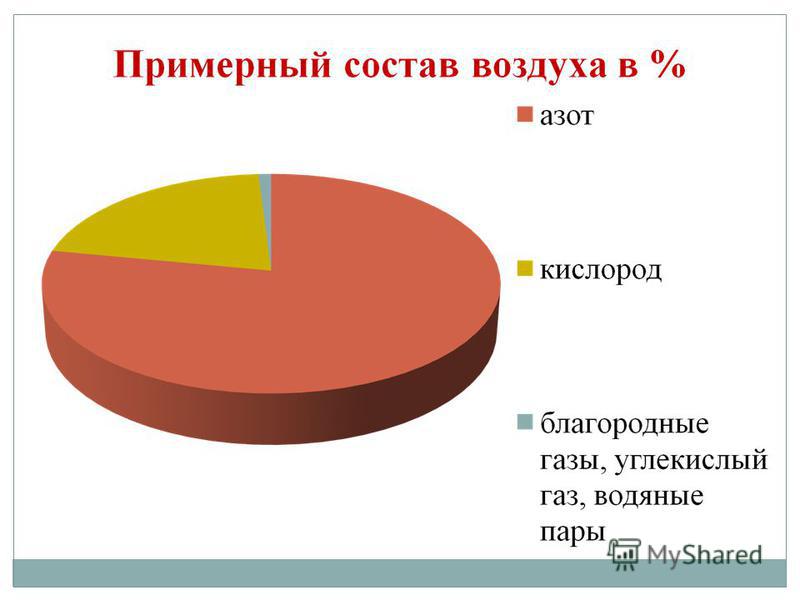
Det finns bara 16 kemiska element som inte är metall! Inte mycket när man tänker på att det finns 114 kända element. Två icke-metalliska element utgör 76% av jordskorpans massa. Dessa är syre (49%) och kisel (27%). Atmosfären innehåller 0,03% av massan av syre i jordskorpan. Icke-metaller utgör 98,5% av växternas massa, 97,6% av den mänskliga kroppens massa. Icke-metaller C, H, O, N, S är biogena element som bildar de viktigaste organiska substanserna i en levande cell: proteiner, fetter, kolhydrater, nukleinsyror. Luften vi andas består av enkel och komplexa ämnen, även bildad av icke-metalliska element (syre O2, kväve N2, koldioxid CO 2, vattenånga H2O, etc.)
Oxiderande egenskaper hos enkla ämnen - icke-metaller
För atomer av icke-metaller, och därför, för de enkla ämnen som bildas av dem, karakteriseras de som oxidativoch stärkande egenskaper.
1. Oxiderande egenskaper hos icke-metaller visas först och främst vid interaktion med metaller (metaller är alltid reduktionsmedel):

De oxiderande egenskaperna för klor Cl2 är mer uttalade än för svavel, därför oxideras metallen Fe, som har stabila oxidationstillstånd på +2 och +3 i föreningarna, till ett högre oxidationstillstånd.
1. De flesta icke-metaller uppvisar oxiderande egenskaper vid interaktion med väte... Som ett resultat bildas flyktiga väteföreningar.
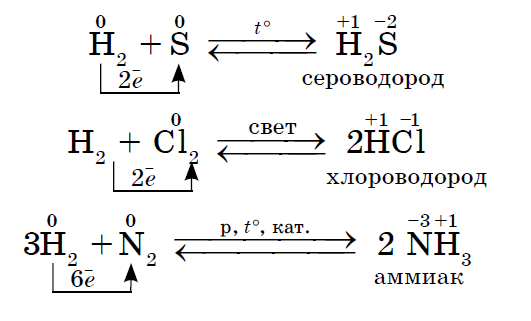
2. Varje icke-metall fungerar som ett oxidationsmedel i reaktioner med de icke-metaller som har ett lägre elektronegativitetsvärde:
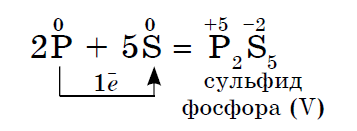
Svavelens elektronegativitet är större än för fosfor, så det uppvisar oxiderande egenskaper här.
Elektronegativiteten för fluor är större än för alla andra kemiska element, därför uppvisar den egenskaperna hos ett oxidationsmedel. Fluor F2 är det starkaste oxidationsmedlet bland icke-metaller och uppvisar endast oxidationsegenskaper i reaktioner.
3. Icke-metaller uppvisar också oxiderande egenskaper i reaktioner med vissa komplexa ämnen..
Låt oss först notera de oxiderande egenskaperna hos det icke-metalliska syret i reaktioner med komplexa ämnen:
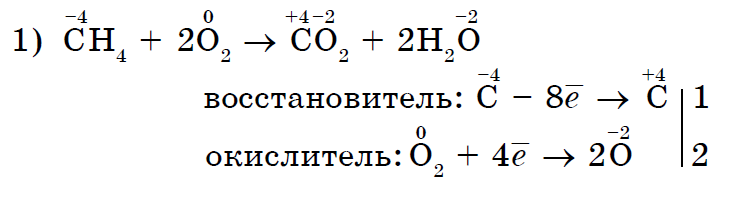
Inte bara syre utan även andra icke-metaller kan också vara oxidationsmedel vid reaktioner med komplexa ämnen- oorganisk (1, 2) och organisk (3, 4):
Det starka oxidationsmedlet klor Cl2 oxiderar järn (II) klorid till järn (III) klorid;
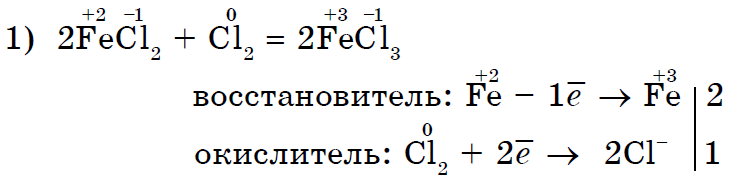
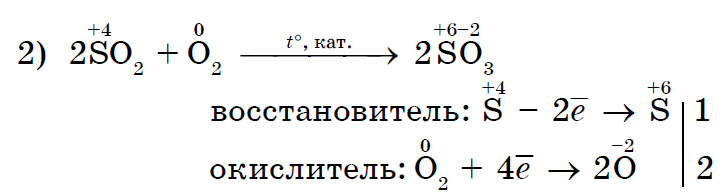
Klor Cl2 som en starkare oxidant förskjuter jod I2 i fri form från kaliumjodidlösningen;
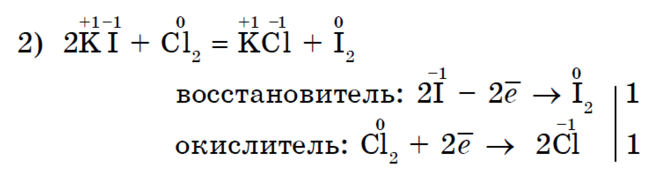
Metanhalogenering är en karakteristisk reaktion för alkaner;
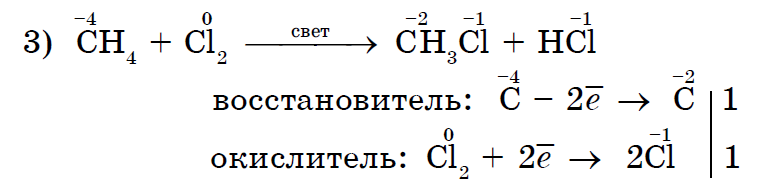
En kvalitativ reaktion på omättade föreningar är deras missfärgning av bromvatten.
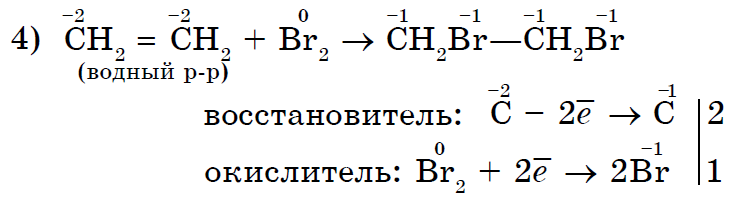
Minskande egenskaper hos enkla ämnen - icke-metaller
Genom att revidera reaktioner av icke-metaller med varandra, att beroende på värdet av deras elektronegativitet uppvisar en av dem egenskaperna hos ett oxidationsmedel, och den andra - egenskaperna hos ett reduktionsmedel.
1. I förhållande till fluor uppvisar alla icke-metaller (även syre) reducerande egenskaper.
2. Naturligtvis fungerar icke-metaller, förutom fluor, som reduktionsmedel vid interaktion med syre.

Som ett resultat av reaktionerna, icke-metalloxider: icke-saltbildande och saltbildande sura. Och även om halogener inte kombineras direkt med syre, är deras oxider kända: Cl 2 + 1 O -2, Cl 2 + 4 O 2 -2, Cl 2 +7 O 7 -2, Br 2 + 1 O -2, Br + 4 O2 -2, I2 +5O5-2, och andra, som erhålls indirekt.
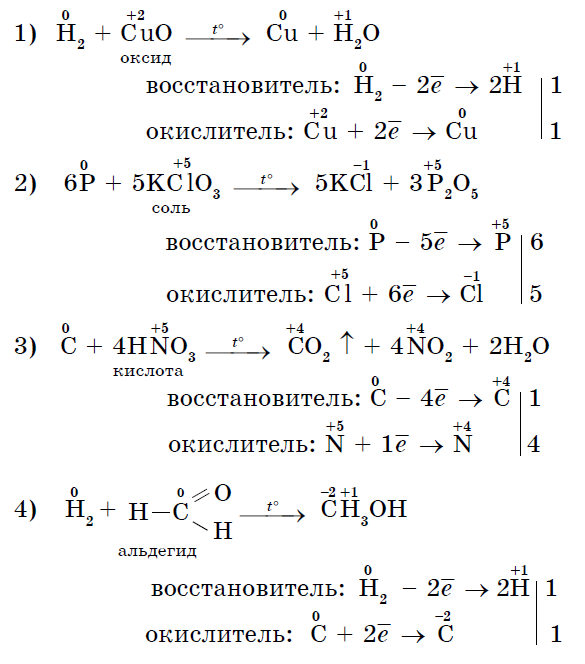
3. Många icke-metaller kan fungera som reduktionsmedel vid reaktioner med komplexa ämnen - oxidationsmedel:
Det finns också sådana reaktioner där en och samma icke-metall både är ett oxidationsmedel och ett reduktionsmedel. Dessa är självoxiderande-självläkande (oproportionerliga) reaktioner:
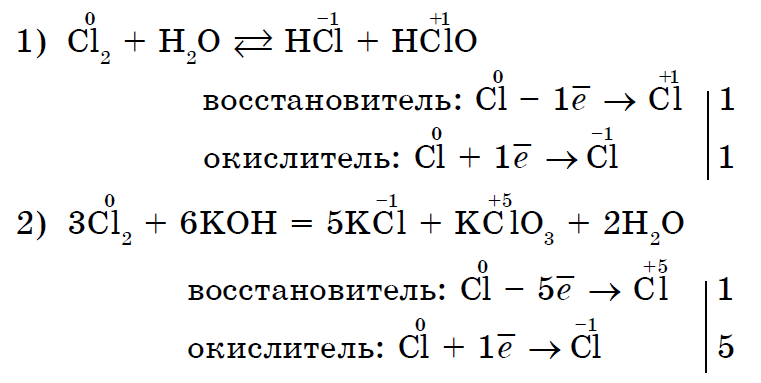
Således kan de flesta icke-metaller prestera i kemiska reaktioner både som ett oxidationsmedel och som ett reduktionsmedel (reducerande egenskaper är inte endast inneboende i fluor F2).
Väteföreningar av icke-metaller
Till skillnad från metaller bildar icke-metaller gasformiga väteföreningar. Deras sammansättning beror på oxidationstillståndet för icke-metaller.
RH4 → RH3 → H2R → HR
En gemensam egendom för alla icke-metaller är bildandet av flyktiga väteföreningar, i vilka de flesta icke-metallen har det lägsta oxidationstillståndet. Bland de givna formlerna av ämnen finns det många sådana vars egenskaper, tillämpning och beredning du har studerat tidigare: CH4, NH3, H2O, H2S, HCl.
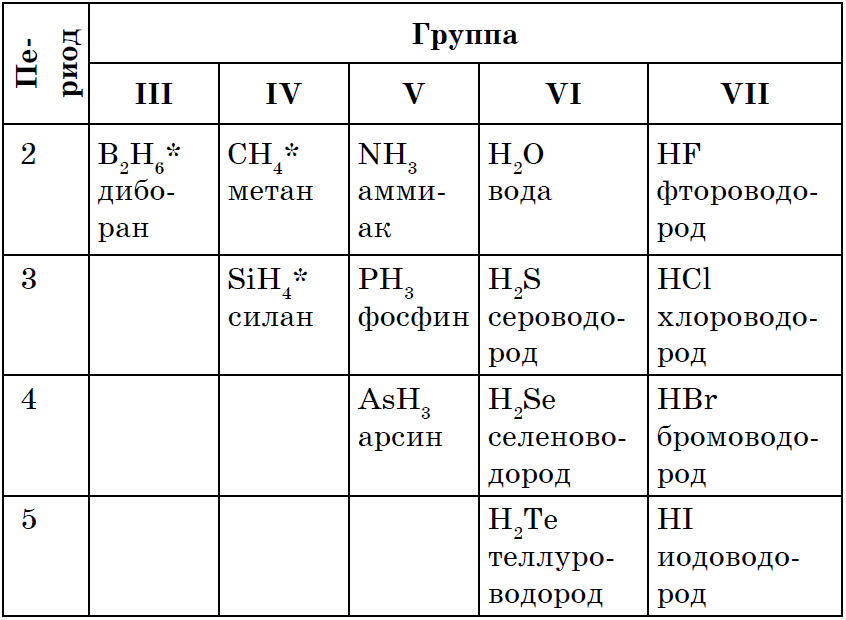
Det är känt att dessa föreningar lätt kan erhållas direkt samspelet mellan en icke-metall och väte, dvs genom syntes:
![]()
Alla väteföreningar av icke-metaller bildas av kovalenta polära bindningar, har en molekylär struktur och är under normala förhållanden gaser, förutom vatten (vätska). Väteföreningar av icke-metaller kännetecknas av en annan inställning till vatten. Metan och silan är praktiskt taget olösliga i den. Ammoniak bildar, när den är upplöst i vatten, en svag bas NH3H20. När vätesulfid, väteselenid, vätetellurid och även vätehalogenider löses i vatten bildas syror med samma formel som själva väteföreningarna: H2S, H2Se, H2 Te, HF, HCl, HBr, HI.
Om vi \u200b\u200bjämför syrabasegenskaperna hos väteföreningar bildade av icke-metaller under en period, till exempel den andra (NH3, H2O, HF) eller den tredje (PH3, H2S, HCl), kan vi dra slutsatsen att deras sura egenskaper naturligt förbättras och därmed försvagar de viktigaste. Detta beror uppenbarligen på ökningen av polariteten kommunikation E-N (där E är en icke-metall).
Syrabasegenskaperna hos väteföreningar av icke-metaller i en undergrupp skiljer sig också. Till exempel i serien av vätehalogenider HF, HCl, HBr, HI minskar styrkan för E-H-bindningen, eftersom bindningslängden ökar. I HCl-, HBr-, HI-lösningar dissocierar de nästan helt - dessa är starka syror och deras styrka ökar från HF till HI. I det här fallet hänvisar HF till svaga syror, vilket beror på en annan faktor - intermolekylär interaktion, bildandet av vätebindningar ... H-F ... H-F .... Väteatomer är bundna till fluor-F-atomer inte bara av sin egen molekyl utan också av den angränsande.
Sammanfattande jämförande egenskaper syra-basegenskaper hos väteföreningar av icke-metaller, drar vi slutsatsen att den sura och försvagningen av de grundläggande egenskaperna hos dessa ämnen med perioder och huvudundergrupper med en ökning av atomantalet hos de element som bildar dem.
Under perioden i PS för kemiska element, med en ökning av det ordinarie antalet av elementet - icke-metall, ökar den sura naturen hos väteföreningen.
SiH4 → PH3 → H2S → HCI
Förutom de betraktade egenskaperna uppvisar väteföreningar av icke-metaller i redoxreaktioner alltid egenskaperna hos reduktionsmedel, eftersom icke-metallen i dem har det lägsta oxidationstillståndet.
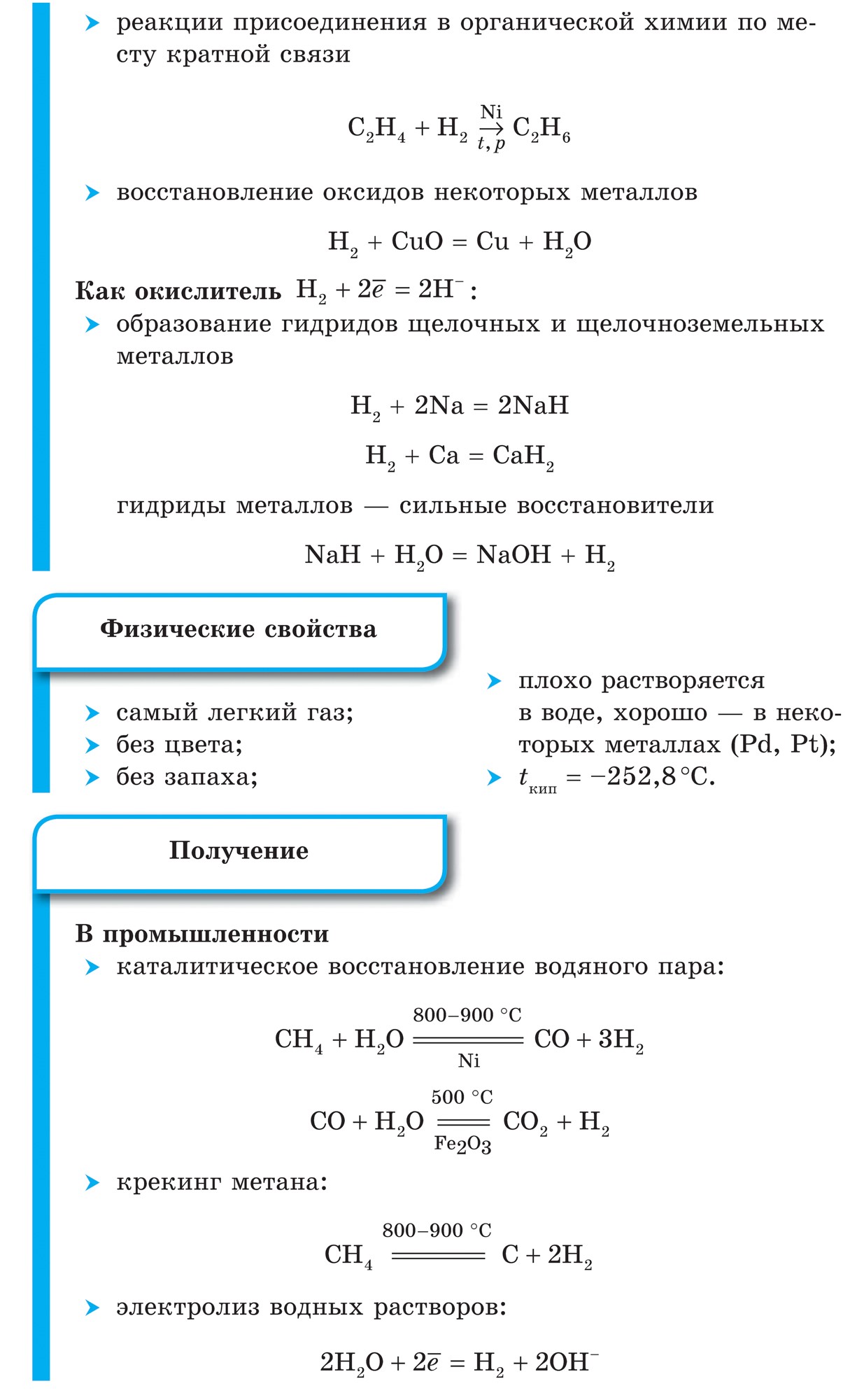
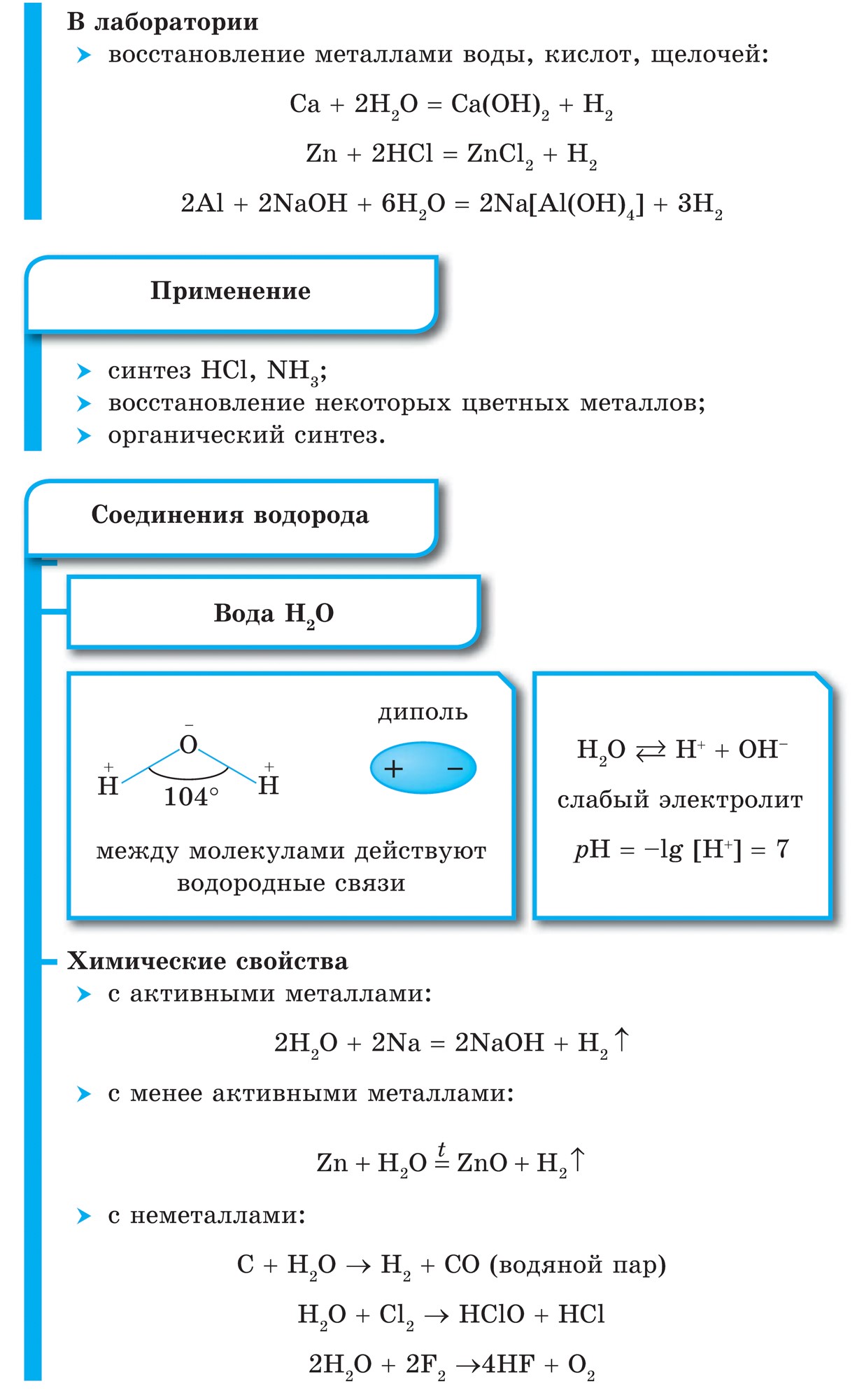
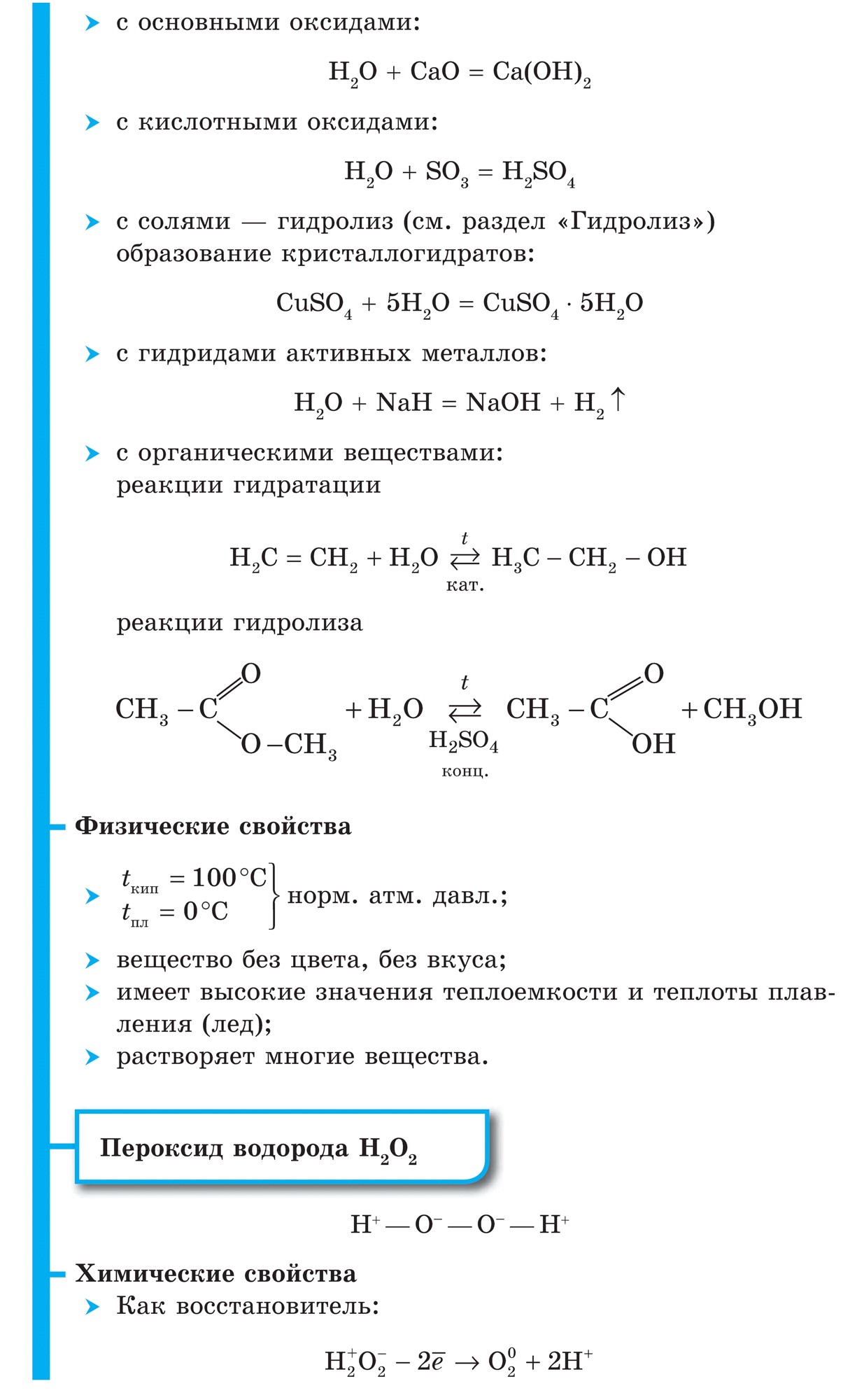
Väte
Väte - huvudelement Universum. Många rymdobjekt (gasmoln, stjärnor inklusive solen) består av mer än hälften av väte. På jorden är den, inklusive atmosfären, hydrosfären och litosfären, bara 0,88%. Men detta är efter massa, och atommassan av väte är mycket liten. Därför är dess lilla innehåll bara uppenbart, och av 100 atomer på jorden är 17 väteatomer.
I ett fritt tillstånd finns väte i form av H2-molekyler, atomerna är kopplade till en molekyl kovalent icke-polär bindning.
Väte (H2) är den lättaste gasen av alla gasformiga ämnen. Har den högsta värmeledningsförmågan och den lägsta kokpunkten (efter helium). Lätt löslig i vatten. Vid en temperatur av -252,8 ° C och atmosfärstryck förvandlas väte till flytande tillstånd.
1. Vätemolekylen är mycket stark, vilket gör den inaktiv:
H2 \u003d 2H - 432 kJ
2. Vid vanliga temperaturer, väte reagerar med aktiva metaller:
Ca + H2 \u003d CaH2,
bildar kalciumhydrid och med F2 bildar vätefluorid:
F2 + H2 \u003d 2HF
3. När höga temperaturer få ammoniak:
N2 + 3H2 \u003d 2NH3
och titanhydrid (metall i pulver):
Ti + H2 \u003d TiH2
4. Vid antändning, väte reagerar med syre:
2H2 + O2 \u003d 2H20 + 484 kJ
5. Väte har en regenerativ förmåga:
CuO + H2 \u003d Cu + H2O
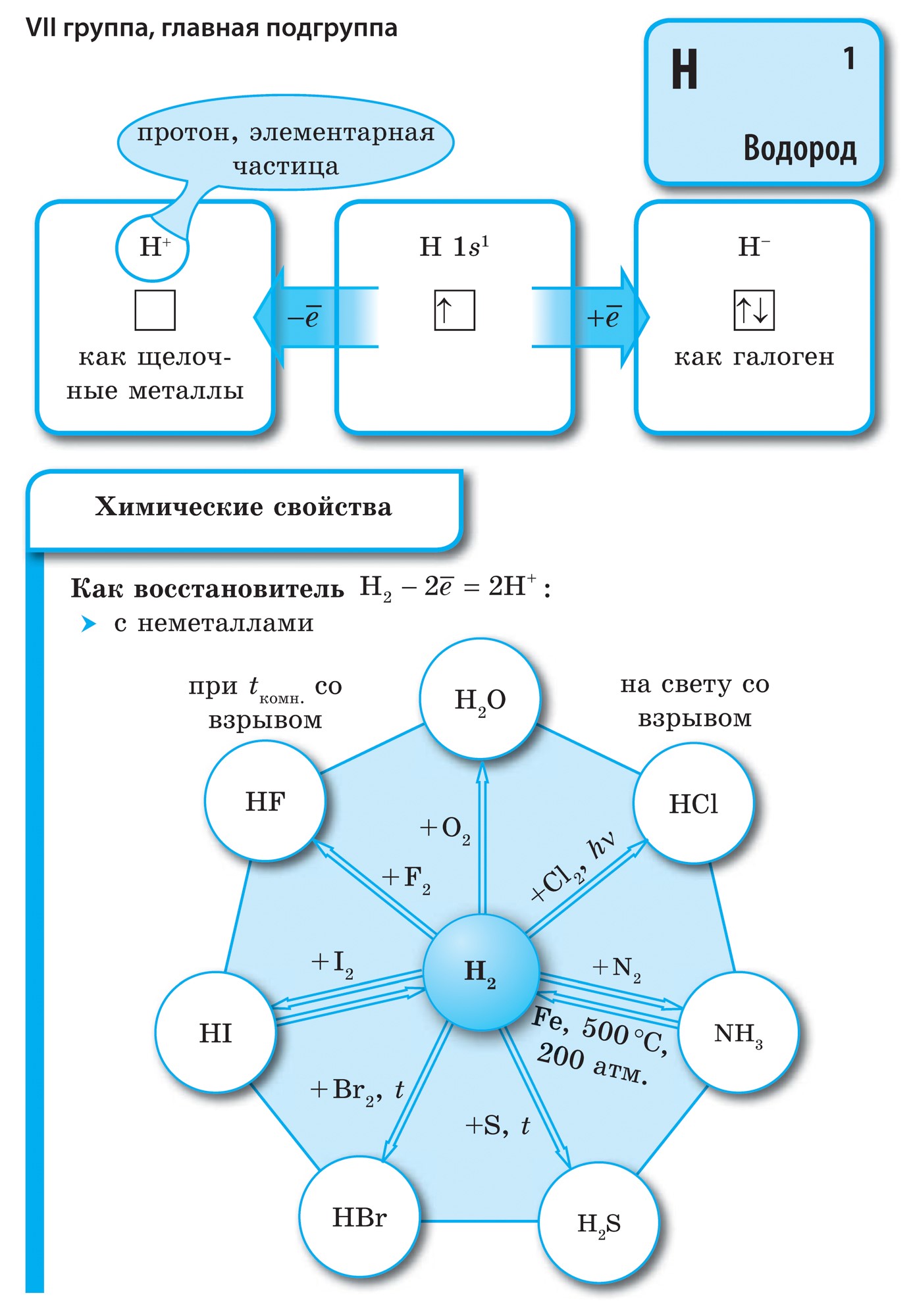

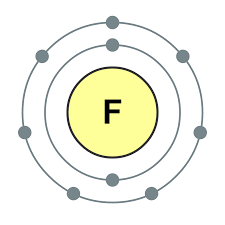
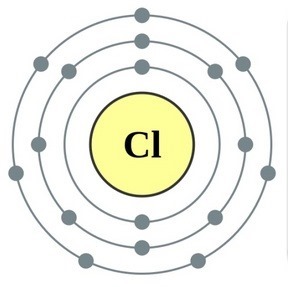
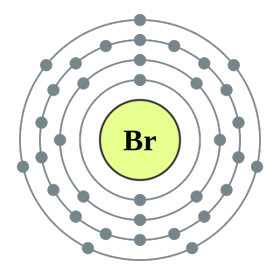
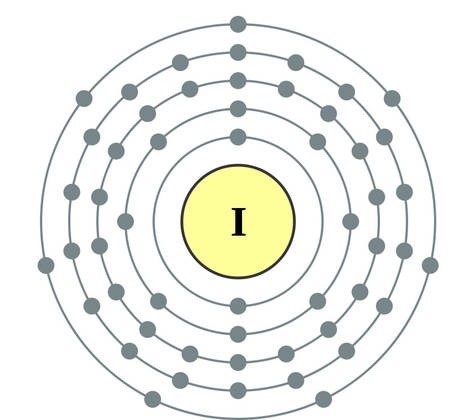
Element i huvudundergruppen i VII-gruppen i det periodiska systemet, förenade under ett gemensamt namn halogenerfluor (F), klor (Cl), brom (Bg), jod (I), astatin (At) (sällan finns i naturen) är typiska icke-metaller. Detta är förståeligt, eftersom deras atomer innehåller på den externa energinivån sju elektroneroch de behöver bara en elektron för att slutföra den. Atomerna i dessa element, när de interagerar med metaller, får en elektron från metallatomerna. I detta fall uppstår en jonbindning och salter bildas. Därav det vanliga namnet "halogener", det vill säga "föda salter."
mycket starka oxidanter... Fluor i kemiska reaktioner uppvisar endast oxiderande egenskaper, och det kännetecknas av oxidationstillståndet -1. Resten av halogenerna kan också uppvisa reducerande egenskaper när de interagerar med mer elektronegativa element - fluor, syre, kväve, medan deras oxidationstillstånd kan ta värdena +1, +3, +5, +7. Halogenernas reducerande egenskaper förbättras från klor till jod, vilket är förknippat med en ökning av radierna hos deras atomer: kloratomer är ungefär hälften av jodens.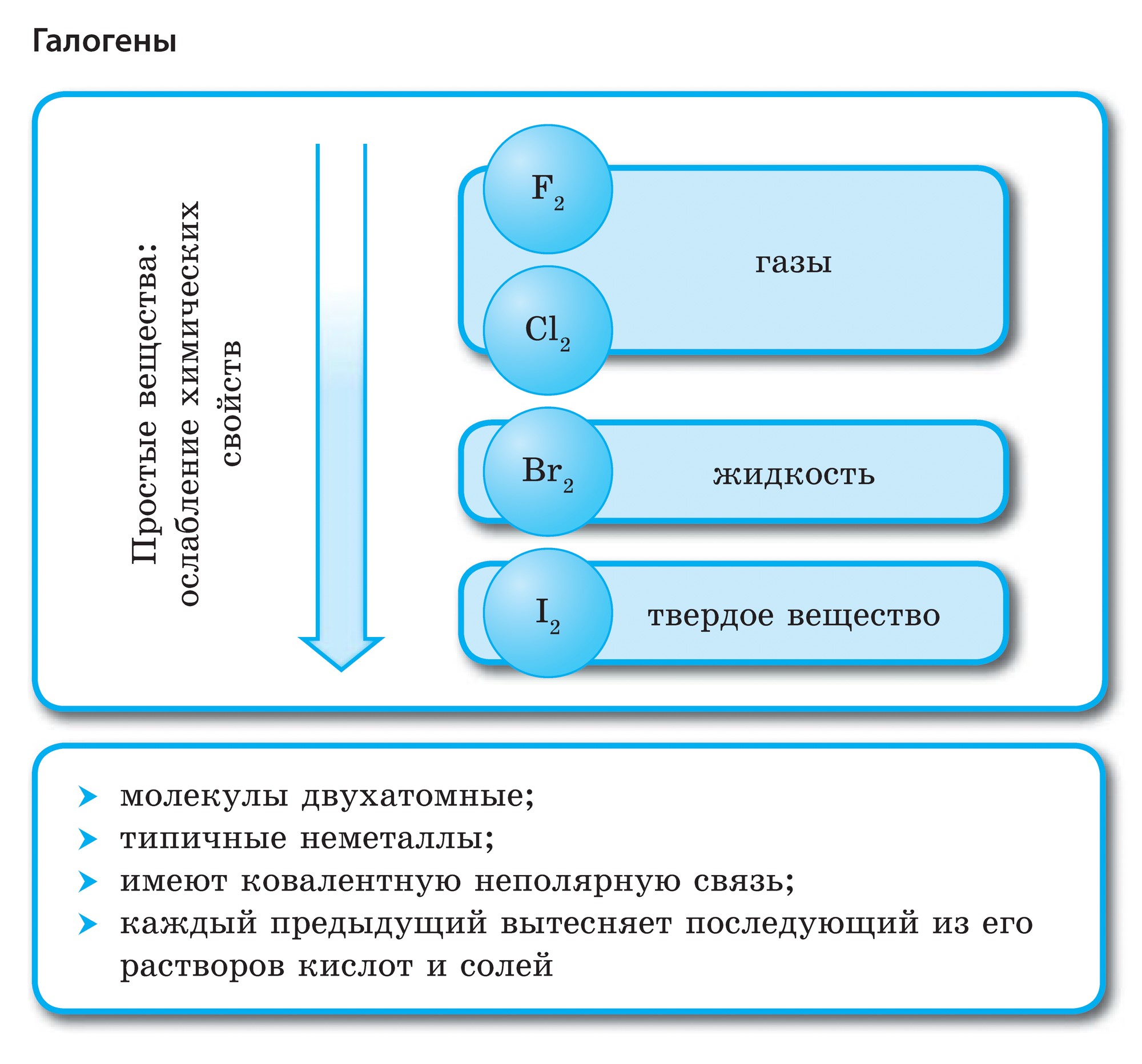
Halogener är enkla ämnen
Alla halogener finns i ett fritt tillstånd som diatomiska molekyler med en kovalent, icke-polär kemisk bindning mellan atomer. I fast tillstånd F2, Cl2, Br2, I2 har molekylära kristallgaller, vilket bekräftas av deras fysikaliska egenskaper.
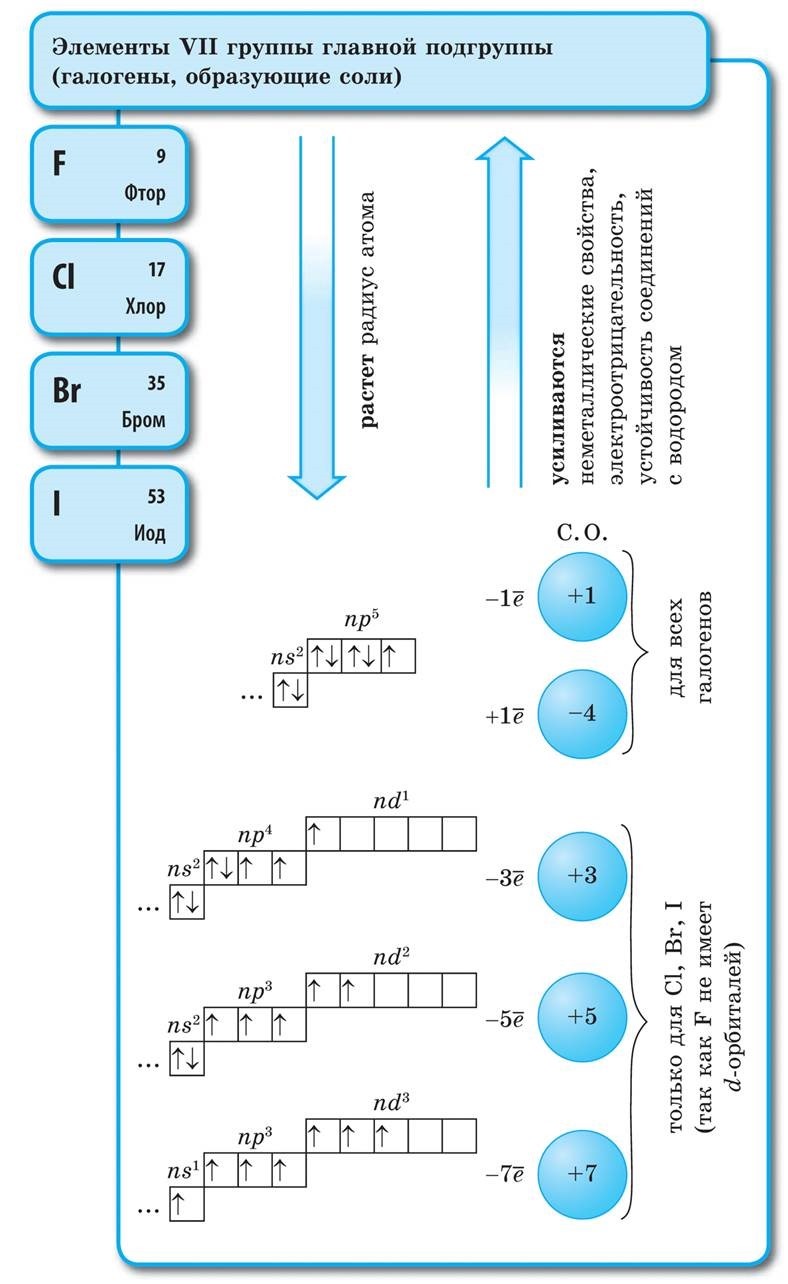
Med en ökning av halogenernas molekylvikt ökar smält- och kokpunkterna, densiteten ökar: brom är en vätska, jod är ett fast ämne, fluor och klor är gaser. Detta beror på det faktum att med en ökning av storleken på atomer och halogenmolekyler ökar krafterna för intermolekylär interaktion mellan dem. Från F2 till I2 ökar halogenernas färgintensitet.
Halogenernas kemiska aktivitet, som icke-metaller, minskar från fluor till jod, jodkristaller har en metallisk glans. Varje halogen är det starkaste oxidationsmedlet under sin period... Halogenernas oxiderande egenskaper manifesteras tydligt när de interagerar med metaller. Detta producerar salter. Således reagerar fluor, även under normala förhållanden, med de flesta metaller och vid upphettning med guld, silver, platina, som är kända för sin kemiska passivitet. Aluminium och zink i en fluoratmosfär antänds:
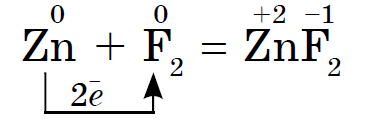
Resten av halogenerna reagerar med metaller vid upphettning... Uppvärmt järnpulver antänds också vid exponering för klor. Experimentet kan genomföras som med antimon, men endast järnfiléer måste först värmas upp i en järnsked och häll dem sedan i små portioner i en kolv med klor. Eftersom klor är ett starkt oxidationsmedel bildas järn (III) klorid som ett resultat av reaktionen:
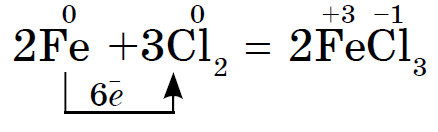
I bromånga rödglödande koppartråd brinner ut:
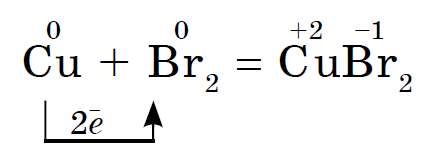
Jod oxiderar metaller långsammare, men i närvaro av vatten, som är en katalysator, fortsätter reaktionen av jod med aluminiumpulver mycket våldsamt:
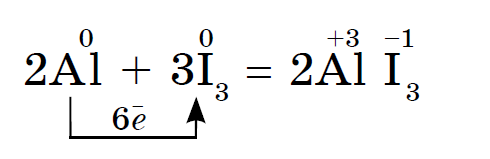
Reaktionen åtföljs av frisättning av violett jodånga.
På en minskning av oxidationen och en ökning av de reducerande egenskaperna hos halogener från fluor till jod kan bedömas utifrån deras förmåga att förskjuta varandra från lösningar av deras salter, och det manifesteras också tydligt när de interagerar med väte. Ekvationen för denna reaktion kan skrivas i allmänhet enligt följande:
Om fluor interagerar med väte under alla förhållanden med en explosion, reagerar en blandning av klor och väte endast när det antänds eller bestrålas av direkt solljus, brom interagerar med väte vid upphettning och utan explosion. Dessa reaktioner är exoterma. Reaktionen mellan kombinationen av jod och väte är svagt endoterm; den fortsätter långsamt även vid upphettning.
Som ett resultat av dessa reaktioner bildas vätefluorid HF, väteklorid HCl, vätebromid HBr respektive vätejodid Hl.
Klor kemiska egenskaper i tabeller

Få halogener
Fluor och klor erhålls genom elektrolys av smältor eller lösningar av deras salter. Till exempel kan elektrolysprocessen för natriumkloridsmältning reflekteras av ekvationen:
När klor erhålls genom elektrolys av natriumkloridlösning, bildas förutom klor också väte och natriumhydroxid:
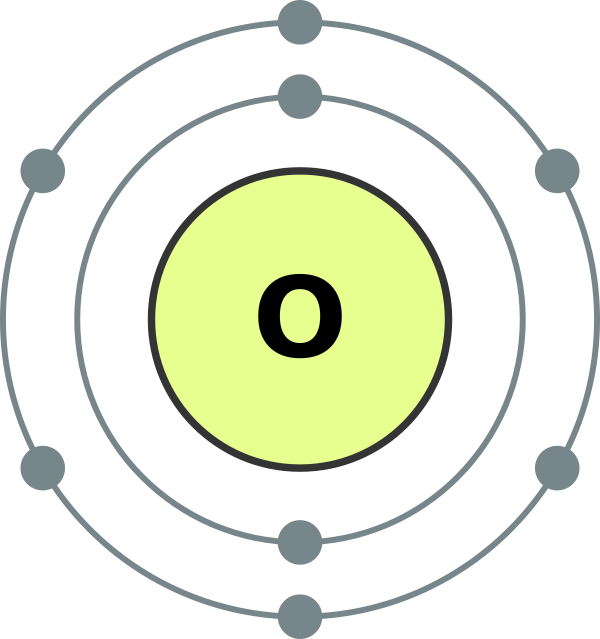
Syre (O) - grundaren av huvudundergruppen i VI-gruppen i elementens periodiska system. Elementen i denna undergrupp - syre O, svavel S, selen Se, tellurium Te, polonium Po - har det allmänna namnet "kalkogener", vilket betyder "producerande malm".
Syre är det vanligaste elementet på vår planet. Det är en del av vattnet (88,9%), men det täcker 2/3 av jordens yta och bildar dess vattenskal - hydrosfären. Syre är det andra i kvantitet och först av betydelse för livet komponent jordskal av jorden - atmosfären, där den står för 21% (i volym) och 23,15% (i vikt). Syre är en del av många mineraler i jordskorpans hårda skal - litosfären: av 100 atomer i jordskorpan står 58 atomer för syre.
Vanligt syre finns i form av O 2. Det är en färglös, luktfri och smaklös gas. I flytande tillstånd har den en ljusblå färg, i fast tillstånd är den blå. Gasformigt syre är mer lösligt i vatten än kväve och väte.
Syre samverkar med nästan alla enkla ämnen, utom halogener, ädelgaser, guld och platina metaller... Reaktioner från icke-metaller med syre förekommer mycket ofta med frisättning av en stor mängd värme och åtföljs av antändningsförbränningsreaktioner. Till exempel förbränningen av svavel med bildandet av S02, fosfor - med bildandet av P2O5 eller kol - med bildandet av C02. Nästan alla reaktioner som involverar syre är exoterma. Ett undantag är växelverkan mellan kväve och syre: detta är en endoterm reaktion som inträffar vid temperaturer över 1200 ° C eller med en elektrisk urladdning:
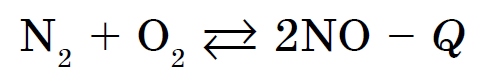
Syre oxiderar kraftigt inte bara enkla utan också många komplexa ämnen, medan oxiderna av elementen från vilka de är byggda bildas:
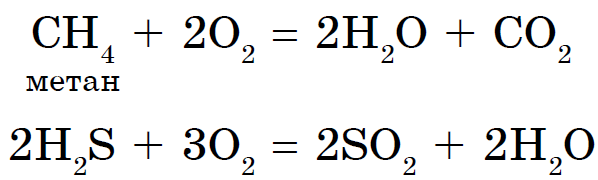
Syrens höga oxiderande kraft är grunden för förbränning av alla typer av bränsle.
Syre deltar också i processerna för långsam oxidation av olika ämnen vid vanliga temperaturer. Syreens roll i andningsprocessen hos människor och djur är extremt viktig. Växter absorberar också atmosfäriskt syre. Men om det bara är processen att absorbera syre av växter i mörkret, inträffar en annan motsatt process i ljuset - fotosyntes, vilket resulterar i att växter absorberar koldioxid och släpper ut syre.
I industrin erhålls syre från flytande luft och i laboratoriet - genom sönderdelning av väteperoxid i närvaro av en mangandioxidkatalysator MnO 2 :
![]()
och sönderdelning av kaliumpermanganat KMnO 4 vid uppvärmning:
Syre kemiska egenskaper i tabeller

Syreapplikation
Syre används i metallurgiska och kemiska industrier för att påskynda (intensifiera) produktionsprocesser. Rent syre används också för att uppnå höga temperaturer, till exempel vid gassvetsning och metallskärning. I medicin används syre i fall av tillfälliga andningssvårigheter i samband med vissa sjukdomar. Syre används också i metallurgi som ett oxidationsmedel för raketbränsle, i luftfart för andning, för skärning av metaller, för svetsning av metaller och för sprängning. Syre lagras i blåmålade stålcylindrar under ett tryck på 150 atm. Under laboratorieförhållanden lagras syre i glasanordningar - gasmätare.
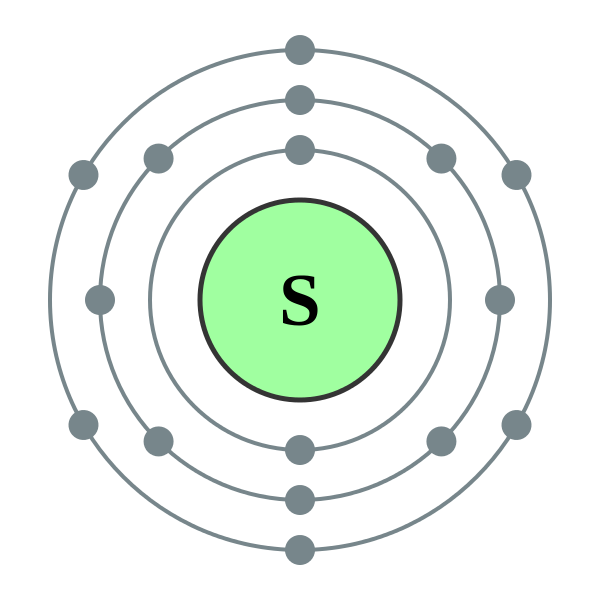
Atomer svavel (S), som syreatomer och alla andra element i huvudundergruppen i grupp VI, innehåller på den externa energinivån 6 elektroner, varav två elektroner oparade... I jämförelse med syreatomer har svavelatomer emellertid en större radie, ett lägre elektronegativitetsvärde och uppvisar därför uttalade reducerande egenskaper och bildar föreningar med oxidationstillstånd +2, +4, +6. I förhållande till mindre negativa element (väte, metaller) uppvisar svavel oxidationsegenskaper och förvärvar ett oxidationstillstånd -2 .
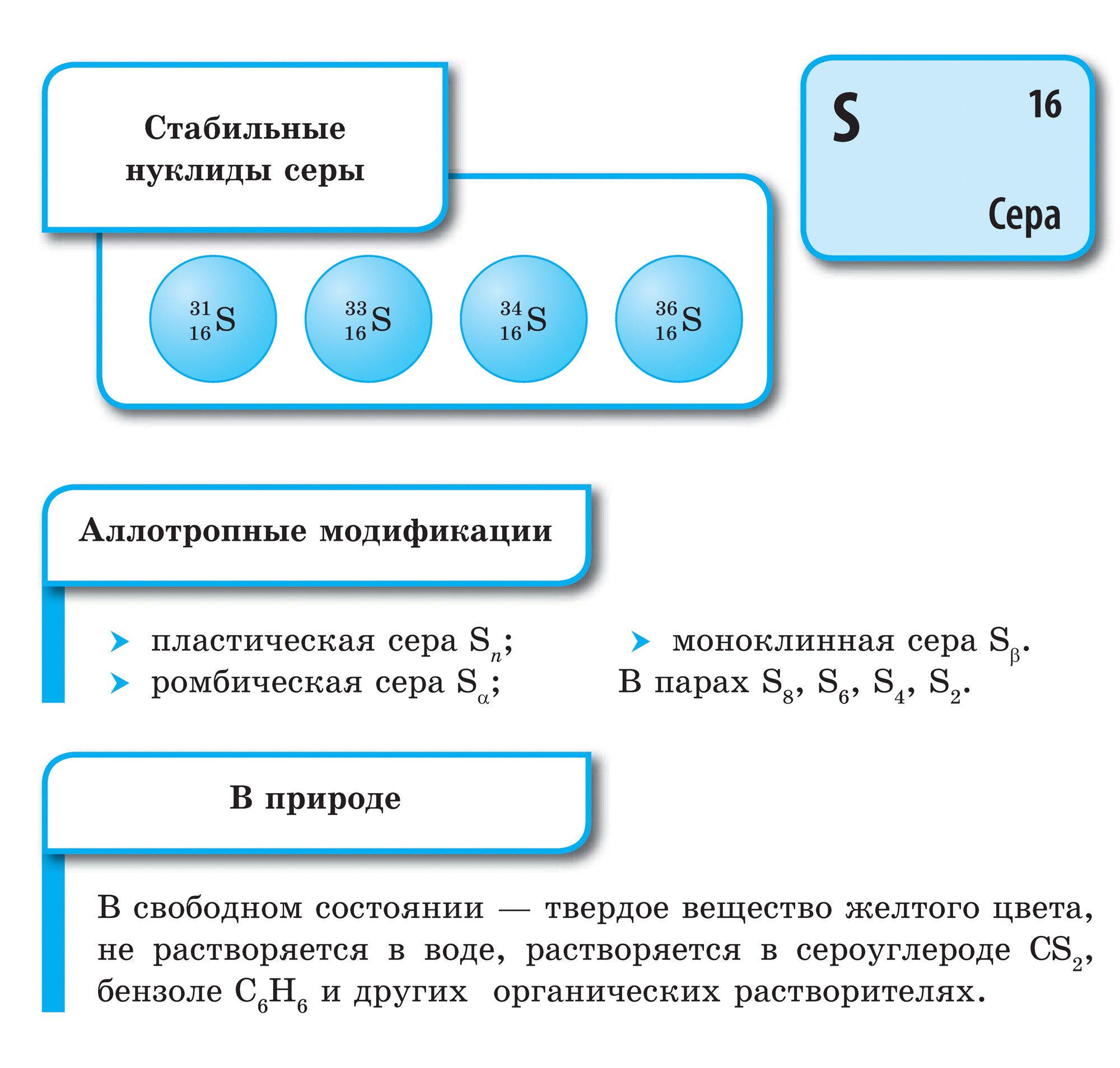
Svavel är ett enkelt ämne
Svavel såväl som syre kännetecknas av allotropi. Många modifieringar av svavel med en cyklisk eller linjär struktur av molekyler med olika kompositioner är kända.
Den mest stabila modifieringen är känd som rombsvavel, bestående av S8-molekyler. Dess kristaller är oktaedra med skurna hörn. De är färgade citrongula och genomskinliga, smältpunkt 112,8 ° C. Alla andra modifieringar omvandlas till denna modifiering vid rumstemperatur. Kristallisation från smältan producerar först monokliniskt svavel (nålkristaller, smältpunkt 119,3 ° C), som sedan blir rombisk. Vid uppvärmning av svavelbitar i ett provrör smälter det och förvandlas till en gul vätska. Vid en temperatur av ca 160 ° C börjar flytande svavel att mörkna, blir tjockt och visköst, häller inte ut ur provröret, vid ytterligare uppvärmning blir det till en lätt rörlig vätska men behåller sin tidigare mörkbruna färg. Om du häller den i kallt vatten, stelnar den i form av en transparent gummiliknande massa. Detta är plastsvavel. Det kan också erhållas i form av trådar. Efter några dagar blir det också rombsvavel.
Svavel löses inte upp i vatten. Svavelkristaller sjunker i vatten, men pulvret flyter på vattenytan, eftersom små svavelkristaller inte fuktas med vatten och hålls flytande av små luftbubblor. Detta är en flotationsprocess. Svavel är något lösligt i etylalkohol och dietyleter; det är lätt lösligt i koldisulfid.
Under normala förhållanden svavel reagerar med alla jord- och jordalkalimetaller, koppar, kvicksilver, silver, t.ex:
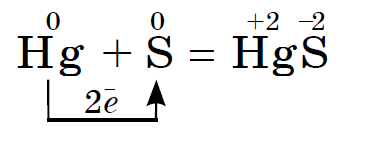
Denna reaktion ligger till grund för avlägsnande och bortskaffande av spillt kvicksilver från till exempel en trasig termometer. Synliga droppar av kvicksilver kan samlas på ett papper eller kopparplast. Kvicksilver som har kommit in i sprickorna måste täckas med svavelpulver. Denna process kallas demercurization.
Vid upphettning reagerar svavel också med andra metaller (Zn, Al, Fe), och endast guld interagerar inte med det under några förhållanden. Svavel uppvisar också oxiderande egenskaper med väte, med vilket det reagerar vid upphettning:
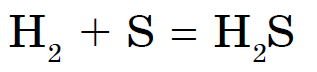
Av icke-metallerna reagerar endast kväve, jod och ädelgaser inte med svavel. Svavel brinner med en blåaktig flamma och bildar svaveloxid (IV):
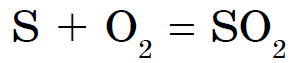
Denna förening är allmänt känd som svaveldioxid.
Svavels kemiska egenskaper i tabeller

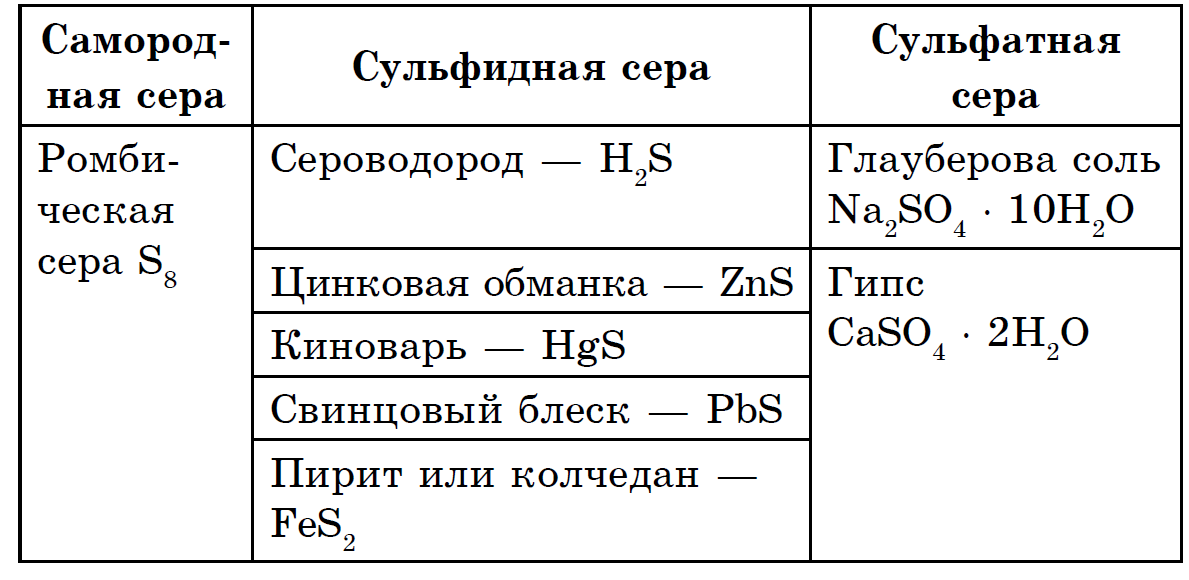
Svavel är ett av de vanligaste elementen: jordskorpan innehåller 4,7 × 10-2% masssvavel (15: e plats bland andra element), och jorden som helhet är mycket mer (0,7%). Huvudmassan av svavel ligger i jordens djup, i dess mantelskikt som ligger mellan jordskorpan och jordens kärna. Här ligger ett tjockt lager sulfider och metalloxider på ett djup av cirka 1200-3000 km. I jordskorpan finns svavel både i ett fritt tillstånd (nativt) och huvudsakligen i form av sulfider och sulfater. De vanligaste sulfiderna i jordskorpan är pyrit FeS2, chalcopyrite FeCuS2, blyglans (galena) PbS, zink blende (sfalerit) ZnS. Stora mängder svavel finns i jordskorpan i form av lite lösliga sulfater - gips CaSO4 2H2O, barit BaSO4, magnesium, natrium och kaliumsulfater är vanliga i havsvatten.
Det är intressant att det under gamla tider av jordens geologiska historia (för cirka 800 miljoner år sedan) inte fanns några sulfater i naturen. De bildades som produkter av sulfidoxidation när en syreatmosfär uppstod som ett resultat av växternas liv. Vätesulfid H2S och svaveldioxid SO2 finns i vulkaniska gaser. Därför kan naturligt svavel som finns i områden nära aktiva vulkaner (Sicilien, Japan) bildas genom växelverkan mellan dessa två gaser:
2H2S + SO2 \u003d 3S + 2H20.
Andra avlagringar av nativt svavel är associerade med den vitala aktiviteten hos mikroorganismer.
Mikroorganismer är involverade i många kemiska processer, som i allmänhet utgör svavelcykeln i naturen. Med deras hjälp oxideras sulfider till sulfater, sulfater absorberas av levande organismer, där svavel reduceras och ingår i proteiner och andra vitala ämnen. När de döda resterna av organismer förfaller förstörs proteiner och vätesulfid frigörs, som sedan oxideras antingen till elementärt svavel (så bildas svavelavlagringar) eller till sulfater. Intressant är att bakterier och alger som oxiderar vätesulfid till svavel samlar det i sina celler. Cellerna i sådana mikroorganismer kan vara 95% rent svavel.
Svavels ursprung kan fastställas genom närvaron av dess analog, selen: om selen finns i nativt svavel, är svavel av vulkaniskt ursprung, om inte, är det biogeniskt, eftersom mikroorganismer undviker att inkludera selen i sin livscykel, och biogeniskt svavel innehåller också mer av 32S-isotopen än den tyngre 34S.
Svavels biologiska betydelse
Ett viktigt kemiskt element. Det är en del av proteiner - en av de viktigaste kemiska komponenterna i celler i alla levande organismer. Särskilt mycket svavel finns i proteinerna i hår, horn, ull. Dessutom är svavel en integrerad del av kroppens biologiskt aktiva substanser: vitaminer och hormoner (till exempel insulin). Svavel är involverat i kroppens redoxprocesser. Med brist på svavel i kroppen observeras skörhet och skörhet i ben och håravfall.
Baljväxter (ärtor, linser), havregryn, ägg är rik på svavel.
Svavelapplikation
Svavel används vid tillverkning av tändstickor och papper, gummi och färger, sprängämnen och droger, plast och kosmetika. I jordbruket används det för att bekämpa växtskadegörare. Huvudkonsumenten av svavel är dock den kemiska industrin. Cirka hälften av svavel som produceras i världen går till produktion av svavelsyra.
Kväve
![]()
Kväve (N)- den första representanten för huvudundergruppen i grupp V i det periodiska systemet. Dess atomer innehåller fem elektroner på den externa energinivån, varav tre är oparade. Det följer att atomen i dessa element kan fästa tre elektroner och fullborda den yttre energinivån.
Kväveatomer kan donera sina yttre elektroner till mer elektronegativa element (fluor, syre) och få oxidationstillstånd +3 och +5. Kväveatomer uppvisar reducerande egenskaper i oxidationstillstånd +1, +2, +4.
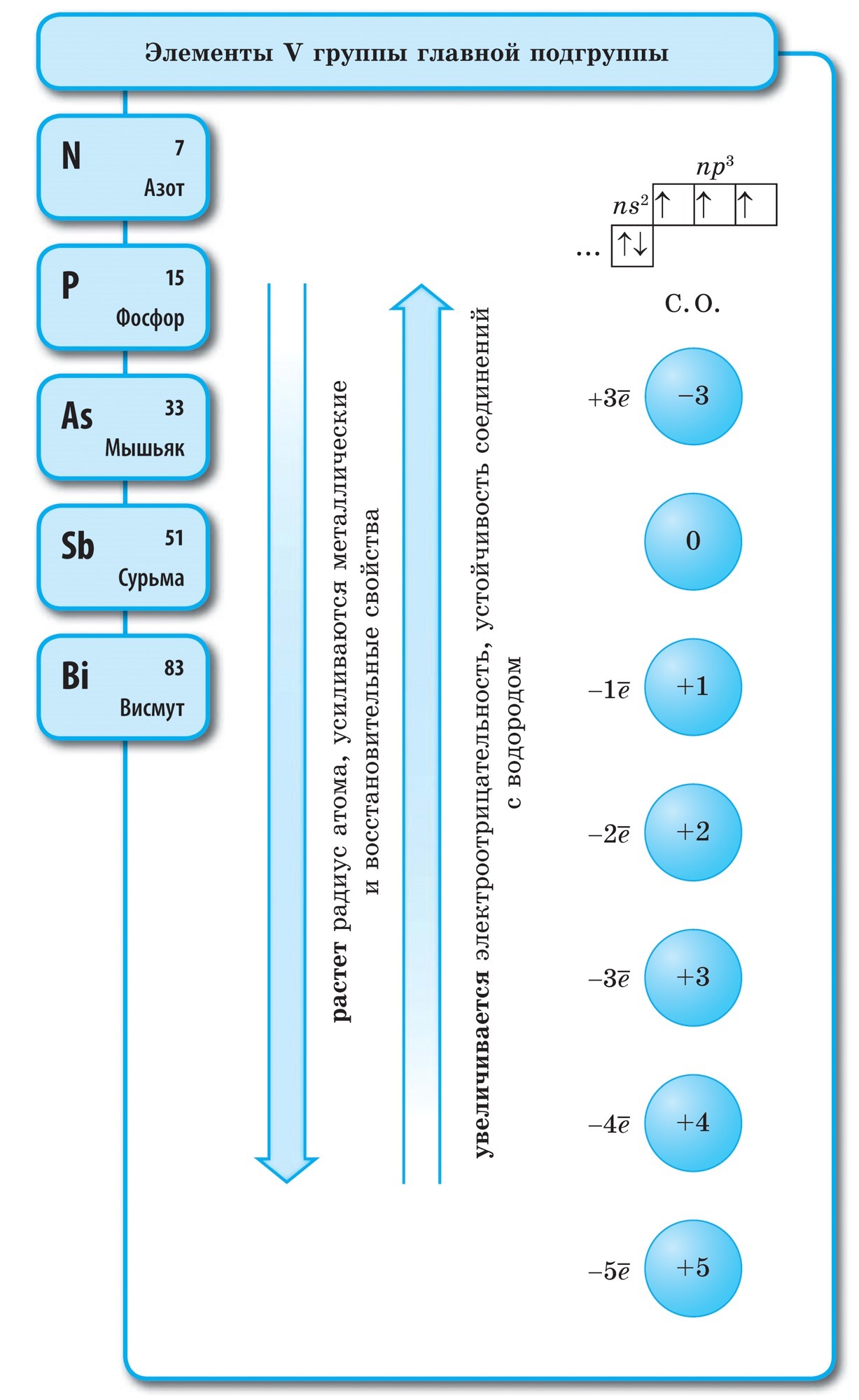
I ett fritt tillstånd finns kväve i vattnet i den diatomiska molekylen N2. I denna molekyl är två N-atomer kopplade genom en mycket stark trippel kovalent bindning, dessa bindningar kan betecknas enligt följande:

Kväve är en färglös, luktfri och smaklös gas.
Under normala förhållanden kväve samverkar endast med litium och bildar Li-nitrid 3 N:
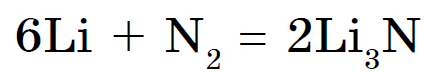
Det interagerar med andra metaller endast vid höga temperaturer.
Även vid höga temperaturer och tryck i närvaro av en katalysator reagerar kväve med väte och bildar ammoniak:
Vid temperaturen i ljusbågen kombineras den med syre för att bilda kväveoxid (II):
Kemiska egenskaper hos kväve i tabeller

Applicering av kväve
Kväve erhållet genom destillation av flytande luft används inom industrin för syntes av ammoniak och framställning av salpetersyra... I medicinen används rent kväve som ett inert medium för behandling av lungtuberkulos och flytande kväve används vid behandling av sjukdomar i ryggraden, lederna etc.
Fosfor
Det kemiska grundämnet fosfor bildar flera allotropa modifieringar. Två av dem är enkla ämnen: vit fosfor och röd fosfor. Vit fosfor har ett molekylärt kristallgitter som består av P4-molekyler. Olöslig i vatten, lättlöslig i koldisulfid. Det oxiderar lätt i luft och antänds till och med i pulverform. Vit fosfor är mycket giftigt. En speciell egenskap är förmågan att glöda i mörkret på grund av oxidation. Förvara den under vatten Röd fosfor är ett mörkt hallonpulver. Det löser sig inte i vatten eller koldisulfid. Det oxideras långsamt i luft och antänds inte själv. Icke giftigt och lyser inte i mörkret. När röd fosfor värms upp i ett provrör blir det till vit fosfor (koncentrerade ångor).
De kemiska egenskaperna hos röd och vit fosfor är lika, men vit fosfor är mer kemiskt aktiv. Så båda interagerar med metaller och bildar fosfider:
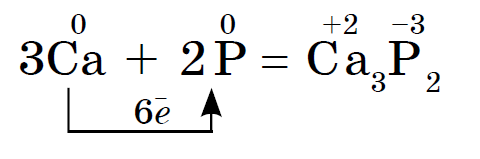
Vit fosfor antänds spontant i luften och rött brinner vid antändning. I båda fallen bildas fosfor (V) oxid som avges som en tjock vit rök:
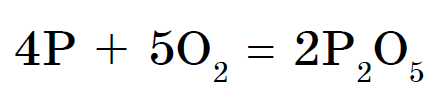
Fosfor reagerar inte direkt med väte, fosfin PH3 kan erhållas indirekt, till exempel från fosfider:
Fosfin - mycket giftig gas från obehaglig lukt... Brandfarligt i luften. Det är denna egenskap hos fosfin som förklarar utseendet på vandrande myrbränder.
Kemiska egenskaper hos fosfor i tabeller


Användning av fosfor
Fosfor är det viktigaste biogena elementet och används samtidigt i stor utsträckning inom industrin. Röd fosfor används vid tillverkning av tändstickor. Tillsammans med finmalt glas och lim appliceras det på lådans sidoyta. När ett tändstickshuvud, som innehåller kaliumklorat och svavel, gnids, uppstår antändning.
Kanske är den första egenskapen hos fosfor som en person har lagt till sin tjänst brandfarlighet. Brännbarheten hos fosfor är mycket hög och beror på den allotropa modifieringen.
Den mest aktiva kemiska, giftiga och brandfarliga vita ("gula") fosfor, därför används den mycket ofta (i eldbomber etc.).
Röd fosfor är den viktigaste modifieringen som produceras och konsumeras av industrin. Det används vid tillverkning av tändstickor, sprängämnen, brandföreningar, olika typer bränsle, liksom smörjmedel med extremt tryck, som en getter vid tillverkning av glödlampor.
Fosfor (i form av fosfater) är ett av de tre viktigaste biogena elementen som är involverade i syntesen av ATP. De flesta av fosforsyra går till produktion av fosforgödselmedel - superfosfat, fällning, ammophoska etc.
Fosfater används ofta:
- som komplexbildande medel (vattenavhärdare),
- som en del av metallytpassivatorer (skydd mot korrosion, till exempel den så kallade "majef" -kompositionen).
Fosfaternas förmåga att bilda ett starkt tredimensionellt polymernätverk används för att framställa fosfat- och aluminofosfatbindemedel.
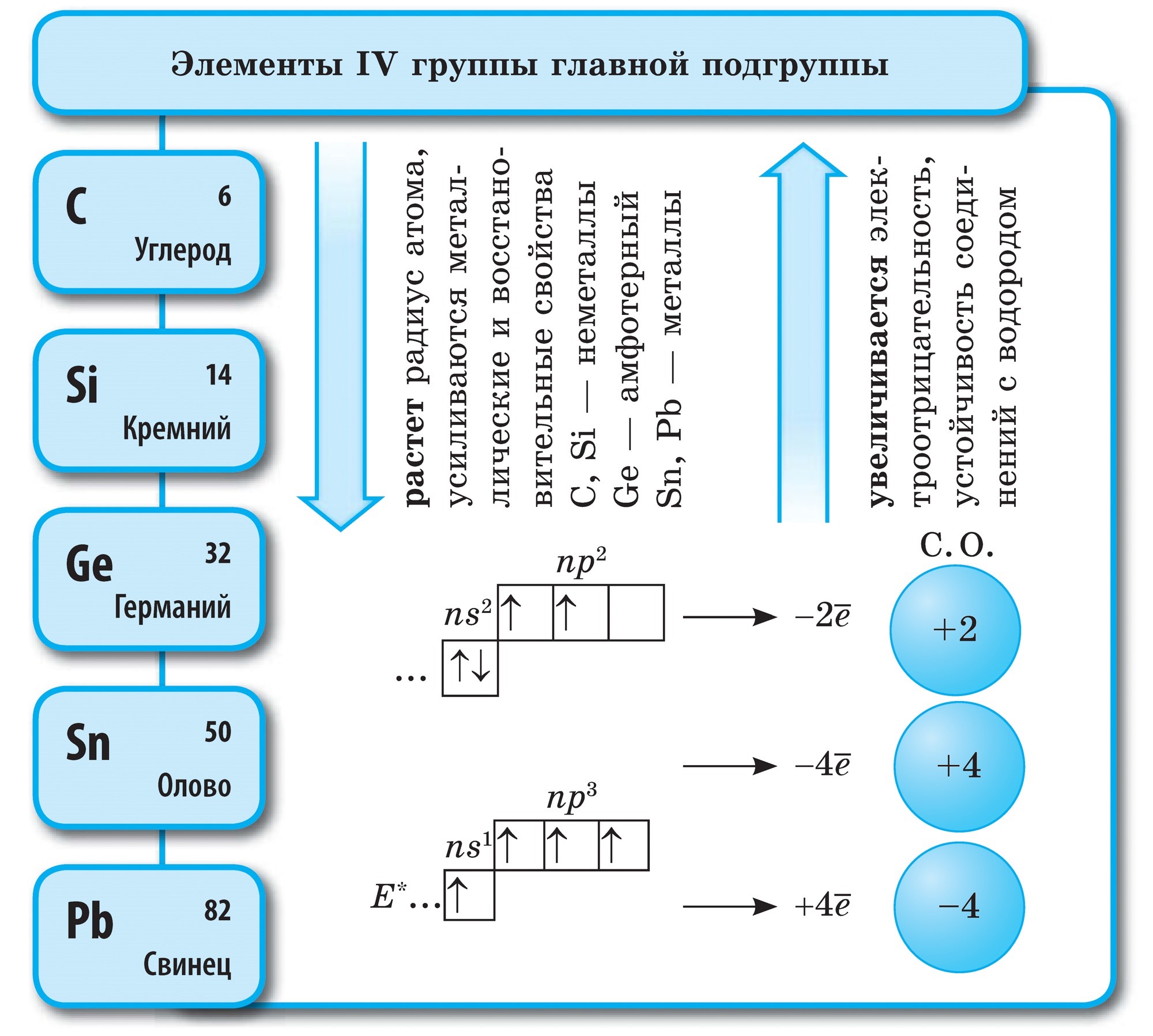
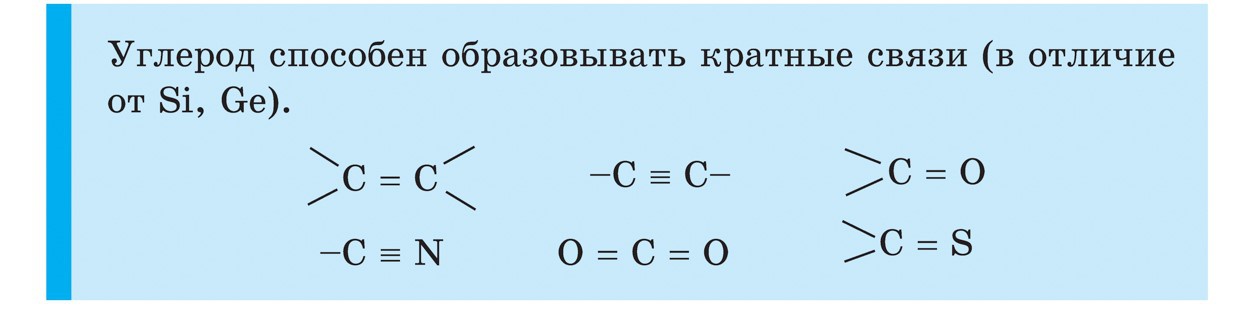
Kol
Kol (C) - det första elementet i huvudundergruppen i VI-gruppen i det periodiska systemet. Dess atomer innehåller 4 elektroner på den yttre nivån, så att de kan acceptera fyra elektroner, medan de förvärvar oxidationstillståndet -4 , dvs uppvisar oxidationsegenskaper och donerar deras elektroner till mer elektronegativa element, dvs uppvisar reducerande egenskaper, medan de erhåller ett oxidationstillstånd +4.
Kol är ett enkelt ämne
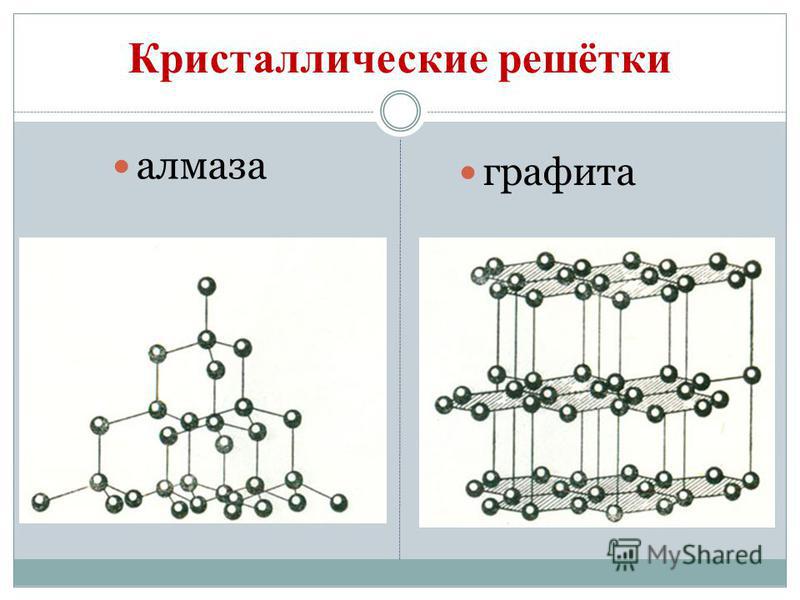
Kol bildar allotropa modifieringar diamant och grafit... Diamant är en transparent kristallin substans, den hårdaste av alla naturliga ämnen. Det tjänar som en hårdhetsstandard, som enligt tiopunktssystemet uppskattas med den högsta poängen på 10. Denna hårdhet hos en diamant beror på den speciella strukturen hos dess atomkristallgitter. I den är varje kolatom omgiven av samma atomer belägna vid topparna på en vanlig tetraeder.
Diamantkristaller är vanligtvis färglösa, men de finns i blått, ljusblått, rött och svart. De har en mycket hög glans på grund av deras höga ljusbrytnings- och reflekterande egenskaper. Och på grund av sin extremt höga hårdhet används de för tillverkning av borrar, borrar, slipverktygskärande glas.
De största diamantfyndigheterna finns i Sydafrika, medan de i Ryssland bryts i Yakutia.
Grafit är en mörkgrå, oljig kristallin substans med en metallisk glans. Till skillnad från diamant är grafit mjukt (lämnar ett märke på papper) och ogenomskinligt, leder värme och elektrisk ström väl. Grafitens mjukhet beror på dess skiktade struktur. I kristallgallret av grafit är kolatomer som ligger i samma plan ordentligt bundna till vanliga hexagoner. Bindningarna mellan skikten är svaga. Det är väldigt eldfast. Grafit används för att tillverka elektroder, fasta smörjmedel, neutronmoderatorer i kärnreaktorer och penna stavar. Vid höga temperaturer och tryck erhålls konstgjorda diamanter från grafit, som ofta används inom teknik.
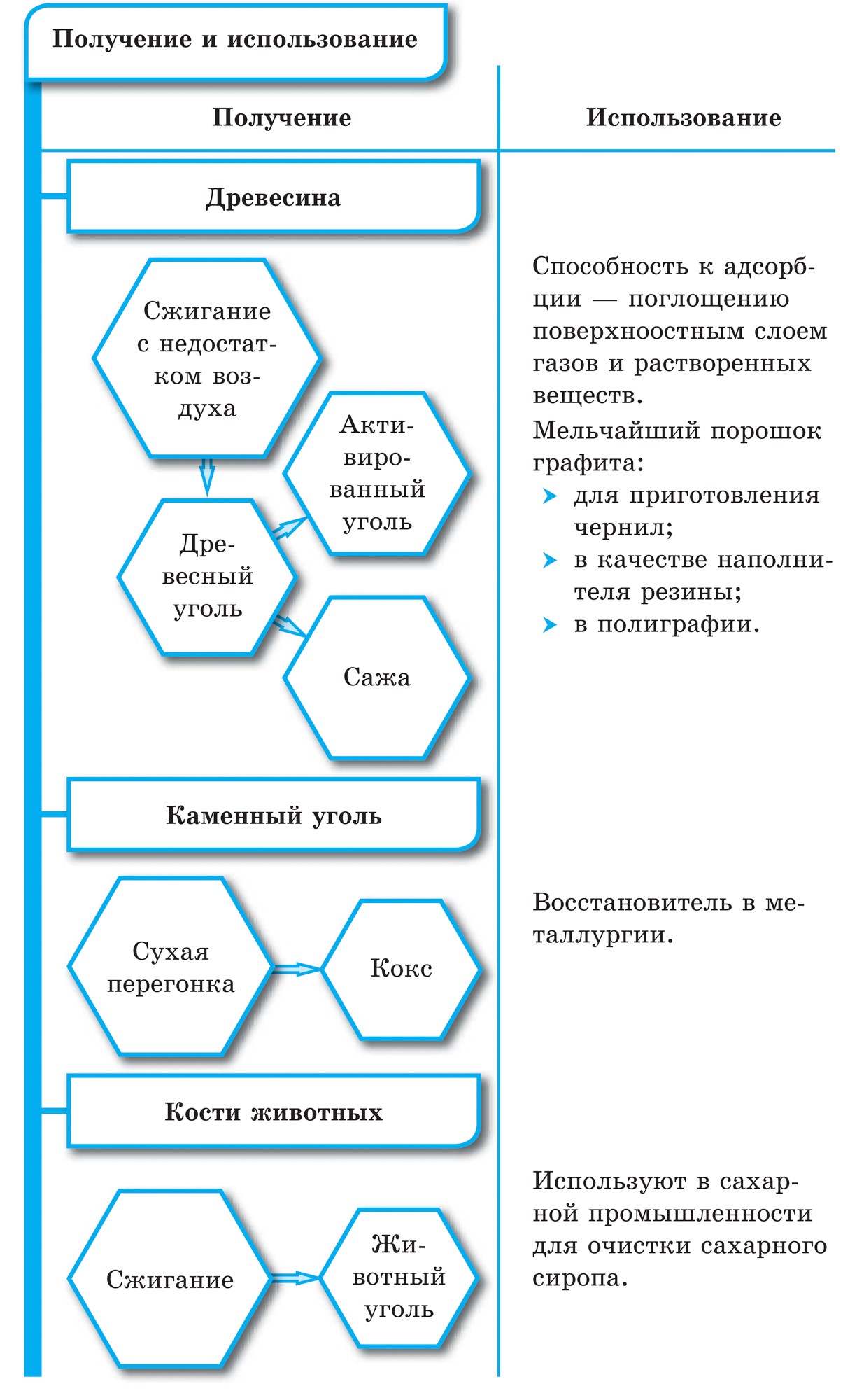
Sot och kol har en struktur som liknar grafit. Kol erhålls genom torr destillation av trä. Detta kol har på grund av sin porösa yta en anmärkningsvärd förmåga att absorbera gaser och lösta ämnen. Denna egenskap kallas adsorption. Ju större kolens porositet är, desto effektivare blir adsorptionen. För att öka absorptionskapaciteten behandlas kolet med varm ånga. Kolbehandlat på detta sätt kallas aktiverat eller aktivt. På apotek säljs det i form av svarta karbolentabletter.
Kemiska egenskaper hos kol
Diamant och grafit kombineras med syre vid mycket höga temperaturer. Sod och kol interagerar mycket lättare med syre och brinner i det. Men i vilket fall som helst är resultatet av en sådan interaktion densamma - koldioxid bildas:
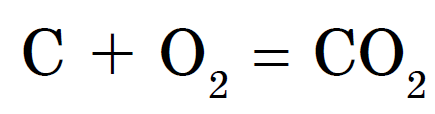
Med metaller bildas kol vid upphettning karbider:
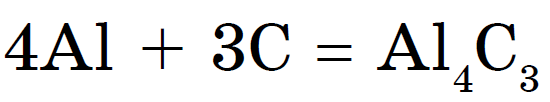
Aluminiumkarbid - ljusgula genomskinliga kristaller. Känd kalciumkarbid CaC 2 i form av bitar av grått. Den används av gassvetsare för att producera acetylen:
Acetylenanvänds för skärning och svetsning av metaller, förbränning med syre i speciella facklor.
Om du agerar på aluminiumkarbid med vatten får du ytterligare en gas - metanCH 4:
Kisel
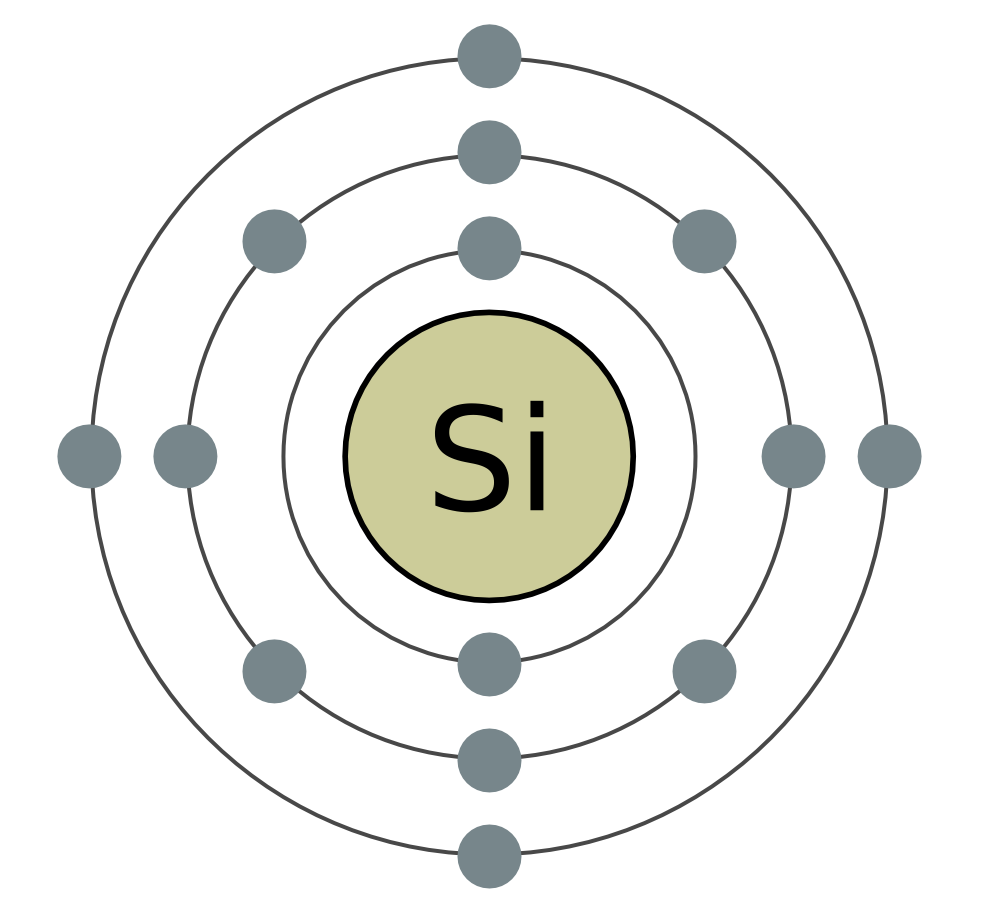
Kisel (Si) är det andra elementet i huvudundergruppen i grupp IV i det periodiska systemet. I naturen är kisel det näst vanligaste kemiska grundämnet efter syre. Mer än en fjärdedel av jordskorpan består av dess föreningar. Den vanligaste kiselföreningen är dess SiO2-kiseldioxid. I naturen bildar den mineralkvartset och många sorter, som bergkristall och dess berömda lila form - ametist, samt agat, opal, jaspis, kalsedon, karneol. Kiseldioxid är också vanligt och kvartssand. Den andra typen av naturliga kiselföreningar är silikater. Bland dem är de vanligaste aluminosilikaterna - granit, olika sorter lera, glimmer. Det icke-aluminiumsilikatet är till exempel asbest. Kiseloxid är viktigt för växt- och djurlivet. Det ger styrka för växtstammar och djurskydd. Kisel ger jämnhet och styrka till mänskliga ben. Kisel är en del av de lägsta levande organismerna - kiselalger och radioaktiva.
Kisel kemiska egenskaper
Kisel brinner i syre bildar kiseldioxid eller kiseloxid (IV):
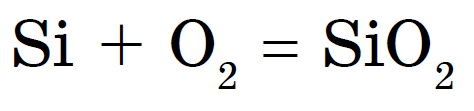
Som en icke-metall kombineras den med upphettning med metaller för att bildas silikider:
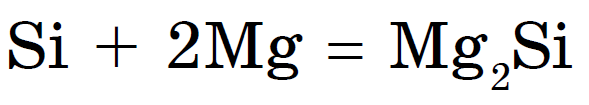
Silicider sönderdelas lätt av vatten eller syror, medan en gasformig vätesilikonförening frigörs - silan:
4HCl + Mg2Si → SiH4 + 2MgCl2
Till skillnad från kolväten antänds silan spontant i luften och brinner för att bilda kiseldioxid och vatten:
Den ökade reaktiviteten hos silan jämfört med metan CH4 förklaras av det faktum att kisel har en större atomstorlek än kol, därför kemiska bindningar Si-H är svagare än CH-obligationer.
Kisel samverkar med koncentrerade vattenlösningar av alkali, bildar silikater och väte:
Kisel erhålls, reducerar den från dioxid med magnesium eller kol:
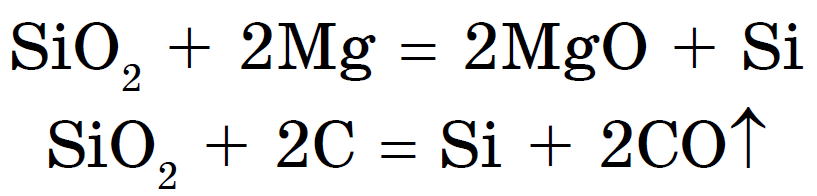
Kiseloxid (IV), eller kiseldioxid, eller kiseldioxid Si02, som C02, är en sur oxid. Till skillnad från CO 2 har den dock inte molekylär utan atomär kristallgitter... Därför är Si02 en fast och eldfast substans. Det löser sig inte i vatten och syror, förutom fluorvätesyra, men reagerar vid höga temperaturer med alkalier för att bilda kiselsyrasalter - silikater:
Silikater kan också erhållas genom att smälta kiseldioxid med metalloxider eller karbonater:
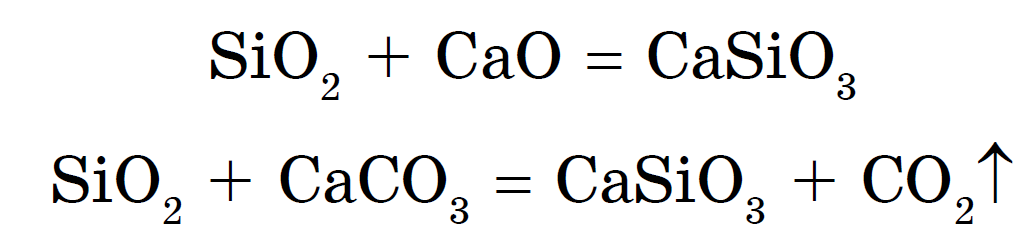
Natrium- och kaliumsilikater kallas lösligt glas. Dem vattenlösningar är ett välkänt silikatlim. Från silikatlösningar, verkan av starkare syror på dem - saltsyra, svavelsyra, ättiksyra och till och med kolsyra - kiselsyra H 2 SiO 3 :
Därmed, H 2 SiO 3 - mycket svag syra... Den är olöslig i vatten och faller ut ur reaktionsblandningen i form av en gelatinös fällning och fyller ibland hela volymen av lösningen kompakt och omvandlar den till en halvfast massa, liknar gelé, gelé. När denna massa torkar bildas en mycket porös substans - kiselgel, som ofta används som ett adsorbent som absorberar andra ämnen.



Referensmaterial för testning:
periodiska systemet
Löslighetstabell