Inverkan av mediets surhet på typen av reaktionsprodukter inses särskilt tydligt i exemplet med reduktion av permanganatjonen MnO4 -.
och) i en sur miljö, i enlighet med det första schemat, sker den djupaste minskningen av manganatomen.
MnO 4 - + 8H + + 5e - → Mn 2+ +4 H20.
I detta fall bildas mangansalter (II), vars anjon beror på syran, vilket skapar en sur miljö. Så i en svavelsyramiljö bildas MnSO4 i en saltsyra MnCl2. Observera att metallisk mangan inte kan bildas, eftersom denna metall i serien av metallspänningar är betydligt till vänster om väte och oxideras av H + -joner. b) i neutralt(svagt alkaliskt eller svagt surt medium) permanganatjon reduceras till mangandioxid MnO 2 faller ut ur lösningen i form av en svartbrun fällning
Bästa svaret: Hydrogen Chemistry. Väte kan inte betraktas som en del av någon av grupperna, eftersom det har hög joniseringsenergi, låg elektronaffinitet och måttlig elektronegativitet. Väte är inte särskilt reaktivt när det är vid låga temperaturer.
Reaktionen av väte med syre och klor är exoterm och spontan men har hög aktiveringsenergi. Reaktionshastigheten kan ökas med en katalysator. Alla element i denna grupp är mjuka och silvergrå. Dess smältpunkt minskar med ökande atomnummer.
MnO 4 - + 2Н 2 О + 3е - → MnO 2 + 4ОН -.
I detta fall sker väsentlig alkalisering av lösningen.
i) i en mycket alkalisk miljööverföringen av elektroner utförs med stora svårigheter (på grund av den höga koncentrationen av negativt laddade OH-joner). Minskning sker av manganatjonen MnO4 2-, som har en grön färg:
Litium skiljer sig avsevärt från andra element i grupp 1 och har en diagonal relation med magnesium. Litenheten hos denna katjon gör den mycket polariserande, och kemiska bindningar har en uttalad kovalent karaktär. Alkalimetaller har stora radier, låga kärnkraftsladdningar och låga joniseringsenergier. Därför är de mycket reaktiva. De reagerar med nästan alla icke-metaller, liksom många föreningar.
Som ett resultat av den höga reaktiviteten hos alkalimetaller är deras föreningar mycket viktigare än själva metallerna. Reaktionerna av alkalimetaller med vatten blir mer och mer explosiva när vi går till det periodiska systemet. Grupp 2: Alkaliska jordartsmetaller.
MnO 4 - + 1е - → MnO 4 2-
Viss försiktighet måste iakttas när man arbetar med krom (VI) föreningar. Faktum är att dikromatjonen Cr207 2- är stabil i en sur miljö med egenskaper som ett starkt oxidationsmedel i en alkalisk miljö, utan att ändra oxidationstillståndetblir kromatjon CrO4 2- och uppvisar mycket svaga oxidationsegenskaper.
Denna grupp består av beryllium, kalcium, magnesium och barium. Jordalkalimetaller är inte lika reaktiva som alkalimetaller. De har mindre radier och deras kärnladdningar är större än alkalimetaller av samma linje i det periodiska systemet. De måste också förlora två elektroner för att uppnå den elektroniska konfigurationen av ädelgasen.
När alkalimetallernas reaktivitet ökar alkalimetaller när gruppen går ner i det periodiska systemet och av samma skäl. I vissa fall liknar egenskaperna för elementen i den andra perioden mer egenskaperna hos elementet från den tredje perioden i gruppen med större nummer. Till exempel ser litium mer ut som magnesium än natrium på flera sätt. Likheterna mellan litium och magnesium är exempel på en diagonalbindning i det periodiska systemet.
Cr207 2- + 2OH - → 2CrO 4 2- + H2O
Tvärtom bildar kromat dikromat i en sur miljö.
2CrO 4 2- + 2Н + → Cr 2 O 7 2- + Н 2 О
I en sur miljö reduceras Cr207-2-jonen till Cr3+ -joner:
Cr207 2- + 14H + + 6e - → 2Cr 3+ +7 H20.
Beroende på det specifika reduktionsmedlet och de faktiska syrabasparametrarna för lösningen kan krom reduceras antingen till en fällning av Cr (OH) 3 eller, på grund av de amfotära egenskaperna hos krom (III) föreningar, till ett lösligt komplex anjon 3-. I vilket fall som helst kommer oxidationstillståndet i kromreduktionsprodukterna alltid att vara + III.
Harv extraheras från gruvor i form av borax och kärna. Under extraktionsprocessen omvandlas mineraler till boroxid med syra, som sedan reduceras med magnesium till en oren, brun och amorf form av bor. Elementärbor har olika allotropa sorter. Det är vanligtvis ett svartgrått, icke-metalliskt högsmältande fast ämne eller ett fint pulver med en struktur baserad på grupper om 12 atomer.
Den används i flyg, missiler och skottsäkra jackor. Elementet är mycket inert och utsätts för endast de mest kraftfulla oxidanterna. Bor, som det första elementet i grupp 13, i de flesta av sina kemiska egenskaper, beter sig som en icke-metall. Den har syraoxider och bildar ett stort antal intressanta binära molekylära hydrider.
Å andra sidan, om oxidationen av kromföreningar utförs i ett alkaliskt medium, kommer oxidationsprodukterna att vara kromatjoner CrO4 2-, men om oxidationen sker i ett surt medium, då är joner Cr20772 - kommer att bildas.
Effekt av koncentration på kompositionen av reaktionsprodukter
Påverkan av koncentrationen av reaktanter i ORR manifesteras tydligast i exemplet med reaktioner med salpetersyra och svavelsyra.
Enkla ämnen, icke-metaller. Strukturera. Fysikaliska egenskaper
Bor, är icke-metalliskt, har sura oxider. Borsyra används som ett milt antiseptiskt medel och är en mycket mild monoprotinsyra. Boroxid är en syraanhydrid. Bor och aluminiumhalogenider fungerar som Lewis-syror.
Det används som ett bränsle i rymdraketer på grund av den stora mängden energi som frigörs när det interagerar med syre. Aluminium är den vanligaste metallen i jordskorpan. Aluminiummineraler i rasform bildar lera, som är en viktig del av jorden. Geologer tror att detta är den viktigaste kemiska reaktionen på jorden, för utan jord kunde växter inte växa.
Reaktioner salpetersyra .
Låt oss komma ihåg att dessa syror både är oxidationsmedel och skapare av miljön.
Salpetersyra reagerar, som ett oxidationsmedel, med metaller, oxider och hydroxider av metaller i mellanliggande oxidationstillstånd, med icke-metaller och deras oxider som innehåller en icke-metall i ett mellanliggande oxidationstillstånd. Produkterna för reduktion av salpetersyra bildar som regel en blandning av ämnen (som regel oxider), men beroende på koncentrationen kommer en eller annan produkt att råda i reaktionsblandningen. Följande regelbundenheter fastställdes experimentellt:
Metalliskt aluminium erhålls genom Hall-processen. Metall är en mycket bra ledare för värmeenergi och elektricitet; den är mycket formbar och segbar. Det lockas inte av magneter eller gnistor. Den kan formas med alla metallbearbetningsmetoder, bindas ihop sig själv eller andra metaller med användning av alla procedurer och avsevärt minska kostnaderna för många processer.
Aluminium har låg densitet; Det är en stark metall och en utmärkt elektrisk ledare. Även om den är mycket deprimerande och därför lätt oxiderad, är den motståndskraftig mot korrosion. Aluminiums låga densitet, breda tillgänglighet och korrosionsbeständighet gör den idealisk för konstruktion.
Koncentrerad salpetersyra reduceras till NEJ 2 .
NO 3 - + 2H + + 1e - → NO2 + H2O
Måttligt utspädd salpetersyra reduceras till NEJ.
NO 3 - + 4H + + 3e - → NO + 2H20
Mycket utspädd salpetersyra, som reagerar med ett aktivt reducerande medel (Mg, Ca, Al, etc.) reduceras till ett salt - ammoniumnitrat NH 4 NEJ 3 .
Den metalliska karaktären ökar när den minskar med gruppen, och till och med borens närmaste granne, aluminium, är en metall. Hur som helst är aluminium för långt till höger om det periodiska systemet för att inte visa några icke-metalliska symboler. Således är aluminium amfotert och reagerar med icke-oxiderande syror för att bilda aluminiumjoner.
Och med heta alkaliska lösningar för att bilda aluminatjoner. Aluminium, borens metallgranne, har amfotera oxider. Dessutom är denna katjon mycket polariserad. Den finns i ett brett utbud av kristallstrukturer. Det är ganska reaktivt och amfotert.
NO 3 - + 10H + + 8e - → NH4 + + 3H20
Reduktionsprodukterna kan också inkludera kvävgas N2, N20.
Denna definition utelämnar elementen i grupp VIII i huvudundergruppen - inerta eller ädelgaser, vars atomer har ett fullständigt yttre elektronskikt. Den elektroniska konfigurationen av dessa elementers atomer är sådan att de inte kan tillskrivas vare sig metaller eller icke-metaller. De är föremålen som naturligt system separera elementen tydligt i metaller och icke-metaller och uppta en gränsposition mellan dem. Inerta eller ädelgaser ("adel" uttrycks i tröghet) kallas ibland icke-metaller, men rent formellt, enligt fysiska egenskaper. Dessa ämnen förblir gasformiga till mycket låga temperaturer.
Denna form absorberar vatten och används som en stationär fas vid kromatografi. Aluminiumhydroxid bildar ett svampigt och gelatinöst nätverk som fångar upp föroreningar under utfällning och separerar fällningen genom filtrering. Talium är giftigt på grund av dess förmåga att ersätta kalium.
Oxidationstillståndet för fluor i föreningar
Grupp 14: Kolfamiljen. Grupp 14 innehåller kol, den viktigaste föreningen för livet, och kisel, det viktigaste för modern teknik och artificiell intelligens. Kol, i spetsen för gruppen, bildar så många ämnen att det har sin egen gren inom kemi, organisk kemi.
De kemiska trögheten hos dessa element är relativt. För xenon och krypton är föreningar med fluor och syre kända. Utan tvekan fungerade inerta gaser som reduktionsmedel vid bildandet av dessa föreningar.
Från definitionen av icke-metaller följer att deras atomer kännetecknas av höga värden för elektronegativitet. Oia varierar från 2 till 4. Icke-metaller är element i huvudundergrupperna, huvudsakligen p-element, med undantag av väte - s-element.
Alla icke-metalliska element (utom väte) upptar i det periodiska systemet kemiska element DI Mendeleev övre högra hörnet, bildar en triangel vars topp är fluor.
Elementen visar en alltmer metallisk karaktär när de går ner genom gruppen. Kol har bestämda icke-metalliska egenskaper; bildar kovalenta föreningar med icke-metaller och jonföreningar med metaller. Oxiderna av kol och kisel är syror. Germanium är en typisk metalloid som har metalliska eller icke-metalliska egenskaper i linje med det andra elementet som finns i föreningen. Denna burk, och ännu mer bly, har bestämt dess metalliska egenskaper.
Tenn ligger dock nära bordet av metalloider och har vissa amfotära egenskaper. Även om kol är det fjärde mest förekommande elementet som finns i universum, förekommer det inte i samma proportion på jorden. Diamanter och grafit förekommer naturligt, men mest kol kombineras med andra ämnen för att bilda föreningar.
Särskild uppmärksamhet bör emellertid ägnas vätens dubbla position i det periodiska systemet: i grupperna I och VII i huvudundergrupperna. Detta är ingen slump. Å ena sidan har en väteatom, som alkalimetallatomer, en elektron (1s1 elektronisk konfiguration) på det yttre (och endast för det) elektronskiktet, som det kan donera, och uppvisar egenskaperna hos ett reduktionsmedel.
Exempel på problemlösning
Kol har en viktig serie allotroper: diamant, grafit och fullerener. Varken diamant eller grafit reagerar vid rumstemperatur; ingen av dem reagerar med syre, med reduktionsmedel eller med syror eller baser. Men vid höga temperaturer reagerar diamant och grafit med olika element och föreningar.
Grafit är mer reaktivt än diamant. För interaktion mellan diamanten, mer höga temperaturerän i fallet med grafit. I normala förhållanden grafit är den mest termodynamiskt stabila allotropen. Kol är det enda elementet i grupp 14 som vanligtvis bildar flera bindningar.
I de flesta av dess föreningar uppvisar väte, som alkalimetaller, ett oxidationstillstånd på +1, men frisättningen av en elektron av en väteatom är svårare än för alkalimetallatomer. Å andra sidan saknar väteatomen, liksom halogenatomer, en elektron för att komplettera det yttre elektronskiktet, så väteatomen kan acceptera en elektron, som uppvisar egenskaperna hos ett oxidationsmedel och oxidationstillståndet som är karaktäristiskt för halogen -1 i hydrider - föreningar med metaller, liknar metallföreningar med halogener - halogenider. Men fästningen av en elektron till en väteatom är svårare än med halogener.
Kol har två viktiga oxider, koldioxid och kolmonoxid; den första är syraanhydriden av kolsyra, en föregångare till karbonater och karbonater. Koldioxid bildas när organiskt material bränns i överskott av luft. Koldioxid är en färglös gas, vilket innebär att den inte absorberar synligt ljus.
Koldioxid är luktfri, lätt sur och orsakar i höga koncentrationer död på grund av syrebrist. Koldioxid är mycket lösligt i vatten. Koldioxid är en typisk icke-metalloxid och är en syra. Fast koldioxid kallas torris eftersom den sublimerar istället för smält is och används för att kyla glass, kött och frysta livsmedel under transport.
När normala förhållanden väte H2 - gas. Dess molekyl, liksom halogener, är diatomisk.
Kolmonoxid är en färglös, luktfri, brandfarlig, nästan olöslig och mycket giftig gas. Kolmonoxid är ett reduktionsmedel som används vid produktion av stora mängder metaller, där järn är det viktigaste i masugnar.
Glasindustrin använder mer än en tredjedel av kalciumkarbonatet som produceras varje år. Natriumkarbonat används för att göra bakpulver. Natriumkarbonat används också i brandsläckare med torrt pulver. Kisel är det näst vanligaste elementet i jordskorpan. Det finns rikligt i stenar i form av silikater, silikatjonföreningar och som kiseldioxid i sand.
Atomer av icke-metaller domineras av oxiderande egenskaper, det vill säga förmågan att fästa elektroner. Denna förmåga kännetecknas av värdet av elektronegativitet, som regelbundet förändras i perioder och undergrupper (Fig. 47).
Fluor - det mest kraftfulla oxidationsmedlet, dess atomer i kemiska reaktioner kan inte donera elektroner, det vill säga uppvisa reducerande egenskaper.
Minskande egenskaper hos enkla ämnen - icke-metaller
Kiselföreningar kan fungera som Lewis-baser eftersom en kiselatom kan expandera sitt valensskal. Kiselföreningar kan fungera som Lewis-syror, men kolsyror kan inte. Det förekommer naturligt som kvarts och sand, som består av små kvartsfragment, vanligtvis färgade med orenheter med guldbrun järnoxid.
Vissa ädelstenar eller halvedelstenar är oren kiseldioxid. Silikater kan betraktas som strukturer av kiseltetrahedrala oxoanoner. Germanium liknar mycket kisel; den första är också en halvmetall, har en kristallstruktur i form av en diamant och används för tillverkning av halvledaranordningar. Båda de nedre medlemmarna i grupp 14, tenn och bly, är metaller.
Konfiguration av det yttre elektronskiktet
Andra icke-metaller kan uppvisa reducerande egenskaper, om än i mycket svagare grad än metaller; i perioder och undergrupper förändras deras reduktionsförmåga i omvänd ordning jämfört med den oxidativa.
Det finns bara 161 icke-metalliska kemiska element. En hel del, med tanke på att 114 element är kända. Två icke-metalliska element utgör 76% av jordskorpans massa. Dessa är syre (49%) och kisel (27%). Atmosfären innehåller 0,03% av massan av syre i jordskorpan. Icke-metaller utgör 98,5% av växternas massa, 97,6% av den mänskliga kroppens massa. Sex icke-metaller - C, H, O, N, P och S - är biogena element som utgör de viktigaste organiska substanserna i en levande cell: proteiner, fetter, kolhydrater, nukleinsyror. Luften vi andas in innehåller också enkla och komplexa ämnen format element mineraler (syre O2, kväve, koldioxid CO2, vattenånga H2O, etc.).
Tenn och bly erhålls lätt från sina mineraler och har varit kända sedan antiken. Tenn är dyrt och inte särskilt starkt, men motstår korrosion. Blyens hållbarhet och dess smidighet gör det användbart material för konstruktion. Bly är giftigt och blyförgiftning kallas akut blyförgiftning eller kronisk blyförgiftning.
De enda lösliga blysalterna är nitrat och acetat. Grupp 15: Kvävefamilj. Grupp 15-element har egenskaper som har egenskaper som sträcker sig från icke-metalliskt kväve och fosfor till typiskt metallisk vismut.
Väte - huvudelement Universum. Många rymdobjekt (gasmoln, stjärnor inklusive solen) består av mer än hälften av väte. På jorden är den, inklusive atmosfären, hydrosfären och litosfären, bara 0,88%. Men detta är efter massa, och atommassan av väte är mycket liten. Därför är dess lilla innehåll bara uppenbart, och av 100 atomer på jorden är 17 väteatomer.
Enkla ämnen, icke-metaller. Strukturera. Fysikaliska egenskaper
I enkla ämnenah-atomer av icke-metaller är kovalent bundna av en icke-polär bindning. På grund av detta bildas ett mer stabilt elektroniskt system än hos isolerade atomer. I detta fall, enkel (till exempel i vätemolekyler H2, halogener Ru, Br2), dubbel (till exempel i svavelmolekyler, till exempel, kovalenta bindningar i kvävemolekyler.
Som du redan vet kan enkla icke-metalliska ämnen ha:
1. Molekylär struktur. Under normala förhållanden är de flesta av dessa ämnen gaser eller fasta ämnen, och endast en enda brom (Br2) är flytande. Alla dessa ämnen har en molekylär struktur och är därför flyktiga. I fast tillstånd är de smältbara på grund av den svaga intermolekylära interaktionen som håller deras molekyler i kristallen och kan sublimera.
2. Atomstruktur. Dessa ämnen bildas av långa kedjor av atomer. På grund av den höga hållfastheten hos kovalenta bindningar har de som regel en hög hårdhet och alla förändringar associerade med förstörelsen av den kovalenta bindningen i deras kristaller (smältning, avdunstning) utförs med stora energikostnader. Många av dessa ämnen har höga smält- och kokpunkter, och deras flyktighet är mycket låg. (I figur 47 är symbolerna för de icke-metalliska elementen som endast bildar atomkristallgaller understrukna.)
Många icke-metalliska element bildar flera enkla ämnen - allotropa modifieringar. Som ni minns kallas denna atoms egenskap allotropi. Allotropi kan associeras med en annan sammansättning av molekyler och med en annan struktur av kristaller. Allotropa modifieringar av kol är grafit, diamant, karby, fulleren (fig. 48).

Icke-metalliska element med egenskapen allotropi indikeras i figur 47 med en asterisk. Så det finns mycket enklare icke-metalliska ämnen än icke-metalliska kemiska element.
Du vet att de flesta metaller, med sällsynta undantag (guld, koppar och några andra), kännetecknas av en silvervit färg. Men för enkla ämnen som inte är metall är färgerna mycket mer varierande.
Trots de stora skillnaderna i fysikaliska egenskaper icke-metaller bör dock vissa av deras gemensamma särdrag noteras. Alla gasformiga ämnen, flytande brom, liksom typiska kovalenta kristaller är dielektriska ämnen, eftersom alla yttre elektroner i deras atomer används för att bilda kemiska bindningar... Kristaller är inte plastiska, och eventuell deformation orsakar förstörelse av kovalenta bindningar. De flesta icke-metaller har ingen metallisk glans.
Kemiska egenskaper
Som vi redan har noterat är både oxiderande och reducerande egenskaper karakteristiska för atomerna hos icke-metaller och följaktligen för de enkla ämnen som bildas av dem.
Oxiderande egenskaper hos enkla ämnen av icke-metaller
1. Oxiderande egenskaper hos icke-metaller manifesteras främst när de interagerar med metaller (som ni vet är metaller alltid reduktionsmedel):

De oxiderande egenskaperna för klor Cl2 är mer uttalade än för svavel, därför är metallen Fe, som har stabila oxidationstillstånd på +2b +3 i föreningar. den oxideras av den till ett högre oxidationstillstånd.
2. De flesta icke-metaller uppvisar oxiderande egenskaper när de interagerar med väte. Som ett resultat bildas flyktiga väteföreningar.
3. Varje icke-metall fungerar som ett oxidationsmedel i reaktioner med de icke-metaller som har ett lägre värde för elektronegativitet:
Elektronegativiteten för svavel är större än för fosfor, så den uppvisar oxiderande egenskaper här.
Elektronegativiteten för fluor är större än för alla andra kemiska element, därför uppvisar den egenskaperna hos ett oxidationsmedel.
Fluor är det starkaste oxidationsmedlet bland icke-metaller; det uppvisar endast oxidationsegenskaper i reaktioner.
4. Oxiderande egenskaper hos icke-metaller uppträder också i reaktioner med vissa komplexa ämnen... Inte bara syre utan även andra icke-metaller kan också vara oxidationsmedel vid reaktioner med komplexa ämnen - oorganiska och organiska.
Klor Cl2, ett starkt oxidationsmedel, oxiderar järn (II) klorid till järn (III) klorid.
Du kommer naturligtvis ihåg den kvalitativa reaktionen på omättade föreningar - missfärgning av bromvatten.
Minskande egenskaper hos enkla ämnen - icke-metaller
När man överväger reaktionen av icke-metaller med varandra har vi redan noterat att beroende på värdena på deras elektronegativitet uppvisar en av dem egenskaperna hos ett oxidationsmedel och den andra uppvisar egenskaperna hos ett reduktionsmedel.
1. I förhållande till fluor uppvisar alla icke-metaller (även syre) reducerande egenskaper.
2. Naturligtvis fungerar icke-metaller, förutom fluor, som reduktionsmedel vid interaktion med syre:

8 Många icke-metella kan fungera som ett reduktionsmedel vid reaktioner med komplexa oxiderande ämnen:

Det finns också reaktioner där en och samma icke-metall både är ett oxidationsmedel och ett reduktionsmedel, dessa är självoxiderande-självreduktionsreaktioner.
Så, låt oss sammanfatta! De flesta icke-metaller kan verka i kemiska reaktioner både som oxidationsmedel och som reduktionsmedel (reducerande egenskaper är inte inneboende i enbart fluor).
Väteföreningar av icke-metaller
En gemensam egenskap hos alla icke-metaller är bildandet av flyktiga väteföreningar, i vilka de flesta icke-metaller har ett lägre oxidationstillstånd.

Det är känt att dessa föreningar enklast kan erhållas direkt genom växelverkan mellan icke-metall och väte, dvs genom syntes.
Vm-väteföreningar av icke-metaller obdoeoany är konala polära bindningar, har en molekylär struktur och är under normala förhållanden gaser, förutom vatten (vätska). Lla-väteföreningar av icke-metaller kännetecknas av ett bra förhållande till vatten. Metai och Enlan är praktiskt taget olösliga i det. När den är upplöst i vatten bildar ammoniak en plattbas - ammoniakhydrat.
Förutom de betraktade egenskaperna uppvisar väteföreningar av icke-metaller i redoxreaktioner alltid reduktiva egenskaper, eftersom icke-metallen i dem har det lägsta oxidationstillståndet.
Icke-metalloxider och deras motsvarande hydroxider
I oxider av icke-metaller är bindningen mellan atomer kovalent polär. Bland oxiderna med molekylstruktur finns gasformiga, flytande (flyktiga), fasta (flyktiga).
Icke-metalloxider är uppdelade i två grupper: icke-saltbildande och målbildande. När syraoxider löses i vatten bildas hydrater av oxider - hydroxider, som är syror i naturen. Syror och sura oxider som ett resultat kemiska reaktioner bilda salter i vilka icke-metallen behåller sitt oxidationstillstånd.
Oxider och deras motsvarande hydroxider - syror i vilka icke-metallen uppvisar ett oxidationstillstånd lika med gruppnumret, det vill säga dess högsta värde, kallas högre. När vi överväger den periodiska lagen har vi redan karaktäriserat deras sammansättning och egenskaper.
förbättring av sura egenskaper hos oxider och shdronepdop Inom en huvudundergrupp, exempelvis grupp VI, fungerar följande mönster av förändringar i egenskaperna hos högre oxider och hydroxider.
Om en icke-metall bildar två eller flera sura oxider, och därmed motsvarande syreinnehållande syror, ökar deras sura egenskaper med en ökning av oxidationsgraden för den icke-metallen.
Oxider och syror, i vilka icke-metallen har det högsta oxidationstillståndet, kan endast uppvisa oxidationsegenskaper.
Oxider och syror, där icke-metallen har ett mellanliggande oxidationstillstånd, kan uppvisa både oxiderande och reducerande egenskaper.
Praktiska uppgifter
1. Till vilka elektroniska familjer kommer icke-metalliska element att lutas?
2. Vilka icke-metallelement är biogena?
3. Vilka faktorer avgör valensförmågan hos icke-metalliska atomer? Tänk på dem med exemplet syre- och svavelatomer.
4. Varför är vissa icke-metaller under normala förhållanden - gaser, andra - fasta eldfasta ämnen? 5. Ge exempel på enkla icke-metalliska substanser som existerar under normala förhållanden i ett annat aggregationstillstånd: a) gasformigt, b) flytande, c) fast ämne.
6. Gör ekvationerna för redoxreaktioner som involverar icke-metaller. Vilka egenskaper (oxiderande eller reducerande) uppvisar icke-metaller i dessa reaktioner?

Av vilken anledning är kokpunkterna för vatten och vätesulfid väldigt olika, men kokpunkterna för vätesulfid och selen ligger nära varandra?
7. Varför är metan stabil i luft, men stark i luft antänds spontant: vätefluorid är motståndskraftigt mot uppvärmning, vätejod sönderdelas i jod och väte även med svag upphettning?
8. Skriv reaktionsekvationerna med vilka du kan utföra följande övergångar:
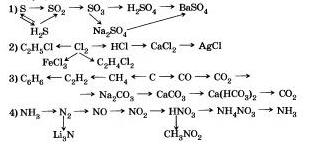
9. Skriv reaktionsekvationerna med vilka du kan utföra följande övergångar:

12. Genom en lösning innehållande 10 g natriumhydroxid passerade 20 g vätesulfid. Vilken typ av salt och hur mycket kommer det att tjäna?
Svar: 0,25 mol NaHS.
14. Vid bearbetning av 30 g kalksten med saltsyra erhölls 11 g koldioxid. Vad är massfraktionen av kalciumkarbonat i naturlig kalksten? Svar: 83,3%. 15. Jodtinkturen som används i medicin är en 51% lösning av kristallin jod i etylalkohol. Vad är alkoholvolymen, vars densitet är 0,8 g / ml. krävs det att bereda 250 g av en sådan lösning?
Svar: 297 ml. 16. En blandning av kisel, grafit och kalciumkarbonat, 34 g i vikt, behandlades med en natriumhydroxidlösning och 22,4 liter gas erhölls (ej tillämpligt). Vid bearbetning av en sådan del av blandningen med saltsyra erhölls 2,24 liter gas (n.u.). Bestäm massans sammansättning av blandningen.
Svar: 14 g 81: 10 g C; 10 g CaCO2.
17. Gasformig ammoniak med en volym av 2,24 liter (standardenhet) absorberas av 20 g av en fosforsyralösning med en massfraktion på 49%. Vilket salt bildades, vilken massa har det?
Svar: 11,5 g
19. Vilken volym ammoniak krävs för att erhålla 6,3 ton salpetersyra, förutsatt att produktionsförluster är lika med 5%?
Svar: 2352 m3.
20. Från naturgas Acetylen erhölls med en volym av 300 liter (standardenhet) med en volymfraktion av metan i gasen på 96%. Bestäm volymen om produktutbytet är 65%.
Svar: 93,6 l.
21. Bestäm strukturformel kolväte med en ångdensitet i luften av 1,862 och en massfraktion av kol 88,9%. Det är känt att ett kolväte interagerar med en ammoniaklösning av silveroxid.
Icke-metallers roll i människors liv
Icke-metaller spelar en stor roll i människolivet, eftersom utan dem är livet omöjligt inte bara för människor utan också för andra levande organismer. Trots allt tack vare sådana icke-metalliska elementsom syre, kol, väte och kväve bildas aminosyror, från vilka proteiner bildas, utan vilka allt liv på jorden inte kan existera.
Låt oss ta en närmare titt på bilden nedan, som visar de viktigaste icke-metallerna:

Låt oss nu titta på några icke-metaller mer detaljerat och ta reda på deras betydelse att de spelar i en människas liv och i hans kropp.
En persons fulla liv beror på luften han andas in, och luften innehåller icke-metaller och föreningar mellan dem. Syre är involverat i att tillhandahålla de viktigaste funktionerna i vår kropp, och kväve och andra gasformiga ämnen späd ut den och skyddar därmed våra luftvägar. När allt kommer omkring, från biologins gång vet du redan att alla kroppens skyddande funktioner är nära relaterade till närvaron av syre.
Ozon skyddar vår kropp från penetration av skadlig UV-strålning.
Ett sådant viktigt spårämne som svavel i människokroppen fungerar som ett mineral av skönhet, eftersom tack vare det kommer huden, naglarna och håret att förbli friska. Glöm inte heller att svavel deltar i bildandet av brosk och benvävnader, hjälper till att förbättra ledernas funktion, stärker vår muskelvävnad och utför många andra funktioner som är mycket viktiga för människors hälsa.
Kloranjoner spelar också en viktig biologisk roll för människor eftersom de deltar i aktiveringen av vissa enzymer. Med deras hjälp upprätthålls en gynnsam miljö i magen och det osmotiska trycket upprätthålls. Klor kommer som regel in i människokroppen på grund av bordssalt när man äter.
Förutom de viktiga egenskaperna som icke-metaller har på människokroppen och andra levande organismer, används dessa ämnen i olika andra industrier.
Applicering av icke-metaller
Väte
Denna typ av icke-metaller, som väte, används ofta i den kemiska industrin. Det används för syntes av ammoniak, metanol, väteklorid samt för hydrering av fetter. Du kan inte heller göra utan väte, som reduktionsmedel och i produktionen av många metaller och deras föreningar.
Väte används också i stor utsträckning inom medicin. Vid behandling av sår och för att stoppa mindre blödning används en lösning av väteperoxid med tre procent.
Klor
Klor används för produktion av saltsyra, gummi, vinylklorid, plast, liksom många organiska ämnen. Det används i branscher som textilier och pappersarbete som blekmedel. På hushållsnivå är klor oumbärligt för desinfektion dricker vatteneftersom den har oxiderande egenskaper har den en stark desinficeringseffekt. Klorvatten och kalk har samma egenskaper.
För medicinska ändamål används vanligtvis natriumklorid som en saltlösning. Många vattenlösliga läkemedel produceras på grundval av det.
Svavel
En icke-metall såsom svavel används för produktion av svavelsyra, krutt, tändstickor. Det används också för vulkanisering av gummi. Det används vid produktion av färgämnen och fosfor. Och kolloidalt svavel är viktigt inom medicin.
Svavel används också i jordbruket. Det används som ett fungicid för att bekämpa olika skadedjur.
Vid syntes av polymera material såväl som för framställning av olika medicinska preparat används även icke-metaller såsom jod och brom i stor utsträckning.
