Sida 1
Kristallgitteret av aluminium är en ansiktscentrerad kub, som är stabil vid temperaturer från 4 K till smältpunkten.
Kristallgitteret av aluminium består, precis som många andra metaller, av ansiktscentrerade kuber (se s. Aluminiumens värmeledningsförmåga är dubbelt så mycket som värmeledningsförmågan för järn och är lika med halva kopparnas värmeledningsförmåga. Dess elektriska ledningsförmåga är mycket högre än för järn och når 60% av kopparnas elektriska ledningsförmåga).
Förvrängningen av kristallgallret i aluminium på grund av dess övermättnad med koppar leder till en ökning av legeringens hållfasthet och hårdhet. När den härdade legeringen är i luft förekommer spontant processer som förändrar strukturen i den. Kopparatomer, som strävar efter att sticka ut från kristallgallret i aluminium, är grupperade i dess individuella sektioner, jämnt fördelade över hela volymen av legeringen. Detta ökar förvrängningen av kristallgitteret och ökar legeringens hårdhet och hållfasthet. På platser där kopparatomer ackumuleras bildas ett CuA12-kristallgaller, där A1-atomerna längs gränsen samtidigt kommer in i strukturen för CuAls kristallgitter och aluminiumkristallgallret. Bildandet av en sådan struktur leder till ytterligare förvrängning av aluminiumkristallgitteret och, som en följd, till härdningen av legeringen.
Så kristallgitteret av aluminium, koppar, silver har formen av en ansiktscentrerad kub; natrium, kalium, barium - en kroppscentrerad kub och magnesium, zink och kadmium kristalliserar i ett sexkantigt galler. Vissa metaller kristalliserar i två eller flera polymorfa former.
Dessa element, som löses upp i kristallgitteret av aluminium, stärker det avsevärt och minskar bara plasticiteten något, vilket ger god deformerbarhet hos legeringarna.
Eftersom koppar har en stor atomradie (/ GU 1 275 A) förvränger det kristallgitteret av aluminium (rAi 1 43 A) och ökar legeringens mekaniska egenskaper. Exponering vid 150 - 180 ° C orsakar konstgjord åldring, åtföljd av nedbrytning av den fasta lösningen med frisättning av den mellanliggande 0-fasen på ställen för kopparkoncentration, vilket inte skiljer sig i kemisk sammansättning från den stabila CuA12-fasen, men har ett förvrängt tetragonal gitter.
Eftersom koppar har en stor atomradie (r si 1 275 A) förvränger detta kristallgitteret av aluminium / A1 1 43 A) och ökar legeringens mekaniska egenskaper. Exponering vid 150 - 180 ° C orsakar konstgjord åldring, åtföljd av nedbrytning av den fasta lösningen med frigöring på platserna för kopparkoncentration av den mellanliggande b - fasen, som inte skiljer sig i kemisk sammansättning från den stabila CuA12-fasen, men har ett förvrängt tetragonal gitter.
Aktiviteten hos A1 beror inte bara på deltagandet i bildandet av bindningar av d - orbitaler utan också på den lägre styrkan hos kristallgitteret i aluminium jämfört med bor.
Aktiviteten hos aluminium beror inte bara på dess deltagande i bildandet av bindningar av rf - orbitaler, utan också på den lägre styrkan hos kristallgitteret i aluminium jämfört med bor.
En elektronstråle som inträffar på en aluminiumplatta ger ett diffraktionsmönster vid reflektion och vinkelavvikelsen (från centrum för detta mönster) för andra ordningens diffraktionsmaximum i Г Perioden för aluminiumkristallgitteret (avståndet mellan atomplanen) d 0 405 nm.
Således har kristallgitteret av aluminium, koppar och silver formen av en ansiktscentrerad kub; natrium, kalium och barium - en kroppscentrerad kub och magnesium, zink och kadmium - ett sexkantigt galler. Vissa metaller kristalliserar i två eller flera polymorfa former.
I luft täcks aluminium snabbt med en tunn oxidfilm. De första skikten i denna film återger kristallgitteret av aluminium och bildar en mycket stark bindning. Under de senaste 15 åren har tillväxtmekanismen för oxidfilmen framgångsrikt använts för att skapa extremt höga temperaturlegeringar, förstärkta av spridda partiklar av aluminiumoxid. Genom att speciellt odla en förtjockad film med en kemisk eller elektrokemisk metod och införa olika fyllmedel i den kan du ge den vilken färg som helst.
Nyhärdad duralumin har låg hållfasthet och hög duktilitet, trots närvaron av en övermättad fast lösning av koppar i aluminium. Detta beror på det faktum att strukturen hos kristallgitteret av aluminium och koppar är densamma (fcc), och gitterparametrarna skiljer sig något åt. Duralumin förvärvar egenskaper med hög hållfasthet endast som ett resultat av efterföljande åldring. Åldrande är processen för förändringar i strukturen och egenskaperna hos härdade legeringar som sker spontant vid rum eller förhöjda temperaturer.
Siluminer, härdande efter värmebehandling, till exempel efter släckning vid 520 - 530 och långvarig konstgjord åldring i 10 - 30 timmar. Deras höga hållfasthet efter åldrande förklaras av förvrängningen av kristallgitteret i aluminium och separeringen av Guinier-Preston-zoner.
"Kristallgitterkemi" - Molekylära gitter kallas kristallgaller, i vilka noder molekyler finns. Bedömning av dina egna framsteg. Fast ämne. I naturen finns det få ämnen med atomkristallgitter. Metallisk. Atom. Joniska kristallgaller har salter, vissa metalloxider och hydroxider.
"Kristallina och amorfa kroppar" - Druse Marion. Nobelpristagare. Installation för odling av optiska kristaller. Amorf kropp. Metall polykristall. Druse kristaller av bergkristall. N.G. Basov. Den första installationen för odling av LUCH-kristaller. Ametist polykristall (ett slags kvarts). Grovkornad svavelkristall. Fasta egenskaper.
"Egenskaper hos aluminium" - Aluminium som ett enkelt ämne: att erhålla. Aluminium som en enkel substans: kemiska egenskaper: Udda. Ar \u003d 27. Betrakta diagrammet. Vid svårigheter, sätt ett frågetecken bredvid motsvarande egendom. Aluminosilikater utgör den största delen av jordskorpan. Gör en slutsats om förekomsten av aluminium i jordskorpan jämfört med andra metaller.
"Kristallgitter" - Uppgift: Bestäm typen av kemisk bindning i dessa föreningar: Egenskaper för huvudtyperna av kristallgitter. ämnet för lektionen är CRYSTAL GRIDS. Klassificering av fasta ämnen. HCl, Cl2, H2O, NaBr, BaCl2, CaS, O2, NH3, CO2, C.
"Aluminium av klass 9" - Produktion av aluminium. Amfotericitet hos aluminium. Metaller. Placeringen av aluminium i det periodiska systemet för D.I. Mendeleev. Kemiundervisning i klass 9 om ämnet "Aluminium". 3. Av skäl. AL. Fysikaliska egenskaper aluminium. Kemiska egenskaper aluminium. 2. Med syror (med svavelsyra och saltsyra (utspädd). Elektrolys är den viktigaste metoden för framställning av aluminium idag.
"Aluminiummetall" - Tillämpning. Har amfotära egenskaper. Interaktion med vatten. Fysikaliska egenskaper. Det erhölls först av den danska fysikern Oersted 1925. Kan interagera under påverkan av temperatur med svavel, kväve och kol. Den vanligaste metallen i naturen. Interaktion med syror. Bariumaluminat - för vattenrening från sulfat, karbonatisering och kalciumjoner.





![]()








 Tillbaka framåt
Tillbaka framåt
Uppmärksamhet! Bildförhandsgranskningen används endast i informationssyfte och representerar kanske inte alla presentationsalternativ. Om du är intresserad av detta arbete, vänligen ladda ner hela versionen.
Lektionstyp: Kombinerad.
Huvudmålet med lektionen: Att ge eleverna konkreta idéer om amorfa och kristallina ämnen, typer av kristallgaller, för att fastställa förhållandet mellan ämnens struktur och egenskaper.
Lektionsmål.
Pedagogiskt: att bilda begrepp om det kristallina och amorfa tillståndet av fasta ämnen, att bekanta eleverna med olika typer av kristallgaller, att fastställa beroendet av en kristalls fysikaliska egenskaper på den kemiska bindningens natur i kristallen och typen av kristallgaller, att ge eleverna grundläggande idéer om effekten av kemiska bindningar och typer av kristallgaller egenskaper för ett ämne för att ge eleverna en uppfattning om lagen om kompositionens beständighet.
Pedagogiskt: fortsätt med att bilda elevernas världsbild, överväga det ömsesidiga inflytandet från komponenterna i de hela strukturella partiklarna av ämnen, som ett resultat av vilka nya egenskaper dyker upp, ta upp förmågan att organisera sitt utbildningsarbete, följ arbetsreglerna i ett team.
Utveckling: utveckla kognitivt intresse hos skolbarn som använder problemsituationer förbättra elevernas färdigheter för att fastställa orsak-och-effektberoende av ämnens fysikaliska egenskaper på kemiska bindningar och typen av kristallgitter, för att förutsäga typen av kristallgitter baserat på ämnets fysiska egenskaper
Utrustning: DI Mendeleevs periodiska system, samling ”Metaller”, icke-metaller: svavel, grafit, röd fosfor, syre; Presentation "Kristallgaller", modeller av kristallgaller av olika slag (bordssalt, diamant och grafit, koldioxid och jod, metaller), prover av plast och produkter från dem, glas, plasticin, hartser, vax, tuggummi, choklad, dator, multimedia installation, videoexperiment “Sublimering av bensoesyra”.
Under lektionerna
1. Organisatoriskt ögonblick.
Läraren hälsar eleverna, registrerar de frånvarande.
Sedan kommunicerar han lektionens ämne och syftet med lektionen. Eleverna skriver lektionsämnet i en anteckningsbok. (Bild 1, 2).
2. Kontrollera läxor
(2 elever vid tavlan: Bestäm typen av kemisk bindning för ämnen med formlerna:
1) NaCl, C02, 12; 2) Na, NaOH, H 2 S (skriv ner svaret på tavlan och ingår i undersökningen).
3. Analys av situationen.
Lärare: Vad studerar kemi? Svar: Kemi är ämnenas vetenskap, deras egenskaper och omvandlingar av ämnen.
Lärare: Vad är ett ämne? Svar: Ämne är vad den fysiska kroppen består av. (Bild 3).
Lärare: Vilket aggregeringsläge känner du till?
Svar: Det finns tre tillstånd av aggregering: fast, flytande och gasformigt. (Bild 4).
Lärare: Ge exempel på ämnen som vid olika temperaturer kan finnas i alla tre aggregationstillstånd.
Svar: Vatten. När normala förhållanden vattnet är i flytande tillstånd, när temperaturen sjunker under 0 ° C blir vattnet till ett fast tillstånd - is, och när temperaturen stiger till 100 ° C får vi vattenånga (gasform).
Lärare (tillsats): Vilket ämne som helst kan erhållas i fast, flytande och gasform. Förutom vatten är detta metaller, som under normala förhållanden är i fast tillstånd, börjar mjukna vid upphettning och vid en viss temperatur (tpl) förvandlas till flytande tillstånd - smälta. Vid ytterligare upphettning, till kokpunkten, börjar metallerna att avdunsta, d.v.s. gå i gasformigt tillstånd. Vilken gas som helst kan omvandlas till flytande och fast tillstånd genom att sänka temperaturen: till exempel syre, som vid en temperatur (-194 0 ° C) förvandlas till en blå vätska och vid en temperatur (-218,8 ° C) stelnar till en snöliknande massa bestående av kristaller av blått. I dag i lektionen kommer vi att överväga materiens fasta tillstånd.
Lärare: Namnge vilka fasta ämnen som finns på dina bord.
Svar: Metaller, plasticine, bordssalt: NaCl, grafit.
Lärare: Vad tycker du? Vilka av dessa ämnen är överflödiga?
Svar: Modellera.
Lärare: Varför?
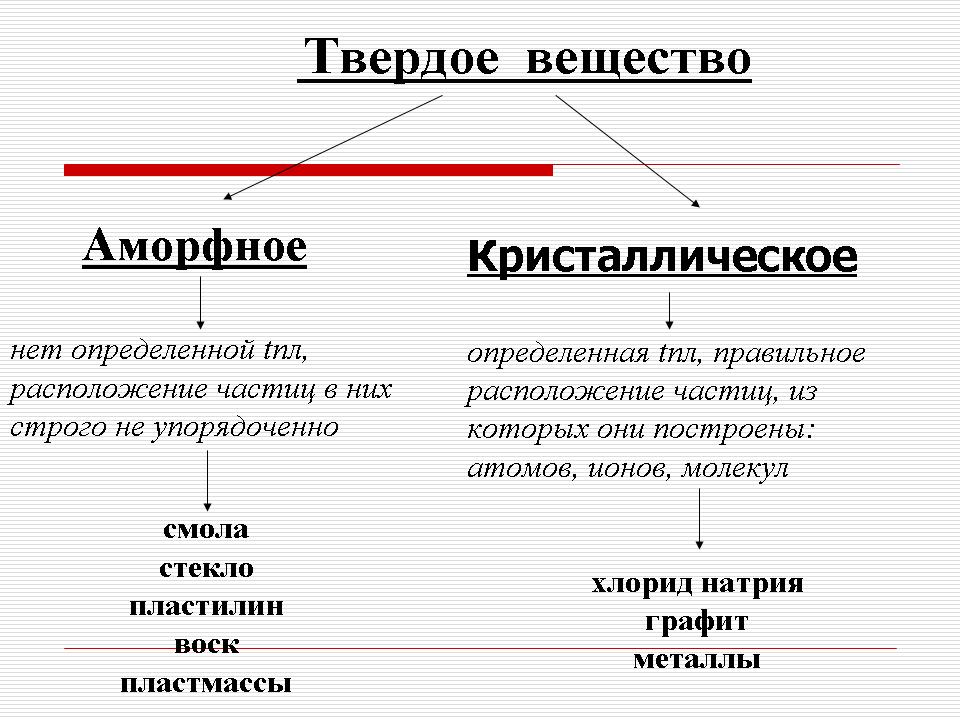
Antaganden görs. Om eleverna har svårt, kommer de med hjälp av läraren till slutsatsen att plasticine, till skillnad från metaller och natriumklorid, inte har en viss smältpunkt - den mjuknar gradvis och förvandlas till flytande tillstånd. Detta är till exempel choklad som smälter i munnen eller tuggummi, såväl som glas, plast, hartser, vax (under förklaringen visar läraren klassproverna av dessa ämnen). Sådana ämnen kallas amorfa. (bild 5) och metaller och natriumklorid är kristallina. (Bild 6).
Således finns det två typer av fasta ämnen. : amorf och kristallin. (bild 7).
1) Amorfa ämnen har ingen bestämd smältpunkt och arrangemanget av partiklar i dem är inte strikt ordnat.
Kristallina ämnen har en strikt definierad smältpunkt och, viktigast av allt, kännetecknas av rätt arrangemang av partiklarna från vilka de är uppbyggda: atomer, molekyler och joner. Dessa partiklar är placerade på strikt definierade punkter i rymden, och om dessa noder är anslutna med raka linjer bildas en rumslig ram - kristallcell.
Frågar läraren problematiska frågor
Hur förklarar man att det finns fasta ämnen med så olika egenskaper?
2) Varför delas kristallina ämnen i vissa plan vid inverkan, medan amorfa ämnen inte har denna egenskap?
Lyssna på elevernas svar och led dem till slutsats:
Egenskaperna hos ämnen i fast tillstånd beror på typen av kristallgitter (främst på vilka partiklar som finns i dess noder), vilket i sin tur beror på typen av kemisk bindning i ett givet ämne.
Läxkontroll:
1) NaCl - jonbindning,
CO 2 - kovalent polär bindning
I 2 - kovalent icke-polär bindning
2) Na-metallbindning
NaOH - jonbindning mellan Na + och OH - (kovalent O och H)
H2S - kovalent polär
Frontal omröstning.
- Vilken bindning kallas jonisk?
- Vilken bindning kallas kovalent?
- Vad heter den kovalenta polära bindningen? icke-polär?
- Vad kallas elektronegativitet?
Slutsats: En logisk sekvens spåras, förhållandet mellan fenomen i naturen: Atomstruktur-\u003e EO-\u003e Typer av kemiska bindningar-\u003e Typ av kristallgitter-\u003e Egenskaper hos ämnen . (bild 10).
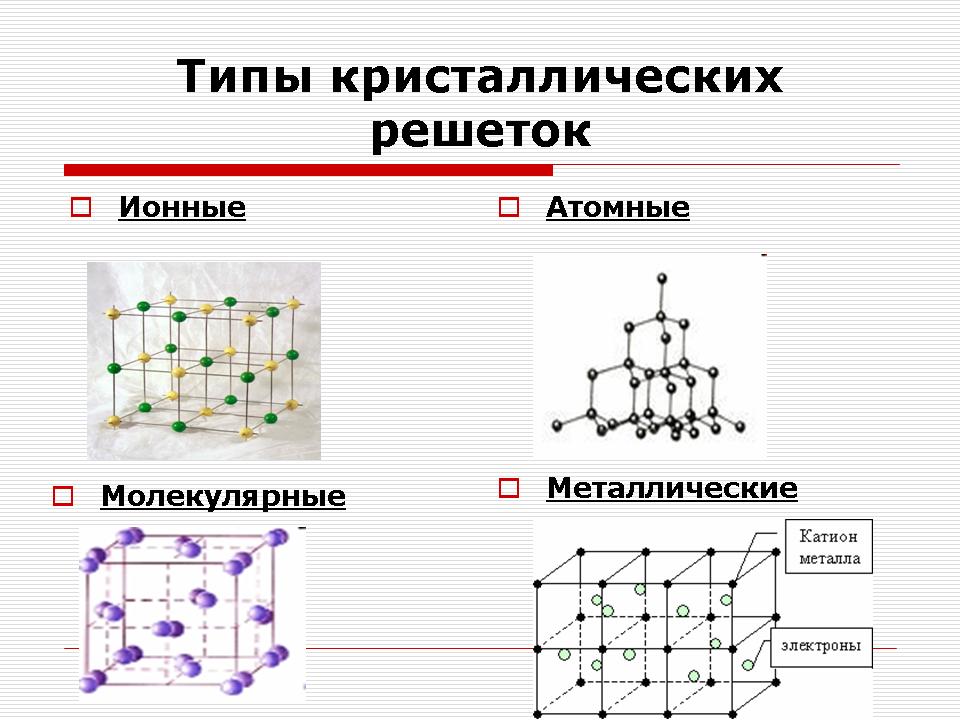
Lärare: Beroende på vilken typ av partiklar och vilken typ av samband som finns mellan dem, skiljer de sig ut fyra typer av kristallgaller: joniska, molekylära, atomära och metalliska. (Bild 11).
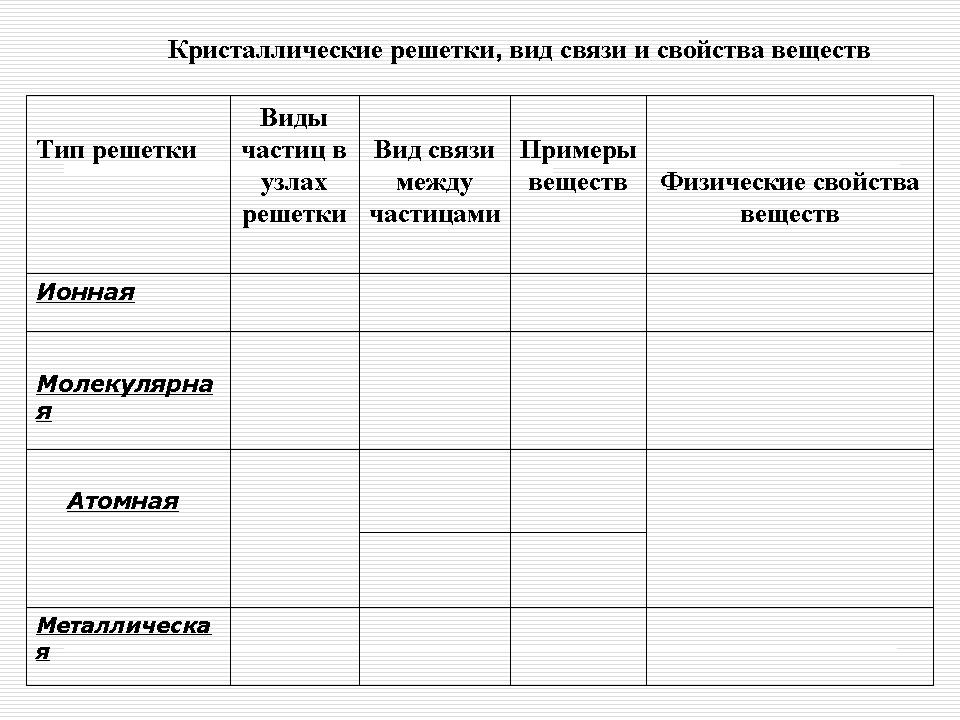
Resultaten registreras i följande tabell, en provtabell för studenter på skrivbordet. (se bilaga 1). (Bild 12).
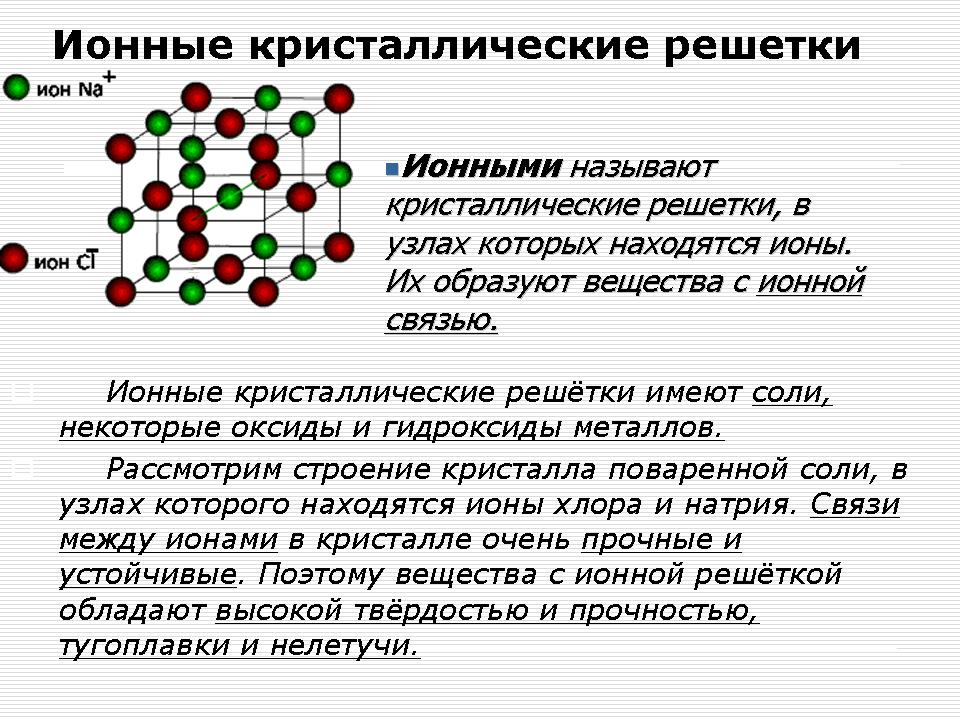
Joniska kristallgaller
Lärare: Vad tycker du? För ämnen med vilken typ av kemisk bindning kommer denna typ av gitter att vara typisk?
Svar: För ämnen med en jonisk kemisk bindning kommer ett joniskt gitter att vara karakteristiskt.
Lärare: Vilka partiklar kommer att finnas i gitternoderna?
Svar: Jona.
Lärare: Vilka partiklar kallas joner?
Svar: Joner är partiklar som har en positiv eller negativ laddning.
Lärare: Vilka joner finns det i komposition?
Svar: Enkelt och komplext.
Demonstration - natriumklorid (NaCl) kristallgittermodell.
Förklaring till läraren: Vid noder i kristallgitteret av natriumklorid finns natrium- och klorjoner.

Enskilda natriumkloridmolekyler finns inte i NaCl-kristaller. Hela kristallen bör betraktas som en jätte makromolekyl som består av lika stort antal Na + och Cl - joner, Na n Cl n, där n är ett stort antal.
Bindningarna mellan joner i en sådan kristall är mycket starka. Därför har ämnen med joniskt gitter relativt hög hårdhet. De är eldfasta, icke-flyktiga, ömtåliga. Deras smälter leder elektrisk ström (Varför?), Lösas enkelt upp i vatten.
Jonföreningar är binära metallföreningar (IA och IIA), salter, alkalier.
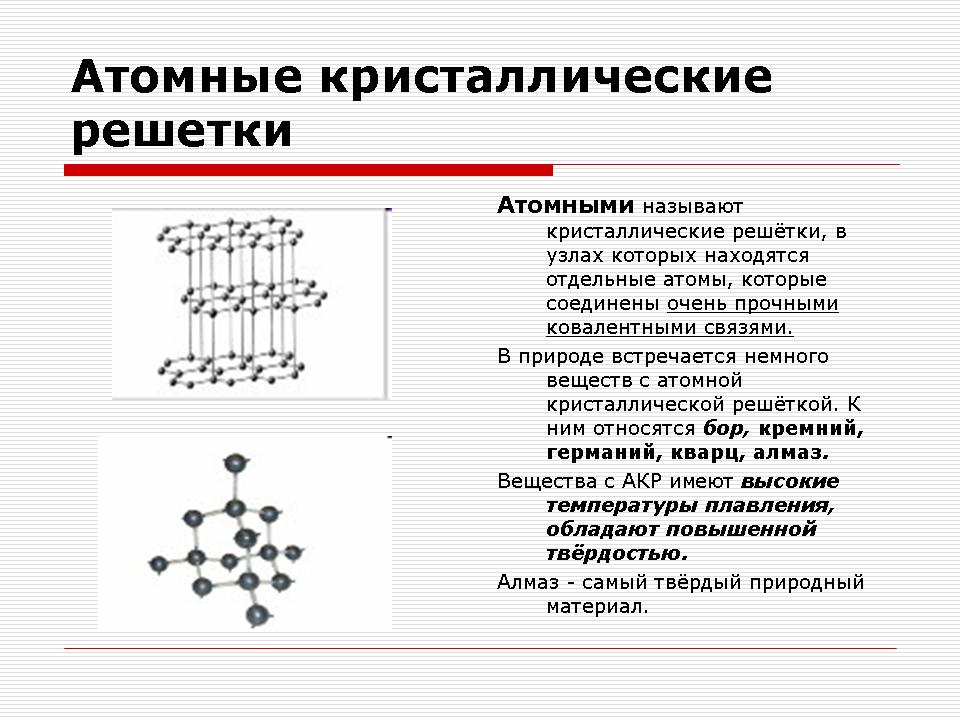
Atomiska kristallgaller
Demonstration av kristallgaller av diamant och grafit.
Eleverna har grafitprover på bordet.
Lärare: Vilka partiklar kommer att finnas i noder i atomkristallgitteret?
Svar: I noderna i atomkristallgitteret finns det enskilda atomer.
Lärare: Vilken typ av kemisk bindning kommer att uppstå mellan atomer?
Svar: Kovalent kemisk bindning.
Förklaringar från läraren.
Faktiskt, på platserna för atomkristallgaller finns det enskilda atomer kopplade av kovalenta bindningar. Eftersom atomer, som joner, kan ordnas på olika sätt i rymden, bildas kristaller med olika former.
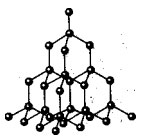
Atomkristallgitter av diamant
Det finns inga molekyler i dessa galler. Hela kristallen bör ses som en jätte molekyl. Ett exempel på ämnen med denna typ av kristallgitter kan fungera som allotropa modifieringar av kol: diamant, grafit; samt bor, kisel, röd fosfor, germanium. Fråga: Vad är dessa ämnen när det gäller sammansättning? Svar: Enkel i komposition.
Atomiska kristallgaller är inte bara enkla utan också komplexa. Till exempel aluminiumoxid, kiseloxid. Alla dessa ämnen har en mycket höga temperaturer smältning (för diamanter över 3500 ° C), stark och hård, icke-flyktig, praktiskt taget olöslig i vätskor.
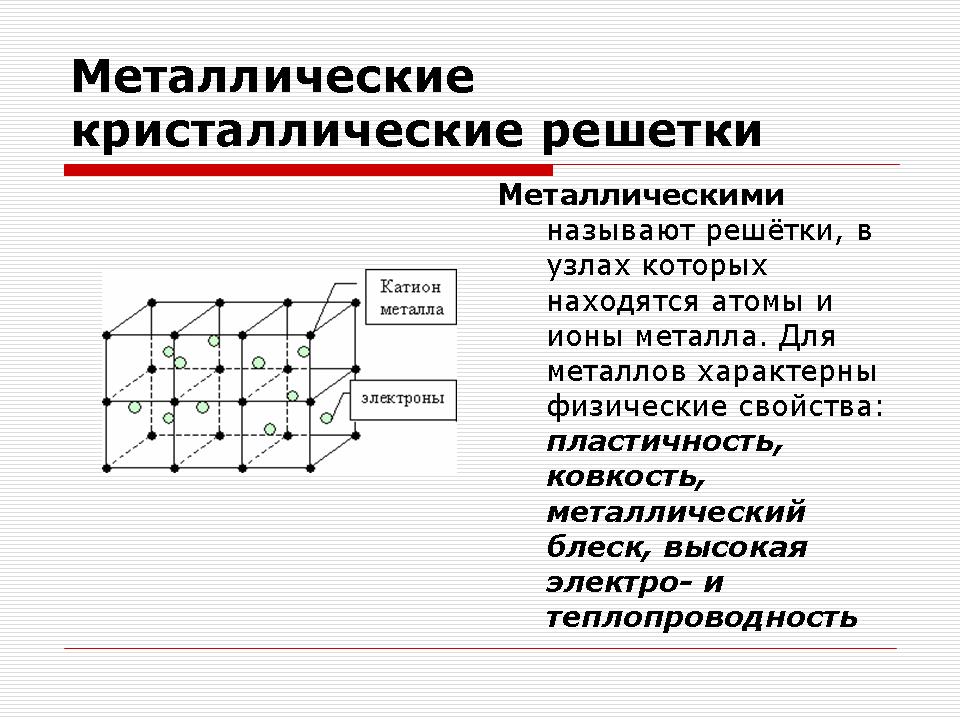
Metallkristallgaller
Lärare: Killar, ni har en samling metaller på era bord, överväg dessa prover.
Fråga: Vilken kemisk bindning är karakteristisk för metaller?
Svar: Metallic. Kommunikation i metaller mellan positiva joner med hjälp av delade elektroner.
Fråga: Vilka allmänna fysikaliska egenskaper är typiska för metaller?
Svar: Glans, elektrisk ledningsförmåga, värmeledningsförmåga, plasticitet.
Fråga: Förklara, vad är anledningen till att så många olika ämnen har samma fysiska egenskaper?
Svar: Metaller har en enda struktur.
Demonstration av modeller av kristallgaller av metaller.
Förklaring till läraren.
Ämnen med metallbindning har metallkristallgaller
På platserna för sådana galler finns atomer och positiva metalljoner, och valenselektroner rör sig fritt i kristallens volym. Elektroner lockar elektrostatiskt positiva metalljoner. Detta förklarar gitterets stabilitet.
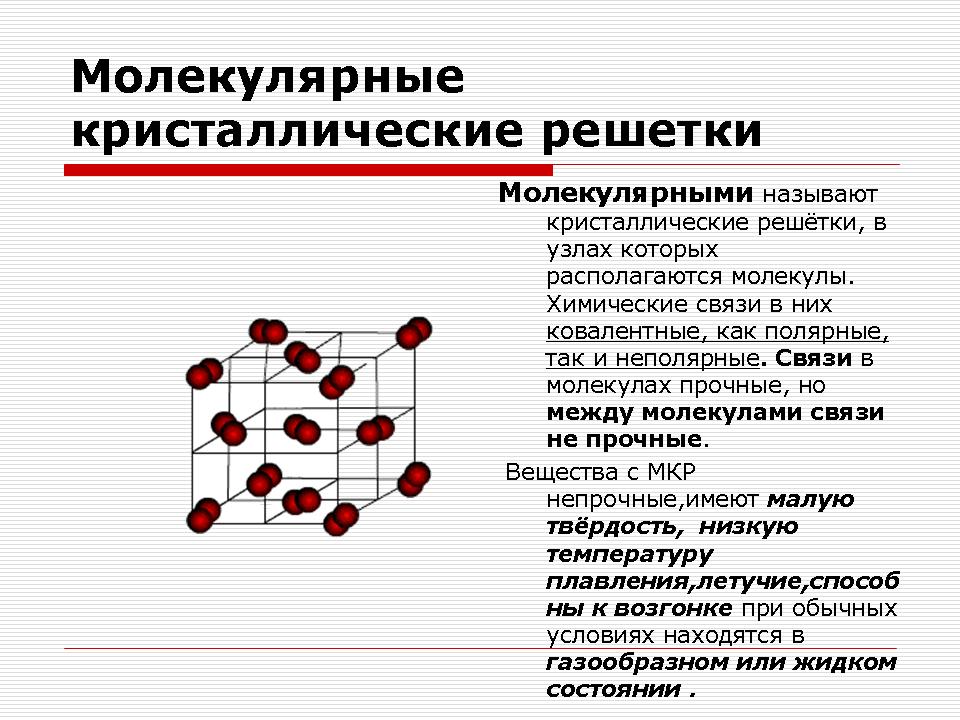
Molekylärt kristallgitter
Läraren demonstrerar och namnger ämnena: jod, svavel.
Fråga: Vad förenar dessa ämnen?
Svar: Dessa ämnen är icke-metaller. Enkel i komposition.
Fråga: Vad är den kemiska bindningen inuti molekylerna?
Svar: Kemisk bindning inuti molekyler är det kovalent, icke-polärt.
Fråga: Vilka fysiska egenskaper är karakteristiska för dem?
Svar: Flyktig, lågsmältande, lätt löslig i vatten.
Lärare: Låt oss jämföra egenskaperna hos metaller och icke-metaller. Eleverna svarar att egenskaperna är fundamentalt olika.
Fråga: Varför är egenskaperna hos icke-metaller så annorlunda än hos metaller?
Svar: Metaller har en metallbindning, medan icke-metaller har en icke-polär kovalent bindning.
Lärare: Därför är typen av galler annorlunda. Molekyl.
Fråga: Vilka partiklar finns på gallerplatserna?
Svar: Molekyler.
Demonstration av kristallgitter av koldioxid och jod.
Förklaring till läraren.
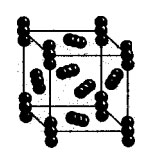
Molekylärt kristallgitter
Som du kan se kan det molekylära kristallgitteret inte bara ha fast enkel ämnen: ädelgaser, H2, O2, N2, I2, O3, vit fosfor P4, men också komplex: fast vatten, fast väteklorid och vätesulfid. De flesta fasta organiska föreningar har molekylära kristallgitter (naftalen, glukos, socker).
Gitterställena innehåller icke-polära eller polära molekyler. Trots det faktum att atomerna inuti molekylerna är bundna av starka kovalenta bindningar, verkar svaga krafter av intermolekylär interaktion mellan molekylerna själva.
Slutsats:Ämnen är ömtåliga, har låg hårdhet, låg smältpunkt, flyktiga, kan sublimera.
Fråga : Vilken process kallas sublimering eller sublimering?
Svar : Övergången av ett ämne från ett fast tillstånd av aggregering direkt till ett gasformigt tillstånd, förbi en vätska, kallas sublimering eller sublimering.
Demonstration av erfarenhet: sublimering av bensoesyra (videoexperiment).
Arbeta med ett fyllt bord.
Bilaga 1. (Bild 17)
Kristallina gitter, typ av bindning och egenskaper hos ämnen
| Gittertyp | Partikeltyper på gallerplatser |
Förhållandet mellan partiklar | Exempel på ämnen | Substansers fysiska egenskaper |
| Jonisk | Jonah | Joniskt - starkt band | Salter, halider (IA, IIA), oxider och hydroxider av typiska metaller | Fast, hållbart, icke-flyktigt, sprött, eldfast, många är lösliga i vatten, smälter leder elektrisk ström |
| Atom | Atomer | 1. Kovalent icke-polär - bindningen är mycket stark 2. Kovalent polar - bindningen är mycket stark |
Enkla ämnena: diamant (C), grafit (C), bor (B), kisel (Si).
Komplexa ämnen: aluminiumoxid (Al203), kiseloxid (IY) -SiO2 |
Mycket hård, mycket eldfast, stark, icke-flyktig, olöslig i vatten |
| Molekyl | Molekyler | Mellan molekyler finns svaga krafter för intermolekylär attraktion, men inuti molekylerna finns en stark kovalent bindning | Torrsubstanser under speciella förhållanden som konventionella - gaser eller flytande (02, H2, Cl2, N2, Br2, H2O, C02, HCl); svavel, vit fosfor, jod; organiskt material |
Bräcklig, flyktig, smältbar, sublimeringsförmåga, har en liten hårdhet |
| Metall | Atomjoner | Metall med olika styrka | Metaller och legeringar | Formbar, blank, duktil, värme och elektriskt ledande |
Fråga: Vilken typ av kristallgitter från de som diskuterats ovan finns inte i enkla ämnen?
Svar: Joniska kristallgaller.
Fråga: Vilka kristallgaller är typiska för enkla ämnen?
Svar: För enkla ämnen - metaller - ett metallkristallgitter; för icke-metaller - atomära eller molekylära.
Arbeta med D.I. Mendeleevs periodiska system.
Fråga: Var finns metallelementen i det periodiska systemet och varför? Icke-metalliska element och varför?
Svar: Om du ritar en diagonal från bor till astatin, kommer det att finnas metallelement i det nedre vänstra hörnet av denna diagonal. vid den sista energinivån innehåller de från en till tre elektroner. Dessa är elementen I A, II A, III A (utom bor), liksom tenn och bly, antimon och alla element i sekundära undergrupper.
Icke-metalliska element finns i det övre högra hörnet av denna diagonal, eftersom vid den sista energinivån innehåller fyra till åtta elektroner. Dessa är elementen IY A, Y A, YI A, YII A, YIII A och bor.
Lärare: Låt oss hitta icke-metalliska element som har enkla ämnen har ett atomkristallgitter (Svar: C, B, Si) och molekylär ( Svar: N, S, O , halogener och ädelgaser ).
Lärare: Formulera en slutsats om hur du kan bestämma typen av kristallgaller av en enkel substans beroende på elementens position i D. I. Mendeleevs periodiska system.
Svar: För metallelement som finns i I A, II A, IIIA (utom bor), liksom tenn och bly, och alla element i sekundära undergrupper i en enkel substans, är gittertyp metall.
För icke-metalliska element IY A och bor i en enkel substans är kristallgitteret atomiskt; och elementen YA, YI A, YII A, YIII A i enkla ämnen har ett molekylkristallgitter.
Vi fortsätter att arbeta med den färdiga tabellen.
Lärare: Titta noga på bordet. Vad är mönstret?
Vi lyssnar noga på elevernas svar, varefter vi tillsammans med klassen avslutar:
Det finns följande regelbundenhet: om ämnets struktur är känd, kan deras egenskaper förutsägas, eller vice versa: om ämnens egenskaper är kända, kan strukturen bestämmas. (Bild 18).
Lärare: Titta noga på bordet. Vilken annan klassificering av ämnen kan du föreslå?
Om eleverna har svårt förklarar läraren det ämnen kan delas in i ämnen med molekylär och icke-molekylär struktur. (Bild 19).
Ämnen med molekylär struktur består av molekyler.
Ämnen med icke-molekylär struktur består av atomer, joner.
Konstant kompositionslag
Lärare: Idag kommer vi att bekanta oss med en av kemiens grundläggande lagar. Detta är lagen om kompositionens beständighet, som upptäcktes av den franska kemisten J.L. Proust. Lagen gäller endast ämnen med molekylär struktur. För närvarande läser lagen följande: "Molekylära kemiska föreningar, oavsett metod för deras produktion, har en konstant sammansättning och egenskaper." Men för ämnen med en icke-molekylär struktur är denna lag inte alltid sant.
Den teoretiska och praktiska betydelsen av lagen ligger i det faktum att sammansättningen av ämnen på grundval kan uttryckas med kemiska formler (för många ämnen med icke-molekylär struktur visar den kemiska formeln sammansättningen av egentligen inte existerande, men villkorad molekyl).
Slutsats: den kemiska formeln för ett ämne innehåller mycket information. (Bild 21)
Till exempel SO 3:
1. Det specifika ämnet är svavelgas eller svaveloxid (YI).
2. Typ av ämne - komplex; klass - oxid.
3. Kvalitativ komposition - består av två element: svavel och syre.
4. Kvantitativ sammansättning - molekylen består av 1 svavelatom och 3 syreatomer.
5. Relativ molekylvikt - Mr (SO3) \u003d 32 + 3 * 16 \u003d 80.
6. Molmassa - M (SO3) \u003d 80 g / mol.
7. Massor av annan information.
Konsolidering och tillämpning av den kunskap som erhållits
(Bild 22, 23).
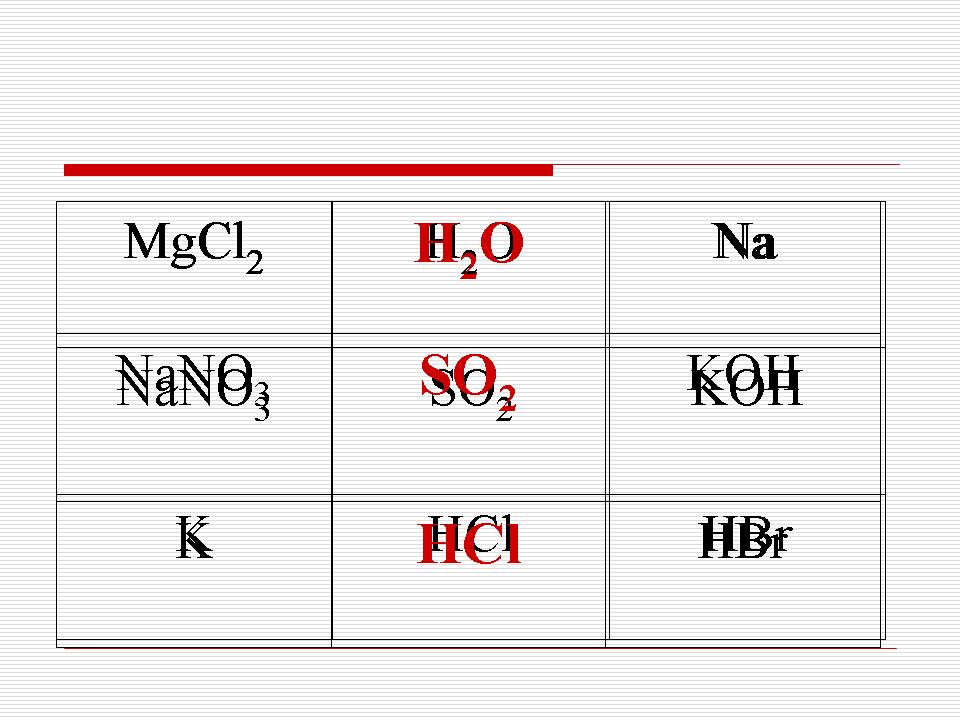
Ett spel med tic-tac-toe: korsa vertikalt, horisontellt, diagonaler av ämnen som har samma kristallgitter.
Reflexion.
Läraren ställer frågan: "Killar, vad nytt har du lärt dig i lektionen?"
Sammanfattar lektionen
Lärare: Killar, låt oss sammanfatta de viktigaste resultaten av vår lektion - svara på frågorna.
1. Vilka klassificeringar av ämnen har du lärt dig?
2. Hur förstår du termen kristallgitter.
3. Vilka typer av kristallgaller känner du nu till?
4. Vilket strukturmönster och egenskaper hos ämnen lärde du dig om?
5. I vilket tillstånd av aggregering har ämnen kristallgaller?
6. Vilken grundläggande kemilag lärde du dig i lektionen?
Läxor: §22, sammanfattning.
1. Gör formlerna för ämnen: kalciumklorid, kiseloxid (IY), kväve, vätesulfid.
Bestäm vilken typ av kristallgitter och försök att förutsäga: vad som ska vara smältpunkterna för dessa ämnen.
2. Kreativ uppgift -\u003e komponera frågor till stycket.
Läraren tackar för lektionen. Märker studenter.
