Вивчення параграфа допоможе вам:
· Наводити приклади простих речовин металів і неметалів;
· Розрізняти метали і неметали, металеві та неметалеві елементи;
· Користуватися періодичною системою як довідкової для визначення розміщення в ній деяких неметалічних і металічних хімічних елементів.
ЯКІ РЕЧОВИНИ НАЛИВАТИ ДО ПРОСТИХ? Особливістю будь-якої науки є те, що досліджувані об'єкти підлягають класифікації. Хімічна наука не є винятком, адже речовини без належної класифікації вивчати неможливо.
За якісним складом речовини підрозділяють на прості і складні.
Прості речовини - це речовини, утворені атомами одного хімічного елемента
У наведеному переліку формул: Fe, О2, Н2О, NaHCO 3, NaCl, H 2 SO 4, N 2, Аl 2 O 3, Аl, O 3 знайдемо формули простих речовин. Користуючись зазначеним вище визначенням простих речовин, робимо висновок, що це будуть формули: Fe, O 2, N 2, Аl, В 3. Інші формули утворені з атомів різних хімічних елементів. Як вам відомо з природознавства, це - складні речовини.
Атоми одного хімічного елемента можуть утворювати кілька простих речовин. Наприклад, з атомів Кисню складаються молекули кисню O 2 і озону їх хімічні формули відрізняються кількістю атомів Кисню. Саме це відображено на малюнку 55.
Мал. 55. Моделі молекул кисню (а) і озону (6)
* Поділ чого-небудь за певними ознаками.

Мал. 56. Алмаз (а) і графіт (в) і моделі їх структури (6. г)
З атомів Карбону утворені найтвердіша природна речовина алмаз, і настільки м'який, що залишає написи на папері, - графіт. Хімічні формули цих речовин записують однаково - С. Відмінності у властивостях алмазуq графіту обумовлені не різним кількісним або якісним складом, але різним просторовим розміщення атомів вуглецю в речовині відносно один одного (рис. 56). У графіту вони розміщені шарами, причому відстані між атомами всередині одного шару значно менше, ніж між сусідніми шарами (рис. 56г.) Тому досить злегка натиснути на олівець і цілісність між шарами порушується. У алмазі атоми вуглецю розміщені таким чином, що знаходяться на однаковій відстані одна від одної, а зв'язки між ними спрямовані до вершин тетраедра (рис. 56б). Це обумовлює високу твердість речовини.
Незважаючи на наведені приклади, подумайте, чого більше - хімічних елементів або простих речовин.
За сучасної української хімічної номенклатурі назви деяких простих речовин не збігаються з назвами хімічних елементів, з яких вони утворилися. У таблиці наведено приклади таких речовин. Ознайомтеся з ними.
Знайдіть в таблиці і випишіть в зошит назви і формули простих речовин. в яких молекула утворена двома або більше атомами.
Таблиця 4
Формули і назви простих речовин
|
проста речовина |
Назва хімічного елемента |
проста речовина |
Назва хімічного елемента |
||
|
Назва |
Назва |
||||
|
Аргентум |
|||||
|
кисень |
|||||
|
Меркурій |
графіт, алмаз |
||||
Зверніть увагу! Назви простих речовин пишуть з малої літери, назви хімічних елементів - з великою.
Металів і неметалів. Прості речовини поділяють на метали і неметали. До металів належать цинк Zn, калій К, кальцій Са, магній Mg, олово Sn, свинець Pb, мідь Cu, залізо Fe, алюміній Аl, срібло Ag, золото Аі та інші (рис. 57).
Прикладами неметалів є водень H 2 кисень O 2 і озон О3, азот N 2, гелій Не, неон Ne, аргон Аг, вуглець С (таку спільну наяву застосовують до всіх простих речовин Карбону), сірка S, фосфор Р, хлор Сl 2 , йод I 2 і інші (рис. 58).
Серед хімічних елементів переважають металеві. З відомих на сьогодні хімічних елементів неметаллическими тільки 22.
У параграфах 6 та 7 були розглянуті основні фізичні властивості речовин. Орієнтуючись на це, складемо характеристики простих речовин металів і неметалів.
Спільними властивостями всіх металів є висока теплопровідність і електропровідність; сірий, сріблясто-сірий колір (приклади винятків: золото - жовте, мідь - цегляно-червона); відсутність запаху; пластичність - їх легко кувати, витягати в дріт, прокатувати бляхи. Всі метали при кімнатній температурі знаходяться в твердому агрегатному стані, крім ртуті (рідина).
Перераховані властивості не характерні для неметалів. Тому про них можна сказати, що це прості речовини, Які не мають металевих властивостей. Так, неметали не проводять або погано проводять тепло і електричний струм, є крихкими, а не пластичними. Водень, кисень, азот, фтор, хлор, гелій, аргон та інші при кімнатній температурі знаходяться в газоподібному агрегатному стані. Фосфор, вуглець, сірка, йод є твердими речовинами, бром - рідина. У неметалів спостерігається більше відмінностей за кольором, ніж у металів. Так, кисень і водень безбарвні, сірка жовта, хлор - жовто-зелений, бром - темно-бурий.
Мал. 57. Зразки металів: а - цинк; б - алюміній, в - залізо, г - мідь

Мал. 58. Зразки неметалів: а - йод, сірка, в - фосфор, г - хлор
Слід підкреслити, що поділ простих речовин тільки за фізичними властивостями на метали і неметали є неточним. Наприклад, неметал йод має металевий блиск, а неметалу графіту властива висока електропровідність. У наступних класах ви розширите знання про розподіл простих речовин на метали і неметали на основі відмінностей будови їх атомів і хімічних властивостей.
РОЗМІЩЕННЯ МЕТАЛЕВИХ І НЕМЕТАЛЕВИХ ЕЛЕМЕНТІВ У ПЕРІОДИЧНОЇ СИСТЕМІ. Хімічні елементи, атоми яких утворені прості речовини - метали, називають металевими, а хімічні елементи, атоми яких утворені прості речовини - неметали - неметаллическими.
У параграфі 12 ви вперше познайомилися з періодичною системою хімічних елементів. Тепер вам відомо, що хімічні елементи розміщені зі збільшенням заряду ядер атомів, і що за кожним елементом незмінно закріплена одна клітинка. А чи існує якась закономірність в розміщенні металевих і неметалевих елементів в періодичній системі? Щоб отримати відповідь на це питання, попрацюємо з таблицею. Виберемо для розгляду 1-й, 2-й і 3-й періоди. У першому періоді металеві елементи відсутні. Другий період починається металевим елементом літієм Li. Наступний елемент Берилій Be теж відноситься до металевих. Інші елементи цього періоду єнеметалічнімі.
Третій період також починається металевим елементом Натрієм Na, після якого розміщені ще два металевих елемента - Магній Mg і Алюміній Аl. Далі, як і в другому періоді, розміщені неметалеві елементи.
Прочитайте вголос назви елементів 1-го, 2-го і 3-го періодів.
Дещо по-іншому розміщені металеві та неметалеві елементи в вертикальних стовпчиках таблиці - групах, пронумеровані римськими цифрами від i до VIII. Так, все осередки i І II груп (крім першої І в групі) заповнені металевими елементами. На початку інших груп розміщені неметалеві елементи, а в кінці - металеві.
Знайдіть з учителем і прочитайте вголос назви неметалічних елементів, якими починаються III- VIII групи.
Розглянуті приклади ілюструють загальне правило розміщення металевих і неметалевих елементів в періодах і групах періодичної системи:
Металеві елементи розміщені в періодичній системі хімічних елементів Д. І. Менделєєва на початку періодів і в кінці груп, а неметалеві - в кінці періодів і на початку груп.
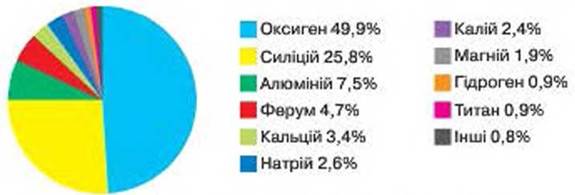
Мал. 59. Поширення хімічних елементів на Землі (по масі)
Поширення ЕЛЕМЕНТІВ У ПРИРОДІ. Хоча в природі в складі різних речовин зустрічаються близько 90 хімічних елементів, поширені вони нерівномірно. Є елементи-лідери, а є такі, вміст яких дуже малий.
За рис. 59 з'ясуйте, три металевих і три неметалічних елементи найпоширеніші на Землі. Металеві або неметалеві хімічні елементи переважають в складі речовин на планеті Земля?
скарбничка ерудита
Серед простих речовин є свої «чемпіони» з тих чи інших фізичних властивостей. Так, алмаз має найвищу твердість, метал вольфрам - найбільш тугоплавкий. Найлегшим металом є літій, а найлегшим неметалом - водень. Серед металів найвищу теплопровідність мають срібло, мідь, алюміній. Низька теплопровідність у вісмуту і ртуті. Існують м'які метали, які можна різати ножем, наприклад, натрій, калій, кальцій, а найбільшу твердість серед металів має хром - їм можна різати скло. Висока пластичність у золота. Це дозволяє виготовляти з нього плівку всього лише 0,003 мм завтовшки.
1. Які речовини називають простими? Наведіть приклади.
2. На які групи поділяють прості речовини? Представників якої групи існує більше?
3. Назвіть загальні фізичні властивості металів.
4. Що вам відомо про розташування металевих і неметалевих елементів в періодичній системі?
5. Яким металевим елементом починається 4-й період?
6. Яким неметалічнім елементом розпочинається V група?
7. Назвіть по три поширені на Землі неметалеві і металеві хімічні елементи.
8. З переліку хімічних елементів виберіть неметалеві і розташуйте їх у порядку збільшення відносної атомної маси: Магній, Кисень, Водень, Залізо, Азот, Хлор.
9. Користуючись періодичною системою хімічних елементів, назвіть хімічний елемент, розміщений у 3-му періоді і VIII групі. До металевих або неметалевих елементів він належить? Скільки протонів і електронів в складі його атома?
10. Заповніть пропуски в пропозиціях словами «металевим», «неметалічнім» і назвами відповідних елементів Другий період періодичної системи починається _________ елементом _________, а закінчується ________ елементом ___________.
Шоста група періодичної системи починається елементом _________, а закінчується елементом ________,
11. Вкажіть як можна більше ознак, за якими укладено переліки простих речовин:
а) кисень, азот, водень;
6) срібло, залізо, алюміній?
Виконайте проект на тему «Хімічні елементи в складі різних небесних тіл».
На тему: Метали. Неметали
ВСТУП
Все різноманіття навколишнього нас природи складається з поєднань порівняно невеликого числа хімічних елементів.
У різні історичні епохи в поняття «елемент» вкладався різний зміст. Давньогрецькі філософи як «елементів» розглядали чотири «стихії» - тепло, холод, сухість і вологість. Поєднуючись попарно, вони утворювали чотири «почала» всіх речей - вогонь, повітря, воду і землю. У середні століття до цих початків додалися сіль, сірка і ртуть. У XVII столітті Р. Бойль вказав на те, що всі елементи носять матеріальний характер і їх число може бути досить велике.
У 1787 році французький хімік А. Лавуазьє створив «Таблицю простих тіл». До неї увійшли всі відомі на той час елементи. Під останніми розумілися прості тіла, які не вдавалося розкласти хімічними методами на ще більш прості. Згодом з'ясувалося, що в таблицю увійшли і деякі складні речовини.
В даний час поняття «хімічний елемент» встановлено точно.
Хімічний елемент - вил атомів з однаковим позитивним зарядом ядра. (Останній дорівнює порядковому номеру елемента в таблиці Менделєєва.)
В даний час відомо 107 елементів. Близько 90 з них існують в природі. Решта отримані штучно за допомогою ядерних реакцій. 104-107 елементи були синтезовані вченими-фізиками в Об'єднаному інституті ядерних досліджень в місті Дубні. В даний час тривають роботи по штучному отриманню хімічних елементів з більш високими порядковими елементами.
Всі елементи діляться на метали і неметали. З 107 елементів 85 ставляться до металам. До неметаллам відносять такі елементи: гелій, неон, аргон, криптон, ксенон, радон, фтор, хлор, бром, йод, астат, кисень, сірка, селен, телур, азот, фосфор, миш'як, вуглець, кремній, бор, водень. Однак це поділ умовний. При певних умовах деякі метали можуть проявляти неметалічні властивості, а деякі неметали - металеві властивості.
Неметали
Положення неметалічних елементів у періодичній системі хімічних елементів. Знаходження в природі. Загальні хімічний і фізичні властивості
Неметалічних елементів у порівнянні до металевими елементами відносно небагато. Їх розміщення в періодичній системі хімічних елементів Д.І. Менделєєва відображено в таблиці №1.
Розміщення неметалічних елементів у періодичній сис темі по групам |
||||||||
VIII (благородні гази) |
||||||||
Таблиця №1.
Як видно з таблиці №1 неметалеві елементи в основному розташовані в правій верхній частині періодичної системи. Так як в періодах зліва направо у атомів елементів збільшується заряди ядер і зменшуються атомні радіуси, а в групах зверху вниз атомні радіуси також зростають, то зрозуміло, чому атому неметалів сильніше, ніж атоми металів, притягають зовнішні електрони. У зв'язку з цим у неметалів переважають окисні властивості. Особливо сильні окислювальні властивості, тобто здатність приєднувати електрони, виявляють неметали, що знаходяться в 2-му і 3-му періодах VI-VII груп. Найсильнішим окислювачем є фтор. Відповідно до чисельними значеннями відносних електроотріцательностей окисні здатності неметалів збільшується в наступному порядку: Si, B, H, P, C, S, I, N, Cl, O, F. Отже, енергійніше усього взаємодіє з воднем і металами фтор:
Менш енергійно реагує кисень:
2H2 + O2 a 2H2 Про
Фтор - найтиповіший неметалл, якому не характерні відновні властивості, тобто здатність віддавати електрони в хімічних реакціях.
Кисень ж, судячи з його сполук з фтором, може виявляти і позитивну ступінь окислення, тобто бути відновником.
Всі інші неметали виявляють відновні властивості. Причому ці властивості поступово зростають від кисню до кремнію: O, Cl, N, I, S, C, P, H, B, Si. Так, наприклад, хлор безпосередньо з киснем не з'єднує, але непрямим шляхом можна отримати його оксиди (Cl2 O, ClO2, Cl2O2), в яких хлор виявляє позитивну ступінь окислення. Азот при високій температурі безпосередньо з'єднується з киснем і, отже, проявляє відновні властивості. Ще легше з киснем реагує сірка: вона проявляє і окисні властивості.
Перейдемо до розгляду будови молекул неметалів. Неметали утворюють як одноатомні, так і двоатомних молекули.
До одноатомних неметаллам відносяться інертні гази, практично не реагують навіть з самими активними речовинами. Інертні гази розташовані в VIII групі Періодичної системи, а хімічні формули відповідних простих речовин наступні: He, Ne, Ar, Kr, Xe і Rn.
Деякі неметали утворюють двохатомних молекул. Це H2, F2, Cl2, Br2, I2 (елементи VII групи періодичної системи), а також кисень O2 і азот N2. З трьохатомних молекул складається газ озон (O3).
Для речовин неметалів, що знаходяться в твердому стані, скласти хімічну формулу досить складно. Атоми вуглецю в графіті з'єднані один з одним по-різному. Виділити окрему молекулу в наведених структурах важко. При написанні хімічних формул таких речовин, як і в випадку з металами, вводиться припущення, що такі речовини складаються тільки з атомів. Хімічні формули, при цьому, записуються без індексів - C, Si, S і т.д.
Такі прості речовини, як озон і кисень, що мають однаковий якісний склад (обидва складаються з одного і того ж елемента - кисню), але різняться за кількістю атомів в молекулі, мають різні властивості. Так, кисень запаху не має, в той час як озон має різким запахом, який ми відчуваємо під час грози. Властивості твердих неметалів, графіту і алмазу, мають також однаковий якісний склад, але різну будову, різко відрізняються (графіт крихкий, алмаз твердий). Таким чином, властивості речовини визначаються не тільки його якісним складом, але і тим, скільки атомів міститься в молекулі речовини і як вони пов'язані між собою.
Неметали у вигляді простих тіл знаходяться в твердому або газоподібному стані (виключаючи бром - рідина). Вони не мають фізичних властивостей, властивих металам. Тверді неметали не володіють характерним для металів блиском, вони зазвичай тендітні, погано проводять електричний струм і тепло (за винятком графіту).
Загальні хімічні властивості неметалів.
Оксиди неметалів відносять до кислотних оксидів, яким відповідають кислоти. З воднем неметали утворюють газоподібні сполуки (наприклад HCl, H2S, NH3). Водні розчини деяких з них (наприклад, галогеноводородов) - сильні кислоти. З металами типові неметали дають з'єднання з іонним зв'язком (наприклад, NaCl). Неметали можуть при певних умовах між собою реагувати, утворюючи з'єднання з ковалентного полярної (H2O, HCl) і неполярний зв'язками (CO2).
З воднем неметали утворюють леткі сполуки, як, наприклад, фтороводород HF, сірководень H2S, аміак NH3, метан CH4. При розчиненні в воді водневі сполуки галогенів, сірки, селену і телуру утворюють кислоти тієї ж формули, що і самі водневі сполуки: HF, HCl, HCl, HBr, HI, H2S, H2Se, H2Te.
При розчиненні в воді аміаку утворюються аміачна вода, зазвичай позначена формулою NH4OH і звана гідроксидом амонію. Її також позначають формулою NH3 H2O і називають гідратом аміаку.
З киснем неметали утворюють кислотні оксиди. В одних оксидах вони проявляють максимальну ступінь окислення, що дорівнює номеру групи (наприклад, SO2, N2O5), а інших - більш низьку (наприклад, SO2, N2O3). Кислотних оксидів відповідають кислоти, причому з двох кисневих кислот одного неметалла сильніше та, в якій він проявляє вищу ступінь окислення. наприклад, азотна кислота HNO3 сильніше азотистої HNO2, а сірчана кислотаH2SO4 сильніше сірчистої H2SO3.
Будова і властивості простих речовин - неметалів.
Найтиповіші неметали мають молекулярну будову, а менш типові - немолекулярное. Цим і пояснюється відмінність їх властивостей. Наочно це відображено в схемі №2.
Таблиця №2
Кристалічний бор В (як і кристалічний кремній) має дуже високу температуру плавлення (2075 ° С) і високу стійкість. електрична провідність бору з підвищенням температури сильно збільшується, що дає можливість широко застосовувати його в напівпровідниковій техніці. Добавка бору до сталі і до сплавів алюмінію, міді, нікелю та ін. Покращує їх механічні властивості.
Бориди (сполуки бору з деякими металами, наприклад з титаном: TiB, TiB2) необхідні при виготовленні деталей реактивних двигунів, лопаток газових турбін.
Як видно зі схеми №2, вуглець С, кремній Si, бор В мають схожу будову і володіють деякими загальними властивостями. Як прості речовини вони зустрічаються в двох видозмінах - в кристалічному і аморфному. Кристалічні видозміни цих елементів дуже тверді, з високими температурами плавлення. Кристалічний кремній має напівпровідниковими властивостями.
Всі ці елементи утворюють сполуки з металами - карбіди, силіциди та бориди (CaC2, Al4C3, Fe3C, Mg2Si, TiB, TiB2). Деякі з них мають більшу твердість, наприклад Fe3C, TiB. Карбід кальцію використовується для отримання ацетилену.
Якщо порівняти розташування електронів по орбіталях в атомах фтору, хлору та інших галогенів, то можна судити і про їх відмінні властивості. У атома фтору вільних орбіталей немає. Тому атоми фтору можуть проявити лише валентність I і ступінь окислення - 1. В атомах інших галогенів, наприклад в атомі хлору, на тому ж енергетичному рівні є вільні d-орбіталі. Завдяки цьому розпарювання електронів може відбутися трьома різними шляхами.
У першому випадку хлор може проявити ступінь окислення +3 і утворити хлористую кислоту HClO2, якій відповідають солі - хлорити, наприклад хлорит калію KClO2.
У другому випадку хлор може утворити з'єднання, в яких ступінь окислення хлору +5. До таких сполук відносяться хлорнова тая кислота HClO3 і її солі - хлорати, наприклад хлорат калію КClO3 (бертолетової сіль).
У третьому випадку хлор проявляє ступінь окислення +7, наприклад в хлорним кислоті HClO4 і в її солях - перхлорати, наприклад в перхлорат калію КClO4.
Кисневі і водневі сполуки неметалів. Коротка характеристика їх властивостей.
З киснем неметали утворюють кислотні оксиди. В одних оксидах вони проявляють максимальну ступінь окислення, що дорівнює номеру групи (наприклад, SO2, N2O5), а інших - більш низьку (наприклад, SO2, N2O3). Кислотних оксидів відповідають кислоти, причому з двох кисневих кислот одного неметалла сильніше та, в якій він проявляє вищу ступінь окислення. Наприклад, азотна кислота HNO3 сильніше азотистої HNO2, а сірчана кислота H2SO4 сильніше сірчистої H2SO3.
Характеристики кисневих з'єднань неметалов:
1. Властивості вищих оксидів (тобто оксидів, до складу яких входить елемент даної групи з вищим ступенем окислення) в періодах зліва направо поступово змінюються від основних до кислотних.
2. У групах зверху вниз кислотні властивості вищих оксидів поступово слабшають. Про це можна судити за властивостями кислот, які відповідають цим оксидам.
3. Зростання кислотних властивостей вищих оксидів відповідних елементів в періодах зліва направо пояснюється поступовим зростанням позитивного заряду іонів цих елементів.
4. У головних підгрупах періодичної системи хімічних елементів в напрямку зверху вниз кислотні властивості вищих оксидів неметалів зменшуються.
Загальні формули водневих з'єднань по групах періодичної системи хімічних елементів наведені в таблиці №3.
Таблиця №3.
З металами водень утворює (за деяким винятком) нелеткі з'єднання, які є твердими речовинами немолекулярного будови. Тому їх температури плавлення порівняно високі.
З неметалами водень утворює леткі сполуки молекулярного будови. У звичайних умовах це гази або летючі рідини.
У періодах зліва направо кислотні властивості летких водневих з'єднань неметалів в водних розчинах посилюється. Це пояснюється тим, що іони кисню мають вільні електронні пари, а іони водню - вільну орбіталь, то відбувається процес, який виглядає наступним чином:
H2O + HF a H3O + F
Фтороводород у водному розчині відщеплює позитивні іони водню, тобто проявляє кислотні властивості. Цьому процесу сприяє й те обставина: іон кисню має неподіленого електронну пару, а іон водню - вільну орбіталь, завдяки чому утворюється донорно-акцепторні зв'язок.
При розчиненні аміаку в воді відбувається протилежний процес. А так як іони азоту мають неподіленого електронну пару, а іони водню - вільну орбіталь, виникає додаткова зв'язок і утворюються іони амонію NH4 + і гідроксид-іони ОН. В результаті розчин набуває основні властивості. Цей процес можна виразити формулою:
H2O + NH3 a NH4 + OH
Молекули аміаку у водному розчині приєднують позитивні іони водню, тобто аміак проявляє основні властивості.
Тепер розглянемо, чому водневе з'єднання фтору - фтороводород HF - у водному розчині є кислотою, але більш слабкою, ніж хлороводородная. Це пояснюється тим, що радіуси іонів фтору значно менше, ніж іонів хлору. Тому іони фтору набагато сильніше притягують до себе іони водню, ніж іони хлору. У зв'язку з цим ступінь дисоціації фтороводородной кислоти значно менше, ніж соляної кислоти, тобто фтороводородной кислота слабкіше соляної кислоти.
З наведених прикладів можна зробити такі загальні висновки:
1. В періодах зліва направо у іонів елементів позитивний заряд збільшується. У зв'язку з цим кислотні властивості летких водневих з'єднань елементів у водних розчинах посилюються.
2. У групах зверху вниз негативно заряджені аніони все слабше притягують позитивно заряджені іони водню Н +. У зв'язку з цим полегшується процес відщеплення іонів водню Н + та кислотні властивості водневих з'єднань збільшуються.
3. Водневі сполуки неметалів, що володіють у водних розчинах кислотними властивостями, реагують з лугами. Водневі ж з'єднання неметалів, що володіють у водних розчинах основними властивостями, реагують з кислотами.
4. Окислювальна активність водневих з'єднань неметалів в групах зверху вниз сильно збільшується. Наприклад, окислити фтор з водневого з'єднання HF хімічним шляхом не можна, окислити ж хлор з водневого з'єднання HCl можна різними окислювачами. Це пояснюється тим, що в групах зверху вниз різко зростають атомні радіуси, у зв'язку з чим віддача електронів полегшується.
В даний час відомо 105 хімічних елементів, більшість з них - метали. Останні вельми поширені в природі і зустрічаються у вигляді різних з'єднань в надрах землі, водах річок, озер, морів, океанів, складі тіл тварин, рослин і навіть в атмосфері.
За своїми властивостями метали різко відрізняються від неметалів. Вперше ця різниця металів і неметалів визначив М. В. Ломоносов. "Метали, - писав він, - тіла тверді, ковкі блискучі".
Зараховуючи той чи інший елемент до розряду металів, ми маємо на увазі наявність у нього визначеного комплексу властивостей:
1. Щільна кристалічна структура.
2.Характерний металевий блиск.
3.Високая теплопровідність і електрична провідність.
4. Зменшення електричної провідності з ростом температури.
5. Низькі значення потенціалу іонізації, тобто здатність легко віддавати електрони.
6. Гнучкість і тягучість.
7. Здатність до утворення сплавів.
Всі метали і сплави, що застосовуються в даний час в техніці, можна розділити на дві основні групи. До першої з них відносять чорні метали - залізо і всі його сплави, в яких воно складає основну частину. Цими сплавами є чавуни і стали. У техніці часто використовують так звані леговані стали. До них відносяться сталі, що містять хром, нікель, вольфрам, молібден, ванадій, кобальт, титан і інші метали. Іноді в леговані сталі входять 5-6 різних металів. Методом легування одержують різні коштовні сталі, що володіють в одних випадках підвищеною міцністю, в інших - високою опірністю до стирання, в третіх - корозійною стійкістю, тобто здатністю не руйнуватися під дією зовнішнього середовища.
До другої групи відносять кольорові метали і їх сплави. Вони отримали таку назву тому, що мають різне забарвлення. Наприклад, мідь світло-червона, нікель, олово, срібло - білі, свинець - блакитно-білий, золото -жовте. З сплавів в практиці знайшли велике застосування: бронза - сплав міді з оловом і іншими металами, латунь - сплав міді з цинком, бабіт - сплав олова з сурмою і міддю і ін.
Цей поділ на чорні і кольорові метали умовно. Поряд з чорними і кольоровими металами виділяють ще групу шляхетних металів: срібло, золото, платину, рутеній і деякі інші. Вони названі так тому, що практично не окислюються на повітрі навіть при підвищеній температурі і не руйнуються при дії на них розчинів кислот і лугів.
II. Фізичні властивості металів.
Із зовнішнього боку метали, як відомо, характеризуються насамперед особливим "металевим" блиском, що обумовлюється їх здатністю сильно відбивати промені світла. Однак цей блиск спостерігається звичайно тільки в тому випадку, коли метал утворює суцільну компактну масу. Правда, магній і алюміній зберігають свій блиск, навіть будучи перетвореними в порошок, але більшість металів в мелкораздробленном вигляді має чорний або темно-сірий колір. Потім типові метали володіють високою тепло- і електропровідністю, причому по здатності проводити тепло і струм розташовуються в одному і тому ж порядку: кращі провідники - срібло і мідь, гірші - свинець і ртуть. З підвищенням температури електропровідність падає, при зниженні температури, навпаки, збільшується.
Дуже важливою властивістю металів є їх порівняно легка механічна деформованість. Метали пластичні, вони добре куються, витягуються в дріт, прокочуються в листи і т.п.
Характерні фізичні властивості металів знаходяться в зв'язку з особливостями їх внутрішньої структури. Відповідно до сучасних поглядів, кристали металів складаються з позитивно заряджених іонів і вільних електронів, відщепилися від відповідних атомів. Весь кристал можна собі уявити у вигляді просторової решітки, вузли якої зайняті іонами, а в проміжках між іонами знаходяться легкорухливі електрони. Ці електрони постійно переходять від одних атомів до інших і обертаються навколо ядра то одного, то іншого атома. Так як електрони не пов'язані з певними іонами, то вже під впливом невеликої різниці потенціалів вони починають переміщатися в певному напрямку, тобто виникає електричний струм.
Наявністю вільних електронів обумовлюється і висока теплопровідність металів. Перебуваючи в безперервному русі, електрони постійно зіштовхуються з іонами і обмінюються з ними енергією. Тому коливання іонів, що посилилися в даній частині металу внаслідок нагрівання, зараз же передаються сусіднім іонам, від них - наступним і т.д., і тепловий стан металу швидко вирівнюється; вся маса металу приймає однакову температуру.
За щільністю метали умовно поділяються на дві великі групи: легкі метали, щільність яких не більше 5 г / см3, і важкі метали - всі інші.
Частинки металів, що знаходяться в твердому і рідкому стані, зв'язані особливим типом хімічного зв'язку - так називаним металевим зв'язком. Вона визначається одночасною наявністю звичайних ковалентних зв'язків між нейтральними атомами і кулоновским тяжінням між іонами і вільними електронами. Таким чином, металевий зв'язок є властивістю не окремих частинок, а їх агрегатом.
III. Хімічні властивості металів.
Основним хімічним властивістю металів є здатність їх атомів легко віддавати свої валентні електрони і переходити в позитивно заряджені іони. Типові метали ніколи не приєднують електронів; їх іони завжди заряджені позитивно.
Легко віддаючи при хімічних реакціях свої валентні електрони, типові метали є енергійними відновниками. Здатність до віддачі електронів виявляється в окремих металів далеко не в однаковій мірі. Чим легше метал віддає свої електрони, тим він активніше, тим енергійніше вступає у взаємодію з іншими речовинами. Опустимо шматочок цинку в розчин якої-небудь свинцевої солі. Цинк починає розчинятися, а з розчину виділяється свинець. Реакція виражається рівнянням:
Zn + Pb (NO3) 2 \u003d Pb + Zn (NO3) 2
З рівняння випливає, що ця реакція є типовою реакцією окислення-відновлення. Суть її зводиться до того, що атоми цинку віддають свої валентні електрони іонів двовалентного свинцю, тим самим перетворюючись в іони цинку, а іони свинцю відновлюються і виділяються у вигляді металевого свинцю. Якщо надійти навпаки, тобто занурити шматочок свинцю в розчин цинкової солі, то ніякої реакції не відбудеться. Це показує, що цинк більш активний, ніж свинець, що його атоми легше віддають, а іони важче приєднують електрони, ніж атоми і іони свинцю.
Витіснення одних металів з їхніх сполук іншими металами вперше було докладно вивчене росіянином ученим Бекетовим, що розташував метали по їх убутній хімічній активності в так званий "витіснювальний ряд". В даний час витіснювальний ряд Бекетова носить назву ряду напруг.
Метали, розташовані в порядку зростання їх стандартних
електроднихпотенціалів, і утворюють електрохімічний ряд напруг металів: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb,
H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Ряд напруг характеризує хімічні властивості металів:
- Чим менше електродний потенціал металу, тим більше його відновна здатність.
- Кожен метал здатний витісняти (відновлювати) з розчинів солей ті метали, які стоять в ряду напруг після нього.
- Всі метали, що мають негативний стандартний електродний потенціал, тобто що знаходяться в ряді напруг лівіше водню, здатні витісняти його з розчинів кислот.
Необхідно відзначити, що представлений ряд характеризує поводження металів і їх солей тільки у водних розчинах і при кімнатній температурі.
Крім того, потрібно мати на увазі, що висока електрохімічна активність металів не завжди означає його високу хімічну активність. Наприклад, ряд напруг починається літієм, тоді як більш активні в хімічному відношенні рубідій і калій знаходяться правіше літію. Це пов'язано з винятково високою енергією процесу гідратації іонів літію в порівнянні з іонами інших лужних металів.
IV. Корозія металів.
Майже всі метали, приходячи в зіткнення з навколишньою їх газоподібним чи рідким середовищем, більш-менш швидко піддаються з поверхні руйнуванню. Причиною його є хімічна взаємодія металів з розташованими в повітрі газами, а також водою і розчиненими в ній речовинами.
Всякий процес хімічного руйнування металів під дією навколишнього середовища називають корозією.
Найпростіше протікає корозія при зіткненні металів з газами. На поверхні металу утворюються відповідні сполуки: оксиди, сірчисті з'єднання, основні солі вугільної кислоти, які нерідко покривають поверхню щільним шаром, що захищає метал від подальшого впливу тих же газів.
Інша справа при зіткненні металу з рідким середовищем - водою і розчиненими в ній речовинами.
Утворені при цьому, можуть розчинятися, завдяки чому корозія поширюється далі вглиб металу. Крім того, вода, що містить розчинені речовини, є провідником електричного струму, внаслідок чого постійно виникають електрохімічні процеси, які є одним з головних факторів, що обумовлюють і прискорюють корозію.
Чисті метали в більшості випадків майже не піддаються корозії. Навіть такий метал, як залізо, в абсолютно чистому вигляді майже не іржавіє. Але звичайні технічні метали завжди містять різні домішки, що створює сприятливі умови для корозії.
і т.д.................
неметалами називають хімічні елементи, які утворюють в вільному вигляді прості речовини, вони не володіють фізичними властивостями металів. З 109 хімічних елементів 87 можна віднести до металів, 22 є неметалами.
при звичайних умовах неметали можуть знаходиться в газоподібному, рідкому, а також твердому стані.
газами є гелій He, неон Ne, аргон Ar, криптон Kr, ксенон Xe, радон Rn. Це все інертні гази. Кожна молекула інертного газу складається з одного атома. На зовнішньому електронному рівні у атомів інертних газів (крім гелію) розташовані вісім електронів. У гелію лише два. Через свою хімічної стійкості інертні гази можна порівнювати з благородними дорогоцінними металами - золотом і платиною, у них також є й інша назва - благородні гази. Подібну назву краще підходить до інертних газів, так як вони можуть вступати в хімічні реакції і утворювати хімічні сполуки. У 1962 році стало відомо, що ксенон і фтор можуть утворювати сполуки. З того часу, відомо більше 150 хімічних сполук ксенону, криптону, радону з фтором, киснем, хлором і азотом.
Подання про хімічну винятковості благородних або інертних газів, виявилося не зовсім вірним, тому замість очікуваної нульової групи інертні гази були віднесені до восьмої групи періодичної системи.
Такі гази як водень, кисень, азот, хлор і фтор утворюють двохатомних молекул, вже знайомі нам H 2, O 2, N 2, CL 2, F 2.
Висловити склад речовини можна за допомогою хімічних і математичних знаків - хімічною формулою. Як ми вже знаємо, за хімічною формулою можна обчислити відносну молекулярну масу речовини (Mr). Відносна молекулярна маса простого речовини дорівнює добутку відносної атомної маси на число атомів в молекулі, наприклад, кисню: O 2
Mr (O 2) \u003d Ar (O) · 2 \u003d 16 · 2 \u003d 32
Проте, кисень може утворювати ще одне газоподібне найпростіше речовина - озон, до складу молекули озону входять вже три атома кисню. Хімічна формула O 3.
Здатність атомів одного хімічного елемента створювати кілька простих речовин називається аллотропией, А ці прості речовини - алотропна змінами, Їх також називають модифікаціями.
Властивості аллотропних модифікацій хімічного елемента кисню: простих речовин O 2 і озону O 3 істотно розрізняються.
Кисень не володіє характерним запахом на відміну від озону (звідси прийшло і назва озону - в перекладі з грецької мови озон означає «пахне»). Подібний аромат, можна відчути під час грози, газ утворюється в повітрі за рахунок електричних розрядів.
Кисень не володіє кольором на відміну від озону, який можна відрізнити по блідо-фіолетового відтінку. Озон має бактерицидні властивості. Він також використовується для знезараження питної води. Озон може перешкоджати проходженню ультрафіолетових променів сонячного спектра, вони згубні для всіх живих організмів на Землі. Озоновий екран (шар), який знаходиться на висоті 20-35 км, захищає все живе від згубних сонячних променів.
З 22 простих речовин-неметалів при звичайних умовах в жідкообразном стані існує тільки бром, його молекули двоатомний. Формула Брома: Br 2.
Бром вдає із себе важку буру, з неприємним запахом рідина (бромос з давньогрецької мови перекладається як «смердючий»).
Такі тверді речовини-неметали як сірка і вуглець відомі ще з давніх часів (деревне вугілля).
тверді речовини-неметали також схильні до явища аллотропии. Вуглець може утворювати такі прості речовини, як алмаз, графіт і т.п. Різниця в будова алмазу і графіту полягає в будові кристалічних решіток.
Залишилися питання? Не знаєте, як зробити домашнє завдання?
Щоб отримати допомогу репетитора - зареєструйтеся.
Перший урок - безкоштовно!
www.сайт, при повному або частковому копіюванні матеріалу посилання на першоджерело обов'язкове.
Неметали, хімічні елементи, які не володіють властивостями, характерними для металів. Неметали як правило погані провідники тепла і електрики (вони зазвичай є ізоляторами тепла і електрики). До неметаллам відносяться вуглець, ... ... Науково-технічний енциклопедичний словник
Хімічні елементи, які утворюють прості тіла, що не володіють властивостями, характерними для металів. До неметаллам зазвичай відносять 22 елементи: гази водень, азот, кисень, фтор, хлор і інертні гази; рідина бром; тверді тіла бор, ... ... Великий Енциклопедичний словник
Неметали - хім. елементи, які утворюють у вільному стані прості речовини, що не володіють фіз. і хім. властивостями (див.); застаріла назва металоїди. До Н. прийнято відносити 22 елемента Періодичної системи елементів Д. І. Менделєєва (див.): Водень ... Велика політехнічна енциклопедія
Хімічні елементи, які утворюють прості тіла, що не володіють властивостями, характерними для металів. До неметаллам зазвичай відносять 22 елементи: гази водень, азот, кисень, фтор, хлор і інертні гази; рідина бром; тверді тіла бор, ... ... енциклопедичний словник
Неметали - хімічні елементи, які утворюють прості тіла, що не володіють характерними для металів властивостями. До неметаллам відносяться 22 елементи. З них при кімнатній температурі знаходяться в газоподібному стані Н, N, О, F, Cl ... Енциклопедичний словник по металургії
Хімічні елементи, які утворюють прості тіла, що не володіють властивостями, характерними для металів (Див. Метали). Назва Металоїди, яке іноді застосовують для Н., виходить з ужитку. До Н. відносяться 22 елементи. З них при ... ... Велика Радянська Енциклопедія
Прості в ва, що не володіють св вами металів. Хоча чіткої межі між металами і Н. провести не можна, до Н. прийнято відносити благородні гази, водень, галогени, кисень, халькогена, азот, фосфор, миш'як, вуглець, кремній і бор ... Великий енциклопедичний політехнічний словник
Хім. елементи, до риє утворюють прості тіла, що не володіють властивостями, характерними для металів. До Н. зазвичай відносять 22 елементи: гази водень, азот, кисень, фтор, хлор і інертні гази; рідина бром; тв. тіла бор, вуглець, кремній, фосфор, ... ... Природознавство. енциклопедичний словник
Неметали - прості речовини, що не володіють властивостями металів: вони не мають металевого блиску, нековким, погано проводять теплоту і електрику. Різкого розмежування між неметалами і металами немає. До неметаллам відносяться 22 елементи. З них при нормальній ... ... металургійний словник
Неорганічна хімія розділ хімії, пов'язаний з вивченням будови, реакційної здатності та властивостей всіх хімічних елементів і їх неорганічних сполук. Це область охоплює всі хімічні сполуки, за винятком органічних ... ... Вікіпедія
книги
- Комплект таблиць. Хімія. Неметали (18 таблиць),. Навчальний альбом з 18 аркушів. Арт. 5-8688-018 Галогени. Хімія галогенів. Сірка. Аллотропия. Хімія сірки. Сірчана кислота. Хімія азоту. Оксиди азоту. Азотна кислота - окислювач. Фосфор. ...
- Хімія. Метали. Неметали. 9 клас. Робочий зошит, Корощенко Антоніна Степанівна. Робочий зошит містить велику кількість завдань, які можуть бути використані для досягнення предметних, метапредметних і особистісних результатів обученіяхіміі в 9 класі. Посібник…
- Тести з хімії: 9 кл. : Неметали. Узагальнення знань з хімії за курс основної школи. Підготовка до Основного державного іспиту. ФГОС, Рябов, Михайло Олексійович. Даний посібник повністю відповідає федеральному державному освітньому стандарту (другого покоління). Посібник містить тести, що охоплюють дві теми підручника О. С. Габрієляна ...
МНОУ «Ліцей»
Реферат з хімії на тему:
«Неметали»
виконали:
учениці 11 «А» класу
Кучеренко Марія,
Шадріна Ксенія.
перевірила:
вчитель хімії
Щербакова Марина
Олександрівна.
Кемерово - 2002
Введение .............................................................................. ..3
§1. Положення неметалічних елементів у періодичній системі хімічних елементів. Знаходження в природі. Загальні хімічний і фізичні властивості .......................................... 4
§2. Загальні хімічні властивості неметалів ........................... ..6
§3. Будова і властивості простих речовин - неметалів ......... 7
§4. Кисневі і водневі сполуки неметалів. коротка характеристика їх властивостей ................................................... 9
тест
Список використаної літератури
Вступ .
Все різноманіття навколишнього нас природи складається з поєднань порівняно невеликого числа хімічних елементів.
У різні історичні епохи в поняття «елемент» вкладався різний зміст. Давньогрецькі філософи як «елементів» розглядали чотири «стихії» - тепло, холод, сухість і вологість. Поєднуючись попарно, вони утворювали чотири «почала» всіх речей - вогонь, повітря, воду і землю. У середні століття до цих початків додалися сіль, сірка і ртуть. У XVII столітті Р. Бойль вказав на те, що всі елементи носять матеріальний характер і їх число може бути досить велике.
У 1787 році французький хімік А. Лавуазьє створив «Таблицю простих тіл». До неї увійшли всі відомі на той час елементи. Під останніми розумілися прості тіла, які не вдавалося розкласти хімічними методами на ще більш прості. Згодом з'ясувалося, що в таблицю увійшли і деякі складні речовини.
В даний час поняття «хімічний елемент» встановлено точно.
Хімічний елемент - вил атомів з однаковим позитивним зарядом ядра. (Останній дорівнює порядковому номеру елемента в таблиці Менделєєва.)
В даний час відомо 107 елементів. Близько 90 з них існують в природі. Решта отримані штучно за допомогою ядерних реакцій. 104-107 елементи були синтезовані вченими-фізиками в Об'єднаному інституті ядерних досліджень в місті Дубні. В даний час тривають роботи по штучному отриманню хімічних елементів з більш високими порядковими елементами.
Всі елементи діляться на метали і неметали. З 107 елементів 85 ставляться до металам. До неметаллам відносять такі елементи: гелій, неон, аргон, криптон, ксенон, радон, фтор, хлор, бром, йод, астат, кисень, сірка, селен, телур, азот, фосфор, миш'як, вуглець, кремній, бор, водень. Однак це поділ умовний. При певних умовах деякі метали можуть проявляти неметалічні властивості, а деякі неметали - металеві властивості.
§1. Положення неметалічних елементів у періодичній системі хімічних елементів. Знаходження в природі. Загальні хімічний і фізичні властивості.
Неметалічних елементів у порівнянні до металевими елементами відносно небагато. Їх розміщення в періодичній системі хімічних елементів Д.І. Менделєєва відображено в таблиці №1.
Таблиця №1.
Як видно з таблиці №1 неметалеві елементи в основному розташовані в правій верхній частині періодичної системи. Так як в періодах зліва направо у атомів елементів збільшується заряди ядер і зменшуються атомні радіуси, а в групах зверху вниз атомні радіуси також зростають, то зрозуміло, чому атому неметалів сильніше, ніж атоми металів, притягають зовнішні електрони. У зв'язку з цим у неметалів переважають окисні властивості. Особливо сильні окислювальні властивості, тобто здатність приєднувати електрони, виявляють неметали, що знаходяться в 2-му і 3-му періодах VI-VII груп. Найсильнішим окислювачем є фтор. Відповідно до чисельними значеннями відносних електроотріцательностей окисні здатності неметалів збільшується в наступному порядку: Si, B, H, P, C, S, I, N, Cl, O, F. Отже, енергійніше усього взаємодіє з воднем і металами фтор:
Менш енергійно реагує кисень:
Фтор - найтиповіший неметалл, якому не характерні відновні властивості, тобто здатність віддавати електрони в хімічних реакціях.
Кисень ж, судячи з його сполук з фтором, може виявляти і позитивну ступінь окислення, тобто бути відновником.
Всі інші неметали виявляють відновні властивості. Причому ці властивості поступово зростають від кисню до кремнію: O, Cl, N, I, S, C, P, H, B, Si. Так, наприклад, хлор безпосередньо з киснем не з'єднує, але непрямим шляхом можна отримати його оксиди (Cl2 O, ClO2, Cl2O2), в яких хлор виявляє позитивну ступінь окислення. Азот при високій температурі безпосередньо з'єднується з киснем і, отже, проявляє відновні властивості. Ще легше з киснем реагує сірка: вона проявляє і окисні властивості.
Перейдемо до розгляду будови молекул неметалів. Неметали утворюють як одноатомні, так і двоатомних молекули.
До одноатомних неметаллам відносяться інертні гази, практично не реагують навіть з самими активними речовинами. Інертні гази розташовані в VIII групі Періодичної системи, а хімічні формули відповідних простих речовин наступні: He, Ne, Ar, Kr, Xe і Rn.
Деякі неметали утворюють двохатомних молекул. Це H2, F2, Cl2, Br2, I2 (елементи VII групи періодичної системи), а також кисень O2 і азот N2. З трьохатомних молекул складається газ озон (O3).
Для речовин неметалів, що знаходяться в твердому стані, скласти хімічну формулу досить складно. Атоми вуглецю в графіті з'єднані один з одним по-різному. Виділити окрему молекулу в наведених структурах важко. При написанні хімічних формул таких речовин, як і в випадку з металами, вводиться припущення, що такі речовини складаються тільки з атомів. Хімічні формули, при цьому, записуються без індексів - C, Si, S і т.д.
Такі прості речовини, як озон і кисень, що мають однаковий якісний склад (обидва складаються з одного і того ж елемента - кисню), але різняться за кількістю атомів в молекулі, мають різні властивості. Так, кисень запаху не має, в той час як озон має різким запахом, який ми відчуваємо під час грози. Властивості твердих неметалів, графіту і алмазу, мають також однаковий якісний склад, але різну будову, різко відрізняються (графіт крихкий, алмаз твердий). Таким чином, властивості речовини визначаються не тільки його якісним складом, але і тим, скільки атомів міститься в молекулі речовини і як вони пов'язані між собою.
Неметали у вигляді простих тіл знаходяться в твердому або газоподібному стані (виключаючи бром - рідина). Вони не мають фізичних властивостей, властивих металам. Тверді неметали не володіють характерним для металів блиском, вони зазвичай тендітні, погано проводять електричний струм і тепло (за винятком графіту).
§2. Загальні хімічні властивості неметалів.
Оксиди неметалів відносять до кислотних оксидів, яким відповідають кислоти. З воднем неметали утворюють газоподібні сполуки (наприклад HCl, H2S, NH3). Водні розчини деяких з них (наприклад, галогеноводородов) - сильні кислоти. З металами типові неметали дають з'єднання з іонним зв'язком (наприклад, NaCl). Неметали можуть при певних умовах між собою реагувати, утворюючи з'єднання з ковалентного полярної (H2O, HCl) і неполярний зв'язками (CO2).
З воднем неметали утворюють леткі сполуки, як, наприклад, фтороводород HF, сірководень H2S, аміак NH3, метан CH4. При розчиненні в воді водневі сполуки галогенів, сірки, селену і телуру утворюють кислоти тієї ж формули, що і самі водневі сполуки: HF, HCl, HCl, HBr, HI, H2S, H2Se, H2Te.
При розчиненні в воді аміаку утворюються аміачна вода, зазвичай позначена формулою NH4OH і звана гідроксидом амонію. Її також позначають формулою NH3 H2O і називають гідратом аміаку.
З киснем неметали утворюють кислотні оксиди. В одних оксидах вони проявляють максимальну ступінь окислення, що дорівнює номеру групи (наприклад, SO2, N2O5), а інших - більш низьку (наприклад, SO2, N2O3). Кислотних оксидів відповідають кислоти, причому з двох кисневих кислот одного неметалла сильніше та, в якій він проявляє вищу ступінь окислення. Наприклад, азотна кислота HNO3 сильніше азотистої HNO2, а сірчана кіслотаH2SO4 сильніше сірчистої H2SO3.
§3. Будова і властивості простих речовин - неметалів.
Найтиповіші неметали мають молекулярну будову, а менш типові - немолекулярное. Цим і пояснюється відмінність їх властивостей. Наочно це відображено в схемі №2.
Таблиця №2
Кристалічний бор В (як і кристалічний кремній) має дуже високу температуру плавлення (2075 ° С) і високу стійкість. Електрична провідність бору з підвищенням температури сильно збільшується, що дає можливість широко застосовувати його в напівпровідниковій техніці. Добавка бору до сталі і до сплавів алюмінію, міді, нікелю та ін. Покращує їх механічні властивості.
Бориди (сполуки бору з деякими металами, наприклад з титаном: TiB, TiB2) необхідні при виготовленні деталей реактивних двигунів, лопаток газових турбін.
Як видно зі схеми №2, вуглець С, кремній Si, бор В мають схожу будову і володіють деякими загальними властивостями. Як прості речовини вони зустрічаються в двох видозмінах - в кристалічному і аморфному. Кристалічні видозміни цих елементів дуже тверді, з високими температурами плавлення. Кристалічний кремній має напівпровідниковими властивостями.
Всі ці елементи утворюють сполуки з металами - карбіди, силіциди та бориди (CaC2, Al4C3, Fe3C, Mg2Si, TiB, TiB2). Деякі з них мають більшу твердість, наприклад Fe3C, TiB. Карбід кальцію використовується для отримання ацетилену.
Якщо порівняти розташування електронів по орбіталях ф атомах фтору, хлору та інших галогенів, то можна судити і про їх відмінні властивості. У атома фтору вільних орбіталей немає. Тому атоми фтору можуть проявити лише валентність I і ступінь окислення - 1. В атомах інших галогенів, наприклад в атомі хлору, на тому ж енергетичному рівні є вільні d-орбіталі. Завдяки цьому розпарювання електронів може відбутися трьома різними шляхами.
У першому випадку хлор може проявити ступінь окислення +3 і утворити хлористую кислоту HClO2, якій відповідають солі - хлорити, наприклад хлорит калію KClO2.
У другому випадку хлор може утворити з'єднання, в яких ступінь окислення хлору +5. До таких сполук відносяться хлороноватая кислота HClO3 і її солі - хлорати, наприклад хлорат калію КClO3 (бертолетової сіль).
У третьому випадку хлор проявляє ступінь окислення +7, наприклад в хлорним кислоті HClO4 і в її солях - перхлорати, наприклад в перхлорат калію КClO4.
§4. Кисневі і водневі сполуки неметалів. Коротка характеристика їх властивостей.
З киснем неметали утворюють кислотні оксиди. В одних оксидах вони проявляють максимальну ступінь окислення, що дорівнює номеру групи (наприклад, SO2, N2O5), а інших - більш низьку (наприклад, SO2, N2O3). Кислотних оксидів відповідають кислоти, причому з двох кисневих кислот одного неметалла сильніше та, в якій він проявляє вищу ступінь окислення. Наприклад, азотна кислота HNO3 сильніше азотистої HNO2, а сірчана кислота H2SO4 сильніше сірчистої H2SO3.
Характеристики кисневих з'єднань неметалов:
1. Властивості вищих оксидів (тобто оксидів, до складу яких входить елемент даної групи з вищим ступенем окислення) в періодах зліва направо поступово змінюються від основних до кислотних.
2. У групах зверху вниз кислотні властивості вищих оксидів поступово слабшають. Про це можна судити за властивостями кислот, які відповідають цим оксидам.
3. Зростання кислотних властивостей вищих оксидів відповідних елементів в періодах зліва направо пояснюється поступовим зростанням позитивного заряду іонів цих елементів.
4. У головних підгрупах періодичної системи хімічних елементів в напрямку зверху вниз кислотні властивості вищих оксидів неметалів зменшуються.
Загальні формули водневих з'єднань по групах періодичної системи хімічних елементів наведені в таблиці №3.
Таблиця №3.
З металами водень утворює (за деяким винятком) нелеткі з'єднання, які є твердими речовинами немолекулярного будови. Тому їх температури плавлення порівняно високі.
З неметалами водень утворює леткі сполуки молекулярного будови. У звичайних умовах це гази або летючі рідини.
У періодах зліва направо кислотні властивості летких водневих з'єднань неметалів у водних розчинах посилюється. Це пояснюється тим, що іони кисню мають вільні електронні пари, а іони водню - вільну орбіталь, то відбувається процес, котроие виглядає наступним чином:
H2O + HF - H3O + F
Фтороводород у водному розчині відщеплює позитивні іони водню, тобто проявляє кислотні властивості. Цьому процесу сприяє й те обставина: іон кисню має неподіленого електронну пару, а іон водню - вільну орбіталь, завдяки чому утворюється донорно-акцепторні зв'язок.
При розчиненні аміаку в воді відбувається протилежний процес. А так як іони азоту мають неподіленого електронну пару, а іони водню - вільну орбіталь, виникає додаткова зв'язок і утворюються іони амонію NH4 + і гідроксид-іони ОН. В результаті розчин набуває основні властивості. Цей процес можна виразити формулою:
H2O + NH3- NH4 + OH
Молекули аміаку у водному розчині приєднують позитивні іони водню, тобто аміак проявляє основні властивості.
Тепер розглянемо, чому водневе з'єднання фтору - фтороводород HF - у водному розчині є кислотою, але більш слабкою, ніж хлороводородная. Це пояснюється тим, що радіуси іонів фтору значно менше, ніж іонів хлору. Тому іони фтору набагато сильніше притягують до себе іони водню, ніж іони хлору. У зв'язку з цим ступінь дисоціації фтороводородной кислоти значно менше, ніж соляної кислоти, тобто фтороводородной кислота слабкіше соляної кислоти.
З наведених прикладів можна зробити наступні загальні висновки:
1. В періодах зліва направо у іонів елементів позитивний заряд збільшується. У зв'язку з цим кислотні властивості летких водневих з'єднань елементів у водних розчинах посилюються.
2. У групах зверху вниз негативно заряджені аніони все слабше притягують позитивно заряджені іони водню Н +. У зв'язку з цим полегшується процес відщеплення іонів водню Н + та кислотні властивості водневих з'єднань збільшуються.
3. Водневі сполуки неметалів, що володіють у водних розчинах кислотними властивостями, реагують з лугами. Водневі ж з'єднання неметалів, що володіють у водних розчинах основними властивостями, реагують з кислотами.
4. Окислювальна активність водневих з'єднань неметалів в групах зверху вниз сильно збільшується. Наприклад, окислити фтор з водневого з'єднання HF хімічним шляхом не можна, окислити ж хлор з водневого з'єднання HCl можна різними окислювачами. Це пояснюється тим, що в групах зверху вниз різко зростають атомні радіуси, у зв'язку з чим віддача електронів полегшується.
Список використаної літератури.
1. Рудзитис Г.Є., Фельдман Ф.Г. Хімія-11 - М .: Просвещение, 1992.
2. Кременчуцька М., Васильєв С. Довідник школяра - М .: АСТ, 1999..
3. Хомченко Г.П. Хімія для вступників до ВНЗ - М .: Вища школа, 1993.
