Найбільша кількість установок з виробництва сірчаної кислоти використовує в якості сировини сірку. Сірка ниже побічним продуктом переробки природного газу і деяких інших промислових газів (генераторного, газон нафтопереробки). Такі гази завжди містять якусь кількість сірчистих сполук. Спалювання неочищеного від сірки природного газу призведе до забруднення навколишнього середовища оксидами сірки. Тому сірчисті з'єднання зазвичай спочатку видаляють і вигляді сірководню, який потім частково спалюють до SO2, після чого суміш сірководню і діоксиду сірки взаємодіє на шарі бокситу при 270-300 º С, перетворюючись в результаті цієї взаємодії в S і Н2О. Отримана таким чином сірка називається «газової». Крім «газової», в якості сировини може використовуватися самородна сірка.
Сірка як сировину для виробництва сірчаної кислоти має ряд переваг. По-перше, вона на відміну від сірчаного колчедану, майже не містить домішок, які могли б представляти собою каталітичні отрути на стадії контактного окислення діоксиду сірки, наприклад, сполук миш'яку. По-друге, при її спалюванні не утворюється твердих та інших відходів, які вимагали б складування або пошуку методів їх подальшої переробки (при випалюванні колчедану на 1 т вихідного колчедана утворюється практично стільки ж твердого відходу - недогарка). По-третє, сірку значно дешевше транспортувати, ніж колчедан, так як це концентроване сировину.
Розглянемо "коротку" схему отримання сірчаної кислоти з сірки методом ДКДА (рис. 2).
Мал. 2. Схема виробництва сірчаної кислоти з сірки по методу подвійного контактування і подвійний абсорбції:
1 - піч для спалювання сірки; 2 - котел-утилізатор; 3 --економайзер 4 - пускова топка: 5. 6 - теплообмінники пусковий топки. 7 - контактний апарат: 8 - теплообмінники 9 - сушильна вежа. 10, 11 - перший і другий моногідрат абсорбери. 12 - збірники кислоти: 13 - вихлопна труба.
Розплавлену сірку пропускають через сітчасті фільтри для очищення від можливих механічних домішок (сірка плавиться при температурі. Трохи вище 100 º С, тому такий спосіб її очищення найбільш простий) і направляють в піч 1, в яку в якості окислювача подають повітря, попередньо осушене продукционной сірчаною кислотою в сушильній башті 9. Вихід з печі випалювальних газ охолоджують в котлі-утилізатори 2 з 1100-1200 º с до 440-450 º с і направляють з цієї температурою, що дорівнює температурі запалювання промислових каталізаторів на основі пентоксіда ванадію, на перший шар полично-контактного апарату 7 .
Температурний режим, необхідний для наближення робочої лінії процесу до лінії оптимальних температур, регулюється пропусканням потоків частково вступило в реакцію обжигового газу через теплообмінники 8, де відбувається його охолодження нагріваються потоками газу після абсорбції (або осушеного повітря). Після третього ступеня контактування випалювальних газ охолоджують в теплообмінниках 8 і направляють в проміжний моногідрат абсорбер 10, зрошувану циркулюючої через збірник кислоти 12 сірчаною кислотою з концентрацією, близькою до 98,3%. Після вилучення в абсорбере 10 триоксида сірки і досягнутого внаслідок цього відхилення від майже досягнутого рівноваги газ знову нагрівають до температури запалювання в теплообмінниках 8 і направляють на четверту сходинку контактування.
В даній схемі для охолодження газу після четвертої ступені та додаткового змішування рівноваги до нього додають частину осушенного повітря. Прореагували в контактом апараті гази пропускають для охолодження через економайзер 3 і направляють в заключний 11 моногідрат абсорбер 11, з якого не містять оксидів сірки гази викидають через вихлопну трубу 13 в атмосферу.
Для пуску установки (виведення її на заданий технологічний, зокрема температурний, режим) передбачені пускова топка 4 і теплообмінники пусковий топки 5 і 6. Ці апарати відключаються після виведення установки в робочий режим.
Виробництво сірчаної кислоти
Сірчана кислота - найдешевша з мінеральних кислот. Її виробниц-ство в Росії в 1993 р становило 8,2 млн. Т. Властивості сірчаної кислоти: щільність - 1,85 г / см 3 при 0 о С;
t кип - 296 о С, з водою змішується в будь-яких співвідношеннях з виділенням біль-шого кількості тепла. Дуже хімічно активна: розчиняє оксиди металів і більшість чистих металів, витісняє всі інші кислоти з їх со-лей. Має високу водовіднімаючих здатністю. Дерево і інші рас-тітельние і тваринні тканини руйнуються в концентрованої сірчаної ки-слоті.
Застосування сірчаної кислоти: виробництво мінеральних добрив, кольорова металургія, травлення металів, отримання барвників, лаків, кра-сік і інших органічних речовин.
способи отримання:
1.Терміческім розкладанням залізного купоросу (відкритий в ХIII в)
2.Нітрозний метод (використовується 200 років)
3.Контактний метод (використовується менше 100 років) в даний час витіснив всі інші. Цим методом виробляється більше 80% сірчаної кислоти.
Виробництво сірчаної кислоти контактним методом
Основні стадії виробництва сірчаної кислоти:
1.Получение двоокису сірки
2.Очістка двоокису сірки
3.Окісленіе двоокису сірки в сірчаний ангідрид
4.Одержання олеума
I.Полученіе so2
Сировина для виробництва SO 2 - самородна сірка, пірит, мідний колчедан; сульфати кальцію і натрію.
Отримання двоокису сірки з піриту.
Пірит має формулу FeS 2. З піриту отримують до 40% сірчаної кисло-ти, він містить до 50% сірки і до 40% заліза. Якщо пірит містить велику кількість кольорових металів, то його піддають флотаційного збагачення з отриманням сульфідів кольорових металів і піриту.
Для отримання двоокису сірки пірит обпалюють в печах різної конст-рукції. При цьому йдуть такі реакції:
4 FeS 2 + 11O 2 → 2Fe 2 O 3 + 8 SO 2 + 3400 кДж
Цей процес складається з декількох стадій:
При температурі понад 500 ° С йде дисоціація піриту:
2 FeS 2 → 2FeS + S 2 після чого сірка швидко згоряє
S 2 + 2O 2 → 2 SO 2
Що залишився FeS окислюється:
4 FeS + 7O 2 → Fe 2 O 3 + 4 SO 2
При випалюванні піриту 5-10% сірки переходить в SO 3
2 SO 2 + O 2 → 2SO 3
Для випалу піриту використовують печі:
механічні поличні- це універсальні печі, які можуть ис-користуватися для випалу будь-якого сипучого матеріалу. При випалюванні піриту по-лучают газ наступного складу: SO 2 -10%, O 2 -9%, N 2 -82%. При t\u003e 850 0 С пірит спікається в шматки, що небажано. Тому випал ведуть при темпера-турі не більше 850 0 С. запиленість газу становить не більше 10 г / м 3.
Недоліки механічних поличних печей: вони складні в пристрої і дороги, не забезпечують повного випалювання сірки, виходить газ з низькою концентрацією SO 2, в піритових огарків залишається до 2% сірки.
Печі пилоподібного випалуможна використовувати тільки для сухого флоту-ційного колчедана, який подається в піч за допомогою форсунки. Від згоряння йде набагато інтенсивніше, а можливість спікання менше, тому можна використовувати температуру до 1100 0 С - це дозволить подавати менший хати-ток повітря. Концентрація SO 2 ≤ 13%, в огарки залишається до 1,5% сірки. Відх-дящие гази мають температуру близько 1000 0 С і подаються в котел утилізатор для отримання пара.
Недоліки печей пилоподібного випалу: необхідність застосування кол-Чеда з малою вологістю, висока запиленість газу (до 100 г / м 3).
Печі киплячого шару івикористовуйте для випалу як флотаційного, так і рядового колчедана. Концентрація частинок в об'ємі повітря більше, ніж в пилоподібних печах. Випал ведеться при температурі 800 0 С. Концентрація SO 2 в газі до 15%, в огарки залишається близько 0,5% сірки. Печі прості в пристрої і високопродуктивні. В даний час знаходять все більш широке при-трансформаційних змін.
Недоліки печей киплячого шару: високий вміст пилу (до 200 г / м 3) необхідність використання частинок близьких за розміром.
Використання сірки для отримання двоокису сірки.
Сірку спочатку плавлять глухим паром, відфільтровують від механічних домішок і подають через форсунку в піч. При цьому сірка випаровується і згорить-ет.
Крім форсункових використовують також циклонні печі, де за рахунок тан-генціального підведення повітря інтенсивність перемішування і згорання сірки вище, ніж в форсункових. Тому в даний час циклонні печі ви-тісняться форсункові.
2.Очістка газу від пилу.
Груба очищення проводиться в циклонах і пилеосадітельних камерах, кото-які встановлюються після печей. Доочищення проводиться в промивних баш-нях і мокрих електрофільтрах.
3.Контактное окислення двоокису сірки в сірчаний ангідрид - ето процес гетерогенний каталітичний, тобто реагують речовини і каталізатор знаходяться в різних фазових станах. В даному випадку реагують віщо-ства - гази, а каталізатор знаходиться в твердому стані. На каталізаторі йде наступна реакція:
2 SO 2 + O 2 ↔ 2SO 3 +190 кДж.
Для того, щоб підвищити вихід SO 3. необхідно підвищувати тиск і поні-жати температуру, проте при зниженні температури зменшується швидкість реакції. Тому для забезпечення досить високої швидкості реакції процес ведуть при температурі не менше 450 0 С.
Додатково використовують каталізатори. Відомі сотні речовин, ко-торие прискорюють цю реакцію. Кращими є Pt, FeO, V 2 O 5. Найбільш ак-тивна платина, але вона дуже дорога і легко окислюється домішками, утримуючи-щимися в випалювальному газі, особливо миш'яком. Тому зазвичай використовують V 2 O 5. Він менш активний, але набагато дешевше і отруюється сполуками миш'яку в кілька тисяч разів менше, ніж платина. Ванадієва контактна маса містить 7% V 2 O 5 в якості активатора - оксид калію, а носієм є пористі алюмосилікати. Каталізатор використовують у вигляді таблеток при t \u003d 400-600 0 С. При t\u003e 600 0 С відбувається необоротне падіння активності каталізатора, внаслідок спікання активних компонентів з освітою не-активних сполук. при t< 400 0 С активность катализатора тоже падает.
Процес каталізу йде в кілька стадій:
1.Діффузія компонентів з ядра газового потоку до гранул, і всередину пір контактної маси
2.Сорбція кисню каталізатором.
3.Сорбція молекул SO 2 з утворенням комплексу SO 2 * O * Kt
4.Перегруппіровка електронів з утворенням комплексу SO 3 * Kt
5.Десорбція SO 3
6.Діффузія SO 3 з зерен каталізатора в газовий потік.
При використанні великих гранул каталізатора загальна швидкість про-процесу визначається дифузією (1,6 стадії) тому зазвичай використовують гра-нули діаметром не більше 5 мм, і в цьому випадку лимитирующей є сорбція молекул SO 2 (2 стадія). Термін служби каталізатора близько 4 років.
Технологічна схема виробництва сірчаної кислоти.
Технологічна схема виробництва сірчаної кислоти представлена \u200b\u200bна рис.1. Сірчистий газ з печі випалу надходить на очистку спочатку в циклон 1, а за-тим в сухий електрофільтр 2: температура газу на виході з електрофільтру близько 300 0 С. Потім газ надходить в порожнисту промивну вежу 3, де разбриз-ГІВА холодна сірчана кислота з концентрацією 75%. При охолодженні газу, що містяться в ньому SO 3 і пари води конденсуються у вигляді дрібних ка-Пелеком, в яких розчиняється окис миш'яку. В результаті утворюється миш'яково-кислотний туман, який вловлюється в порожнистої вежі 3 і в башті з насадкою 4. Одночасно уловлюються залишки пилу, селен та інші домішки. Остаточне очищення SO 2 проводиться в мокрих електрофільтрах
5. Зазвичай встановлюється послідовно 2-3 фільтра. Очищення газу закан-чивается його осушенням від парів води концентрованої сірчаної кислотою у вежі з насадкою 6.
Апарати для очищення газу виготовляються з нержавіючої сталі і додатково футеруются кислототривким цеглою.
Сухі SO 2 і SO 3 не агресивні, тому інші апарати можна монтувати зі звичайної сталі. Сухий SO 2 надходить в контактний вузол, кото-рий складається з:
Контактного апарату 7
теплообмінника 8
Пускового вогневого підігрівача газу, який служить для підігріву газу під час пуску установки або падінні температури.
Газ в контактний вузол подають турбокомпресором 9. Контактний аппа-рат є циліндр діаметром 3-12 м, висотою 10-25 м. Усередині корпусу встановлюють 4-5 решіток із шаром гранул контактної маси. Між-ду гратами встановлюють теплообмінники.
Свіжий газ підігрівається за рахунок тепла прореагировавшего гарячого газу в зовнішніх теплообмінниках, а потім у внутрішніх теплообменниках на-Гревал до t \u003d 440-450 0 С, після чого надходить в перший шар контактної маси. Після кожного шару контактної маси газ проходить через один з внутрішніх теплообмінників для охолодження. Після контактного апарату газ надходить на абсорбцію в вежі з насадкою 11,12. Абсорбентом є в башті 11 - олеум, а в башті 12 - 98,3% -ва сірчана кислота, яка має найкращу абсорбційної здатністю.
Абсорбцію ведуть концентрованої сірчаної кислотою, так як, якщо поглинутої-щення проводити водою, сірчистий ангідрид буде взаємодіяти з пара-ми води з утворенням сірчанокислого туману, який дуже важко вловити. 

Абсорбція сірчистого ангідриду супроводжується виділенням великої кількості тепла, в результаті чого кислота розігрівається і абсорбція замед-ляется, тому для поліпшення абсорбції газ і кислоту охолоджують в тепло-обміннику. Кількість орошающей кислоти в багато разів більше, ніж потрібно для поглинання сірчистого ангідриду, і ця кількість визначається тепло-вим балансом.
Метод подвійного контактування
Ступінь перетворення SO 2 в SO 3 в контактному апараті становить 90%. Оста-точний зміст SO 2 в газах становить до 1,5%, що значною але вище ГДК. Тому гази з абсорбера подають знову в контакт-ний апарат. В результаті збільшується співвідношення O 2 до SO 2 і ступінь перетворення становить вже 95-97%, а вміст SO 2 в газах становить близько 0,003%.
Утилізація твердих відходів сірчанокислотного виробництва
Твердими відходами виробництва сірчаної кислоти є:
1. Піритні недогарки;
2. Пил циклонів і сухих електрофільтрів;
3. Шлами промивних веж і мокрих електрофільтрів.
Переробка піритових огірків
В результаті випалення 1 т піриту утворюється 0,55 т піритових огарків, ко-торий містить 40- 63% заліза, 1-2% сірки, 0,33-0,47% міді; 0,42-1,35% цин-ка, а також дорогоцінні метали в кількості 10-20 г / т. Витяг кольорових металів з недогарка
хлорує випалвикористовується в тому випадку, якщо вміст міді перевищує 0,5%. Використання цього методу дозволяє отримати 85-90% міді, значну частку благородних металів, а також забезпечує практично повне знесірчення недогарка. Вартість одержуваної міді покриває витрати на переробку недогарка.
Перед випалюванням до Огарков домішують до 20% розмеленого хлориду на-трия. У процесі випалу утворюється хлорид міді. Оптимальна температура випалу становить 550-600 0 С. При температурі менше 530 0 С в шихті образу-ється водорозчинний сульфат заліза, який заважає подальшому вище-лачіванію міді. При температурі понад 600 0 С різко падає вихід основних продуктів.
Умови оптимального протікання процесу:
Перемішування шихти;
Достатній вміст сірки в огарки. Сірка необхідна для перекладу хлориду натрію в сульфат натрію. Якщо сірки мало, то додають колчедан.
Для того, щоб процес почався і йшов автотермічно, досить суміш підігріти до температури 200-300 0 С.
хімізм процесу
Процес і дет в 3 стадії:
На першій стадії відбувається окислення сульфідів і освіту хло-ріда заліза (Ш):
2MeS + 3O 2 → 2MeO + 2 SO 2
MeO + SO 2 + 0,5O 2 → MeSO 4
SO 2 + 0,5 O 2 → SO 3
Fe2 (SO 4) 3 + 6 NaCl → 3Na 2 SO 4 + 2FeCl 3
На другій стадії відбувається взаємодія газової фази з шихтою з утворенням газоподібних хлорують агентів:
2NaCl + SO 2 + O 2 → Na 2 SO 4 + Cl 2
4NaCl + 2 SO 3 + O 2 → 2Na 2 SO 4 + 2Cl 2
2NaCl + SO 3 + H 2 O → Na 2 SO 4 + 2HCl
4FeCl 3 + 3O 2 → 2Fe 2 O 3 + 6Cl 2
2FeCl 3 + 3H 2 O → Fe 2 O 3 + 6HCl
На третій стадії хлорують агенти взаємодіють з оксидами і сульфідами металів:
MeS + Cl 2 + 1,5O 2 → MeCl 2 + SO 3
MeS + Cl 2 + O 2 → MeCl 2 + SO 2
MeS + 2HCl + 1,5O 2 → MeCl 2 + SO 2 + H 2 O
MeO + 2HCl → MeCl 2 + H 2 O
2Me + 3Cl 2 → 2MeCl 3
В результаті випалення 85-90% міді перетворюється в хлорид міді, який добре розчиняється в воді. Тому з обпаленої маси мідь вищелачі-ють теплою водою в кілька стадій: спочатку розчином від попередніх операцій, а потім розведеною кислотою.
Отриману витяжку обробляють залізним скрапом. При цьому йде процес цементації:
CuCl 2 + Fe → Cu + FeCl 2
Процес ведуть без доступу кисню, так як в присутності кисню відбувається утворення нерозчинного гідроксиду заліза (III), який за-забруднюючих мідь.
Відпрацьований розчин містить до 100 г / л сульфату натрію. Його випало-ють або виморожують для отримання десятіводного сульфату натрію. Вилужений недогарок просушують в механічних печах до вологості 8-10%, а потім направляють на агломерацію і в доменне виробництво. 1т огар-ка дає до 20 кг міді і близько 900кг агломерату.
метод хлорідовозгонкі. При використанні цього методу недогарок обра-бативают хлористим воднем в апаратах киплячого шару. При цьому в газо-ву фазу у вільному стані виділяються хлориди важких металів.
Хлористий водень може подаватися в газоподібному вигляді, у вигляді рас-твора соляної кислоти або у вигляді солей, які легко розкладаються або гід-Роліз з утворенням хлористого водню.
У цій технології використовують до трьох послідовних апаратів ки-пящего шару: в першому апараті при температурі 600-800 0 С розкладаються всі сульфіди. У другому реакторі недогарок вступає у взаємодію з хлором-простим воднем. У третьому реакторі створюють відновну середу, бла-цію чому Fe 2 O 3 переходить в Fe 3 O 4. При подальшому магнітному збагачені-ванні недогарка вміст заліза досягає 70%. Огарок направляють в доменне виробництво.
Гази, що виходять з другого реактора містять хлориди кольорових метал-лов і надлишок хлористого водню. Їх направляють в абсорбер, де утворюється концентрований розчин, з якого метали витягають різними способами. Використовуваний хлористий водень практично повністю реге-неріруется.
Використання огірків в доменному виробництві.
Якщо не проводиться витяг кольорових металів, то піритні недогарок може бути відразу використаний в доменному виробництві. Однак цього заважав-ет підвищений вміст сірки (до 3,5%) і висока ступінь подрібнення.
Для зменшення вмісту сірки і укрупнення частинок недогарка зазвичай ис-товують агломерацію.
Виробництво пігментів з огірків і Огаркова пилу.
Отримання залізного сурику . Для отримання залізного сурику использу-ється кілька методів.
При використанні першого методудля отримання залізного сурику недогарок при нагріванні обробляють сірчаної кислотою, в результаті цього об-разуется сульфат заліза, потім отриману суспензію змішують з алебаст-ром, крейдою, глиною і обпалюють в печах. Залежно від температури обжи-га і добавок, що вводяться отримують пігменти різних відтінків.
Недоліком даної технології є те, що в залізному сурику при-сутствует сірка та її сполуки, що робить сурик корозійно-активним. Та-кою сурик не можна використовувати для фарбування металевих поверхонь.

При використанні другого методу,технологічна схема якого представлена \u200b\u200bна рис.2, для отримання залізного сурику беруть фракцію недогарка
0,5-2 мм, найбільш багату оксидами заліза. Цю фракцію подають в кульову млин (2). Подрібнений недогарок промивають водою в промивної чані (3). При цьому видаляються водорозчинні солі заліза, цинку і міді, які призводять до корозії і частково видаляються сполуки сірки. промивання проводять гарячою водою (60-80 0 С) при перемішуванні, яке чергують з від-танення до зникнення забарвлення, спричиненої розчинними солями.
Відмитий недогарок підсушують глухим паром в сушарці (4) і подають на випал при температурі 850-900 0 С у обертову піч (5). Мета випалу - видалення вологи і сірки. Отриманий після випалу напівфабрикат, який со-тримає до 90% Fe 2 O 3, розмелюють в кульової млині (6) і змішують з наповнювачем в змішувачі (7). В результаті отримують залізний сурик, кото-рий можна використовувати для фарбування будь-яких поверхонь.
Отримання жовтої охри і мумії з Огаркова пилу. . Огаркова пил, осідає в циклонах і електрофільтрах, містить більше водорастворі-мих солей. Її використовують для отримання пігментів типу жовтої охри і музичних па-ми Академії.
Технологічна схема представлена \u200b\u200bна рис.3. Для отримання пігментів Огаркова пил подають в реактор-розчинник (1), де її перемішують з водою протягом 20-25 хв. Для перемішування використовують стиснене повітря. Потім розчин відстоюють 8 годин. Забарвлену рідку фазу відкачують в змішувач (2), куди додають крейду і глину. При цьому йде реакція
Fe 2 (SO 4) 3 + 3CaCO 3 → Fe 2 O 3 + 3CaSO 4 + 3CO 2
В результаті отримують насичений вологою осад. Його висушують в сушарці (5) при 80 0 С і подають у кульовий млин (4), з якої виходить готовий продукт - сухий мінеральний пігмент типу жовта охра.

Вологий осад з реактора-розчинника (1), що містить 91% Fe 2 O 3; 3,7% FeS; 5,3% домішок, сушать при температурі 100 0 С в сушарці (3) і потім передають в піч (6), де при температурі 800-900 0 С випалюється сірка. Полу-продукт, що містить до 95% Fe 2 O 3, направляється на подрібнення в кульовий млин (7). Туди ж одночасно подають глину. З млина вивантажують готовий продукт - мінеральний пігмент типу мумії.
Отримувані мінеральні пігменти є стабільними за кольором і незмінними в часі. Масляна фарба на їх основі не згортається, а вапняна добре схоплюється.
Отримання селену з шламів промивних веж і мокрих
електрофільтрів.
У піриті міститься 0,002-0,02% Se, який є хімічним ана-балкою сірки. Тому при випалюванні піриту крім SO 2 утворюється SeO 2. Так як селен зустрічається в природі в дуже малих кількостях і концентраціях, шлами сірчанокислотного виробництва є основною сировиною для його по-лучения. Основна частина селену виділяється зі шлаками в промивних баштах і мокрих електрофільтрах системи очищення обжигового газу.
Механізм виділення селену з випалювальних газів досить складний: при очищенні обжигового газу SeO 2 поглинається туманом і краплями орошающей сірчаної кислоти. Розчинність SeO 2 в сірчаної кислоті велика.
Розчиняється в сірчаної кислоти SO 2 відновлює SeO 2:
SeO 2 + 2SO 2 + 2Н 2 О → Se + 2Н 2 SO 4
Одночасно йдуть процеси утворення політіоселенових кислот і селенистой кислоти:
SeO 2 + 3SO 2 + 2Н 2 О → Н 2 SеS 2 O 6 + Н 2 SO 4
SeO 2 + Н 2 О → Н 2 SeO 3
Політіоселеновие кислоти і селениста кислота стійкі при температурі не більше 70 0 С. При більш високій температурі вони розкладаються:
Н 2 SeO 3 + 2SO 2 + Н 2 О → Sе + 2Н 2 SO 4
Н 2 SеS 2 O 6 → Sе + Н 2 SO 4 + SO 2
Утворений металевий селен осідає разом з частинками пи-ли з кислоти промивних веж у вигляді шламу. Такий шлам містить до 5% селену і називається бідним. Також селен осідає в мокрих електрофільтрах. Через низький вміст пилу вміст селену тут досягає 50%. Такий шлам називають багатим.
Бідний шлам розбавляють водою і прогрівають гострою парою для більш повного виділення селену. Утворену пульпу фільтрують і отриманий осад промивають водою і 0,5% розчином соди. Потім шлам сушать при тим-пературі 90-100 0 С. Також обробляють і багатий шлам. Потім обидва шламу змішують (вміст селену при цьому становить 10-12%) і подають на про-жиг для вилучення селену. З 1 т піриту отримують 10-50 г селену.
Очищення відведених газів сірчанокислого виробництва
Отримання сірчаної кислоти супроводжується утворенням аерозолів і тума-нів. Їх вловлюють в туманопоглотітелях в два ступені:
На першому місці використовують поглиначі з грубими волокнами, що забезпе-печує ефективність очищення 90-92%
На другому ступені використовують поглиначі з тонкими волокнами, що забезпе-чує ефективність очищення 99,8%
Газові викиди SO 2 у виробництві становлять до 50 тис.т. / рік.
Очищення відведених газів проводиться абсорбцією лужними розчинами. Як абсорбентів використовують розчини аміак, соди, вапняне моло-ко.
синтез аміаку
Азот бере участь в основних біохімічних процесах, входить до складу білків. Сполуки азоту використовуються у виробництві мінеральних добрива-ний, барвників, пластмас, хімічних волокон, медикаментів, вибухових речовин. І всюди використовується не вільний азот, а сполуки азоту. Джерел пов'язаного азоту в природі, що мають промислове значення вкрай мало. Найбільш велике родовище селітри розташоване в Чилі. У нашій країні таких родовищ немає, що пов'язано з дуже високою розчини-мостью сполук азоту і вологим кліматом нашої країни.
У той же час величезна кількість азоту міститься в атмосферному повітрі. Тому почали шукати способи перекладу атмосферного азоту в його со-єднання.
Синтез сполук азоту з молекулярного атмосферного азоту був здійснений на початку ХХ ст. трьома методами:
дугового метод полягає в тому, що при температурі електричної дуги
(2000 0 С) азот взаємодіє з киснем:
N 2 + O 2 ↔ 2NO - 179,2 кДж.
Цей метод не знайшов широкого застосування через малу виходу NO і величезних витрат електроенергії на освіту електричної дуги.
Ціанамідний метод полягає в тому, що тонкоподрібненому карбід кальцію при температурі близько 1000 0 С взаємодіє з азотом по уравне-нию:
CaC 2 + N 2 ↔ СaCN 2 + C + 301кДж
Цей метод також не знайшов широкого застосування.
Амміачнийметод полягає в тому, що азот взаємодіє з воднем з утворенням аміаку за рівнянням
N 2 + 3H 2 ↔2NH 3 + Q
При використанні цього методу витрата енергії набагато менше, ніж в перших двох. Тому цей метод почав використовуватися в промислових масштабах. Перший завод з виробництва аміаку був побудований в 1913 році в Німеччині.
Отримання аміаку аміачним методом
Методи одержання азоту
Фізичне розділення повітря
Повітря містить 78,03% -N 2; 21% -O 2; 0,94% -Ar; і в незначній кіль-ве CO 2, H 2, Ne, He, Kr, Xe. Розділення повітря проводять методом ректіфіка-ції рідкого повітря. Метод заснований на відмінності в температурах кипіння га-зов, що входять до складу повітря.
Найбільш складний етап - споживання кисню в рідкий стан. Його про-водять, поєднуючи глибоке охолодження з підвищенням тиску.
Методи отримання водню
Конверсії метану або природного газу відбувається наступним чином:
CH 4 + H 2 O пари ↔ CO + 3H 2 - 206 кДж
2СH 4 + O 2 ↔ 2CO + 4H 2 + 70кДж
CO + H 2 O пари ↔ CO 2 + H 2 + 41кДж
Сумарно процес конверсії метану водяною парою протікає з поглинанням третьому енергії:
CH 4 + 2H 2 O пари ↔ CO 2 + 4H 2 - 165 кДж
Конверсію метану ведуть при підвищеному тиску зазвичай з використан-ням каталізаторів. Вміст метану після конверсії не повинно переви-щувати 0,5%. Залишковий вміст метану залежить від температури, співвідносячи-шення H 2 O: CH 4 і тиску. При температурі 800-1000 0 С досягається необ-ходимое вміст метану, однак швидкість процесу без каталізатора дуже мала. Тому конверсію метану ведуть зазвичай з використанням каталізата-рів (нікель, нанесений на оксид алюмінію). Хоча з підвищенням тиску вміст метану збільшується, процес часто ведуть при підвищеному давши-лення для збільшення швидкості реакції. При цьому використовується той тиск, з яким метан надходить на завод. Це зменшує витрату електроенергії на подальше стиснення газу при виробництві аміаку.
При конверсії окису вуглецю обсяг газу залишається постійним. Тому зміна тиску не зрушується рівноваги, але збільшує швидкість реакції. Збільшення температури зміщує рівновагу вліво, однак при низьких тим-пература швидкість реакції мала навіть в присутності каталізатора.
Зазвичай процес ведуть при t \u003d 200-300 0 С в присутності Zn-Cr-Cu каталізата-ра. Залишковий вміст CO становить 0,2-0,4%. Даний каталізатор дуже чутливий до з'єднань сірки - їх концентрація не повинна переви-щувати 2 мг / м 3.
Отримання азото-водневої суміші з коксового газу.
Коксовий газ має наступний склад:
H 2 - 53%; CH 4 - 23-28%; інші вуглеводні - 2-3%; СO-5-7%; CO 2 -1,5-2,5%;
O 2 -0,3-0,8%; N 2 \u003d 5%.
Температура кипіння азоту становить -195,7 0 С, температура кипіння водо-роду -200 0 С. Всі інші компоненти мають температуру кипіння вище -195 0 С. Тому проводять глибоке охолодження газу до температури -195 0 С. При цьому всі компоненти крім азоту і водню переходить до ліквідність перебуваючи-ня. Однак в отриманому газі залишається деяка кількість окису вуглецю, яка є сильною отрутою для каталізатора. Для видалення окису вуглецю газ промивають рідким азотом, в якому окис вуглецю добре розчинний-ється. При цьому частина азоту випаровується і досягається співвідношення азоту до по-огрядний близьке до 1: 3. Потім додаванням азоту суміш доводять точно до відповід-носіння 1: 3.
очищення газу
Каталізатор синтезу аміаку різко знижується свою активність у присутності сполук сірки і кисню. У той же час природний газ містить соеди-вати сірки, а в результаті конверсії утворюються СО2 і СО. Зміст СО2 може досягати 30%, а СО - 4%. Ретельне очищення газу від цих домішок при найменших витратах - одна з найбільш важких завдань.
Очищення газу від серусодержащих з'єднань.
Природний газ містить наступні сполуки сірки: сірководень, сероуг-лерод CS 2, оксисульфід вуглецю COS, меркаптани (головним чином етілмер-каптан C 2 H 5 -SH) загальний вміст сполук сірки становить 5-30 мг / м 3. Перед очищенням все сполуки сірки гидрируются до сірководню на кобальт-молібденовому каталізаторі при t \u003d 400-450 0 С
CS 2 + 4H 2 → CH 4 +2 H 2 S
COS + 4H 2 → CH 4 + H 2 S + H 2 O
R - SH + H 2 → RH + H 2 S
Утворений сірководень абсорбують або адсорбують. Як адсор-Бенту використовують: активоване вугілля, гідроксид заліза, окис цинку, як абсорбентів - розчин аміаку, мишьяковосодовие розчини, розчини карбонатів натрію і калію. Найчастіше використовують окис цинку:
H 2 S + ZnO → ZnS + H 2 O
Після абсорбції вміст сірки не перевищує норми.
Очищення газу від СО 2
Існує кілька способів очищення газу від СО2
Водна промивка. При використанні цього методу газ промивають водою в башті з насадкою при тиску 20-30 атм. Випливає з вежі вода обертов-ет турбіну, насаджені на одному валу з насосом, що подає воду в вежу. Таким чином, регенерують близько 60% енергії. Після турбіни тиск падає до атмосферного, розчинність газів зменшується і вони виділяються в атмосферу. При цьому виділяється газ, що містить 80% СО 2, 11% H 2 і при-домішки - сірководень і азот. Отриманий газ використовують як «сухого льоду». Вода після виділення газу знову повертається в вежу.
Недоліки цього методу: велика витрата електроенергії, великі втрати водню.
Етаноламіновая очистка здійснюється розчинами суміші моно- і діетано-Ламін: (CH 2 - CH 2 - OH) NH 2 - моноетаноламін, (CH 2 - CH 2 - OH) 2 NH - ді-етаноламін
Процес видалення CO 2 заснований на протіканні наступних реакцій:
CO 2 + 2RNH 2 + H 2 O ↔ (RNH 3) 2 CO 3
CO 2 + (RNH 3) 2 CO 3 + H 2 O ↔ 2RNH 3 НCO 3
Процес поглинання проводять при температурі 40-45 0 С. Утворилися кар-Бонато і бікарбонати розкладаються в десорбері з утворенням CO 2 при температурі 120 0 С.
Очищення гарячим розчином поташу проводиться при тиску 10-20 атм, при температурі 110-120 0 С. Зазвичай використовується 25% -ний розчин поташу, акти-вати миш'яком. При поглинанні CO 2 карбонат перетворюється в Бікар-Бонат
K 2 CO 3 + CO 2 + H 2 O ↔ 2KHCO 3
Регенерація проводиться при зменшенні тиску до атмосферного.
Очищення газу від СО
Поглинання мідно-аміачним розчином. Метод заснований на тому, що CO абсорбується мідно-аміачним розчином з утворенням комплексного со-єднання. Поглинальна здатність мідноаміачних розчинів при звичайних умовах невелика. Тому очищення проводиться при тиску 100-300 атм. і температурі
0-15 0 С. Регенерацію ведуть при температурі 77-79 0 С і атмосферному тиску. Ще більш ефективно регенерація йде під вакуумом. При регенерації по-глотітельний розчин втрачає частину аміаку, який поповнюють. Після реге-нераціі і охолодження насичення розчин знову подають на поглинання. Після очищення залишається не більше 0,003% CO.
Промивання рідким азотом.При промиванні рідким азотом СО розчиняється в азоті. Цей метод зазвичай використовується при отриманні азото-водневої сме-сі з коксового газу.
Теоретичні основи синтезу аміаку
Синтез аміаку заснований на реакції:
N 2 + 3H 2 ↔ 2NH 3 + Q
Реакція екзотермічна. Тепловий ефект реакції залежить від температури і тиску. При температурі 500 0 С, парниковий ефект реакції залежить від тем-ператури і тиску:
p \u003d 1 атм., Q \u003d 50 кДж / моль
P \u003d 100атм., Q \u003d 52 кДж / моль
P \u003d 1000атм., Q \u003d 69 кДж / моль
Для зміщення рівноваги вправо необхідно збільшувати тиск і знижувати температуру. Однак при низькій температурі дуже мала швидкість процесса.В виробничих умовах для отримання необхідної швидкості синтез аміаку ведуть при температурі 400-500 0 С з використанням твердого катали-затору. У промисловості в даний час набув поширення ж-корисної каталізатор містить оксиди алюмінію, кальцію і магнію, кото-які посилюють його дію. Цей каталізатор показав високу активність і стійкість до перегріву і шкідливих домішок. Однак сірковмісні соеди-вати отруюють каталізатор є незворотнім. При утриманні в каталізаторі 0,1% сірки його активність падає на 50%, а при вмісті 1% сірки відбувається повне отруєння каталізатора. Кисень з'єднання отруюють каталізатор сильно, але можна зупинити.
Синтез аміаку типовий гетерогенний каталітичний процес.
Основні стадії процесу:
1.Діффузія азоту і водню з ядра потоку до зерна каталізатора і всередину пір зерна
2.Актівірованная абсорбція азоту і водню на каталізаторі.
3.Взаімодействіе азоту і водню на поверхні каталізатора, при цьому азот приймає електрон від каталізатора, а водень віддає електрон каталізу-тору, в результаті чого послідовно утворюються такі поверхност-ні хімічні сполуки: имид-NH, амід- NH 2, аміак.
4. Десорбція аміаку і його дифузія в обсяг газової фази.
Лимитирующей є 2 стадія.
Фактори, що впливають на вихід аміаку
На вихід аміаку впливає: тиск, температура, активність каталізатора, об'ємна швидкість. Встановлено, що з її збільшенням збільшується з'їм аміаку з одного кубометра каталізатора. Однак при цьому збільшується обсяг прореагувала азото-водневої суміші. Це збільшує витрату енергії на транспортування газу - тому оптимальна швидкість вибираючи-ється виходячи з економічних міркувань. Зазвичай вона становить 15000 год -1.
Промислові способи синтезу аміаку.
У виробництві аміаку використовують тиск 100-1000 атм. і в залежності від тиску розрізняють системи низького тиску (100-150 атм.), середнього
(200-600 атм.) І високого (600-1000 атм.). В основному використовують системи середнього тиску, так як при цьому тиску вдало вирішуються питання ви-ділення аміаку при достатній швидкості процесу. Особливістю синтезу аміаку є його невисокий вихід - 14-20%
Азото-воднева суміш, що виходить з контактного апарату піддав-ється охолодження, аміак при цьому конденсується і виділяється, а азото-воднева суміш повертається в апарат. Свіжа азото-воднева суміш до-додавали в необхідній кількості.
При рециркуляції відбувається поступове накопичення домішок, що призводить до зменшення активності каталізатора і, як наслідок, до зменшення продуктивності. Частково домішки розчиняються в аміаку і ви-водяться з циклу. Однак висновок домішок з аміаком не компенсує при-ток домішок зі свіжої азото-водневої сумішшю. Тому періодично частина азото-водневої суміші доводиться скидати в атмосферу.
Пристрій колони синтезу
Конструкція колони повинна бути надійною і забезпечувати безпека-ву і тривалу роботу.
Азот і водень при підвищеній температурі знижують міцність стали, особливо небезпечно обезуглероживание стали під дією водню. Для зменшення температури стінок холодна азото-воднева суміш надходить в колону уздовж внутрішніх стінок. Корпус виготовлений з хром-ванадієвої сталі, товщина стінки складає 175-200мм. Внутрішній діаметр 1-2,8м, висота 12-20м. Зверху і знизу колона закривається сталевими кришками, укре-полоненими за допомогою фланців. Зовні колона має теплоізоляцію.
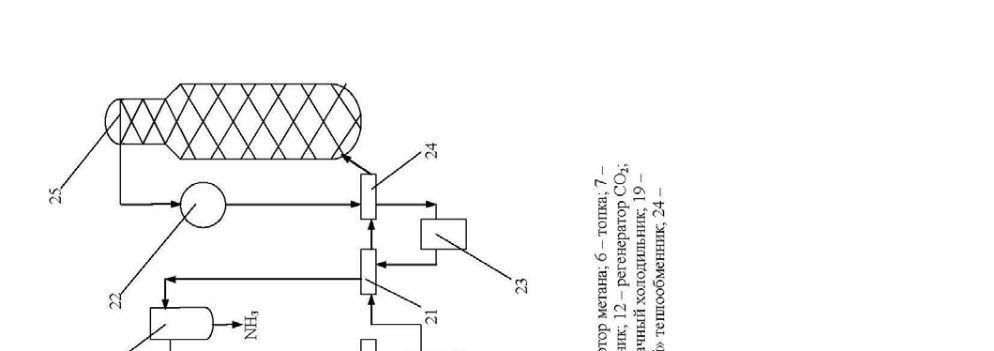
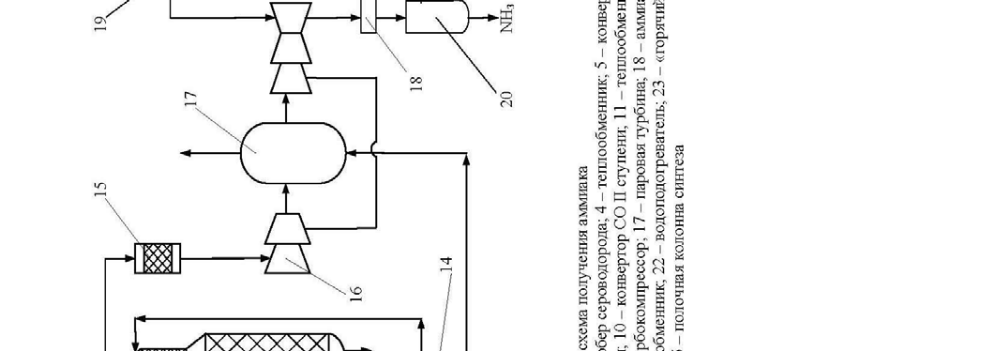
Технологічна схема отримання аміаку
Технологічна схема отримання аміаку представлена \u200b\u200bна рис.4. При-родний газ підігрівається в підігрівач 1 газами і надходить в реактор гідрування серусодержащих з'єднань, туди ж подається водо-род. Після гідрування газ надходить в адсорбер 3, заповнений окисом цинку. На виході з адсорбера газ змішується з парою в співвідношенні 3,7: 1, підігрівається в теплообміннику 4 газами і надходить в трубчас-ту піч 5 з топкою 6. У топці 6 спалюється природний газ. Процес конверсії протікає на нікелевому каталізаторі при температурі 800-850 0 С. Вміст метану після першої стадії конверсії становить 9-10%. Далі газ змішуючи-ється з повітрям і надходить в шахтний конвертер 7, де відбувається конверсія залишкового метану киснем повітря при температурі 900-1000 0 С. З шахтного конвертера газ надходить в котел-утилізатор 8, де отримують пар високих параметрів (температура 480 0 С , тиск - 100 атм.), що направляється в газові турбіни відцентрових компресорів 17. А газ з котла-утилізатора надходить на двоступеневу конверсію CO:
1стадія йде в конверторі 9 на среднетемпературном залізо-хромовому ката-лизатор при температурі 430-470 0 С.
2 стадія відбувається в конвертері 10 на низькотемпературному цинко-хромово-мідному каталізаторі при температурі 200-250 0 С. Між стадіями газ прохо-дить котел-утилізатор 8.
Потім газ надходить через теплообмінник 11 на очистку від кіслородсо-які тримають з'єднань в скрубер 13, зрошуваний холодним розчином моно-етаноламіну, де при температурі 30-40 0 С відбувається очищення газу від СО, СО 2, і О2. На виході з абсорбера газ містить CO до 0,3%, CO 2 ≤ 0,003%. Газ надходить на гідрування кисневмісних домішок в метанатор 15. Далі газ надходить в відцентровий циркуляційний компресор 16 з приводом від парової турбіни 17, де він стискається до тиску 300 атм.
Свіжа азото-воднева суміш потім змішується з циркулюючої сумішшю перед системою вторинної конденсації, яка складається з аміачна-ного холодильника 18, сепаратора 20, потім вся ця суміш проходить теплооб-меннікі 21 і 23 і направляється в колону синтезу 25.
Прореагував газ проходить послідовно водопідігрівач 22, теплообмінник 23, повітряний холодильник 24, теплообмінник 21, надходить в сепаратор рідкого аміаку 19, потім надходить в компресор 16, де сміши-ється зі свіжої азото-водневої сумішшю.
Сконденсувалася аміак виводиться з сепараторів 19 і 20.
Виробництво азотної кислоти
Азотна кислота - це одна з найважливіших мінеральних кислот, пред-ставлять собою важку безбарвну рідину. З водою вона змішується в будь-яких співвідношеннях з виділенням тепла. Є сильним окислювачем. Вона взаємодіє з усіма металами крім металів платинової групи. При взаємодії з азотною кислотою органічні тканини руйнуються. Виробляється і використовується розбавлена \u200b\u200bHNO 3 - 50-60% і концентрований-ва - 96-98%.
Теоретичні основи виробництва азотної кислоти
Процес отримання азотної кислоти з аміаку складається з сле-дмуть стадій:
1. Контактна окислення аміаку до NO
П. Окислення NO до NO 2
Ш. Абсорбція NO 2 водою


Серед мінеральних кислот, вироблених хімічною промисловістю, сірчана кислота за обсягом виробництва і споживання займає перше місце. Пояснюється це двома причинами: її дешевизною в порівнянні з усіма іншими кислотами, і її свойст-вами. Сірчана кислота не димить, в концентрованому вигляді не руйнує чорні метали, в той же час є однією з сильних кислот, в широкому діапазоні температур
(- 40 ... - 20 260 - 336,5С) знаходиться в рідкому стані.
Безвода сірчана кислота (моногідрат) являє собою важку маслянисту рідину, яка змішується з водою з виділенням великої кількості теплоти. Щільність H2SO4 при 0С дорівнює 1,85 г / см3, а температура кристалізації 10,7С.
Найбільшими споживачами сірчаної кислоти є виробництва мінеральні-них добрив: суперфосфату, сульфату амонію.
Багато кислоти (фосфорна, оцтова, соляна, концентрована азотна та ін.) І солі виробляються в значній частині за допомогою сірчаної кислоти.
Сірчана кислота широко застосовується у виробництві кольорових і рідкісних металів, а також в металообробній промисловості. Отримання ряду барвників (для тка-ній), лаків та фарб (для будівель і машин) лікарських речовин і деяких пластмас також пов'язано із застосуванням сірчаної кислоти. За допомогою сірчаної кислоти виробляють етиловий та інші спирти, деякі ефіри, ПАР, ряд отрутохімікатів для боротьби з ча-дителями сільського господарства і бур'янами травами.
Розбавлені розчини сірчаної кислоти і її солей застосовують в текстильній, а також в інших галузях легкої промисловості. У харчовій промисловості сірчана кислота застосовується для отримання крохмалю, патоки і ряду інших продуктів. В електрон-тротехніке вона використовується в якості електроліту в акумуляторах. Сірчану кислоту використовують для осушення газів і при концентрації кислот. Нарешті, сірчану кислоту при-міняють як компонент реакційного середовища в процесах нітрування, зокрема, при по-одержанні вибухових речовин.
При нитровании, у виробництві етилового спирту з етилену, при концентрірова-ванні азотної кислоти і в інших процесах застосовують сірчану кислоту концентрацією від 92 до 98%, а виводять з процесу розбавлену 50 - 80% -ву кислоту. Щоб повернути її в новий цикл, отримані водні розчини упаривают.
Сировинна база виробництва сірчаної кислоти - сірковмісні сполуки, з ко-торих можна отримати діоксид сірки. У промисловості близько 80% сірчаної кислоти по-лучают з природної сірки і залізного (сірчаного) колчедана. Значне місце в сировину-вом балансі займають гази кольорової металургії. Деякі виробництва використовують в якості сировини сірководень, що утворюється при очищенні сірки в нафтопере-розробці. Перший випал серосодержащего сировини для отримання діоксиду сірки.
Виробництво сірчаної кислоти включає в себе наступну послідовність стадій:
Випал сірчаного колчедану або сірки.
Окислювання діоксиду сірки.
Абсорбція триоксид сірки.
Вихідні речовини - мінеральна сировина - містить домішки, тому що виходять зі стадії випалу гази піддаються очищенню. Перша стадія - випал, специфічний для ка-ждого виду сировини, і далі вона буде розглядатися для колчедана і сірки як найбільш поширених вихідних речовин. Стадії окислення і абсорбції в основному одина-підступи в різних способах отримання сірчаної кислоти. Тому ці стадії будуть рассмотре-ни як типові процеси.
Випал серосодержащего сировини.
Випал колчедану (піриту) є складним фізико-хімічним процесом і включає в себе ряд послідовно або паралельно протікають реакцій:
термічна дисоціація
Газофазне горіння сірки
горіння пирротина
Або сумарно:
При невеликому надлишку або нестачі кисню утворюється змішаний оксид заліза
Температура. Термічний розклад піриту починається вже при температурах близько 200С і одночасно запалюється сірка. При температурах вище 680С интен-пасивного протікають все три реакції.
У промисловості випал ведуть при 850 - 900С, коли загальна швидкість процесу лімітується массопереносом окислювача (кисню) до поверхні піриту і продуктів розкладання в газову фазу. У загальному вигляді рушійна сила цього процесу може бути ви-ражена рівнянням
(1)
З цього рівняння видно, що факторами збільшення продуктивності процесу яв-ляють інтенсифікація масопереносу (), збільшення поверхні контакту фаз (F) і концентрації реагентів. Коефіцієнт масопереносу може бути збільшений підвищенням температури, поверхня контакту фаз істотно зростає зі збільшенням ступеня дисперсності твердого матеріалу, а високі концентрації реагентів забезпечуються ис-користуванням збагаченого піриту і збільшенням вмісту кисню в окислювачі. Слід, однак, мати на увазі, що надмірне підвищення температури сприяє раз-м'якшення і злипання частинок твердого сировини, а застосування концентрованих реаг-тов здорожує їх вартість і призводить до надмірного росту температури в умовах ав-тотерміческого режиму. Це обумовлює вибір оптимальної температури, поєдную-щей достатню продуктивність процесу і використання сировини з відповідним-щим вмістом активних компонентів при мінімумі процесів агломерації твердого матеріалу. На практиці процес проводять при температурі 850 - 900С.
Тиск. Відповідно до рівняння (1) тиск є фактором швидкості процесу, проте його зростання може привести в умовах автотермічний режиму до над-мірного збільшення температури і злипання частинок твердого матеріалу. Крім того, збільшення тиску призводить до збільшення витрат на компримування. Оскільки реакція випалу в умовах зазначених температур протікає досить гладко, то перед-шанують працювати при атмосферному тиску.
Співвідношення повітря-колчедан підтримується на рівні, що забезпечує надлишок кисню в порівнянні з його стехиометрическим кількістю, з метою досягнення високих ступенів випалу, однак цей надлишок не повинен бути надмірним, тому що при зна-чанням значних надлишках зростання ступеня вилучення сірки з колчедану перекривається значи-них розведенням газів випалу і зниженням концентрації SO2 в них, що негативні-кові впливає на подальший процес окислення SO2 в SO3.
Раніше домінуючим типом реактора був багатополичний реактор, забезпечений скребками для вирівнювання шару на кожній полиці і організації транспорту твердої фази з верхніх полиць на нижні (див. Типи реакторів для гетерогенних реакцій за участю твердої фази).
У такому реакторі ступінь дисперсності колчедана невелика, що істотно ог-ранічівает продуктивність реактора. Крім того, в такому реакторі рухомі скребки в високотемпературної зоні ускладнюють його конструкцію, створюється неоднорідний-ний температурний режим по полицях, в ньому важко організувати відведення тепла із зони ре-акції. Труднощі теплос'ема не дозволяють отримати випалювальних газ з концентрацією SO2 більше 8 - 9%. Основне обмеження - неможливість використання дрібних частинок, в той час як для гетерогенного процесу основний спосіб прискорення реакції - дроблення частинок. З цієї причини більш перспективними є апарати до «киплячому шаром» твердих частинок. Їх ступінь дисперсності дозволяє на порядок прискорити процес.
Пилоподібний колчедан подається через живильник в реактор. Окислювач (повітря) по-дається знизу через розподільну решітку зі швидкістю, достатньою для зважуючи-ня твердих частинок. Їх витання в шарі запобігає злипання і сприяє гарному контакту з газом, вирівнює температурний режим по всьому шару, забезпечує під-рухливість твердого матеріалу і його перетікання в вихідний патрубок для виведення недогарка з реактора. В шарі рухомих частинок можна розташувати теплообмінні елементи. Бла-цію збільшення глибини випалу зміст SO2 в випалювальному газі збільшується до 13 - 15%. Основний недолік печей киплячого шару - підвищена запиленість обжи-кового газу через механічну ерозії рухомих твердих частинок. Це вимагає більш ретельного очищення газу від пилу в циклоні і електрофільтрі.
Спалювання сірки.
Сірка - легкоплавкое речовина: температура її плавлення 113С. Перед спалюванням її розплавляють, використовуючи пар, отриманий при утилізації тепла її спалювання. Розплав-ленна сірка відстоюється і фільтрується для видалення наявних у природному сере при-домішок і насосом подається в піч спалювання. Сірка горить в основному в Парофазная перебуваючи-ванні. Щоб забезпечити її швидке випаровування, необхідно її диспергировать в потоці повітря. Для цього використовують форсункові і циклонні печі. Перші обладнані го--різонтального форсунками для тонкого розпилення рідини. У циклонічної печі рідка сірка і повітря подаються тангенціально і за рахунок вихрового руху досягається диспер-гірованіе рідини і перемішування двох потоків. Дрібні краплі швидко випаровуються і сірка в пароподібному стані згорає. Горіння протікає адіабатично, і температура залежить від концентрації утворюється SO2.
За рахунок високої теплоти згорання сірки температура в печі становить понад 1000С. Цих умов досить для випаровування рідкої сірки. Піч спалювання працює в комплексі з допоміжним обладнанням для плавлення і фільтрування сірки і кіт-лом-утилізатором для використання тепла реакції.
Гази випалу колчедану містять у вигляді домішок сполуки фосфору, селену, телуру, миш'яку і деякі інші, які утворюються з домішок сировини. Природна волога сировини також переходить в газ. При горінні утворюються кілька SO3 і можливо оксиди азоту. Ці домішки призводять або до корозії апаратури або до отруєний-нию каталізатора, а також погіршують якість сірчаної кислоти. Їх видаляють в промивної відділенні. Згідно зі схемою газ послідовно проходить дві промивні башти, оро-Шаєм розчинами сірчаної кислоти (60 і 20% -ої). У першій вежі випалювальних газ охла-ждается з 300 - 500С до 60 - 70С і звільняється від залишків пилу і частини домішок. Ця вежа порожня. Обеспиленним газ відмивається 15 - 20% -ої сірчаної кислотою від соеди-нений As, Fe, Se в другій вежі з насадкою. Остаточна осушення від вологи осуществля-ється в 3 - 9 вежах (сушильної), зрошуваних концентрованої сірчаної кислотою.
Окислювання діоксиду сірки.
реакція
Є оборотною і екзотермічної і протікає зі зменшенням обсягу. Вона здійснювала-вляется на каталізаторах, основою яких є V2O5 з додаванням оксидів щелоч-них металів, нанесених на оксид кремнію.
Обгрунтування ролі параметрів і їх вибір.
Температура проходить максимум продуктивності, характерний для зверни-мих екзотермічніреакцій. Слід мати на увазі, що надмірне збільшення темпе-ратури може привести до диффузионному гальмування процесу і це може вплинути на становище екстремуму продуктивності і його величину.
Значною мірою вибір температури визначається верхнім і нижнім пре-справою цього параметра. при Т<400 0C активность катализаторов весьма мала, а выше 600 0С происходит их термическая дезактивация. Оптимальными являются температуры, ле-жащие внутри этих пределов.
Тиск є фактором швидкості процесу і фактором зміщення рівноваги, однак на практиці виходячи з міркувань економії енерговитрат, а також завдяки можливості досягти високої робите і ступеня перетворення за рахунок використання інших чинників воліють працювати при тисках, близьких до атмосферного. Неко-лось надлишковий тиск необхідно для подолання гідравлічних опорів установки при організації транспортних потоків реагентів.
Співвідношення O2: SO2. є фактором зміщення рівноваги, а також фактором швидкості процесу відповідно до рівнянням Борескова
(2)
Однак зверху це співвідношення обмежується уповільненням зростання швидкості при високих і значним зниженням вмісту SO2 в контактних газах, поступаю-щих на абсорбцію, що знижує ефективність останньої. На практиці використовують через биток О2 більш ніж півтора по відношенню до стехіометричної.
Час контакту вибирається, виходячи з максимально досяжною конверсії. Пре-справою такої конверсії є максимальний ступінь перетворення, при якій ско-кість процесу близька до нуля. Тому за час реакції вибирається то мінімальний час, при якому ступінь конверсії практично близька рівноважної. Зазвичай ця ве-личина дорівнює 90-95%, а відповідне їй час - кілька секунд.
Технологія контактного окислення SO2.
Найчастіше в промисловості використовують поличні апарати зі зніманням тепла реакції між полицями. Схема теплообмінника передбачає максимальне використан-ня тепла реакції для підігріву вихідного газу. При цьому з'їм тепла між полицями здійснюють в тій мірі, яка дозволяє наближати робочу температуру до опти-мального значення цього параметра.
Одна з найважливіших задач виробництва сірчаної кислоти полягає в збільшенні сте-пені перетворення діоксиду сірки і зниження його викидів в атмосферу. Це завдання мо-же бути вирішена декількома методами.
Один з найбільш раціональних методів вирішення цього завдання - метод подвійного контактування і подвійний абсорбції (ДКДА). Його суть полягає в тому, що реакці-онную суміш, в якій ступінь перетворення SO2 становить 90 - 95%, охолоджують і на-правляться в проміжний абсорбер для виділення SO3; в останньому реакційному газі співвідношення O2: SO2 істотно підвищується, що призводить до зміщення рівноваги реакції вправо. Знову нагріте реакційний газ знову подають в контактний апарат, де на досягається 95% ступінь перетворення залишився SO2. Сумарна ступінь пре-обертання SO2 в такому процесі досягає 99,5 - 99,8%.
Абсорбція триоксид сірки.
Абсорбція триоксид сірки - остання стадія процесу на якій утворюється сірчана кислота. Взаємодія SO3 з водою
Протікає досить інтенсивно як у рідкій, так і в газовій фазі. Крім того H2SO4 може розчиняти в собі SO3, утворюючи олеум. Цей продукт зручний для транспортування, оскільки він не викликає корозії навіть звичайних сталей. У той же час розчини сірчаної кислоти надзвичайно агресивні.
Рівновага «газ-рідина» для «H2O-H2SO4-SO3» представлено на малюнку 1. Осо-бенностью цієї системи є те, що в широкому інтервалі концентрацій розчину сірчаної кислоти в паровій фазі присутні чисті пари води, а над олеум - в газовій фазі переважає SO3. Однаковий склад рідкої і парової фаз (азеотропная точка) буде при концентрації сірчаної кислоти 98,3%. Якщо SO3 поглинати розчином з меншою концентрацією, то реакція (3) буде протікати і в паровій фазі - буде утворюватися туман сірчаної кислоти, який піде з абсорбера з газовою фазою. А це - і втрати продукту, і корозія апаратури, і викиди в атмосферу. Якщо SO3 абсор-біровать олеумом, то поглинання буде неповним.
З цих двох властивостей слід двостадійна схема абсорбції (малюнок 2). Газ, со-тримає SO3 після реактора проходить послідовно ОЛЕУМ (1) і моногідрат (2) абсорбери. Інший компонент реакції (H2O) подається протитечією через збірник в моногідрат абсорбер. За рахунок інтенсивної циркуляції рідини (абсорбатамі) в ній можна підтримувати близьку до оптимальної концентрацію H2SO4 - 98,3% (збільшення концентрації за прохід рідини не більше 1 - 1,5%). Концентраційні умови аб-сорбції забезпечую повне поглинання SO3 і мінімальне утворення сірчанокислого туману. Кислота з моногідрат абсорбера надходить в олеумний. У ньому циркулює 20% розчин Н2SO4, який частково відбирається як кінцевий продукт - олеум. Кі-слота з попереднього абсорбера - моногідрат - також може бути продуктом. В системі циркуляції передбачені холодильники для знімання тепла реакції і забезпечення більш ефективної абсорбції. При температурах менше 100С SO3 поглинається практично повністю, діоксид сірки - практично не поглинається.
Перспективи розвитку сірчанокислотних виробництв.
Потужним засобом підвищення продуктивності сірчанокислотних виробництв є збільшення концентрації діоксиду сірки. Висококонцентровані гази, з-тримають до 80% SO2 вже почали отримувати в виробництвах кольорових металів з їх сульфідних руд із застосуванням технічного кисню.
Отримання висококонцентрованого сірчистого газу дозволяє створити енерго-технологічні циклічні виробництва сірчаної кислоти з сірки і колчедана. Діоко-сид сірки отриманий із застосуванням технічного кисню окислюють на 90% в кон-тактном апараті з «киплячому шаром» каталізатора. При абсорбції SO3 отримують висо-коконцентрірованний олеум і моногідрат. Газ після абсорбції повертають на контак-тирование. У реакторі загальна ступінь перетворення становить 99,995%. Для відводу нака-плівающегося в результаті багаторазового рецикла азоту частина газу після абсорбції про-пускають через малогабаритну сіркокислу установку, з якої азот викидає-ся в атмосферу. Інтенсивність роботи циклічної системи, що працює під тиском близько 1 МПа, із застосуванням кисню в десятки разів перевищує інтенсивність звичайних систем. Втрати сірки та відходять газами і відповідно викиди SO2 і SO3 в окру-колишнього середовища також знижені в десятки разів.
Схеми передбачають генерування водяної пари (4 МПа) за рахунок тепла газів випалу, який може бути використаний як в самій установці для компенсації витрат енергії на роботу компресорів і насосів, так і в інших цехах заводу. Тепло сірчистих газів після проходження чергового каталітичного шару можна використовувати для пред-ньо підігріву реагентів на вході в контактний апарат. Тепло сорбції викорис-зуется для побутових потреб.
Найважливішими напрямками розвитку виробництва сірчаної кислоти є:
1. Збільшення потужності апаратури при одночасній комплексної авто-мотузці виробництва.
2. Інтенсифікація процесів шляхом застосування реакторів «киплячого шару» (як на стадії випалу, так і при контактному окисленні SO2), більш актив-них каталізаторів, підвищених тисків і використання технічного кисню в процесі окислення.
3. Розробка енерготехнологічних схем з максимальним використанням теплоти екзотермічніреакцій, в тому числі циклічних систем під тиском.
4. Збільшення ступенів перетворення на всіх стадіях виробництва для сни-вання видаткових коефіцієнтів по сировині і матеріалам і зниження шкоди-них викидів.
5. Утилізація шкідливих викидів з газів, що відходять, а також твердих відх-дов (недогарок). Наприклад, небажані шкідливі домішки H2S і SO2 з раз-них потоків можна об'єднати і піддати концентрування з метою переведення їх в елементарну сірку.
Твердий залишок, що містить оксид заліза можна використовувати в якості сорбенту для уловлювання газів і очищення стічних вод.
