З курсу фізики Ви пам'ятаєте, що електричний опір будь-якого провідника може бути розраховане за формулою:
де R - опір в Ом;
l - довжина провідника, см;
S - площа поперечного перерізу, см2;
r - питомий опір, тобто опір провідника довжиною 1 см з площею поперечного перерізу 1 см 2.
В електрохімії прийнято користуватися величинами, зворотними зазначеним:
Величина L називається електричну провідність і вимірюється в Сіменса (См) См \u003d Ом -1.
Величина À називається питомою електричну провідність. Неважко вивести, що величина À вимірюється в Див × см -1. На рис.3.1. представлена \u200b\u200bкондуктометрична осередок, що застосовується для вимірювання електричної провідності. Вона являє собою посудину 1, без дна, в який вставлені два платинових електрода 2, що поміщаються в досліджуваний розчин 3.
Величину К визначають експериментально. Для цього необхідно виміряти електричну провідність L розчину, для якого À відома. Зазвичай для цього використовують розчини хлориду калію відомої концентрації (0,1; 0,05; 0,01 моль / дм 3), величини À яких є в таблицях.
З рівняння (3.5.) Випливає, що
питома провідність - це електрична провідність розчину, поміщеного між двома електродами площею 1 см 2, що знаходяться на відстані 1 см.
| À HCl KOH HF CH 3 COOH З Ріс.3.2.Завісімость питомої прово-хідності від концентрації | Питома електрична провідність розчину залежить від природи розчинника і розчиненої речовини, кон-центрації розчину і темпера-тури. На рис.3.2. наведені графіки залежності À від концентрації водних розчинів деяких електролітів при постійній температу-ре.Із малюнка, перш за все слід, що при рівних концентраціях розчинів про-провідність розчинів сильних електролітів значно вище, тому що в них міститься |
більше іонів-носіїв електрики. У розведених розчинах як сильних і слабких електролітів збільшення концентрації призводить до підвищення провідності, що пов'язано зі збільшенням кількості іонів. В області високих концентрацій спостерігається зменшення À. Для сильних електролітів це пов'язано зі збільшенням в'язкості розчинів і посиленням електростатичного взаємодії між іонами. Для слабких електролітів вказаний ефект пов'язаний із зменшенням ступеня дисоціації і, отже, зменшенням кількості іонів.
При підвищенні температури питома провідність електролітів збільшується:
À 2 \u003d À 1 [1 + a (T 2 - T 1)] (3.7.)
У цьому рівнянні À 1 і À 2 - питома провідність при температурах Т 1 і Т 2, а a - температурний коефіцієнт провідності. Наприклад, для солей a »0,02. Це означає, що підвищення температури на один градус призводить до збільшення провідності приблизно на 2%. Пов'язано це з тим, що при підвищенні температури зменшується ступінь гідратації і в'язкість розчинів.
Слід зазначити, що на відміну від електролітів, електричні-кая провідність металів при підвищенні температури зменшується.
Молярна електрична провідність
Молярна провідність l пов'язана з питомою провідністю формулою:
l \u003d À × 1000 / с (3.8.)
У цьому виразі з - молярна концентрація розчину, моль × дм -3. Молярна провідність виражена в Див × см 2 × моль -1. Отже,
молярна провідність - це провідність розчину, що містить 1 моль речовини при відстані між електродами, що дорівнює 1 см.
Молярна електрична провідність як сильних і слабких електролітів зі збільшенням концентрації знижується. Характер залежності l від с для сильних і слабких електролітів різний, тому що вплив концентрації обумовлено різними причинами.
сильні електроліти. При невеликих концентраціях залежність молярної провідності від концентрації виражається емпіричним рівнянням Кольрауша:
l \u003d l 0 -bÖс (3.9.)
де b - обумовлена \u200b\u200bдослідним шляхом постійна,
а l 0 - молярна електрична провідність при нескінченному розведенні або гранична молярна провідність.
Таким чином,
liml C ® 0 \u003d l 0 (3.10.)
Приготувати розчин, концентрація якого дорівнює нулю, неможливо. Величину l 0 для сильних електролітів можна визначити графічно. З рівняння (3.9.) Випливає, що графік залежності l \u003d f (Öc) для сильних електролітів є пряму лінію (рис.3.3., Лінія 1).
Якщо приготувати ряд розчинів різної концентрації, виміряти їх провідність L, розрахувати і побудувати графік l \u003d f (Öс), то екстраполюючи отриману пряму на вісь ординат (з \u003d 0), можна визначити l 0. Якщо врахувати, що сильні електроліти, незалежно від концентрації розчину повністю диссоційовані, то приходимо до висновку, що кількість іонів, що утворюються з 1 моль речовини, завжди одне і те ж. Значить, від концентрації розчину залежить швидкість руху іонів, зі збільшенням концентрації посилюється гальмування іонів. Це явище, пов'язане з утворенням навколо кожного іона в розчині іонної атмосфери, Що складається переважно з іонів протилежного знака. Зі збільшенням концентрації також збільшується в'язкість розчину. Існують і інші причини уповільнення руху іонів в електричному полі, на яких ми зупинятися не будемо.
Якщо експериментально визначити величину l для розчину даної концентрації і графічно знайти l 0 можна розрахувати величину коефіцієнта електропровідності f :
f \u003d L / l 0 (3.11.)
коефіцієнт f характеризує ступінь гальмування іонів і при розведенні розчину прагне до одиниці.
слабкі електроліти. Молярна провідність слабких електролітів значно менше, ніж для розчинів сильних електролітів (рис.3.3, лінія 2). Це пов'язано з тим, що навіть при низьких концентраціях ступінь дисоціації слабких електролітів мала. Підвищення молярної провідності слабких електролітів при розведенні розчинів пов'язано зі збільшенням ступеня дисоціації відповідно до закону розведення Оствальда. С.Арреніус висловив припущення, що молярна провідність слабкого електроліту пов'язана з його ступенем дисоціації виразом:
a\u003d L / l 0 (3.12.)
Таким чином, ступінь дисоціації слабкого електроліту можна розрахувати, якщо відома його гранична молярна провідність l 0. Однак визначити l 0 графічно шляхом екстраполяції графіка l \u003d f (Öс) не можна, тому що крива (рис.3.3., лінія 2) при зменшенні концентрації асимптотично наближається до осі ординат.
Величину l 0 можна визначити за допомогою закону незалежності руху іонів Кольрауша:
Молярна електрична провідність електроліту при нескінченному розведенні розчину дорівнює сумі граничних подвижностей катіонів та аніонів.
l 0 \u003d l 0, + + l 0, - (3.13.)
Рухливості катіона і аніона пропорційні абсолютним швидкостям руху іонів (см.табл. 3.1.).
l 0, + \u003d F × U +; l 0, - \u003d F × U - (3.14.)
У цих формулах F - одиниця кількості електрики, звана Фарадеем, рівна 96494 кулон (Кл). У табл.3.2. наведені граничні рухливості деяких іонів.
Слід зазначити, що закон незалежності руху іонів справедливий як для слабких, так і для сильних електролітів.
Таблиця 3.2.
Граничні рухливості іонів (див 2 × Див × моль -1) при 25 0 С
| катіон | l 0, + | анион | l 0, - |
| Н + К + Na + Li + Ag + Ba 2 Ca 2+ Mg 2+ | 349,8 73,5 50,1 38,7 61,9 127,2 119,0 106,1 | ВІН - I - Br - Cl - NO 3 - CH 3 COO - SO 4 2- | 76,8 78,4 76,3 71,4 40,9 160,0 |
Застосування вимірювань провідності
Метод дослідження заснований на вимірюванні електричної провідності, називається кондуктометрів. Цей метод широко використовується в лабораторній практиці. Прилад для вимірювання електричної провідності називається кондуктоміром. Зокрема, кондуктометрический метод дозволяє визначати константи дисоціації слабких електролітів.
Приклад. Визначення константи дисоціації оцтової кислоти.
а) Для знаходження постійної кондуктометричного осередку приготували розчини хлориду калію з молярними концентраціями 0,1 і 0,02 моль × дм -3 і виміряли їх проводімость.Она виявилася рівною відповідно L 1 \u003d 0,307 Див і L 2 \u003d 0,0645 Див. По таблиці знаходимо значення питомої провідності розчинів хлориду калію зазначених концентрацій:
À 1 \u003d 1,29 × 10 -1 Див × см -1; À 2 \u003d 2,58 × 10 -2 Див × см -1
За рівняння 3.6. розраховуємо постійну осередки:
До 1 \u003d À 1 / L 1 \u003d 0,42 см -1
До 2 \u003d À 2 / L 2 \u003d 0,40 см -1
Середнє значення К \u003d 0,41 см -1
б) Приготували два розчину оцтової кислоти з концентраціями c 1 \u003d 0,02моль × дм -3 і c 2 \u003d 1 × 10 -3 моль × дм -3. За допомогою кондуктометра виміряли їх електричну провідність:
L 1 \u003d 5,8 × 10 -4 См; L 2 \u003d 1,3 × 10 -4 См.
в) Розраховуємо питому провідність:
À 1 \u003d L 1 × K \u003d 5,8 × 10 -4 × 0,41 \u003d 2,378 × 10 -4 Cм × см -1
À 2 \u003d L 2 × К \u003d 1,2 × 10 -4 × 0,41 \u003d 0,492 × 10 -4 См × см -1
г) За формулою (3.8.) знаходимо молярну електричну провідність l 1 \u003d 11,89См × см 2 × моль -1; l 2 \u003d 49,2 Див × см 2 × моль -1
д) Знаходимо, користуючись табл.3.2. величину граничної молярної прово-хідності оцтової кислоти: l 0 \u003d 349,8 +40,9 \u003d 390,7 Див × см 2 × моль -1.
е) Нарешті, розраховуємо для кожного розчину ступінь дисоціації (рівняння 3.12.) і константу дисоціації
a 1 \u003d 3,04 × 10 -2; a 2 \u003d 1,26 × 10 -1
До 1 \u003d 1,91 × 10 -5; До 2 \u003d 1,82 × 10 -5
Середнє значення К \u003d 1,86 × 10 -5
- 102.50 КбЕлектропровідність.
Електрична провідність (електропровідність, провідність) - це здатність тіла проводити електричний струм, а також фізична величина, що характеризує цю здатність і зворотна електричному опору. В системі СІ одиницею вимірювання електричної провідності є Див. Про здатність окремих речовин проводити електричний струм можна судити по їх питомій електричному опору ρ. Для судження про електропровідності матеріалів користуються також поняттям питома електрична провідність
σ \u003d 1 / ρ
Питома електрична провідність вимірюється в Сіменса на метр (См / м).
Відповідно до закону Ома в лінійному ізотропному речовині питома провідність є коефіцієнтом пропорційності між щільністю виникає струму і величиною електричного поля в середовищі:
J \u003d γE
де γ - питома провідність,
J - вектор щільності струму,
E - вектор напруженості електричного поля.
електрична провідність G провідника може бути виражена наступними формулами:
G \u003d 1 / R \u003d S / (ρl) \u003d γS / l \u003d I / U
де ρ - питомий опір,
S - площа поперечного перерізу провідника,
l - довжина провідника,
γ \u003d 1 / ρ - питома провідність,
U - напруга на ділянці,
I - струм на ділянці.
Вимірюється електрична провідність в Сіменс: [G] \u003d 1/1 Ом \u003d 1 Див.
У речовинах є два типи носіїв зарядів: електрони або іони. Рух цих зарядів створює електричний струм.
Електропровідність різних речовин залежить від концентрації вільних електрично заряджених частинок. Чим більше концентрація цих частинок, тим більше електропровідність даної речовини. Всі речовини в залежності від електропровідності ділять на три групи: провідники, діелектрики і напівпровідники.
Вода. Лід. Пар.
Вода (оксид водню) - хімічна речовина у вигляді прозорої рідини, яка не має кольору (в малому обсязі), запаху і смаку (при нормальних умовах). Хімічна формула: Н2О. У твердому стані вода називається льодом або снігом, а в газоподібному - водяною парою. Вода є хорошим сільнополярних розчинником.У природних умовах завжди містить розчинені речовини (солі, гази).
В окремо розглядається молекулі води атоми водню і кисню, точніше їх ядра, розташовані так, що утворюють трикутник. У вершині його - порівняно велике кисневе ядро, в кутах, прилеглих до основи, - по одному ядру водню.
Молекула води являє собою маленький диполь, що містить позитивний і негативний заряди на полюсах. Так як маса і заряд ядра кисню більше ніж у ядер водню, то електронне хмара стягується в сторону кисневого ядра. При цьому ядра водню "оголюються". Таким чином, електронна хмара має неоднорідну щільність. Близько ядер водню є нестача електронної густини, а на протилежному боці молекули, близько ядра кисню, спостерігається надлишок електронної щільності. Саме така структура і визначає полярність молекули води. Якщо з'єднати прямими лініями епіцентри позитивних і негативних зарядів вийде об'ємна геометрична фігура - правильний тетраедр.
Завдяки наявності водневих зв'язків кожна молекула води утворює водневий зв'язок з 4-ма сусідніми молекулами, утворюючи ажурний сітчастий каркас в молекулі льоду. Однак, в рідкому стані вода - невпорядкована рідина; ці водневі зв'язку - спонтанні, короткоживучі, швидко рвуться і утворюються знову. Все це призводить до неоднорідності в структурі води.
Те, що вода неоднорідна за своїм складом, було встановлено давно. Лід плаває на поверхні води, тобто щільність кристалічного льоду менше, ніж щільність рідини.
Майже у всіх інших речовин кристал щільніше рідкої фази. До того ж і після плавлення при підвищенні температури щільність води продовжує збільшуватися і досягає максимуму при 4 ° C. Менш відома аномалія стисливості води: при нагріванні від точки плавлення аж до 40 ° C вона зменшується, а потім збільшується. Теплоємність води теж залежить від температури немонотонно.
Крім того, при температурі нижче 30 ° C зі збільшенням тиску від атмосферного до 0,2 ГПа в'язкість води зменшується, а коефіцієнт самодифузії - параметр, який визначає швидкість переміщення молекул води відносно один одного росте.
Кожна молекула води в кристалічній структурі льоду бере участь в 4 водневих зв'язках, спрямованих до вершин тетраедра. У центрі цього тетраедра знаходиться атом кисню, в двох вершинах - по атому водню, електрони яких задіяні в утворенні ковалентного зв'язку з киснем. Дві що залишилися вершини займають пари валентних електронів кисню, які не беруть участі в утворенні внутрішньомолекулярних зв'язків. При взаємодії протона однієї молекули з парою неподіленого електронів кисню іншої молекули виникає воднева зв'язок, менш сильна, ніж зв'язок внутримолекулярная, але досить могутня, щоб утримувати поруч сусідні молекули води. Кожна молекула може одночасно утворювати чотири водневі зв'язки з іншими молекулами під строго певними кутами, рівними 109 ° 28 ", спрямованих до вершин тетраедра, які не дозволяють при замерзанні створювати щільну структуру.
Водяна пара - газоподібний стан води в умовах, коли газова фаза може знаходитися в рівновазі з рідкою або твердою фазами. Він не має кольору, смаку і запаху, утворюється молекулами води при її випаровуванні. Пар характеризується дуже слабкими зв'язками між молекулами води, а також їх великою рухливістю. Його частинки майже вільно і хаотично рухаються в проміжках між зіткненнями, під час яких відбувається різка зміна характеру їх руху. Властивості насиченої пари (щільність, питома теплоємність і ін.) Визначаються тільки тиском.
Електрична провідність води
Чиста вода є поганими провідником електрики. Але тим не менше, хоч і дуже мало, але вона може проводити електричний струм через часткову дисоціації молекул води на іони H + і OH-. Основне значення для електропровідності і води і льоду мають переміщення іонів H +, так звані «протонні переходи». Мала, майже відсутня провідність обумовлена \u200b\u200bтим, що вода складається з електрично нейтральних атомів і молекул, рух яких не може здійснити електричний струм. Однак розчини солей, кислот і лугів у воді та деяких інших рідинах добре проводять струм, причому чим більше розчиненої речовини, тим більша його частина розпадається на іони, і тим вище провідність розчину.
Концентрація іонів це перший фактор, що впливає на провідність. Якщо при розчиненні не відбувається дисоціації молекул, то розчин не є провідником електрики.
Інші фактори: заряд іона (іон із зарядом +3 переносить в три рази більше струм, ніж з зарядом +1); рухливість іона (важкі іони рухаються повільніше, ніж легкі), а також температура. Розчин, який проводить електричний струм, називається електролітом.
Мінералізація води різко знижує її питомий електричний опір, а значить збільшує її питому провідність. Так, у дистильованої води воно становить приблизно 10ˉ 5 См / м, а у морської - близько 3,33 См / м (для порівняння: папір - 10ˉ 15, мідь - 0,5 × 10 8 См / м). Електрична провідність води може служити показником її забруднення.
електропровідність льоду
Електрична провідність льоду дуже мала і у багато разів менше електричної провідності води, особливо якщо вода хоча б трохи мінералізована. Наприклад, питома електропровідність прісноводного льоду при температурі 0 ° С дорівнює 0,27 · 10ˉ 7 См / м, а при -20 ° С дорівнює 0,52 · 10ˉ 7 См / м, тоді як дистильована вода, з якої було отримано цей лід , мала провідність порядку 10ˉ 6 См / м.
Низька провідність льоду обумовлена \u200b\u200bтим, що в звичайних умовах в ньому практично не міститься ні вільних носіїв заряду, ні атомів, яким не вистачає електрона (так званих «дірок»).
Сухий сніг, перш за все, характеризується малою електричну провідність, що дозволяє розташовувати на його поверхні навіть не ізольовані проводи. Його провідність при температурі від -2 до -16 ° С приблизно 0,35 * 10ˉ 5 - 0,38 · 10ˉ 7 См / м і близька до питомої провідності сухого льоду. Вологий сніг, навпаки, має велику електричну провідність яка доходить до 0,1 См / м.
Підвищити провідність льоду можна за допомогою мінералізації (насичення іонами) вихідної води кислотами, солями і підставами. Тоді іони будуть відтягувати на себе електрони від сусіднього атома, а ті в свою чергу ставати іонами. Так, шляхом послідовного відтягування буде переміщатися позитивний заряд.
Провідність водяної пари
Сам по собі пар, будучи газом в якому відсутні заряджені частинки і не є провідником електрики. Однак, підвищити провідність можна, якщо створити в ньому заряджені частинки - молекули, під впливом різних зовнішніх взаємодій. Найбільший вплив надають такі зовнішні агенти як рентгенівські промені, промені радію, сильне нагрівання газу. Викликають іонізацію, наприклад прилади, які називаються ионизаторами.
Механізм іонізації в газах полягає в наступному: нейтральні атоми і молекули містять однакову кількість позитивного електрики у вигляді центральних ядер і негативного - у вигляді електронів, що оточують ці ядра. Під впливом різних причин електрон може бути вирваний, і молекула, яка залишається, набуває позитивний заряд. А вирваний електрон не залишається вільним, він захоплюється однією або декількома нейтральними молекулами і повідомляє їм негативний заряд. У підсумку виходить пара протилежно заряджених іонів. Для того, щоб електрон відірвався від атома йому необхідно затратити певну енергію - енергію іонізації. Ця енергія різна для різних речовин і залежить від будови атома.
Кожен молекулярний іон, який утворився, притягує нейтральні молекули, і тим самим утворює цілий іонний комплекс. Іони протилежних знаків, при зіткненні один з одним, нейтралізують один одного, в результаті чого знову виходять вихідні нейтральні молекули -такий процес називається рекомбінацією. При рекомбінації електрона і позитивного іона вивільняється певна енергія, яка дорівнює енергії, витраченої на іонізацію.
Після того, як припиняється дія іонізатора кількість іонів в газі з плином часу стає все менше, і в кінці кінців практично зводиться до нуля. Це пояснюється тим, що електрони і іони беруть участь в тепловому русі і тому соударяются один з одним. В результаті зіткнення електрона і позитивного іона вони возз'єднуються в нейтральний атом. А коли стикаються позитивний і негативні іони, останній в свою чергу може віддати позитивного іону свій власний надлишковий електрон і обидва іона стануть нейтральними молекулами.
З цього випливає, що провідність пара - явище тимчасове. Варто тільки припинити іонізацію газу, як він перестане бути провідним, тоді як рідина завжди залишається провідником електричного струму.
Список використаної літератури:
- Вукаловіч М. П., Новіков І. І., Технічна термодинаміка, 4 видавництва., М., 1968;
- Зацепіна Г.Н. Фізичні властивості і структура води. М., 1987
- А.Н. Матвєєв. Електрика і магнетизм.
- http://ru.wikipedia.org/wiki/
- http://www.o8ode.ru/article/ water /
- http://provodu.kiev.ua/smelye- teorii / led
Опис роботи
Електрична провідність (електропровідність, провідність) - це здатність тіла проводити електричний струм, а також фізична величина, що характеризує цю здатність і зворотна електричному опору.
Якщо термін «електрична провідність» знаком, в основному, фахівцям з фізики та електротехніки, то про надпровідниках, стараннями журналістів, чув майже кожен. Поряд з освоєнням термоядерної енергії, створення надпровідних матеріалів, які працюють при нормальних земних значеннях температур, є мрією і філософським каменем фізики 21-го століття.
Технічна реалізація цього завдання дозволить людству не платити непомірну данину за використання найзручнішого виду енергії - у вигляді теплових втрат при генерації, трансформації та передачі електроенергії. Непрямим ефектом освоєння надпровідності стало б і суттєве поліпшення екології навколишнього середовища через зниження рівня викидів шкідливих продуктів горіння вугілля, мазуту і газу тепловими електростанціями, і припинення марного підігріву атмосфери Землі, і скорочення викидів парникових газів.
Крім цього, впровадження надпровідників в різні галузі промисловості і транспорту, призвело б до нової технічної революції, плодами якої могло б користуватися все населення Землі. Всі електричні машини - генератори, трансформатори, двигуни - зменшилися б у розмірах, а потужність їх зросла б; застосування електромагнітів на основі надпровідності суттєво наблизило б вирішення проблеми термоядерного синтезу, а надшвидкісні потяги стали б реальністю.
Виходячи з цього, зрозумілий інтерес до проблеми надпровідності з боку вчених і інженерів усього світу, і вже з'являються перші матеріали, здатні реалізувати практичну надпровідність. Головним напрямком зусиль дослідників стали останнім часом графен і графеноподобние матеріали, які є по суті справи двовимірними структурами з унікальною провідністю.
Визначення та одиниці виміру електричної провідності
Електричну провідність називається здатність матеріалу пропускати через себе електричний струм. Електрична провідність або, інакше, електропровідність є зворотною величиною по відношенню до опору. Позначається провідність буквою G.
В системі СІ електропровідність вимірюється в Сіменса (1 См \u003d 1 Ом⁻¹). У гаусом системі і в СГСЕ використовують статсіменс, а СГСМ - абсіменс.
Провідність, нарівні з опором, грає велику роль в електротехніці та інших технічних науках. Її фізичний зміст інтуїтивно зрозумілий з її гідравлічного аналога - все розуміють, що у широкого шланга опір потоку води нижче, і, відповідно, він краще пропускає воду, ніж тонкий. Також і з електропровідністю - матерія з більш низьким опором краще проводить електрику.
Одиниця електропровідності названа на честь відомого німецького інженера, винахідника, вченого і промисловця - засновника фірми Siemens - Ернста Вернера фон Сіменса (Werner Ernst von Siemens). Між іншим, саме він запропонував ртутну одиницю опору, яка дещо відрізняється від сучасного ома. Сіменс визначив одиницю опору як опір стовпа ртуті висотою 100 см з поперечним перерізом 1 мм ² при температурі 0 ° С.

фізика явищ
Сама по собі електропровідність будь-якого матеріалу визначається, перш за все, його фізичним станом: речовина може бути твердим, рідким або газоподібним. Існує також четвертий стан речовини, зване плазмою, З якого складаються верхні шари нашого Сонця.
При розгляді явищ електропровідності в твердих тілах не обійтися без сучасних уявлень фізики твердого тіла і зонної теорії провідності. З точки зору структури тверді тіла поділяються на кристалічні і аморфні.
Кристалічні речовини мають впорядковану геометричну структуру; атоми або молекули речовини утворюють своєрідну об'ємну або плоску решітку; до таких матеріалів відносяться метали, їх сплави і напівпровідники. аморфні речовини кристалічної решітки не мають.
З валентних електронів атомів всередині кристала утворюються асоціації електронів, які не належать конкретному атому. Точно так же, як стану електронів в ізольованому атомі обмежені дискретними енергетичними рівнями, стану електронів в твердому тілі обмежені дискретними енергетичними зонами. Ці зони називаються валентними або заповненими зонами. Крім валентної зони, кристал має зону провідності, Яка розташована, як правило, вище валентної. Ці дві зони в діелектриках і напівпровідниках розділені забороненою зоною, Т. Е. Енергетичній зоною, в якій не може перебувати жоден електрон.
Діелектрики, напівпровідники і метали з точки зору зонної теорії розрізняються тільки шириною забороненої зони. Діелектрики мають найширшу заборонену зону, іноді досягає 15 еВ. При температурі абсолютного нуля електронів в зоні провідності немає, але при кімнатній температурі в ній вже буде деяка кількість електронів, вибитих з валентної зони за рахунок теплової енергії. У провідниках (металах) зона провідності і валентна зона перекриваються, тому при температурі абсолютного нуля в цій перекритою зоні є досить велика кількість електронів провідності, які можуть рухатися і утворювати струм. Напівпровідники мають невеликі заборонені зони, і їх електропровідність сильно залежить від температури та інших факторів, а також наявність домішок.
електропровідність металів

Ще задовго до відкриття електронів було експериментально показано, що проходження струму в металах не пов'язане, на відміну від струму в рідких електролітах, з перенесенням речовини. Витончений по своїй простоті експеримент, який виконав німецький фізик Карл Віктор Едуард Рикке (Carl Viktor Eduard Riecke) в 1901 році, переконливо довів, що носіями струму в металах є якась субстанція, на той момент невідома. Він протягом року пропускав електричний струм через своєрідний «сендвіч» з різнорідних металів (мідь-алюміній-мідь) і, по завершенню експерименту, виявив відсутність змішування металів. Пізніше, працями датського вченого Нільса Бора була створена і блискуче підтверджена теорія планетарного пристрої атома, що складається з позитивного ядра, що включає в себе частинки, які ми зараз називаємо нуклонами - це протони і нейтрони - і зовнішніх оболонок з негативно заряджених електронів. Цією теорією досі користуються фізики, правда, несучи в неї деякі корективи.
Провідність металів обумовлена \u200b\u200bнаявністю великого числа валентних електронів з зовнішніх оболонок атомів металів, які не належать конкретному атому, але стають надбанням всього ансамблю атомів зразка. Цілком природно, що атоми металів, які мають на зовнішній оболонці більше число електронів, мають і більш високу електропровідність - сюди відносяться мідь (Cu), срібло (Ag) і золото (Au), що завжди відрізняло цінність цих металів для електротехніки та електроніки.

електропровідність напівпровідників
Електропровідність власне напівпровідників носить електронний характер і сильно залежить від домішок. Технічне використання цієї властивості знайшло застосування в створенні підсилюючих і ключових елементів сучасної електроніки. Характерними напівпровідниками є чотиривалентність германій (Ge) і кремній (Si), що утворюють кристалічну структуру з атомів, пов'язаних між собою ковалентними зв'язками з електронних пар зовнішньої оболонки атомів. Привнесення домішок різко змінює провідність цих напівпровідників. Наприклад, при додаванні п'ятивалентних атомів галію (Ga) або миш'яку (As), в напівпровіднику утворюється надлишок валентних електронів, які стають загальним надбанням зразка напівпровідника, в цьому випадку говорять про провідності n-типу. Якщо до напівпровідника додається тривалентний індій (In), то утворюється недолік валентних електронів, в цьому випадку говорять про «доречний» провідності р-типу.
Електропровідність напівпровідників сильно залежить від додатка зовнішніх факторів, як-то: електричного або магнітного поля, освітлення світлом різної інтенсивності і спектру або впливу різного роду опромінень аж до гамма-квантів. Слово «кванти» в англійській термінології не використовується. Це властивість легованих напівпровідників знайшло широке застосування в сучасних технологіях. Унікальною властивістю односторонньої провідності має поєднання напівпровідників з різними видами провідності, так званий p-n перехід, Що став основою сучасної електроніки.

електропровідність електролітів
Електропровідність електролітів - це здатність розчинів речовин проводити електричний струм при додатку електричної напруги. Носіями струму в них є позитивно і негативно заряджені іони - катіони і аніони, Які існують в розчині внаслідок електролітичноїдисоціації. Іонна електропровідність електролітів, на відміну від електронної, характерною для металів, супроводжується перенесенням речовини до електродів з утворенням поблизу них нових хімічних сполук.
Загальна (сумарна) провідність складається з провідності катіонів та аніонів, які під дією зовнішнього електричного поля рухаються в протилежних напрямках. Вона пов'язана з рухливістю іонів - характеристикою, що залежить від розмірів і заряду наявних катіонів та аніонів. Як було доведено, унікальна рухливість іонів води - атома водню катіона Н + і аніона гідроксильної групи ОН, обумовлена \u200b\u200bбудовою води, що утворює асоціації молекул з певним зарядом. Механізм передачі заряду в таких асоціаціях називається крокетний і нагадує по своїй суті механізм передачі енергії в більярді - коли ви наносите удар битком в серію послідовно стоять куль, з цієї асоціації вилітає останній дальній куля.
Електропровідність води, цього самого універсального розчинника на Землі, сильно залежить від домішок, що розчиняються речовин, саме тому електропровідність морської або океанічної води різко відрізняється від електропровідності прісної води річок і озер (ми також користуємося лікувальними властивостями мінеральних вод, І звідси виникають легенди про живу і мертву воду).
Кількісно електропровідність електролітів характеризують еквівалентної електропровідністю - провідної здатністю всіх іонів, що утворюються в 1 грам-еквіваленті електроліту.

електропровідність газів
Електропровідність газів обумовлена \u200b\u200bнаявністю в них вільних електронів та іонів, тому і називається електронно-іонної провідністю. Для газів, в силу їх розрідженості, характерна велика довжина пробігу до зіткнення молекул і іонів; через це їх електропровідність в нормальних умовах невисока. Те ж саме можна стверджувати щодо сумішей газів. Природного сумішшю газів є атмосферне повітря, який в електротехніці вважається хорошим ізолятором. Електропровідність газів дуже сильно залежить від різних фізичних факторів, як-то: тиску, температури, складу суміші. Крім цього, дія надають різного роду іонізуючі випромінювання. Так, наприклад, будучи освітленими ультрафіолетовими або рентгенівськими променями, або перебуваючи під дією часток, що випускаються радіоактивними речовинами, або, нарешті, під дією високої температури, Гази набувають властивість проводити електричний струм.

Цей процес носить назву іонізації. Механізми її між діями: у верхніх шарах атмосфери Землі переважає фотохимическая іонізація за рахунок захоплення нейтральній молекулою фотона ультрафіолетового випромінювання або кванта рентгенівського випромінювання, з випусканням негативного електрона і перетворенням молекули в позитивно заряджений іон. У свою чергу, вільний електрон, приєднуючись до нейтральної молекулі, перетворює її в негативно заряджений іон. У нижніх шарах атмосфери переважає ударна іонізація за рахунок зіткнення молекул газу з корпускулярним частинками сонячного і космічного випромінювання.
Необхідно зауважити, що число позитивних і негативних іонів в атмосферному повітрі при звичайних умовах дуже малó в порівнянні з повним числом його молекул. В 1 кубічному сантиметрі газу при звичайних умовах тиску і температури міститься близько 30 * 10¹⁸ молекул. У той же час в тому ж обсязі кількість іонів обох типів одно в середньому 800-1000. Це кількість іонів варіює в повній відповідності з порою року і часу доби, залежить від геологічних, топографічних і метеорологічних умов і від погоди: так, наприклад, влітку число іонів значно більше, ніж взимку, в ясну і суху погоду більше, ніж в дощову і хмарну, при тумані іонізація приземної атмосфери зводиться практично до нуля.
Електропровідність в біології
Знання електропровідності біологічних об'єктів дає в руки біологів і медиків потужний метод дослідження, діагностики та навіть лікування. З огляду на ту обставину, що земне життя зародилася в морській воді, по суті справи є електролітом, всі біологічні об'єкти в тій чи іншій мірі з точки зору електрохімії є електроліт, незалежно від особливостей структури даного об'єкта.
Але, при розгляді протікання струму через біологічні об'єкти, треба враховувати їх клітинну будову, істотним елементом якого є клітинна мембрана - зовнішня оболонка, що захищає клітину від впливу несприятливих факторів навколишнього середовища за рахунок властивостей селективності. за своїм фізичними властивостями клітинна мембрана являє собою паралельне з'єднання конденсатора і опору, що зумовлює залежність електропровідності біологічного матеріалу від частоти прикладеної напруги і форми його коливань.

У загальному випадку, біологічна тканина являє собою конгломерат з клітин власне органу, міжклітинної рідини (лімфи), кровоносних судин і нервових клітин. Оскільки останні у відповідь на вплив електричного струму відповідають збудженням, протікання струму в біологічної тканини, а значить і її електропровідність носить нелінійний характер.
При низьких частотах впливає струму (до 1 кГц), електропровідність біологічних об'єктів визначається властивостями електропровідності лімфи і каналів кровопостачання, при великих частотах (понад 100 кГц) електропровідність біологічних об'єктів пропорційна загальній кількості електролітів, що містяться в тканини між електродами.
Знання характерних значень питомої електропровідності біологічних тканин і характеристик клітинних мембран дозволяє створювати пристрої об'єктивного контролю процесів, що відбуваються в клітинах організму. Ця інформація також допомагає при діагностиці захворювань, і створення пристроїв, застосовуваних для лікування (електрофорез).
На жаль, швидкість протікання електрохімічних реакцій невисока, тому миухитряється отримати опік раніше, ніж отдёрнем руку від чогось дуже гарячого - не встигають нерви передати сигнал небезпеки в мозок, а той, у свою чергу, відреагувати негайно - швидкість реакції на зовнішні подразники у нас становить сотні мілісекунд. Саме тому служби управління рухом забороняють нам сідати за кермо в стані алкогольного або наркотичного сп'яніння, через додаткового зниження швидкості реакції.
надпровідність
Відкрите Камерлинг-Онессом в 1911 році явище надпровідності (нульового опору протіканню струму) для ртуті, охолодженої до -270 градусів Цельсія, зробило переворот у поглядах фізиків, звернувши їхню увагу на квантові процеси, що зумовлюють такий стан речовини.
З тих пір вчені включилися в гонку температур, піднімаючи планку надпровідності речовин все вище і вище. Розроблені ними з'єднання, сплави і кераміки (фторированная HgBa 2 Ca 2 Cu 3 O 8 + δ або Hg-тисячу двісті двадцять три) підняли температуру надпровідності до 138 кельвінів, що ненабагато нижче мінімальної температури на Землі. Останньою чарівною паличкою, що дозволяє досягти вікової мрії, стали нові матеріали з фантастичними властивостями - графен і графеноподобние матеріали.

У першому наближенні (досить грубому) надпровідність металів може бути пояснена відсутністю коливань атомів кристалічної решітки, що зменшує ймовірність зіткнень з ними електронів.
Зупинимося на кількох аспектах практичного застосування надпровідності. Перша комерційна надпровідна лінія електропередачі була запущена в експлуатацію фірмою American Superconductor на Лонг-Айленді в Нью-Йорку в кінці червня 2008 року. Південнокорейська компанія LS Cable збирається створити в Сеулі та інших містах надпровідні лінії електропередач із загальною довжиною надпровідного кабелю в 3000 км. А трифазний концентричний кабель на 10 000 вольт проекту AmpaCity, розроблений і впроваджений в Німеччині, розрахований на передачу 40 мегават потужності. У порівнянні з мідним кабелем такого ж розміру, надпровідний кабель може передавати в п'ять разів більше енергії, незважаючи на товсту охолоджуючу сорочку. Проект запущений в роботу в м Ессен, Німеччина в 2014 році.
Також заслуговує на увагу проект транспортування електроенергії (і водню) з пустелі Сахара. За оцінками фахівців, існуючі технології здатні забезпечити потреби всього людства всього лише 300-ми квадратними кілометрами сонячних батарей, Розміщеними в пустелі Сахара. А для потреб всієї Європи потрібно тільки 50 квадратних кілометрів. Але питання впирається в транспортування цієї енергії. Через втрат на передачу піде 100% всієї виробленої енергії. Було запропоновано досить оригінальний спосіб передачі її без втрат через трубки з диборида магнію (MgB₂), що охолоджуються зсередини потоком рідкого водню. В результаті маємо передачу електроенергії через надпровідник без втрат плюс екологічно чисте паливо - водень, який виготовляється на місці.
І, крім того, використання сонячної енергії для виробництва електроенергії і водню таким способом, не порушуватиме екологічного та теплового балансу Землі, що не властиво сучасним способам отримання електроенергії за рахунок викопного палива, будь то нафту або газ чи вугілля. Адже їх використання означає введення в атмосферу додаткової сонячної енергії, раніше акумульованої самою природою в цих джерелах.
Окремим питанням застосування надпровідності на практиці є застосування магнітної левітації для наземного транспорту (поїзди на магнітній подушці). Дослідження показали, що цей вид транспорту буде в три рази ефективніше автомобільного транспорту і в п'ять разів ефективніше літаків.
Якщо термін «електрична провідність» знаком, в основному, фахівцям з фізики та електротехніки, то про надпровідниках, стараннями журналістів, чув майже кожен. Поряд з освоєнням термоядерної енергії, створення надпровідних матеріалів, які працюють при нормальних земних значеннях температур, є мрією і філософським каменем фізики 21-го століття.
Технічна реалізація цього завдання дозволить людству не платити непомірну данину за використання найзручнішого виду енергії - у вигляді теплових втрат при генерації, трансформації та передачі електроенергії. Непрямим ефектом освоєння надпровідності стало б і суттєве поліпшення екології навколишнього середовища через зниження рівня викидів шкідливих продуктів горіння вугілля, мазуту і газу тепловими електростанціями, і припинення марного підігріву атмосфери Землі, і скорочення викидів парникових газів.
Крім цього, впровадження надпровідників в різні галузі промисловості і транспорту, призвело б до нової технічної революції, плодами якої могло б користуватися все населення Землі. Всі електричні машини - генератори, трансформатори, двигуни - зменшилися б у розмірах, а потужність їх зросла б; застосування електромагнітів на основі надпровідності суттєво наблизило б вирішення проблеми термоядерного синтезу, а надшвидкісні потяги стали б реальністю.
Виходячи з цього, зрозумілий інтерес до проблеми надпровідності з боку вчених і інженерів усього світу, і вже з'являються перші матеріали, здатні реалізувати практичну надпровідність. Головним напрямком зусиль дослідників стали останнім часом графен і графеноподобние матеріали, які є по суті справи двовимірними структурами з унікальною провідністю.
Визначення та одиниці виміру електричної провідності
Електричну провідність називається здатність матеріалу пропускати через себе електричний струм. Електрична провідність або, інакше, електропровідність є зворотною величиною по відношенню до опору. Позначається провідність буквою G.
В системі СІ електропровідність вимірюється в Сіменса (1 См \u003d 1 Ом⁻¹). У гаусом системі і в СГСЕ використовують статсіменс, а СГСМ - абсіменс.
Провідність, нарівні з опором, грає велику роль в електротехніці та інших технічних науках. Її фізичний зміст інтуїтивно зрозумілий з її гідравлічного аналога - все розуміють, що у широкого шланга опір потоку води нижче, і, відповідно, він краще пропускає воду, ніж тонкий. Також і з електропровідністю - матерія з більш низьким опором краще проводить електрику.
Одиниця електропровідності названа на честь відомого німецького інженера, винахідника, вченого і промисловця - засновника фірми Siemens - Ернста Вернера фон Сіменса (Werner Ernst von Siemens). Між іншим, саме він запропонував ртутну одиницю опору, яка дещо відрізняється від сучасного ома. Сіменс визначив одиницю опору як опір стовпа ртуті висотою 100 см з поперечним перерізом 1 мм ² при температурі 0 ° С.

фізика явищ
Сама по собі електропровідність будь-якого матеріалу визначається, перш за все, його фізичним станом: речовина може бути твердим, рідким або газоподібним. Існує також четвертий стан речовини, зване плазмою, З якого складаються верхні шари нашого Сонця.
При розгляді явищ електропровідності в твердих тілах не обійтися без сучасних уявлень фізики твердого тіла і зонної теорії провідності. З точки зору структури тверді тіла поділяються на кристалічні і аморфні.
Кристалічні речовини мають впорядковану геометричну структуру; атоми або молекули речовини утворюють своєрідну об'ємну або плоску решітку; до таких матеріалів відносяться метали, їх сплави і напівпровідники. Аморфні речовини кристалічної решітки не мають.
З валентних електронів атомів всередині кристала утворюються асоціації електронів, які не належать конкретному атому. Точно так же, як стану електронів в ізольованому атомі обмежені дискретними енергетичними рівнями, стану електронів в твердому тілі обмежені дискретними енергетичними зонами. Ці зони називаються валентними або заповненими зонами. Крім валентної зони, кристал має зону провідності, Яка розташована, як правило, вище валентної. Ці дві зони в діелектриках і напівпровідниках розділені забороненою зоною, Т. Е. Енергетичній зоною, в якій не може перебувати жоден електрон.
Діелектрики, напівпровідники і метали з точки зору зонної теорії розрізняються тільки шириною забороненої зони. Діелектрики мають найширшу заборонену зону, іноді досягає 15 еВ. При температурі абсолютного нуля електронів в зоні провідності немає, але при кімнатній температурі в ній вже буде деяка кількість електронів, вибитих з валентної зони за рахунок теплової енергії. У провідниках (металах) зона провідності і валентна зона перекриваються, тому при температурі абсолютного нуля в цій перекритою зоні є досить велика кількість електронів провідності, які можуть рухатися і утворювати струм. Напівпровідники мають невеликі заборонені зони, і їх електропровідність сильно залежить від температури та інших факторів, а також наявність домішок.
електропровідність металів

Ще задовго до відкриття електронів було експериментально показано, що проходження струму в металах не пов'язане, на відміну від струму в рідких електролітах, з перенесенням речовини. Витончений по своїй простоті експеримент, який виконав німецький фізик Карл Віктор Едуард Рикке (Carl Viktor Eduard Riecke) в 1901 році, переконливо довів, що носіями струму в металах є якась субстанція, на той момент невідома. Він протягом року пропускав електричний струм через своєрідний «сендвіч» з різнорідних металів (мідь-алюміній-мідь) і, по завершенню експерименту, виявив відсутність змішування металів. Пізніше, працями датського вченого Нільса Бора була створена і блискуче підтверджена теорія планетарного пристрої атома, що складається з позитивного ядра, що включає в себе частинки, які ми зараз називаємо нуклонами - це протони і нейтрони - і зовнішніх оболонок з негативно заряджених електронів. Цією теорією досі користуються фізики, правда, несучи в неї деякі корективи.
Провідність металів обумовлена \u200b\u200bнаявністю великого числа валентних електронів з зовнішніх оболонок атомів металів, які не належать конкретному атому, але стають надбанням всього ансамблю атомів зразка. Цілком природно, що атоми металів, які мають на зовнішній оболонці більше число електронів, мають і більш високу електропровідність - сюди відносяться мідь (Cu), срібло (Ag) і золото (Au), що завжди відрізняло цінність цих металів для електротехніки та електроніки.

електропровідність напівпровідників
Електропровідність власне напівпровідників носить електронний характер і сильно залежить від домішок. Технічне використання цієї властивості знайшло застосування в створенні підсилюючих і ключових елементів сучасної електроніки. Характерними напівпровідниками є чотиривалентність германій (Ge) і кремній (Si), що утворюють кристалічну структуру з атомів, пов'язаних між собою ковалентними зв'язками з електронних пар зовнішньої оболонки атомів. Привнесення домішок різко змінює провідність цих напівпровідників. Наприклад, при додаванні п'ятивалентних атомів галію (Ga) або миш'яку (As), в напівпровіднику утворюється надлишок валентних електронів, які стають загальним надбанням зразка напівпровідника, в цьому випадку говорять про провідності n-типу. Якщо до напівпровідника додається тривалентний індій (In), то утворюється недолік валентних електронів, в цьому випадку говорять про «доречний» провідності р-типу.
Електропровідність напівпровідників сильно залежить від додатка зовнішніх факторів, як-то: електричного або магнітного поля, освітлення світлом різної інтенсивності і спектру або впливу різного роду опромінень аж до гамма-квантів. Слово «кванти» в англійській термінології не використовується. Це властивість легованих напівпровідників знайшло широке застосування в сучасних технологіях. Унікальною властивістю односторонньої провідності має поєднання напівпровідників з різними видами провідності, так званий p-n перехід, який став основою сучасної електроніки.

електропровідність електролітів
Електропровідність електролітів - це здатність розчинів речовин проводити електричний струм при додатку електричної напруги. Носіями струму в них є позитивно і негативно заряджені іони - катіони і аніони, Які існують в розчині внаслідок електролітичноїдисоціації. Іонна електропровідність електролітів, на відміну від електронної, характерною для металів, супроводжується перенесенням речовини до електродів з утворенням поблизу них нових хімічних сполук.
Загальна (сумарна) провідність складається з провідності катіонів та аніонів, які під дією зовнішнього електричного поля рухаються в протилежних напрямках. Вона пов'язана з рухливістю іонів - характеристикою, що залежить від розмірів і заряду наявних катіонів та аніонів. Як було доведено, унікальна рухливість іонів води - атома водню катіона Н + і аніона гідроксильної групи ОН, обумовлена \u200b\u200bбудовою води, що утворює асоціації молекул з певним зарядом. Механізм передачі заряду в таких асоціаціях називається крокетний і нагадує по своїй суті механізм передачі енергії в більярді - коли ви наносите удар битком в серію послідовно стоять куль, з цієї асоціації вилітає останній дальній куля.
Електропровідність води, цього самого універсального розчинника на Землі, сильно залежить від домішок, що розчиняються речовин, саме тому електропровідність морської або океанічної води різко відрізняється від електропровідності прісної води річок і озер (ми також користуємося лікувальними властивостями мінеральних вод, і звідси виникають легенди про живу і мертву воді).
Кількісно електропровідність електролітів характеризують еквівалентної електропровідністю - провідної здатністю всіх іонів, що утворюються в 1 грам-еквіваленті електроліту.

електропровідність газів
Електропровідність газів обумовлена \u200b\u200bнаявністю в них вільних електронів та іонів, тому і називається електронно-іонної провідністю. Для газів, в силу їх розрідженості, характерна велика довжина пробігу до зіткнення молекул і іонів; через це їх електропровідність в нормальних умовах невисока. Те ж саме можна стверджувати щодо сумішей газів. Природного сумішшю газів є атмосферне повітря, який в електротехніці вважається хорошим ізолятором. Електропровідність газів дуже сильно залежить від різних фізичних факторів, як-то: тиску, температури, складу суміші. Крім цього, дія надають різного роду іонізуючі випромінювання. Так, наприклад, будучи освітленими ультрафіолетовими або рентгенівськими променями, або перебуваючи під дією часток, що випускаються радіоактивними речовинами, або, нарешті, під дією високої температури, гази набувають властивість проводити електричний струм.

Цей процес носить назву іонізації. Механізми її між діями: у верхніх шарах атмосфери Землі переважає фотохимическая іонізація за рахунок захоплення нейтральній молекулою фотона ультрафіолетового випромінювання або кванта рентгенівського випромінювання, з випусканням негативного електрона і перетворенням молекули в позитивно заряджений іон. У свою чергу, вільний електрон, приєднуючись до нейтральної молекулі, перетворює її в негативно заряджений іон. У нижніх шарах атмосфери переважає ударна іонізація за рахунок зіткнення молекул газу з корпускулярним частинками сонячного і космічного випромінювання.
Необхідно зауважити, що число позитивних і негативних іонів в атмосферному повітрі при звичайних умовах дуже малó в порівнянні з повним числом його молекул. В 1 кубічному сантиметрі газу при звичайних умовах тиску і температури міститься близько 30 * 10¹⁸ молекул. У той же час в тому ж обсязі кількість іонів обох типів одно в середньому 800-1000. Це кількість іонів варіює в повній відповідності з порою року і часу доби, залежить від геологічних, топографічних і метеорологічних умов і від погоди: так, наприклад, влітку число іонів значно більше, ніж взимку, в ясну і суху погоду більше, ніж в дощову і хмарну, при тумані іонізація приземної атмосфери зводиться практично до нуля.
Електропровідність в біології
Знання електропровідності біологічних об'єктів дає в руки біологів і медиків потужний метод дослідження, діагностики та навіть лікування. З огляду на ту обставину, що земне життя зародилася в морській воді, по суті справи є електролітом, всі біологічні об'єкти в тій чи іншій мірі з точки зору електрохімії є електроліт, незалежно від особливостей структури даного об'єкта.
Але, при розгляді протікання струму через біологічні об'єкти, треба враховувати їх клітинну будову, істотним елементом якого є клітинна мембрана - зовнішня оболонка, що захищає клітину від впливу несприятливих факторів навколишнього середовища за рахунок властивостей селективності. За своїми фізичними властивостями клітинна мембрана являє собою паралельне з'єднання конденсатора і опору, що зумовлює залежність електропровідності біологічного матеріалу від частоти прикладеної напруги і форми його коливань.

У загальному випадку, біологічна тканина являє собою конгломерат з клітин власне органу, міжклітинної рідини (лімфи), кровоносних судин і нервових клітин. Оскільки останні у відповідь на вплив електричного струму відповідають збудженням, протікання струму в біологічної тканини, а значить і її електропровідність носить нелінійний характер.
При низьких частотах впливає струму (до 1 кГц), електропровідність біологічних об'єктів визначається властивостями електропровідності лімфи і каналів кровопостачання, при великих частотах (понад 100 кГц) електропровідність біологічних об'єктів пропорційна загальній кількості електролітів, що містяться в тканини між електродами.
Знання характерних значень питомої електропровідності біологічних тканин і характеристик клітинних мембран дозволяє створювати пристрої об'єктивного контролю процесів, що відбуваються в клітинах організму. Ця інформація також допомагає при діагностиці захворювань, і створення пристроїв, застосовуваних для лікування (електрофорез).
На жаль, швидкість протікання електрохімічних реакцій невисока, тому миухитряється отримати опік раніше, ніж отдёрнем руку від чогось дуже гарячого - не встигають нерви передати сигнал небезпеки в мозок, а той, у свою чергу, відреагувати негайно - швидкість реакції на зовнішні подразники у нас становить сотні мілісекунд. Саме тому служби управління рухом забороняють нам сідати за кермо в стані алкогольного або наркотичного сп'яніння, через додаткового зниження швидкості реакції.
надпровідність
Відкрите Камерлинг-Онессом в 1911 році явище надпровідності (нульового опору протіканню струму) для ртуті, охолодженої до -270 градусів Цельсія, зробило переворот у поглядах фізиків, звернувши їхню увагу на квантові процеси, що зумовлюють такий стан речовини.
З тих пір вчені включилися в гонку температур, піднімаючи планку надпровідності речовин все вище і вище. Розроблені ними з'єднання, сплави і кераміки (фторированная HgBa 2 Ca 2 Cu 3 O 8 + δ або Hg-тисячу двісті двадцять три) підняли температуру надпровідності до 138 кельвінів, що ненабагато нижче мінімальної температури на Землі. Останньою чарівною паличкою, що дозволяє досягти вікової мрії, стали нові матеріали з фантастичними властивостями - графен і графеноподобние матеріали.

У першому наближенні (досить грубому) надпровідність металів може бути пояснена відсутністю коливань атомів кристалічної решітки, що зменшує ймовірність зіткнень з ними електронів.
Зупинимося на кількох аспектах практичного застосування надпровідності. Перша комерційна надпровідна лінія електропередачі була запущена в експлуатацію фірмою American Superconductor на Лонг-Айленді в Нью-Йорку в кінці червня 2008 року. Південнокорейська компанія LS Cable збирається створити в Сеулі та інших містах надпровідні лінії електропередач із загальною довжиною надпровідного кабелю в 3000 км. А трифазний концентричний кабель на 10 000 вольт проекту AmpaCity, розроблений і впроваджений в Німеччині, розрахований на передачу 40 мегават потужності. У порівнянні з мідним кабелем такого ж розміру, надпровідний кабель може передавати в п'ять разів більше енергії, незважаючи на товсту охолоджуючу сорочку. Проект запущений в роботу в м Ессен, Німеччина в 2014 році.
Також заслуговує на увагу проект транспортування електроенергії (і водню) з пустелі Сахара. За оцінками фахівців, існуючі технології здатні забезпечити потреби всього людства всього лише 300-ми квадратними кілометрами сонячних батарей, розміщеними в пустелі Сахара. А для потреб всієї Європи потрібно тільки 50 квадратних кілометрів. Але питання впирається в транспортування цієї енергії. Через втрат на передачу піде 100% всієї виробленої енергії. Було запропоновано досить оригінальний спосіб передачі її без втрат через трубки з диборида магнію (MgB₂), що охолоджуються зсередини потоком рідкого водню. В результаті маємо передачу електроенергії через надпровідник без втрат плюс екологічно чисте паливо - водень, який виготовляється на місці.
І, крім того, використання сонячної енергії для виробництва електроенергії і водню таким способом, не порушуватиме екологічного та теплового балансу Землі, що не властиво сучасним способам отримання електроенергії за рахунок викопного палива, будь то нафту або газ чи вугілля. Адже їх використання означає введення в атмосферу додаткової сонячної енергії, раніше акумульованої самою природою в цих джерелах.
Окремим питанням застосування надпровідності на практиці є застосування магнітної левітації для наземного транспорту (поїзди на магнітній подушці). Дослідження показали, що цей вид транспорту буде в три рази ефективніше автомобільного транспорту і в п'ять разів ефективніше літаків.
Довжина і відстань Маса Заходи обсягу сипучих продуктів і продуктів харчування Площа Обсяг і одиниці вимірювання в кулінарних рецептах Температура Тиск, механічне напруження, модуль Юнга Енергія і робота Потужність Сила Час Лінійна швидкість Плоский кут Теплова ефективність і паливна економічність Числа Одиниці виміру кількості інформації Курси валют Розміри жіночого одягу та взуття Розміри чоловічого одягу та взуття Кутова швидкість і частота обертання прискорення Кутове прискорення Щільність Питома обсяг момент інерції момент сили, що обертає Питома теплота згоряння (по масі) Щільність енергії і питома теплота згоряння палива (за обсягом) Різниця температур Коефіцієнт теплового розширення Термічне опір Питома теплопровідність Питома теплоємність Енергетична експозиція, потужність теплового випромінювання Щільність теплового потоку Коефіцієнт тепловіддачі Об'ємний витрата Масова витрата Молярний витрата Щільність потоку маси Молярная концентрація Масова до онцентрації в розчині Динамічна (абсолютна) в'язкість Кінематична в'язкість Поверхневий натяг Паропроникність Паропроникність, швидкість перенесення пара Рівень звуку Чутливість мікрофонів Рівень звукового тиску (SPL) Яскравість Сила світла Освітленість Дозвіл в комп'ютерній графіці Частота і довжина хвилі Оптична сила в діоптріях і фокусна відстань Оптична сила в діоптрій і збільшення лінзи (×) Електричний заряд Лінійна щільність заряду Поверхнева щільність заряду густина заряду Електричний струм Лінійна щільність струму Поверхнева щільність струму Напруженість електричного поля Електростатичний потенціал і напруга Електричний опір Питомий електричний опір електрична провідність Питома електрична провідність електрична ємність Индуктивность Американський калібр проводів Рівні в dBm (дБм або дБмВт), dBV (дБВ), ваттах і ін. одиницях Магніторушійна сила Напруженість магнітного поля Магнітний піт ок Магнітна індукція Потужність поглиненої дози іонізуючого випромінювання Радіоактивність. Радіоактивний розпад Радіація. Експозиційна доза Радіація. Поглинена доза Десяткові приставки Передача даних Типографіка і обробка зображень Одиниці виміру обсягу лісоматеріалів Обчислення молярної маси Періодична система хімічних елементів Д. І. Менделєєва
вихідна величина
перетворена величина
сіменс на метр пікосіменс на метр мо на метр мо на сантиметр абмо на метр абмо на сантиметр статмо на метр статмо на сантиметр сіменс на сантиметр міллісіменс на метр міллісіменс на сантиметр мікросіменс на метр мікросіменс на сантиметр умовна одиниця електропровідності умовний коефіцієнт електропровідності мільйонних часток, коеф. перерахунку 700 мільйонних часток, коеф. перерахунку 500 мільйонних часток, коеф. перерахунку 640 TDS, мільйонних часток, коеф. перерахунку 640 TDS, мільйонних часток, коеф. перерахунку 550 TDS, мільйонних часток, коеф. перерахунку 500 TDS, мільйонних часток, коеф. перерахунку 700
Детальніше про питому електричну провідність
Введення і визначення
Питома електрична провідність (або питома електропровідність) є мірою здатності речовини проводити електричний струм або переміщати електричні заряди в ньому. Це відношення щільності струму до напруженості електричного поля. Якщо розглянути куб з провідного матеріалу зі стороною 1 метр, то питома провідність буде дорівнює електричної провідності, яка вимірюється між двома протилежними сторонами цього куба.
Питома провідність пов'язана з провідністю наступною формулою:
G \u003d σ (A / l)

де G - електрична провідність, σ - питома електрична провідність, А - поперечний переріз провідника, перпендикулярний напрямку електричного струму і l - довжина провідника. Цю формулу можна використовувати з будь-яким провідником у формі циліндра або призми. Відзначимо, що цю формулу можна використовувати і для прямокутного паралелепіпеда, тому що він є окремим випадком призми, підставою якої є прямокутник. Нагадаємо, що питома електрична провідність - величина, зворотна питомому електричному опору.
Людям, далеким від фізики і техніки, буває складно зрозуміти різницю між провідністю провідника і питомою провідністю речовини. Тим часом, звичайно, це різні фізичні величини. Провідність - це властивість даного провідника або пристрої (наприклад, резистора або гальванічної ванни), в той час як питома провідність - це невід'ємна властивість матеріалу, з якого виготовлені цей провідник або пристрій. Наприклад, питома провідність міді завжди однакова, незалежно від того як змінюється форма і розміри предмета з міді. У той же час, провідність мідного дроту залежить від його довжини, діаметру, маси, форми і деяких інших чинників. Звичайно, схожі об'єкти з матеріалів з більш високою питомою провідністю мають більш високу провідність (хоча і не завжди).

У Міжнародній системі одиниць (СІ) одиницею питомої електричної провідності є сіменс на метр (См / м). Вхідна в неї одиниця провідності названа на честь німецького вченого, винахідника, підприємця Вернера фон Сіменса (1816-1892 рр.). Заснована ним в 1847 р компанія Siemens AG (Сіменс) є однією з найбільших компаній, що випускають електротехнічне, електронне, енергетичне, транспортне та медичне обладнання.

Діапазон питомих електричних провідностей дуже широкий: від матеріалів, що володіють високим питомим опором, таких як скло (яке, між іншим, добре проводить електричний струм, якщо його нагріти до червоного) або поліметилметакрилат (органічне скло) до дуже хороших провідників, таких як срібло, мідь або золото. Питома електрична провідність визначається кількістю зарядів (електронів та іонів), швидкістю їх руху і кількістю енергії, яку вони можуть переносити. Середніми значеннями питомої провідності володіють водні розчини різних речовин, які використовуються, наприклад, в гальванічних ваннах. Іншим прикладом електролітів з середніми значеннями питомої провідності є внутрішнє середовище організму (кров, плазма, лімфа та інші рідини).
Провідність металів, напівпровідників і діелектриків детально обговорюється в наступних статтях Конвертера фізичних величин сайт:, і Електрична провідність. У цій статті ми обговоримо докладніше питому провідність електролітів, а також методи і просте обладнання для її вимірювання.
Питома електрична провідність електролітів і її вимір

питома провідність водних розчинів, В яких електричний струм виникає в результаті руху заряджених іонів, визначається кількістю носіїв заряду (концентрацією речовини в розчині), швидкістю їх руху (рухливість іонів залежить від температури) і зарядом, які вони несуть (яка визначається валентністю іонів). Тому в більшості водних розчинів підвищення концентрації призводить до збільшення числа іонів і, отже, до збільшення питомої провідності. Однак після досягнення певного максимуму питома провідність розчину може почати зменшуватися при подальшому збільшенні концентрації розчину. Тому розчини з двома різними концентраціями однієї і тієї ж солі можуть мати однакову питому провідність.
Температура також впливає на провідність, так як при підвищенні температури іони рухаються швидше, що призводить до збільшення питомої провідності. Чиста вода - поганий провідник електрики. Звичайна дистильована вода, в якій міститься в рівноважному стані вуглекислий газ з повітря і загальна мінералізація менше 10 мг / л, має питому електричну провідність близько 20 мСм / см. Питома провідність різних розчинів наведена нижче в таблиці.


Для визначення питомої провідності розчину використовується вимірювач опору (омметр) або провідності. Це практично однакові пристрої, що відрізняються тільки шкалою. Обидва вимірюють падіння напруги на ділянці кола, по якому протікає електричний струм від батареї приладу. Виміряне значення провідності вручну або автоматично перераховується в питому провідність. Це здійснюється з урахуванням фізичних характеристик вимірювального пристрою або датчика. Датчики питомої провідності влаштовані просто: це пара (або дві пари) електродів, занурених у електроліт. Датчики для вимірювання питомої провідності характеризуються постійної датчика питомої провідності, Яка в найпростішому випадку визначається як відношення відстані між електродами D до площі (електрода), перпендикулярної течією струму А
Ця формула добре працює, якщо площа електродів значно більше відстані між ними, так як в цьому випадку велика частина електричного струму протікає між електродами. Приклад: для 1 кубічного сантиметра рідини K \u003d D / A \u003d 1 см / 1 см² \u003d 1 см⁻¹. Відзначимо, що датчики питомої провідності з маленькими електродами, розсунутими на відносно велику відстань, характеризуються значеннями постійної датчика 1.0 cm⁻¹ і вище. У той же час, датчики з відносно великими електродами, розташованими близько один до одного, мають постійну 0,1 cm⁻¹-менш. Постійна датчика для вимірювання питомої електричної провідності різних пристроїв знаходиться в межах від 0,01 до 100 cm⁻¹.
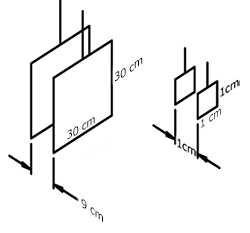
Теоретична постійна датчика: зліва - K \u003d 0,01 см⁻¹, праворуч - K \u003d 1 см⁻¹
Для отримання питомої провідності з виміряної провідності використовується наступна формула:
σ \u003d K ∙ G
σ - питома провідність розчину в См / см;
K - постійна датчика в см⁻¹;
G - провідність датчика в Сіменс.
Постійну датчика зазвичай не розраховують на його геометричні розміри, а вимірюють в конкретному вимірювальному пристрої або в конкретній вимірювальній установці з використанням розчину з відомою провідністю. Ця виміряна величина і вводиться в прилад для вимірювання питомої провідності, який автоматично розраховує питому провідність по виміряним значенням провідності або опору розчину. У зв'язку з тим, що питома провідність залежить від температури розчину, пристрої для її вимірювання часто містять датчик температури, який вимірює температуру і забезпечує автоматичну температурну компенсацію вимірювань, тобто, приведення результатів до стандартної температурі 25 ° C.
Найпростіший спосіб вимірювання провідності - прикласти напругу до двох плоским електродів, зануреним у розчин, і виміряти протікає струм. Цей метод називається потенциометрическим. Згідно із законом Ома, провідність G є відношенням струму I до напруги U:
Однак не все так просто, як описано вище - при вимірюванні провідності є багато проблем. Якщо використовується постійний струм, іони збираються у поверхонь електродів. Також у поверхонь електродів може виникнути хімічна реакція. Це призводить до збільшення поляризаційного опору на поверхнях електродів, що, в свою чергу, призводить до отримання помилкових результатів. Якщо спробувати виміряти звичайним тестером опір, наприклад, розчину хлористого натрію, буде добре видно, як свідчення на дисплеї цифрового приладу досить швидко змінюються в сторону збільшення опору. Щоб виключити вплив поляризації, часто використовують конструкцію датчика з чотирьох електродів.
Поляризацію також можна запобігти або, в усякому разі, зменшити, якщо використовувати при вимірюванні змінний струм замість постійного, та ще й підлаштовувати частоту в залежності від провідності. Низькі частоти використовуються для вимірювання низької питомої провідності, при якій вплив поляризації невелика. більш високі частоти використовуються для вимірювання високих провідностей. Зазвичай частота підлаштовується в процесі вимірювання автоматично, з урахуванням отриманих значень провідності розчину. Сучасні цифрові двохелектродні вимірювачі провідності зазвичай використовують змінний струм складної форми і температурну компенсацію. Вони відкалібровані на заводі-виробнику, проте в процесі експлуатації часто потрібна повторна калібрування, так як постійна вимірювальної комірки (датчика) змінюється з часом. Наприклад, вона може змінитися при забрудненні датчики або при фізико-хімічних змінах електродів.
У традиційному двоелектродної вимірнику питомої провідності (саме такий ми будемо використовувати в нашому експерименті) між двома електродами прикладена змінна напруга і вимірюється протікає між електродами струм. Цей простий метод має один недолік - вимірюється не тільки опір розчину, а й опір, викликане поляризацією електродів. До відома впливу поляризації до мінімуму використовують чотириелектродні конструкцію датчика, а також покриття електродів платинової черню.
Загальна мінералізація
Пристрої для вимірювання питомої електричної провідності часто використовують для визначення загальної мінералізації або змісту твердих речовин (Англ. Total dissolved solids, TDS). Це міра загальної кількості органічних і неорганічних речовин, Що містяться в рідині в різних формах: іонізованої, молекулярної (розчиненої), колоїдної та у вигляді суспензії (нерозчиненої). До розчиненим речовин відносяться будь-які неорганічні солі. Головним чином, це хлориди, бікарбонати і сульфати кальцію, калію, магнію, натрію, а також деякі органічні речовини, розчинені у воді. Щоб ставитися до загальної мінералізації, речовини повинні бути або розчиненими, або в формі дуже дрібних частинок, які проходять крізь фільтри з діаметром пор менше 2 мікрометрів. Речовини, які постійно перебувають в розчині в підвішеному стані, але не можуть пройти крізь такий фільтр, називається зваженими твердими речовинами (Англ. Total suspended solids, TSS). Загальна кількість зважених речовин зазвичай вимірюється для визначення якості води.

Існує два методи вимірювання вмісту твердих речовин: гравиметрический аналіз, Який є найбільш точним методом, і вимір питомої провідності. Перший метод - найточніший, але вимагає великих витрат часу і наявності лабораторного обладнання, так як воду потрібно випарувати до отримання сухого залишку. Зазвичай це робиться при температурі 180 ° C в лабораторних умовах. Після повного випаровування залишок зважується на точних вагах.
Другий метод не такий точний, як гравиметрический аналіз. Однак він дуже зручний, широко поширений і є найбільш швидким методом, Тому що являє собою просте вимірювання провідності і температури, яке виконує за кілька секунд недорогим вимірювальним приладом. Метод вимірювання питомої електропровідності можна використовувати в зв'язку з тим, що питома провідність води прямо залежить від кількості розчинених у ній іонізованих речовин. Даний метод особливо зручний для контролю якості питної води або оцінки загальної кількості іонів в розчині.
Виміряна провідність залежить від температури розчину. Тобто, чим вище температура, тим вище провідність, так як іони в розчині при підвищенні температури рухаються швидше. Для отримання вимірювань, незалежних від температури, використовується концепція стандартної (опорної) температури, до якої наводяться результати вимірювання. Опорна температура дозволяє порівняти результати, отримані при різних температурах. Таким чином, вимірювач питомої провідності може вимірювати реальну провідність, а потім використовувати коригувальну функцію, яка автоматично призведе результат до опорної температурі 20 або 25 ° C. Якщо необхідна дуже висока точність, зразок можна помістити в термостат, потім відкалібрувати вимірювальний прилад при тій же температурі, яка буде використовуватися при вимірах.
Більшість сучасних вимірювачів питомої провідності забезпечені вбудованим датчиком температури, який використовується як для температурної корекції, так і для вимірювання температури. Найдосконаліші прилади здатні вимірювати і відображати виміряні значення в одиницях питомої провідності, питомого опору, солоності, загальної мінералізації та концентрації. Однак ще раз зазначимо, що всі ці прилади показують тільки провідність (опір) і температуру. Всі фізичні величини, які показує дисплей, розраховуються приладом з урахуванням виміряної температури, яка використовується для автоматичної температурної компенсації і приведення виміряних значень до стандартної температури.
Експеримент: вимір загальної мінералізації та провідності
На закінчення ми виконаємо кілька експериментів по вимірюванню питомої провідності за допомогою недорогого вимірювача загальної мінералізації (званого також солеміром, салінометром або Кондуктоміри) TDS-3. Ціна «безіменного» приладу TDS-3 на eBay з урахуванням доставки на момент написання статті менш US $ 3.00. Точно такий же прилад, але з назвою виробника коштує вже в 10 раз дорожче. Але це для любителів платити за бренд, хоча дуже висока ймовірність того, що обидва прилади будуть випущені на одному і тому ж заводі. TDS-3 здійснює температурну компенсацію і для цього забезпечений датчиком температури, розташованим поруч з електродами. Тому його можна використовувати і в якості термометра. Слід ще раз відзначити, що прилад реально вимірює не саму мінералізацію, а опір між двома дротяними електродами і температуру розчину. Все інше він автоматично розраховує з використанням калібрувальних коефіцієнтів.

Вимірювач загальної мінералізації допоможе визначити зміст твердих речовин, наприклад, при контролі якості питної води або визначення солоності води в акваріумі або в прісноводому ставку. Його можна також використовувати для контролю якості води в системах фільтрації та очищення води, щоб дізнатися коли прийшов час замінити фільтр або мембрану. Прилад відкалібрований на заводі-виробнику за допомогою розчину хлориду натрію NaCl з концентрацією 342 ppm (частин на мільйон або мг / л). Діапазон вимірювання приладу - 0-9990 ppm або мг / л. PPM - мільйонна частка, безрозмірна одиниця виміру відносних величин, що дорівнює 1 10⁻⁶ від базового показника. Наприклад, масова концентрація 5 мг / кг \u003d 5 мг в 1 000 000 мг \u003d 5 частин на мільйон або мільйонних часток. Точно так же, як відсоток є однією сотою часткою, мільйонна частка є однієї мільйонної часткою. Відсотки і мільйонні частки за змістом дуже схожі. Мільйонні частки, на відміну від відсотків, зручні для вказівки концентрації дуже слабких розчинів.
Прилад вимірює електричну провідність між двома електродами (тобто величину, зворотну опору), потім перераховує результат в питому електричну провідність (в англомовній літературі часто використовують скорочення EC) за наведеною вище формулою провідності з урахуванням постійної датчика K, потім виконує ще один перерахунок, множачи отриману питому провідність на коефіцієнт перерахунку 500. в результаті виходить значення загальної мінералізації в мільйонних частках (ppm). Детальніше про це - нижче.

Даний прилад для вимірювання загальної мінералізації не можна використовувати для перевірки якості води з високим вмістом солей. Прикладами речовин з високим вмістом солей є деякі харчові продукти (звичайний суп з нормальним вмістом солі 10 г / л) і морська вода. Максимальна концентрація хлориду натрію, яку може виміряти цей прилад - 9990 ppm або близько 10 г / л. Це звичайна концентрація солі в харчових продуктах. Даним приладом також можна виміряти солоність морської води, так як вона зазвичай дорівнює 35 г / л або 35000 ppm, що набагато вище, ніж прилад здатний виміряти. При спробі виміряти таку високу концентрацію прилад виведе повідомлення про помилку Err.
Солемір TDS-3 вимірює питому провідність і для калібрування і перерахунку в концентрацію використовує так звану «шкалу 500» (або «шкалу NaCl»). Це означає, що для отримання концентрації в мільйонних частках значення питомої провідності в мСм / см множиться на 500. Тобто, наприклад, 1,0 мСм / см множиться на 500 і виходить 500 ppm. У різних галузях промисловості використовують різні шкали. Наприклад, в гідропоніці використовують три шкали: 500, 640 і 700. Різниця між ними тільки в використанні. Шкала 700 заснована на вимірі концентрації хлориду калію в розчині і перерахунок питомої провідності в концентрацію виконується так:
1,0 мСм / см x 700 дає 700 ppm
Шкала 640 використовує коефіцієнт перетворення 640 для перетворення мСм в ppm:
1,0 мСм / см x 640 дає 640 ppm
У нашому експерименті ми спочатку виміряємо загальну мінералізацію дистильованої води. Солемір показує 0 ppm. Мультиметр показує опір 1,21 МОм.

Для експерименту приготуємо розчин хлориду натрію NaCl з концентрацією 1000 ppm і виміряємо концентрацію за допомогою TDS-3. Для приготування 100 мл розчину нам потрібно розчинити 100 мг хлориду натрію і долити дистильованої води до 100 мл. Зважимо 100 мг хлориду натрію і помістимо його в мірний циліндр, додамо трохи дистильованої води і розмішати до повного розчинення солі. Потім доллємо воду до мітки 100 мл і ще раз як слід розмішати.
Для експериментального визначення провідності ми використовували два електроди, виготовлені з того ж матеріалу і з тими ж розмірами, що і електроди TDS-3. Виміряний опір склало 2,5 КОм.
Тепер, коли нам відомо опір і концентрація хлориду натрію в мільйонних частках, ми можемо приблизно розрахувати постійну вимірювальної осередки солеміра TDS-3 за наведеною вище формулою:
K \u003d σ / G \u003d 2 мСм / см x 2,5 кОм \u003d 5 см⁻¹
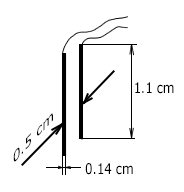
Це значення 5 см⁻¹ близько до розрахункової величини постійної вимірювальної осередки TDS-3 з зазначеними нижче розмірами електродів (див. Малюнок).
- D \u003d 0,5 см - відстань між електродами;
- W \u003d 0,14 см - ширина електродів
- L \u003d 1,1 см - довжина електродів
Постійна датчика TDS-3 дорівнює K \u003d D / A \u003d 0,5 / 0,14x1,1 \u003d 3,25 cm⁻¹. Це не сильно відрізняється від отриманого вище значення. Нагадаємо, що наведена вище формула дозволяє лише приблизно оцінити постійну датчика.
Ви маєте труднощі в перекладі одиниці виміру з однієї мови на іншу? Колеги готові вам допомогти. Опублікуйте питання в TCTerms і протягом декількох хвилин ви отримаєте відповідь.
