Вплив кислотності середовища на вигляд продуктів реакції особливо яскраво реалізується на прикладі відновлення Перманганатна іона MnO 4 -.
а) в кислотному середовищі, Відповідно до першої схемою, протікає найбільш глибоке відновлення атома марганцю.
MnO 4 - + 8H + + 5e - → Mn 2+ +4 Н 2 О.
При цьому утворюються солі марганцю (II), аніон яких залежить від кислоти, що створює кислотне середовище. Так, в кислотною середовищі образуетсяMnSO 4, в солянокіслойMnCl 2. Відзначимо, що металевий марганець утворитися не може, тому що цей метал в ряду напруг металів знаходиться істотно лівіше водню і окислюється іонаміH +. б) в нейтральній(Слаболужною або слабокислою середовищі) перманганат-іон відновлюється до діоксиду марганцаMnO 2 , Що випадає з розчину у вигляді чорно-бурого осаду
Найкращою відповіддю: хімія водню. Водень можна розглядати як частину будь-якої з груп, оскільки він володіє високою енергією іонізації, низькою спорідненістю до електрону і середньої електронегативні. Водень не надто реактивний, коли він знаходиться при низьких температурах.
Реакція водню з киснем і хлором є екзотермічної і спонтанної, але володіє високою енергією активації. Швидкість реакції може бути збільшена каталізатором. Всі елементи цієї групи м'які та сріблясто-сірі. Його температура плавлення зменшується в міру збільшення атомного номера.
MnO 4 - + 2Н 2 О + 3е - → MnO 2 + 4ОН -.
В цьому випадку відбувається істотне защелачивание розчину.
в) в сильно лужному середовищіперенос електронів здійснюється з великими труднощами (через велику концентрацію негативно заряджених іонів ОН -). Відновлення відбувається до манганатного іонаMnO 4 2-, має зелене забарвлення:
Літій значно відрізняється від інших елементів групи 1 і має діагональне співвідношення з магнієм. Трохи цього катіона робить його сильно поляризующим, а хімічні зв'язки мають виражений ковалентний характер. Лужні метали мають великі радіуси, низькі заряди ядер і низькі енергії іонізації. Отже, вони дуже реактивні. Вони реагують практично з усіма неметалами, а також з багатьма сполуками.
В результаті великої реакційної здатності лужних металів їх з'єднання набагато важливіше, ніж самі метали. Реакції лужних металів з водою стають все більш вибухонебезпечними, коли ми заходимо в періодичну таблицю. Група 2: Лужноземельні метали.
MnO 4 - + 1е - → MnO 4 2-
Певну уважність треба проявляти при роботі з сполуками хрому (VI). Справа в тому, що стійкий в кислому середовищі Дихромат-іонCr 2 O 7 2-, має властивості сильного окислювача, в лужному середовищі, без зміни ступеня окислення, Перетворюється в хромат-іонCrO 4 2-, що виявляє дуже слабкі окислювальні властивості.
Ця група складається з берилію, кальцію, магнію і барію. Лужноземельні метали не так реакционноспособни, як лужні метали. Вони мають менші радіуси, а їхні ядерні заряди більше, ніж у лужних металів тієї ж лінії на періодичній таблиці. Їм також необхідно втратити два електрона, щоб досягти електронної конфігурації благородного газу.
У міру того, як реакційна здатність лужних металів, лужних металів зростає в міру того, як група спускається в періодичній таблиці і з тих же причин. У деяких випадках властивості елементів другого періоду більше схожі на властивості елемента третього періоду в групі більшого числа. Наприклад, літій більше схожий на магній, ніж на натрій декількома способами. Схожість між літієм і магнієм є прикладами діагональної зв'язку в періодичній таблиці.
Cr 2 O 7 2- + 2ОН - → 2CrO 4 2 + Н 2 О
Навпаки, хромат в кислотному середовищі утворює Дихромат.
2CrO 4 2 + 2Н + → Cr 2 O 7 2- + Н 2 О
У кислотному середовищі іон Cr 2 O 7 2- відновлюється до іоновCr 3+:
Cr 2 O 7 2- + 14H + + 6e - → 2Cr 3+ +7 Н2О
Залежно від конкретного відновника і реальних кислотно-основних параметрів розчину хром може відновлюватися або до осаду Cr (OН) 3, або, внаслідок амфотерних властивостей сполук хрому (III), до розчинного комплексного аніону 3. У будь-якому випадку, ступінь окислення в продуктах відновлення хрому завжди буде дорівнює + III.
Борін витягується з шахт у вигляді бури і ядра. У процесі екстракції мінерали перетворюються в оксид бору кислотою, яка потім відновлюється магнієм до нечистої, коричневої і аморфної форми бору. Елементарний бор має різні аллотропние різновиди. Зазвичай це неметалевої тверда речовина з високою температурою плавлення чорного сірого кольору або дрібний порошок зі структурою, заснованою на групах з 12 атомів.
Він використовується в авіації, ракетах і куленепробивних куртках. Елемент дуже інертний і піддається впливу тільки найсильніших окислювачів. Бор, як перший елемент групи 13, в більшості своїх хімічних властивостей, Веде себе як неметалл. Він має оксиди кислот і утворює велику кількість цікавих бінарних молекулярних гідридів.
З іншого боку, якщо окислення сполук хрому проводиться в лужному середовищі, то продуктів окислення будуть хроматних іони CrO 4 2-, якщо ж окислення відбувається в кислотному середовищі, то будуть утворюватися іониCr 2 O 7 2-.
Вплив концентрації на склад продуктів реакції
Вплив концентрації реагуючих речовин в ОВР найбільш яскраво проявляється на прикладі реакцій з азотної та сірчаної кислотами.
Прості речовини-неметали. Будова. Фізичні властивості
Бор, є неметаллическим, має кислотні оксиди. Борна кислота використовується як слабкий антисептик і є дуже слабкою монопротной кислотою. Окис бору являє собою ангідрид кислоти. Галогеніди бору і алюмінію діють як кислоти Льюїса.
Він використовується як паливо в космічних ракетах через великої кількості енергії, що виділяється при його взаємодії з киснем. Алюміній є найпоширенішим металом в земній корі. Мінерали алюмінію в міжпородної формі утворюють глину, яка є важливою частиною грунту. Геологи вважають, що це найважливіша хімічна реакція на Землі, тому що без грунту рослини не могли зростати.
реакції азотної кислоти .
Нагадаємо, що ці кислоти одночасно є і окислювачами, і творцями середовища.
Азотна кислота реагує, як окислювач, з металами, оксидами і гідроксидами металів в проміжних ступенях окислення, з неметалами і їх оксидами, що містять неметалл в проміжній ступеня окислення. Як правило, продукти відновлення азотної кислоти утворюють суміш речовин (як правило, оксидів), але, в залежності від концентрації, той чи інший продукт буде переважати в реакційній суміші. Експериментальним шляхом було встановлено наступні закономірності:
Металевий алюміній отримують через процес Холла. Метал - дуже хороший провідник теплової енергії та електрики, він дуже ковкий і пластичний. Його не залучають магніти або іскри. Його можна формувати всіма методами роботи з металом, з'єднувати себе або інші метали за допомогою всіх процедур і значно знизити вартість багатьох процесів.
Алюміній має низьку щільність; Це сильний метал і відмінний електричний провідник. Незважаючи на те, що він сильно знижує і, отже, легко окислюється, він стійкий до корозії. Низька щільність алюмінію, його широка доступність і стійкість до корозії роблять його ідеальним для будівництва.
Концентрована азотна кислота відновлюється до NO 2 .
NO 3 - + 2H + + 1e - → NO 2 + H 2 O
Помірно розбавлена \u200b\u200bазотна кислота відновлюється до NO.
NO 3 - + 4H + + 3e - → NO + 2H 2 O
Дуже розбавлена \u200b\u200bазотна кислота, реагуючи з активним відновником (Mg, Ca, Alі т.п.) відновлюється до солі - нітрату амонію NH 4 NO 3 .
Металевий характер збільшується, оскільки він знижується групою, і навіть, найближчий сусід бору, алюміній є металом. У всякому разі, алюміній знаходиться занадто далеко праворуч від періодичної таблиці, щоб не показувати ніяких неметалічних символів. Таким чином, алюміній є амфотерним, що реагує з неокісляющуюся кислотами з утворенням іонів алюмінію.
І з гарячими лужними розчинами з утворенням алюмінатних іонів. Алюміній, металевий сусід бору, має амфотерні оксиди. Крім того, цей катіон сильно поляризується. Він існує у великій різноманітності кристалічних структур. Він досить реактивний і амфотерний.
NO 3 - + 10H + + 8e - → NH 4 + + 3H 2 O
До складу продуктів відновлення можуть також входити газоподібний азот N 2, N 2 O.
Це визначення залишає осторонь елементи VIII групи головної підгрупи - інертні або благородні гази, атоми яких мають завершений зовнішній електронний шар. Електронна конфігурація атомів цих елементів така, що їх не можна віднести ні до металів, ні до неметалів. Вони є тими об'єктами, які в природній системі чітко розділяють елементи на метали і неметали, займаючи між ними прикордонне положення. Інертні або благородні гази ( «благородство» виражається в інертності) іноді відносять до неметалів, але чисто формально, за фізичними ознаками. Ці речовини зберігають газоподібний стан аж до дуже низьких температур.
Ця форма поглинає воду і використовується в якості стаціонарної фази при хроматографії. Гідроксид алюмінію утворює губчасту і желатинову мережу, яка захоплює домішки при осадженні, відокремлюючи осад фільтрацією. Талій токсичний через його здатності заміщати калій.
Ступінь окислювання фтору в з'єднаннях
Група 14: Сімейство вуглецю. Група 14 включає вуглець, найважливіше з'єднання для життя і кремній, найважливіше для сучасних технологій і штучного інтелекту. Вуглець, на чолі групи, утворює так багато речовин, що має свою власну галузь в хімії, органічної хімії.
Інертність в хімічному відношенні у цих елементів відносна. Для ксенону і криптону відомі сполуки з фтором і киснем. Безсумнівно, в освіті цих з'єднань інертні гази виступали в ролі відновників.
З визначення неметалів слід, що для їх атомів характерні високі значення електроотрнцательності. Оіа змінюється в межах від 2 до 4. Неметали - це елементи головних підгруп, переважно р елементи, виняток становить водень - s-елемент.
Всі елементи-неметали (крім водню) займають в Періодичній системі хімічних елементів Д. І. Менделєєва верхній правий кут, утворюючи трикутник, вершиною якого є фтор.
Елементи проявляють все більше металевий характер, коли вони спускаються через групу. Вуглець визначив неметалеві властивості; утворює ковалентні сполуки з неметалами і іонні з'єднання з металами. Оксидами вуглецю і кремнію є кислоти. Германій є типовим металоїди, який володіє металевими або неметалевими властивостями відповідно до іншого елементом, який присутній в з'єднанні. Це олово, і навіть більше свинцю, визначили металеві характеристики.
Однак олово знаходиться недалеко від таблиці металлоидов і володіє деякими амфотерними властивостями. Хоча вуглець є четвертим найбільш поширеним елементом, який існує у Всесвіті, він не зустрічається з тією ж пропорцією на Землі. Алмази і графіт зустрічаються природним чином, але більшість вуглецю об'єднується з іншими речовинами для утворення сполук.
Однак слід особливо зупинитися на неоднозначному становищі водню в періодичної системи: в I і VII групах головних підгруп. Це не випадково. З одного боку, атом водню, подібно до атомів лужних металів, має на зовнішньому (і єдиному для нього) електронному шарі один електрон (електронна конфігурація 1s1), який він здатний віддавати, проявляючи властивості відновника.
Приклади розв'язання задач
У вуглецю є важлива серія алотропія: алмаз, графіт і фулерени. Ні алмаз, ні графіт не реагують при кімнатній температурі; жоден з них не реагує з киснем, з відновниками або з кислотами або підставами. Однак при високих температурах алмаз і графіт реагують з різними елементами і сполуками.
Графіт більш реактивний, ніж алмаз. Для взаємодії алмазу потрібні більш високі температури, Ніж в разі графіту. В нормальних умовах графіт є найбільш термодинамічно стабільним алотропія. Вуглець - єдиний елемент в групі 14, який зазвичай утворює множинні зв'язку.
У більшості своїх з'єднань водень, як і лужні метали, проявляє ступінь окислення +1, Але віддача електрона атомом водню відбувається важче, ніж у атомів лужних металів. З іншого боку, атому водню, як і атомам галогенів, для завершення зовнішнього електронного шару бракує одного електрона, тому атом водню може приймати один електрон, проявляючи властивості окислювача і характерну для галогену ступінь окислення -1 в гидридах - з'єднаннях з металами, подібних з'єднань металів з галогенами - галогенидам. Але приєднання одного електрона до атома водню відбувається важче, ніж у галогенів.
Вуглець має два важливих оксиду, двоокис вуглецю і окис вуглецю; першим є ангідрид кислоти вугільної кислоти, попередник карбонатів і карбонатів. Вуглекислий газ утворюється, коли органічна речовина спалюється понад повітря. Вуглекислий газ є безбарвний газ, тобто він не поглинає видиме світло.
Вуглекислий газ не має запаху, злегка підкисляє і в високих концентраціях викликає смерть через нестачу кисню. Діоксид вуглецю дуже розчинний у воді. Двоокис вуглецю є типовим неметаллическим оксидом і є кислотою. Твердий вуглекислий газ називається сухим льодом, оскільки він сублімується замість розплавленого і використовується для охолодження морозива, м'яса і заморожених продуктів під час транспортування.
при звичайних умовах водень Н2 - газ. Його молекула, подібно галогенам, двоатомний.
Окис вуглецю є безбарвний, без запаху, легкозаймистий, майже нерозчинний і дуже токсичний газ. Окис вуглецю є відновником, які використовуються при виробництві великої кількості металів, причому залізо є найбільш важливим в доменних печах.
У скляної промисловості використовується більше третини карбонату кальцію, виробленого щороку. Карбонат натрію використовується для приготування порошку для випічки. Карбонат натрію також використовується в сухих порошкових вогнегасниках. Кремній - другий за чисельністю елемент земної кори. Він зустрічається в достатку в породах у формі силікатів, з'єднань, що містять силікат-іон, і в якості кремнезему в піску.
У атомів неметалів переважають окисні властивості, тобто здатність приєднувати електрони. Цю здатність характеризує значення електронегативності, яка закономірно змінюється в періодах і підгрупах (рис. 47).
фтор - найсильніший окислювач, його атоми в хімічних реакціях не здатні віддавати електрони, тобто проявляти відновні властивості.
Відновні властивості простих речовин - неметалів
З'єднання кремнію можуть діяти як підстави Льюїса, тому що атом кремнію може розширити свою валентну оболонку. З'єднання кремнію можуть діяти як кислоти Льюїса, але вуглецеві не можуть. Він зустрічається в природі як кварц і пісок, який складається з дрібних фрагментів кварцу, звичайно пофарбованих золотисто-коричневим кольором домішок оксиду заліза.
Деякі дорогоцінне або напівдорогоцінне каміння - це нечистий кремнезем. Силікати можна розглядати як структури тетраедричних оксоанонов кремнію. Германій дуже схожий на кремній; перший - також напівметал, має кристалічну структуру в формі алмазу і використовується для виготовлення напівпровідникових приладів. Обидва нижніх члена групи 14, олово і свинець, є металами.
Конфігурація зовнішнього електронного шару
Інші неметали можуть проявляти відновні властивості, хоча і в значно більш слабкому ступені в порівнянні з металами; в періодах і підгрупах їх відновна здатність змінюється в зворотному порядку в порівнянні з окислювальним.
Хімічних елементів-неметалів всього 161 Зовсім трохи, якщо врахувати, що відомо 114 елементів. Два елементи-неметали складають 76% від маси земної кори. Це кисень (49%) і кремній (27%). В атмосфері всодержнтся 0,03% від маси кисню в земній корі. Неметали складають 98,5% від маси рослин, 97,6% від маси тіла людини. Шість неметалів - С, Н, О, N, Р і S - біогенні елементи, які утворюють найважливіші органічні речовини живої клітини: білки, жири, вуглеводи, нуклеїнові кислоти. До складу повітря, яким ми дихаємо, входять прості і складні речовини, також утворені елемента мі-неметалами (кисень О2, азот, вуглекислий газ СО2, водяні пари Н2О та ін.).
Олово і свинець легко виходять з їх мінералів і відомі з давніх-давен. Олово дороге і не дуже сильне, але воно чинить опір корозії. Довговічність свинцю і його гнучкість роблять його корисним матеріалом для будівництва. Свинець токсичний, а отруєння свинцем називають гострим отруєнням свинцем або хронічним отруєнням свинцем.
Єдиними розчинними солями свинцю є нітрат і ацетат. Група 15: Сімейство азоту. Елементи групи 15 мають характеристики, які мають характеристики, які варіюються від елементів азоту неметалла і фосфору до типово металевого вісмуту.
водень - головний елемент Всесвіту. Багато космічні об'єкти (газові хмари, зірки, в тому числі і Сонце) більш ніж наполовину складаються з водню. На Землі його, включаючи атмосферу, гідросферу і літосферу, тільки 0,88%. Але це по масі, а атомна маса водню дуже мала. Тому невеликий вміст його тільки здається, і з кожних 100 атомів на Землі 17 - атоми водню.
Прості речовини-неметали. Будова. Фізичні властивості
В простих речовинах атоми неметалів пов'язані кова-лентнон неполярной зв'язком. Завдяки цьому формується більш стійка електронна система, ніж у ізольованих атомів. При цьому утворюються одинарні (наприклад, в молекулах водню Н2, галогенів Кі, Вг2), подвійні (наприклад, в молекулах сірки тронні (наприклад, в молекулах азоту ковалентні зв'язки.
Як вам уже відомо, прості речовини-неметали можуть мати:
1. Молекулярна будова. При звичайних умовах більшість таких речовин є гази або тверді речовини і лише єдиний бром (Вг2) є рідиною. Всі ці речовини молекулярної будови, тому летючі. У твердому стані вони легкоплавкі через слабке межмолекулярвого взаємодії, який утримує їх молекули в кристалі, і здатні до сублімації.
2. Атомне будова. Ці речовини утворені довгими ланцюгами атомів. Через великий міцності ковалентних зв'язків вони, як правило, мають високу твердість, і будь-які зміни, пов'язані з руйнуванням ко-валентного зв'язку в їх кристалах (плавлення, випаровування), здійснюються з великою витратою енергії. Багато такі речовини мають високі температури плавлення і кипіння, а летючість дуже мала. (На малюнку 47 підкреслені символи тих елементів-неметалів, які утворюють тільки атомні кристалічні решітки.)
Багато елементів-неметали утворюють кілька простих речовин - аллотропних модифікацій. Як ви пам'ятаєте, це властивість атомів називають аллотропией. Аллотропия може бути пов'язана і з різним складом молекул, і з різною будовою кристалів. Алотропна модифікаціями вуглецю є графіт, алмаз, карбін, фулерен (рис. 48).

Елементи-неметали, що володіють властивістю аллотропии, позначені на малюнку 47 зірочкою. Так що простих речовин-неметалів набагато більше, ніж хімічних елементів-неметалів.
Ви знаєте, що трива більшості металів, за рідкісним винятком (золото, мідь і деякі інші), характерна сріблясто-біле забарвлення. А ось у простих речовин-неметалів гамма кольорів значно різноманітніші.
Незважаючи на великі відмінності в фізичні властивості неметалів, все-таки потрібно відзначити і деякі їх загальні риси. Всі газоподібні речовини, рідкий бром, а також типові ковалентні кристали - діелектрики, так як всі зовнішні електрони їх атомів використані для освіти хімічних зв'язків. Кристали непластичною, і будь-яка дефор-мація викликає руйнування ковалентних зв'язків. Більшість неметалів не мають металевого блиску.
Хімічні властивості
Як ми вже відзначали, для атомів неметалів, а отже, і для освічених ними простих речовин характерні як окислювальні, так і відновні властивості.
Окисні властивості простих речовин неметалів
1. Окислювальні властивості неметалів проявляються в першу чергу при їх взаємодії з металами (як ви знаєте, метали завжди відновники):

Окисні властивості хлору Сl2 виражені сильніше, ніж у сірки, тому і метал Ре, який має в з'єднаннях стійкі ступеня окіслеіія +2 b +3. окислюється їм до більш високого ступеня окислення.
2. Більшість неметалів проявляють окисні властивості при взаємодії з воднем. В результаті утворюються летючі водневі сполуки.
3. Будь-який неметалл виступає в ролі окислювача в реакціях з тими неметаллами, які мають більш низьке значення елек-троотріцател ьности:
Електронегативність сірки більше, ніж у фосфору, тому вона тут виявляє окисні властивості.
Електронегативність фтору більше, ніж у всіх інших хімічних елементів, тому він проявляє властивості окислювача.
Фтор найсильніший окислювач з неметалів, проявляє в реакціях тільки окисні властивості.
4. Окислювальні властивості неметали виявляють і в реакціях з деякими складними речовинами. Не тільки кисень, але і інші неметали також можуть бути окислювачами в реакціях зі складними речовинами -неорганіческімі і органічними.
Сильний окислювач хлор Сl2 окисляє хлорид заліза (II) в хлорид заліза (III).
Ви пам'ятаєте, звичайно, якісну реакцію на ненасичені з'єднанні - знебарвлення бромної води.
Відновні властивості простих речовин - неметалів
При розгляді реакції неметалів один з одним ми вже відзначали, що в залежності від значень їх електронегативності одні з них проявляє властивості окислювача, а інший - властивості відновника.
1. По відношенню до фтору все неметали (навіть кисень) виявляють відновні властивості.
2. Зрозуміло, неметали, крім фтору, служить восстановителями при взаємодії з киснем:

8 Багато неметелли можуть виступати в ролі відновника в реакціях зі складними речовинами окислювачами:

Існують і такі реакції, в яких один і той же неметалл є одночасно і окислювачем, в відновником, це реакції самоокисления-самовідновлення.
Отже, підіб'ємо підсумки! Більшість неметалів можуть виступав в хімічних реакціях як в ролі окислювача, так і в ролі відновника (відновлювальні властивості не притаманні одному тільки фтору).
Водневі сполуки неметалів
Загальною властивістю всіх неметалів є утворення летких водневих з'єднань, в більшості яких неметалл має нижчу ступінь окислення.

Відомо, що найбільш просто ці сполуки можна отримати безпосередньо взаємодією неметаллв е воднем, тобто синтезом.
Вм водневі з'єднання неметалів обдоеоьани коналентни-ми полярними свялямн, мають молекулярну будову і при звичайних умовах є газами, крім води (рідина). Лла водневих з'єднань неметалів характерно рвалнчное ставлення до води. МЕТА і енлан в ній практмческя нерозчинні. Аміак при расстворенія в воді утворює слябів підставу - гідроксид амонію.
Крім розглянутих властивостей, водневі сполуки неметалів в окисно-відновних реакціях завжди проявляють властивості відновників, адже в них неметалл має нижчу ступінь окислення.
Оксиди неметалів і відповідні їм гідроксиди
В оксидах неметалів зв'язок між атомами ковалентний полярна. Серед оксидів молекулярного будови є газоподібні, рідкі (летючі), тверді (летючі).
Оксиди неметалів ділять на дві групи: несолеобразующіе і голеобразующіе. При розчиненні кислотних оксидів у воді утворюються гідрати оксидів - гідроксиди, за своїм характером є кислотами. Кислоти та кислотні оксиди в результаті хімічних реакцій утворюють солі, в яких неметалл зберігає ступінь окислення.
Оксиди і відповідні їм гідроксиди - кислоти, в яких неметалл проявляє ступінь окислення, що дорівнює номеру групи, тобто вища її значення, називають вищими. При розгляді Періодичного закону ми вже характеризували їх склад і властивості.
посилення кислотних властивостей оксидів і шдронепдоп В межах однієї головної підгрупи, наприклад, VI групи діє наступна закономірність зміни властивостей вищих оксидів і гідроксидів.
Якщо неметалл утворює два або більше кислотних оксидів, а значить, і відповідних кисневмісних кислот, то їх кислотні властивості посилюються зі збільшенням ступеня оксіленія неметалла.
Оксиди і кислоти, в яких неметалл має вищий ступінь окислення, можуть чроявлять тільки окисні властивості.
Оксиди і кислоти, де неметалл має проміжну ступінь окислення, можуть проявляти і окисні, і відновні властивості.
практичні завдання
1. До яких електронних родин укіс елементи-неметали?
2. Які елементи-неметали є біогенними?
3. Які фактори визначають валентні можливості ато-иов неметалів? Розгляньте їх на прикладі атомів кисню і сірки.
4. Чому одні неметали при звичайних умовах - гази, інші - тверді тугоплавкі речовини? 5. Наведіть приклади простих речовин-неметалів, що існують при звичайних умовах в різному агрегатному стані: а) газоподібному, б) рідкому, в) твердому.
6. Складіть рівняння окисно-відновних реакцій за участю неметалів. Які властивість (окисні або відновлювальні) виявляють у цих реакціях неметали?

З якої причини дуже сильно розрізняються температури кипіння води і сірководню, але близькі між собою температури кипіння сіро і селеноводорода?
7. Чому метан стійкий на повітрі, а сильний на повітрі самозаймається: фтороводород стійкий до нагрівання, иодо-водень вже при слабкому нагріванні розкладається на йод і водень?
8. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі переходи:
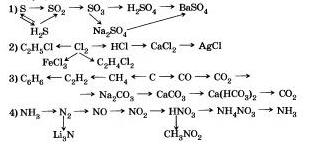
9. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі переходи:

12. Через розчин, що містить 10 г їдкого натру, пропустили 20 г сірководню. Яка сіль і в який кількості вийде?
Відповідь: 0.25 моль NaHS.
14. При обробці 30 г вапняку соляною кислотою вийшло 11 г вуглекислого газу. Яка масова частка карбонату кальцію в природному вапняку? Відповідь: 83.3%. 15. Застосовувана в медицині йодна настойкп є 51% -ним розчином кристалічного йоду в етиловому спирті. Який обсяг спирту, щільність якого 0,8 г / мл. потрібно для приготування 250 г такого розчину?
Відповідь: 297 мл. 16. Суміш кремнію, графіту і карбонату кальція.массой 34 г обробили розчином гідроксиду натрію п отримали 22.4 л газу (н. У.). При обробці такої порції суміші соляної кислотою отримали 2.24 л газу (н. У.). Визначте масовий склад суміші.
Відповідь: 14 г 81: 10 г С; 10 г СаСО2.
17. Газоподібний аміак об'ємом 2.24 л (н. У.) Поглинений 20 г розчину фосфорної кислоти з масовою часткою 49%. Яка сіль утворилася, яка її маса?
Відповідь: 11,5г
19. Який об'єм аміаку потрібно для отримання 6,3 т азотної кислоти, вважаючи втрати у виробництві рівними 5%?
Відповідь: 2352 м3.
20. З природного газу об'ємом 300 л (н. у.) з об'ємною часткою метану в газі 96% отримали ацетилен. Визначте його обсяг, якщо вихід продукту 65%.
Відповідь: 93.6 л.
21. Визначте структурну формулу вуглеводню з щільністю парів повітрям 1,862 і масовою часткою вуглецю 88,9%. Відомо, що вуглеводень взаємодіє з аміачним розчином оксиду срібла.
Роль неметалів в житті людини
Неметали в житті людини відіграють величезну роль, так як без них неможливе життя не тільки людини, а й інших живих організмів. Адже завдяки таким неметаллическим елементам, Як кисень, вуглець, водень і азот, утворюються амінокислоти, з яких потім утворюються білки, без чого не може існувати все живе на Землі.
Давайте уважно розглянемо картинку внизу, на якій представлені основні неметали:

А тепер давайте розглянемо деякі неметали більш детально і дізнаємося їх значення, яке вони грають в житті людини і в його організмі.
Повноцінне життя людини залежить від повітря, яким він дихає, а в повітрі містяться неметали і з'єднання між ними. Забезпеченням найважливіших функцій нашого організму, займається кисень, а азот і інші газоподібні речовини його розбавляють, і тим самим захищають наші дихальні шляхи. Адже, з курсу біологій вам вже відомо, що всі захисні функції організму тісно пов'язані з наявністю кисню.
Від проникнення згубного УФ випромінювання, на захист нашого організму ставати озон.
Такий необхідний мікроелемент, як сірка, в організмі людини виступає в ролі мінералу краси, так як завдяки їй, шкіра, нігті і волосся, будуть залишатися здоровими. Також, не варто забувати, що сірка бере участь у формуванні хрящової і кісткових тканин, допомагає поліпшити роботу суглобів, зміцнює нашу м'язову тканину і виконує ще багато інших функцій, які дуже важливі для здоров'я людини.
Аніони хлору також грають важливу біологічну роль для людини, так як беруть участь в активізації деяких ферментів. З їх допомогою підтримується сприятливе середовище в шлунку і підтримується осмотичний тиск. Хлор, як правило, потрапляє в організм людини, завдяки кухонної солі при прийомі їжі.
Крім важливих якостей, які неметали надають на людський організм, і інші живі організми, ці речовини застосовують і в інших різних галузях.
застосування неметалів
водень
Такий різновид неметалів, як водень, широко застосовується в хімічній промисловості. Його використовують для синтезу аміаку, метанолу, хлороводню, а також для гідрогенізації жирів. Також, не обійтися без участі водню, як відновлення і при виробництві багатьох металів і їх з'єднань.
Широко застосовується водень і в медицині. При обробці ран і для зупинки дрібних кровотеч використовують трьох відсотковий розчин перекису водню.
хлор
Для виробництва соляної кислоти, каучуку, вінілхлориду, пластмас, а також і багатьох органічних речовин, застосовують хлор. Його використовують в таких промисловостях, як текстильна і паперова, як відбілюючого кошти. На побутовому рівні, хлор незамінний для знезараження питної води, Так як, володіючи окисними властивостями, він має сильне дезінфікуючий дію. Такими ж властивостями володіють і хлорне вода, і вапно.
У медичних цілях, як правило, в якості фізрозчину, використовується хлорид натрію. На його основі виробляють багато водорозчинні ліки.
сірка
Такий неметалл, як сірка, використовують для виробництва сірчаної кислоти, пороху, сірників. Також він застосовується при вулканізації каучуку. Її застосовують у виробництві барвників і люмінофорів. А колоїдна сірка необхідна в медицині.
Сірка знайшла застосування і в сільському господарстві. Її використовують, як фунгіцид, для боротьби з різними шкідниками.
У синтезі полімерних матеріалів, а також для виготовлення різних медичних препаратів, широке застосування отримали і такі неметали, як йод і бром.
