
Дайте відповідь на питання: 1. Зі скількох атомів складається кожна молекула інертного газу? 2. Розгляньте етимологію назви «інертні гази». 3. Яке їхнє друга назва? 4. Яка з них краще підходить до інертних газів? з підручника



Використання неону Неон - найефективніший вид зовнішньої реклами. Неонова реклама та світлові короби популярні у всіх країнах світу. Скляна трубка, наповнена неоном або аргоном, вбудована в світлові короби і використовувана в поєднанні з вивіскою або з буквою робить світлову рекламу помітнішою, ефектною і ефективною.


Аллотропія- здатність деяких ХЕ утворювати кілька простих речовин, що розрізняються за будовою і властивостями. З - алмаз, графіт, фулерен. O - кисень, озон. S - ромбічна, Моноклінна, пластична. P - білий, червоний, чорний. Явище аллотропии викликається 2 причинами: 1) різним числом атомів в молекулі, наприклад кисень O2 і озон O3. 2) утворенням різних кристалічних форм, наприклад алмаз і графіт.



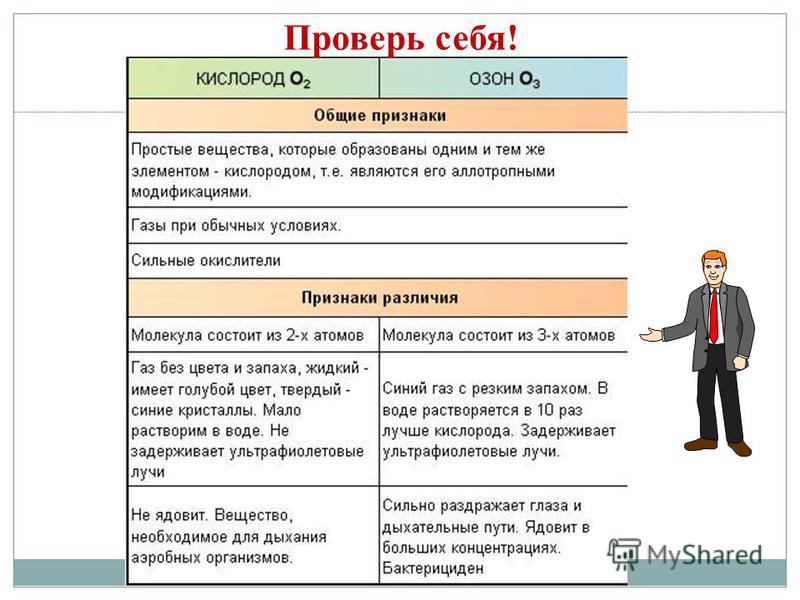






Із запропонованого переліку виберіть властивості, характерні для алмазу і графіту: 1. прозоре кристалічна речовина 2. проводить тепло і струм 3. має дуже сильний блиск 4. темно-сіре, жирне на дотик кристалічна речовина 5. саме тверде з усіх природних речовин 6. не проводить тепло і струм 7. розшаровується на лусочки 8. має металевий блиск
 Метали Неметали 1. Тверді речовини (крім ртуті Hg) 1, Тверді (сірка S, фосфор червоний і фосфор білий Р 4, йод I 2, алмаз і графіт С), газоподібні речовини (кисень О2, озон О3, азот N 2 , водень Н 2, хлор С1 2, фтор F 2, благородні гази) і рідина (бром Вг 2) 2. мають металевий блиск 2. Не мають металевого блиску (виняток становлять йод I 2, графіт С) 3. Електро-і теплопровідність 3. Більшість не проводить електричний струм (провідниками є, наприклад, кремній, графіт) 4. кування, пластичні, тягучі 4. У твердому стані тендітні Прості речовини:
Метали Неметали 1. Тверді речовини (крім ртуті Hg) 1, Тверді (сірка S, фосфор червоний і фосфор білий Р 4, йод I 2, алмаз і графіт С), газоподібні речовини (кисень О2, озон О3, азот N 2 , водень Н 2, хлор С1 2, фтор F 2, благородні гази) і рідина (бром Вг 2) 2. мають металевий блиск 2. Не мають металевого блиску (виняток становлять йод I 2, графіт С) 3. Електро-і теплопровідність 3. Більшість не проводить електричний струм (провідниками є, наприклад, кремній, графіт) 4. кування, пластичні, тягучі 4. У твердому стані тендітні Прості речовини:
![]()
Дайте відповідь на питання Що таке аллотропия? Дайте визначення аллотропних модифікацій. Чим викликано явище аллотропии? У чому одна з причин різноманіття речовин? Чому хімічно невірно поетичне вираження: «В повітрі пахло грозою»? Чому розподіл на метали і неметали щодо? Чому розподіл на метали і неметали щодо?


Хімічні елементи - неметали
Хімічних елементів-неметалів всього 16, але два з них, кисень і кремній складають 76% від маси земної кори. Неметали складають 98,5% від маси рослин і 97,6% від маси людини. З вуглецю, водню, кисню, сірки, фосфору й азоту складаються всі найважливіші органічні речовини, вони є елементами життя. Водень і гелій - основні елементи Всесвіту з них складаються всі космічні об'єкти, включаючи наше Сонце. Без з'єднань неметалів неможливо уявити наше життя, особливо якщо згадати, що життєво важливе хімічне з'єднання - вода - складається з водню і кисню.
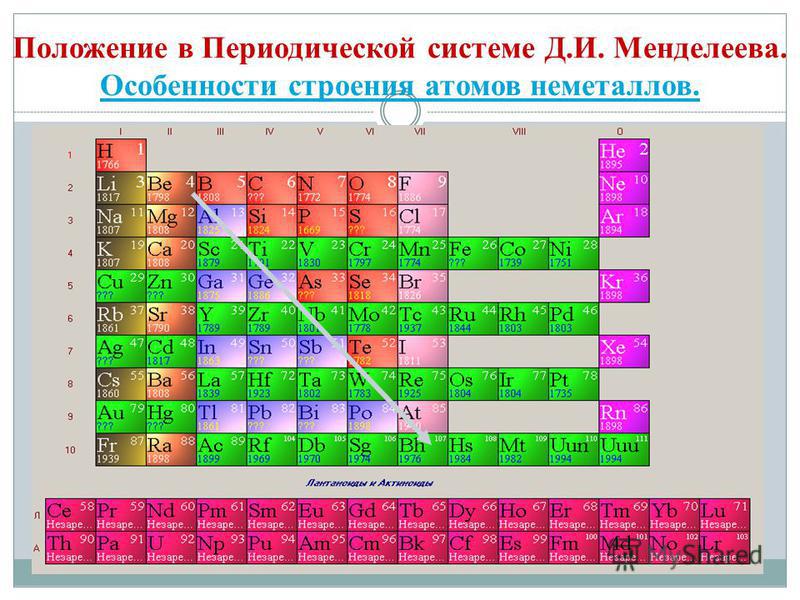
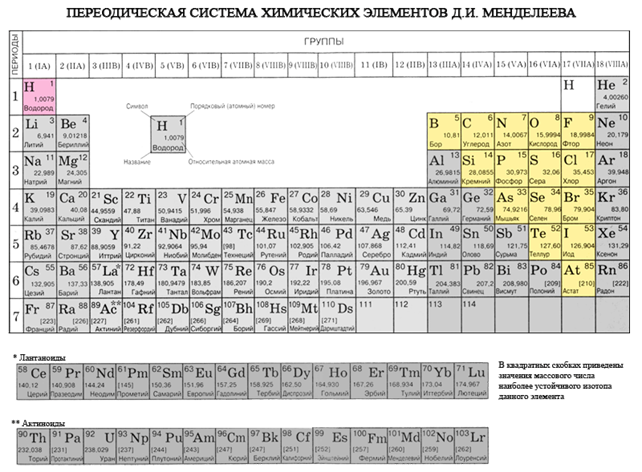
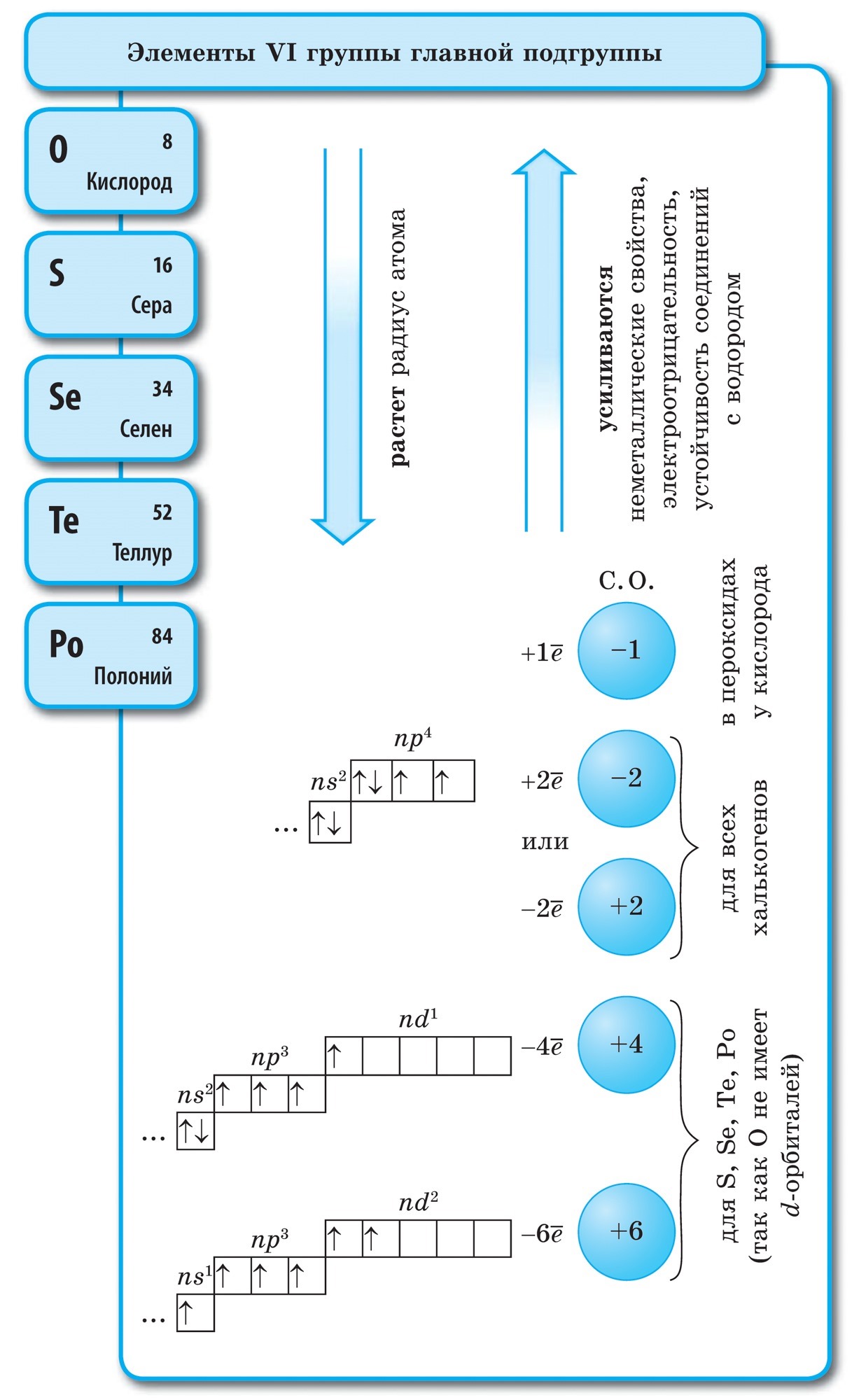
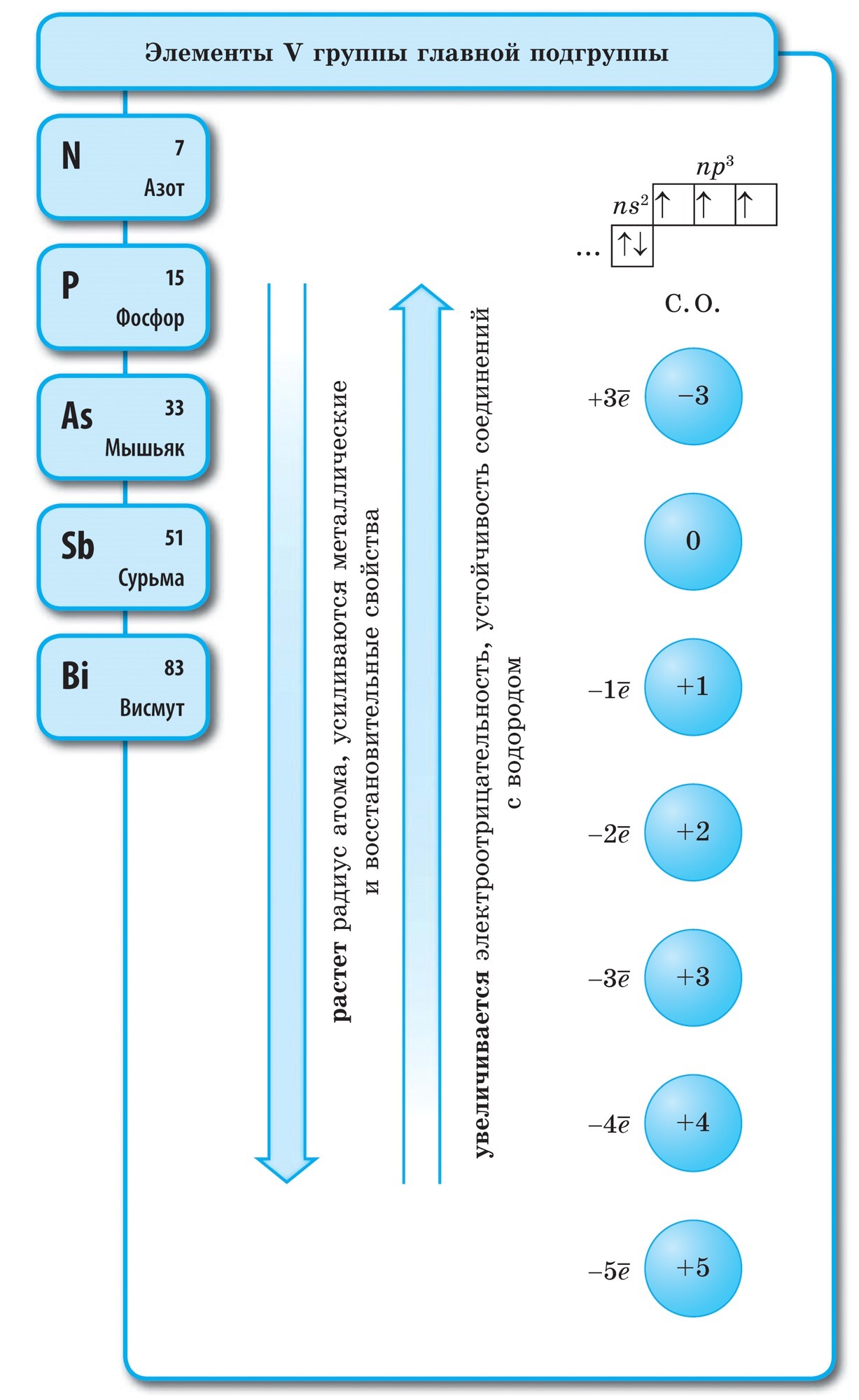
Якщо в Періодичній системі провести діагональ від берилію до астату, то справа вгору по діагоналі будуть знаходитися елементи-неметали, а зліва знизу - метали, до них же відносяться елементи всіх побічних підгруп, лантаноїди і актиноїди. Елементи, розташовані поблизу діагоналі, наприклад, берилій, алюміній, титан, германій, сурма, мають двоїстим характером і відносяться до Металоїди. Елементи-неметали: s-елемент - водень; р-елементи 13 групи - бор; 14 групи - вуглець і кремній; 15 групи - азот, фосфор і миш'як, 16 групи - кисень, сірка, селен і телур і все елементи 17 групи - фтор, хлор, бром, йод і астат. Елементи 18 групи - інертні гази, Займають особливе становище, вони мають повністю завершений зовнішній електронний шар і займають проміжне положення між металами і неметалами. Їх іноді відносять до неметалів, але формально, за фізичними ознаками.
Неметали - це хімічні елементи, Атоми яких беруть електрони для завершення зовнішнього енергетичного рівня, утворюючи при цьому негативно заряджені іони.
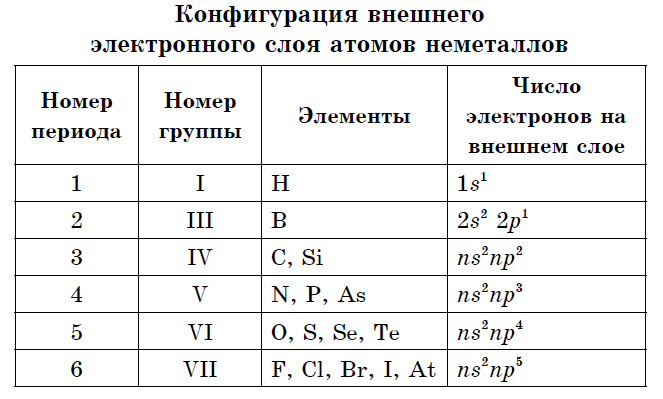
На зовнішньому електронному шарі атомів неметалів знаходиться від трьох до восьми електронів.
Практично всі неметали мають порівняно малі радіуси і велике число електронів на зовнішньому енергетичному рівні від 4 до 7, для них характерні високі значення електронегативності і окисні властивості. Тому в порівнянні з атомами металів неметаллам характерні:
· Менший атомний радіус;
· Чотири і більше електрона на зовнішньому енергетичному рівні;
Звідси і такий важливий властивість атомів неметалів - тенденція до прийому відсутніх до 8 електронів, тобто окисні властивості. Якісною характеристикою атомів неметалів, тобто своєрідною мірою їх неметаллічності, може служити електронний торгівельний, тобто властивість атомів хімічних елементів поляризувати хімічний зв'язок, відтягувати до себе загальні електронні пари;
Найпершою науковою класифікацією хімічних елементів був поділ їх на метали і неметали. Ця класифікація не втратила своєї значущості і в даний час. Неметали - це хімічні елементи, для атомів яких характерна здатність приймати електрони до завершення зовнішнього шару завдяки наявності, як правило, на зовнішньому електронному шарі чотирьох і більше електронів і малому радіусу атомів у порівнянні з атомами металів.
Це визначення залишає осторонь елементи VIII групи головної підгрупи - інертні, або благородні, гази, атоми яких мають завершений зовнішній електронний шар. Електронна конфігурація атомів цих елементів така, що їх не можна віднести ні до металів, ні до неметалів. Вони є тими об'єктами, які поділяють елементи на метали і неметали, займаючи між ними прикордонне положення. Інертні, або благородні, гази ( «благородство» виражається в інертності) іноді відносять до неметалів, але лише формально, за фізичними ознаками. Ці речовини зберігають газоподібний стан аж до дуже низьких температур. Так, гелій Чи не переходить в рідкий стан при t ° \u003d -268,9 ° С.
Інертність в хімічному відношенні у цих елементів відносна. Для ксенону і криптону відомі сполуки з фтором і киснем: KrF 2, XeF 2, XeF 4 і ін. Безсумнівно, в освіті цих з'єднань інертні гази виступали в ролі відновників. З визначення неметалів слід, що для їх атомів характерні високі значення електронегативності. Вона змінюється в межах від 2 до 4. Неметали - це елементи головних підгруп, переважно p-елементи, виняток становить водень - s-елемент.
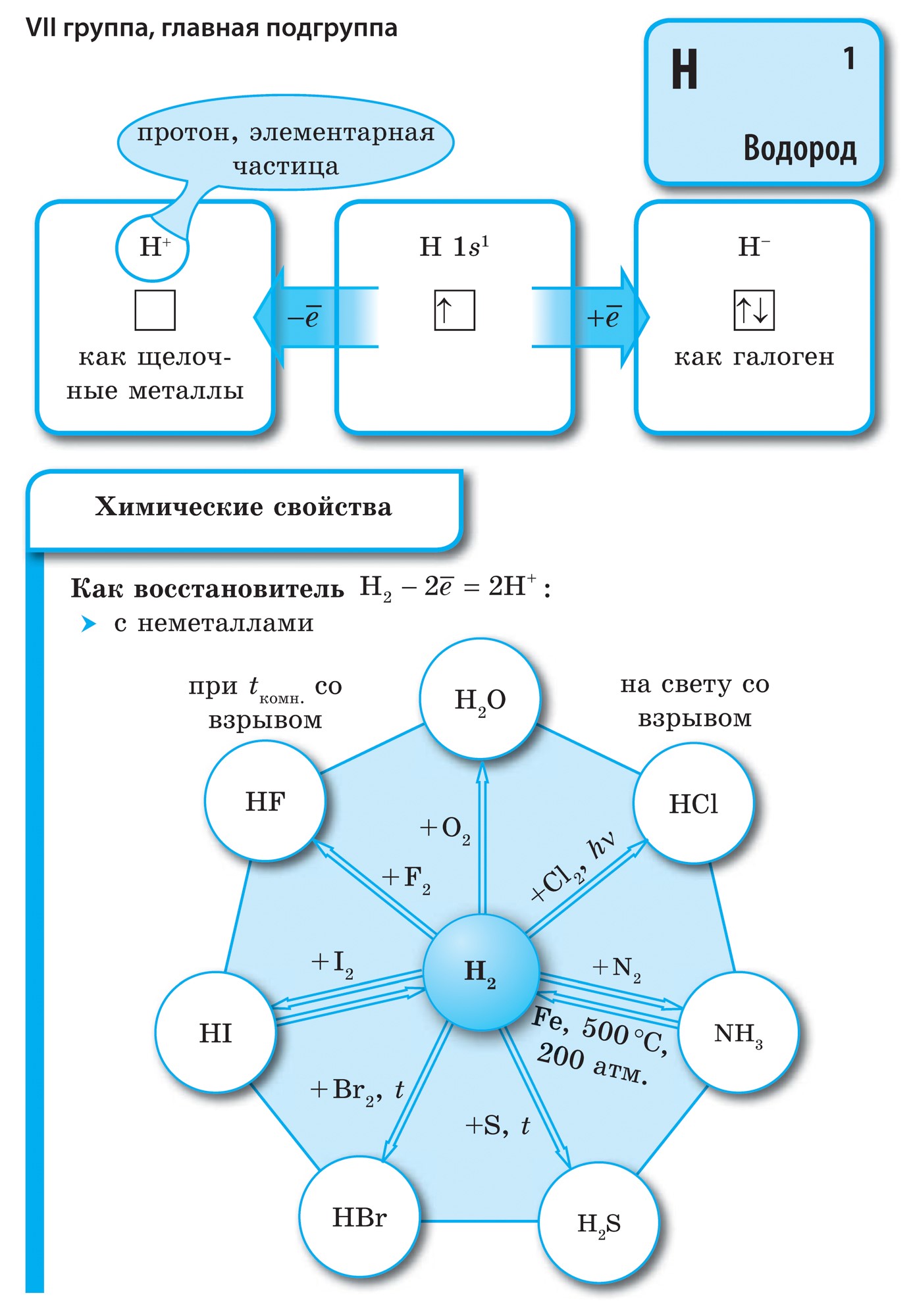
Всі елементи-неметали (крім водню) займають в Періодичній системі хімічних елементів Д. І. Менделєєва верхній правий кут, утворюючи трикутник, вершиною якого є фтор F, а підставою - діагональ B - At. Однак слід особливо зупинитися на неоднозначному становищі водню в періодичної системи: в головних підгрупах I і VII груп. Це не випадково. З одного боку, атом водню подібно атомам лужних металів має на зовнішньому (і єдиному для нього) електронному шарі один електрон (електронна конфігурація 1s 1), який він здатний віддавати, проявляючи властивості відновника.
У більшості своїх з'єднань водень, як і лужні метали, проявляє ступінь окислення +1. Але віддача електрона атомом водню відбувається важче, ніж у атомів лужних металів. З іншого боку, атому водню, як і атомам галогенів, для завершення зовнішнього електронного шару бракує одного електрона, тому атом водню може приймати один електрон, проявляючи властивості окислювача і характерну для галогену ступінь окислення -1 в гидридах (з'єднаннях з металами, подібних з'єднань металів з галогенами - галогенидам). Але приєднання одного електрона до атома водню відбувається важче, ніж у галогенів.
при звичайних умовах водень Н 2 - газ. Його молекула, подібно галогенам, двоатомний. У атомів неметалів переважають окисні властивості, т. Е. Здатність приєднувати електрони. Цю здатність характеризує значення електронегативності, яка закономірно змінюється в періодах і підгрупах. Фтор - найсильніший окислювач, його атоми в хімічних реакціях не здатні віддавати електрони, т. Е. Виявляти відновні властивості. Інші неметали можуть проявляти відновні властивості, хоча і в значно більш слабкому ступені в порівнянні з металами; в періодах і підгрупах їх відновна здатність змінюється в зворотному порядку в порівнянні з окислювальним.
- Елементи-неметали розташовані в головних підгрупах III-VIII груп ПС Д.І. Менделєєва, займаючи її верхній правий кут.
- На зовнішньому електронному шарі атомів елементів-неметалів знаходяться від 3 до 8 електронів.
- Неметалічні властивості елементів посилюються в періодах і слабшають в підгрупах зі збільшенням порядкового номера елемента.
- Вищі кисневі сполуки неметалів мають кислотний характер (кислотні оксиди і гідроксиди).
- Атоми елементів-неметалів здатні як приймати електрони, проявляючи окисні функції, так і віддавати їх, виявляючи відновні функції.
Будова і фізичні властивості неметалів
У простих речовинах атоми неметалів пов'язані ковалентного неполярной зв'язком. Завдяки цьому формується більш стійка електронна система, ніж у ізольованих атомів. При цьому утворюються одинарні (наприклад, в молекулах водню Н 2, галогенів F 2, Br 2, I 2), подвійні (наприклад, в молекулах сірки S 2), потрійні (наприклад, в молекулах азоту N 2) ковалентні зв'язки.
- гнучкість відсутня
- блиску немає
- Теплопровідність (тільки графіт)
- Колір різноманітний: жовтий, жовтувато-зелений, червоно-бурий.
- Електропровідність (тільки графіт і чорний Фосфор.)
Агрегатний стан:
- рідина - Br 2;
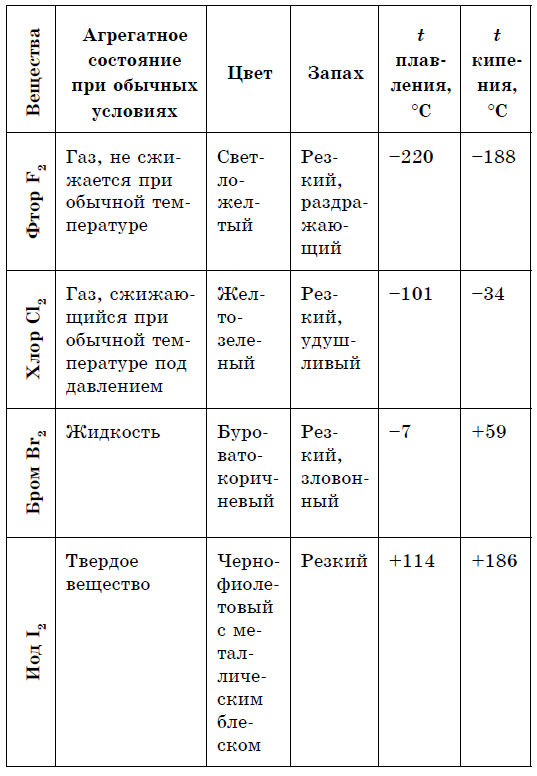
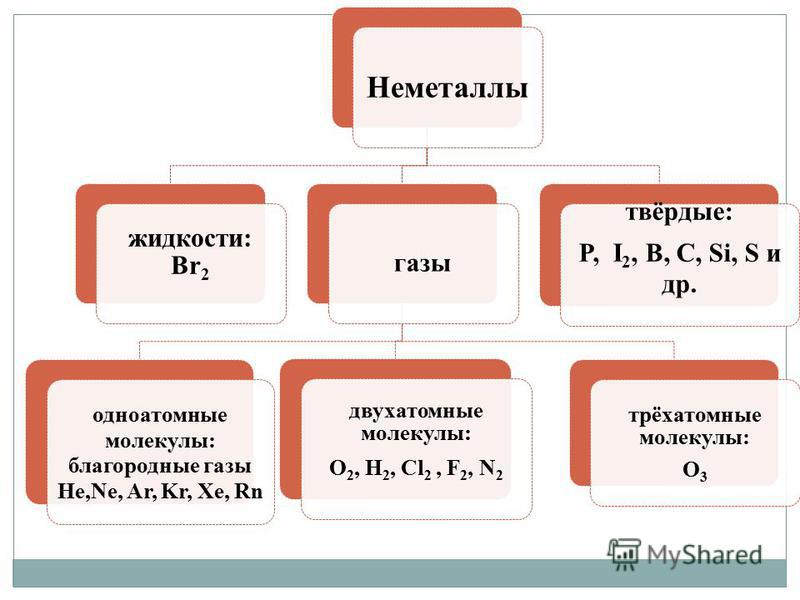
На відміну від металів неметали - прості речовини, Характеризуються великою різноманітністю властивостей. Неметали мають різне агрегатний стан при звичайних умовах:
- гази - H 2, O 2, O 3, N 2, F 2, Cl 2;
- рідина - Br 2;
- тверді речовини - модифікації сірки, фосфору, кремнію, вуглецю і ін.
Набагато багатше у неметалів і спектр кольорів: червоний - у фосфору, червоно-бурий - у брому, жовтий - у сірки, жовто-зелений - у хлору, фіолетовий - у пари йоду. Елементи - неметали більш здатні, в порівнянні з металами, до аллотропии.
Здатність атомів одного хімічного елемента утворювати кілька простих речовин називається аллотропией, а ці прості речовини - алотропна видозмінами
Прості речовини - неметали можуть мати:
1. Молекулярну будову. При звичайних умовах більшість таких речовин є гази (H 2, N 2, O 2, F 2, Cl 2, O 3) або тверді речовини (I 2, P 4, S 8), і лише один-єдиний бром (Br 2) є рідиною. Всі ці речовини мають молекулярну будову, тому летючі. У твердому стані вони легкоплавкі через слабке міжмолекулярної взаємодії, який утримує їх молекули в кристалі, і здатні до сублімації.
2. Атомну будову.Ці речовини утворені довгими ланцюгами атомів (C n, B n, Si n, Se n, Te n). Через великий міцності ковалентних зв'язків вони, як правило, мають високу твердість, і будь-які зміни, пов'язані з руйнуванням ковалентного зв'язку в їх кристалах (плавлення, випаровування), здійснюються з великою витратою енергії. Багато такі речовини мають високі температури плавлення і кипіння, а летючість дуже мала.
Багато елементів-неметали утворюють кілька простих речовин - аллотропних модифікацій. Це властивість атомів називають аллотропией. Аллотропия може бути пов'язана і з різним складом молекул (O 2, О 3), і з різною будовою кристалів. Алотропна модифікаціями вуглецю є графіт, алмаз, карбін, фулерен. Щоб виявити властивості, характерні для всіх неметалів, треба обртіть увагу на їх розташування в періодичній системі елементів і визначити конфігурацію зовнішнього електронного шару.
У періоді:
- заряд ядра збільшується;
- радіус атома зменшується;
- число електронів зовнішнього шару збільшується;
- електронний торгівельний збільшується;
- окисні властивості посилюються;
- неметалічні властивості посилюються.
У головній підгрупі:
- заряд ядра збільшується;
- радіус атома збільшується;
- число електронів на зовнішньому шарі не змінюється;
- електронегативність зменшується;
- окисні властивості слабшають;
- неметалічні властивості слабшають.
Для більшості металів, за рідкісним винятком (золото, мідь і деякі інші), характерна сріблясто-біле забарвлення. А ось у простих речовин - неметалів гамма кольорів значно різноманітніші: P, Se - жовті; B - коричневий; O 2 (ж) - блакитний; Si, As (мет) - сірі; Р 4 - блідо-жовтий; I - фіолетово-чорний з металевим блиском; Вr 2 (ж) - бура рідина; С1 2 (г) - жовто-зелений; F 2 (r) - блідо-зелений; S 8 (тв) - жовта. Кристали неметалів непластичною, і будь-яка деформація викликає руйнування ковалентних зв'язків. Більшість неметалів не мають металевого блиску.

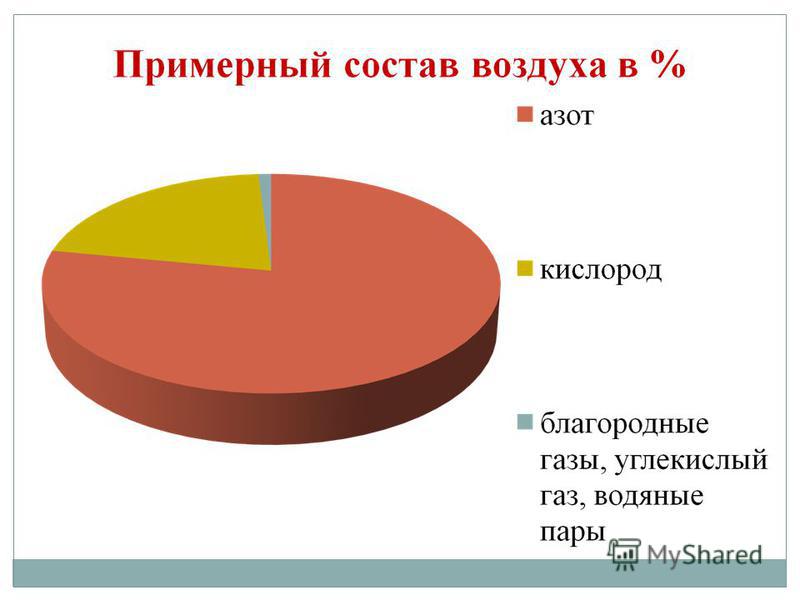
Хімічних елементів-неметалів всього 16! Зовсім небагато, якщо врахувати, що відомо 114 елементів. Два елементи-неметали складають 76% маси земної кори. Це кисень (49%) і кремній (27%). В атмосфері міститься 0,03% маси кисню в земній корі. Неметали становлять 98,5% маси рослин, 97,6% маси тіла людини. Неметали C, H, O, N, S - біогенні елементи, які утворюють найважливіші органічні речовини живої клітини: білки, жири, вуглеводи, нуклеїнові кислоти. До складу повітря, яким ми дихаємо, входять прості і складні речовини, Також утворені елементами-неметалами (кисень O 2, азот N 2, вуглекислий газ СО 2, водяні пари Н 2 O і ін.)
Окисні властивості простих речовин - неметалів
Для атомів неметалів, а отже, і для освічених ними простих речовин характерні як окислювальні, так і відновлювальні властивості.
1. Окисні властивості неметалів проявляються в першу чергу при їх взаємодії з металами (Метали завжди відновники):

Окисні властивості хлору Cl 2 виражені сильніше, ніж у сірки, тому і метал Fe, який має в з'єднаннях стійкі ступені окислення +2 і +3, окислюється їм до більш високого ступеня окислення.
1. Більшість неметалів проявляють окисні властивості при взаємодії з воднем. В результаті утворюються летючі водневі сполуки.
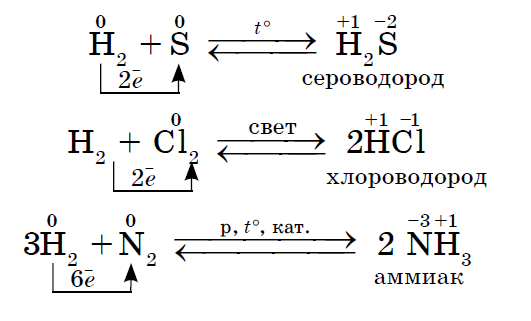
2. Будь-який неметалл виступає в ролі окислювача в реакціях з тими неметаллами, які мають більш низьке значення електронегативності:
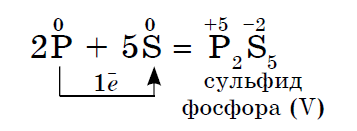
Електронегативність сірки більше, ніж у фосфору, тому вона тут виявляє окисні властивості.
Електронегативність фтору більше, ніж у всіх інших хімічних елементів, тому він проявляє властивості окислювача. Фтор F 2 - найсильніший окислювач з неметалів, проявляє в реакціях тільки окисні властивості.
3. Окисні властивості неметали виявляють і в реакціях з деякими складними речовинами.
Відзначимо в першу чергу окисні властивості неметалла кисню в реакціях зі складними речовинами:
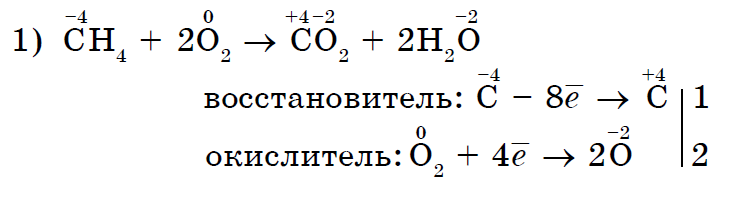
Не тільки кисень, але і інші неметали також можуть бути окислювачами в реакціях зі складними речовинами- неорганічними (1, 2) і органічними (3, 4):
Сильний окислювач хлор Cl 2 окисляє хлорид заліза (II) в хлорид заліза (III);
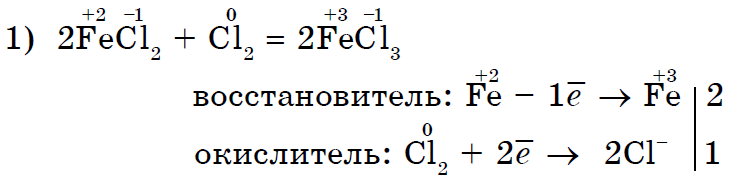
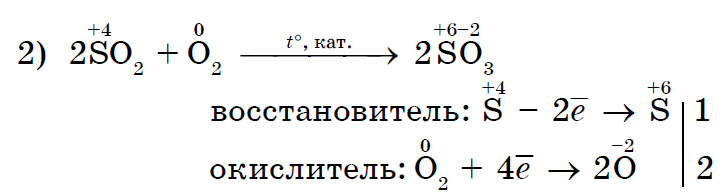
Хлор Cl 2 як більш сильний окислювач витісняє йод I 2 у вільному вигляді з розчину йодиду калію;
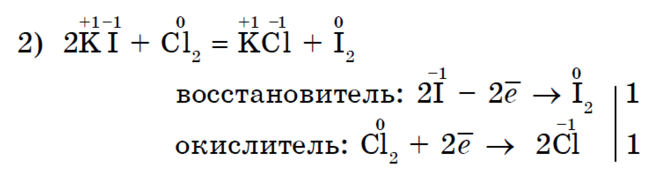
Галогенування метану - характерна реакція для алканів;
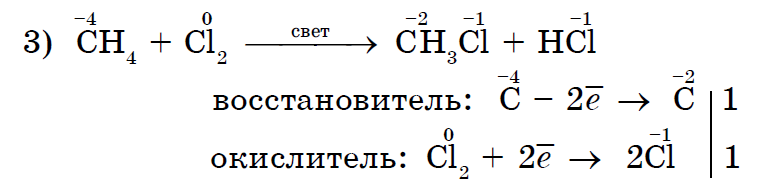
Якісною реакцією на ненасичені сполуки є знебарвлення ними бромної води.
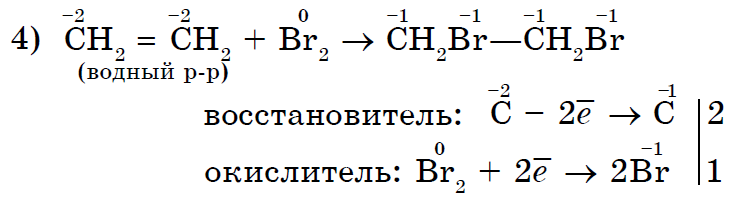
Відновні властивості простих речовин - неметалів
при розгляді реакцій неметалів один з одним, Що в залежності від значення їх електронегативності один з них проявляє властивості окислювача, а інший - властивості відновника.
1. По відношенню до фтору все неметали (навіть кисень) виявляють відновні властивості.
2. Зрозуміло, неметали, крім фтору, служать восстановителями при взаємодії з киснем.

В результаті реакцій утворюються оксиди неметалів: Несолеобразующіе і солеобразующіе кислотні. І хоча галогени безпосередньо з киснем не зливаються, відомі їх оксиди: Cl 2 +1 O -2, Cl 2 +4 O 2 -2, Cl 2 +7 O 7 -2, Br 2 +1 O -2, Br +4 O 2 -2, I 2 +5 O 5 -2, і ін., які отримують непрямим шляхом.
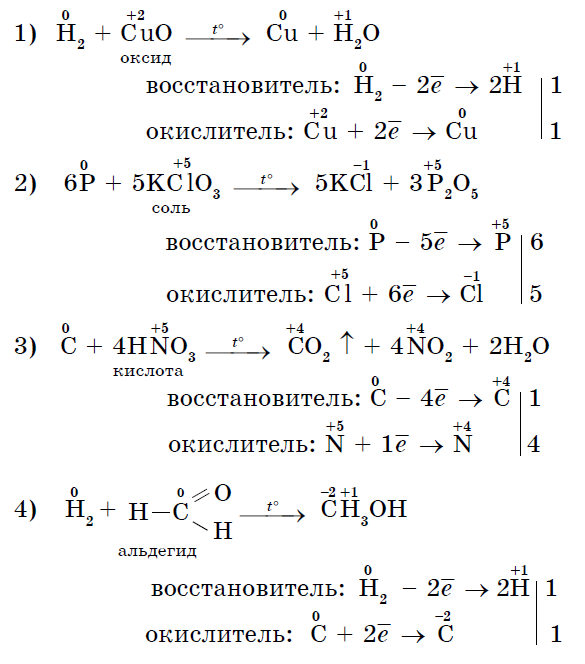
3. Багато неметали можуть виступати в ролі відновника в реакціях зі складними речовинами - окислювачами:
Існують і такі реакції, в яких один і той же неметалл є одночасно і окислювачем, і відновником. Це реакції самоокисления-самовідновлення (диспропорционирования):
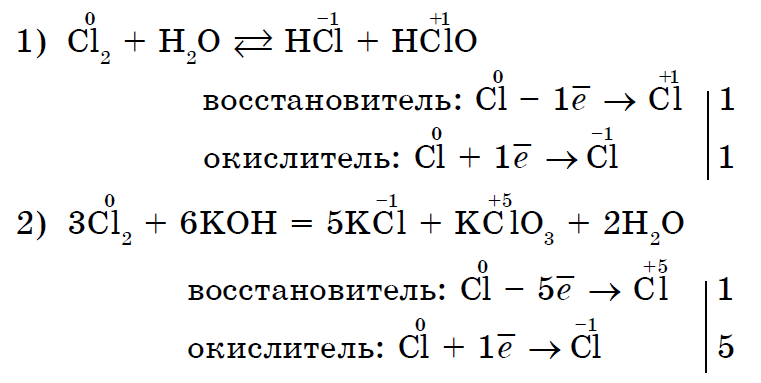
Таким чином, більшість неметалів можуть виступати в хімічних реакціях як в ролі окислювача, так і в ролі відновника (відновлювальні властивості не притаманні тільки фтору F 2).
Водневі сполуки неметалів
На відміну від металів неметали утворюють газоподібні водневі сполуки. Їх склад залежить від ступеня окислення неметалів.
RH 4 → RH 3 → H 2 R → HR
Загальною властивістю всіх неметалів є утворення летких водневих з'єднань, В більшості яких неметалл має нижчу ступінь окислення. Серед наведених формул речовин багато тих, властивості, застосування і отримання яких ви вивчали раніше: CH 4, NH 3, H 2 O, H 2 S, HCl.
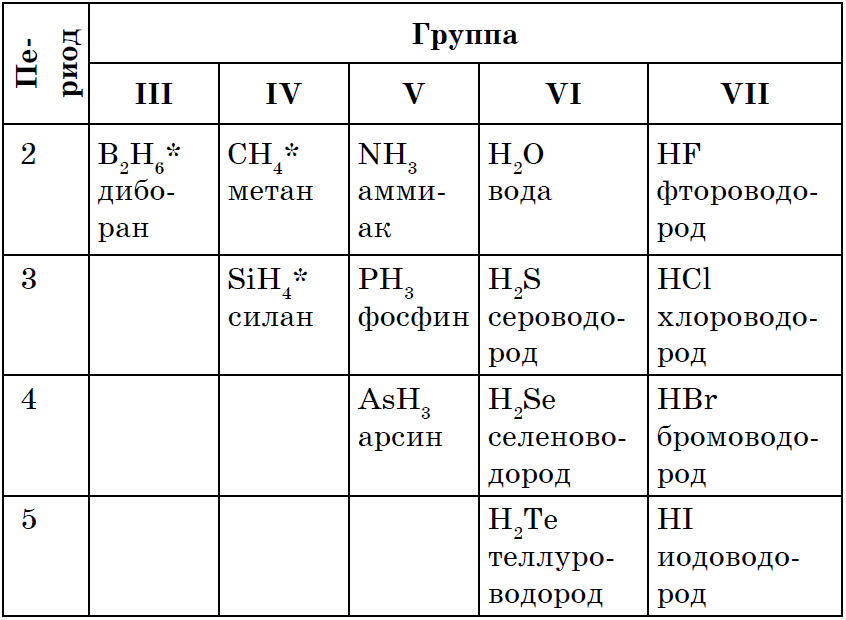
Відомо, що найбільш просто ці сполуки можна отримати безпосередньо взаємодією неметалла з воднем, Тобто синтезом:
![]()
Все водневі сполуки неметалів утворені ковалентними полярними зв'язками, мають молекулярну будову і при звичайних умовах є газами, крім води (рідина). Для водневих з'єднань неметалів характерно різне ставлення до води. Метан і силан в ній практично нерозчинні. Аміак при розчиненні у воді утворює слабка основа NH 3 H 2 O. При розчиненні в воді сірководню, селеноводорода, теллуроводорода, а також галогеноводородов утворюються кислоти з тією ж формулою, що і самі водневі сполуки: H 2 S, H 2 Se, H 2 Te, HF, HCl, HBr, HI.
Якщо порівняти кислотно-основні властивості водневих з'єднань, утворених неметаллами одного періоду, наприклад, другого (NH 3, H 2 O, HF) або третього (PH 3, H 2 S, HCl), то можна зробити висновок про закономірний посилення їх кислотних властивостей і, відповідно, ослабленні основних. Це, очевидно, пов'язано з тим, що збільшується полярність зв'язку Е-Н (Де Е - неметалл).
Кислотно-основні властивості водневих з'єднань неметалів однієї підгрупи також відрізняються. Наприклад, в ряду галогеноводородов HF, HCl, HBr, HI міцність зв'язку Е-Н зменшується, т. К. Збільшується довжина зв'язку. У розчинах HCl, HBr, HI диссоциируют практично повністю - це сильні кислоти, причому їх сила збільшується від HF до HI. При цьому HF відноситься до слабких кислот, що обумовлено ще одним фактором - міжмолекулярним взаємодією, утворенням водневих зв'язків ... HF ... HF .... Атоми водню пов'язані з атомами фтору F не тільки своєю молекули, але ще і сусідній.
Узагальнюючи порівняльну характеристику кислотно-основних властивостей водневих з'єднань неметалів, зробимо висновок про посилення кислотних і ослабленні основних властивостей цих речовин за періодами і головним підгрупах зі збільшенням атомних номерів утворюють їх елементів.
За періодом в ПС хімічних елементів зі збільшенням порядкового номера елемента - неметалла посилюється кислотний характер водневого з'єднання.
SiH 4 → PH 3 → H 2 S → HCl
Крім розглянутих властивостей, водневі сполуки неметалів в окисно-відновних реакціях завжди проявляють властивості відновників, адже в них неметалл має нижчу ступінь окислення.
водень
водень - головний елемент Всесвіту. Багато космічні об'єкти (газові хмари, зірки, в тому числі і Сонце) більш ніж наполовину складаються з водню. На Землі його, включаючи атмосферу, гідросферу і літосферу, тільки 0,88%. Але це по масі, а атомна маса водню дуже мала. Тому невеликий вміст його тільки здається, і з кожних 100 атомів на Землі 17 - атоми водню.
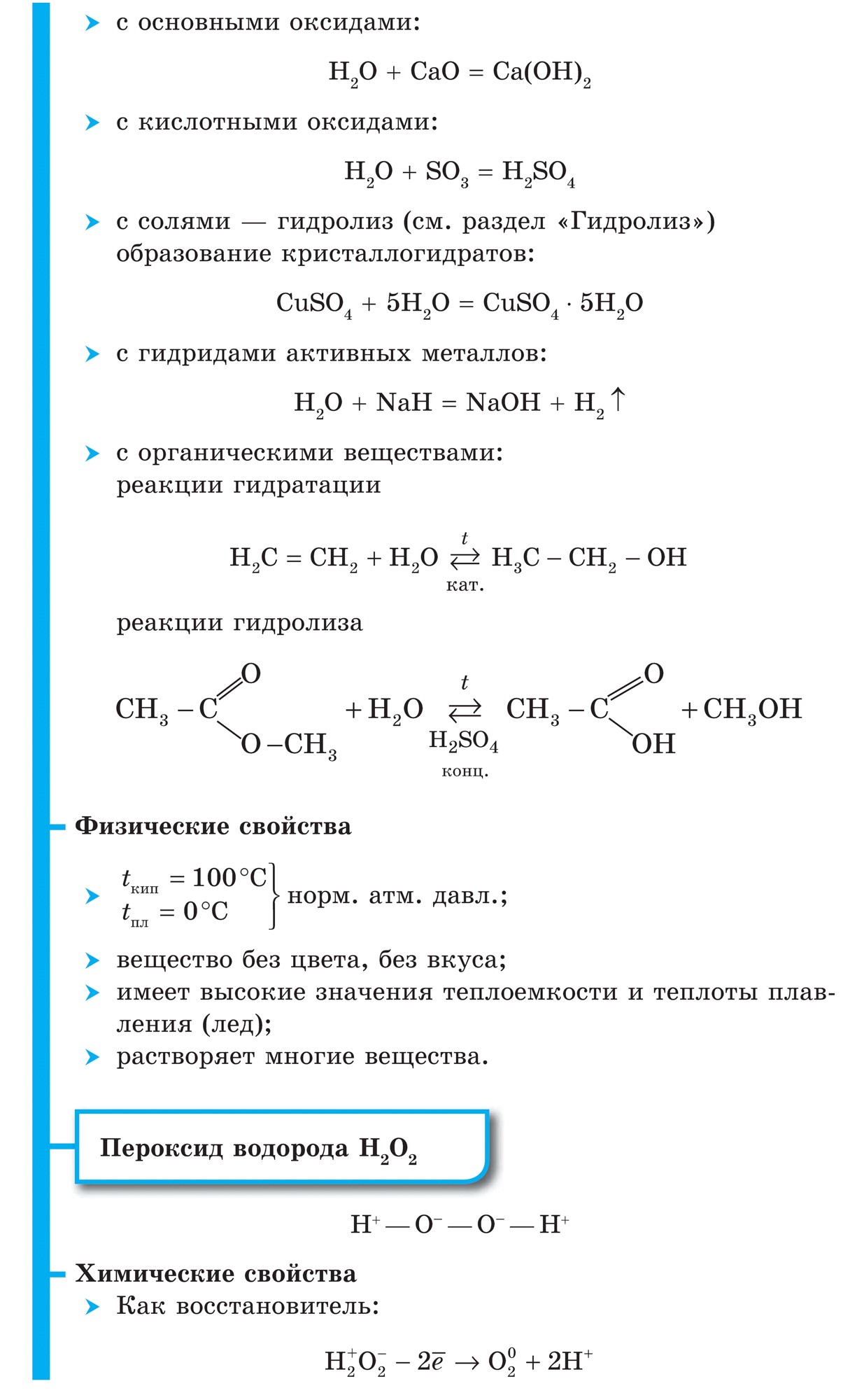
У вільному стані водень існує у вигляді молекул H 2, атоми пов'язані в молекулу ковалентного неполярной зв'язком.
Водень (H 2) - найлегший газ з усіх газоподібних речовин. Має найвищу теплопровідність і найнижчу температуру кипіння (після гелію). Малорастворим в воді. При температурі -252,8 ° С і атмосферному тиску водень переходить в рідкий стан.
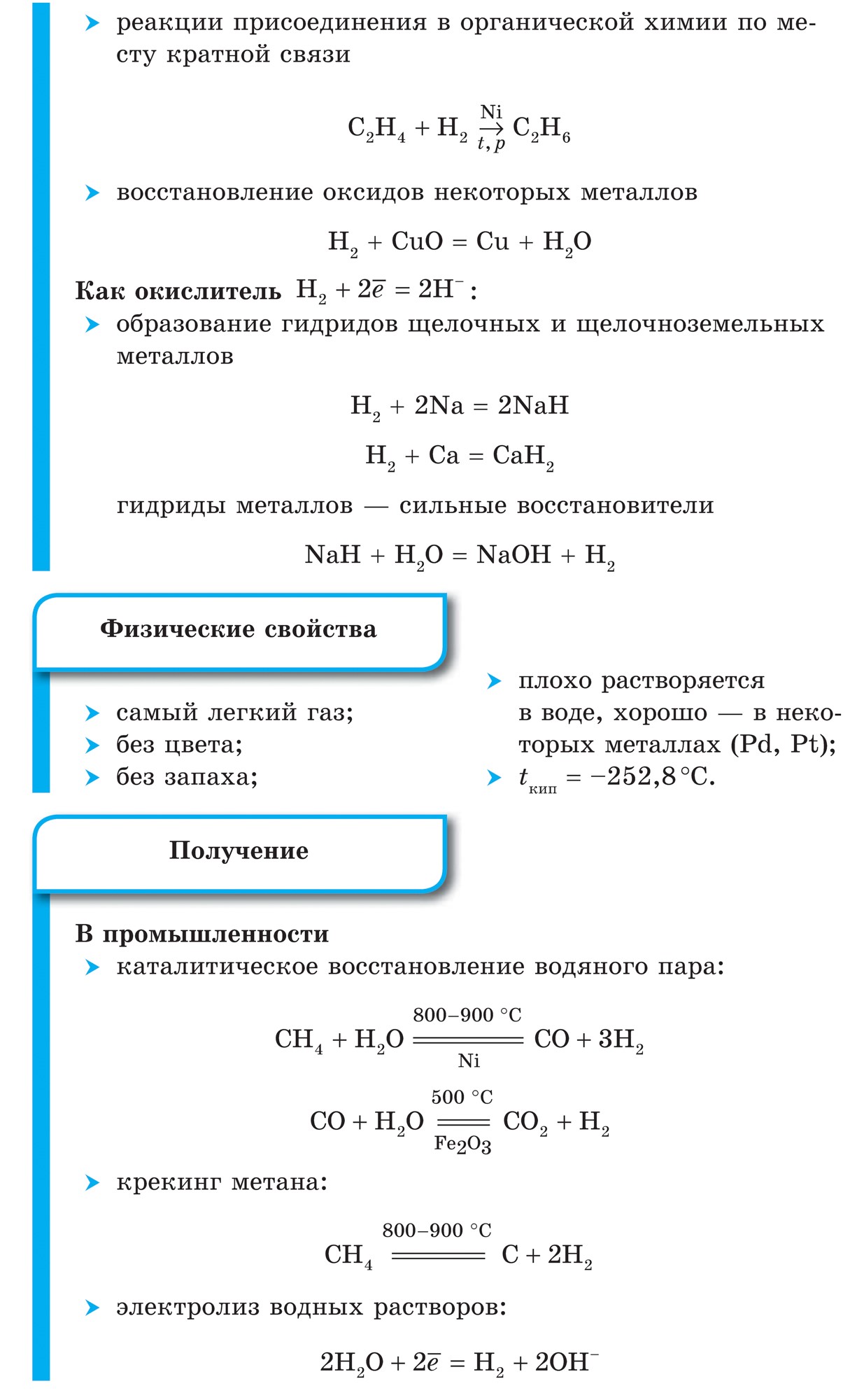
1. Молекула водню дуже міцна, що робить її малоактивною:
H 2 \u003d 2H - 432 кДж
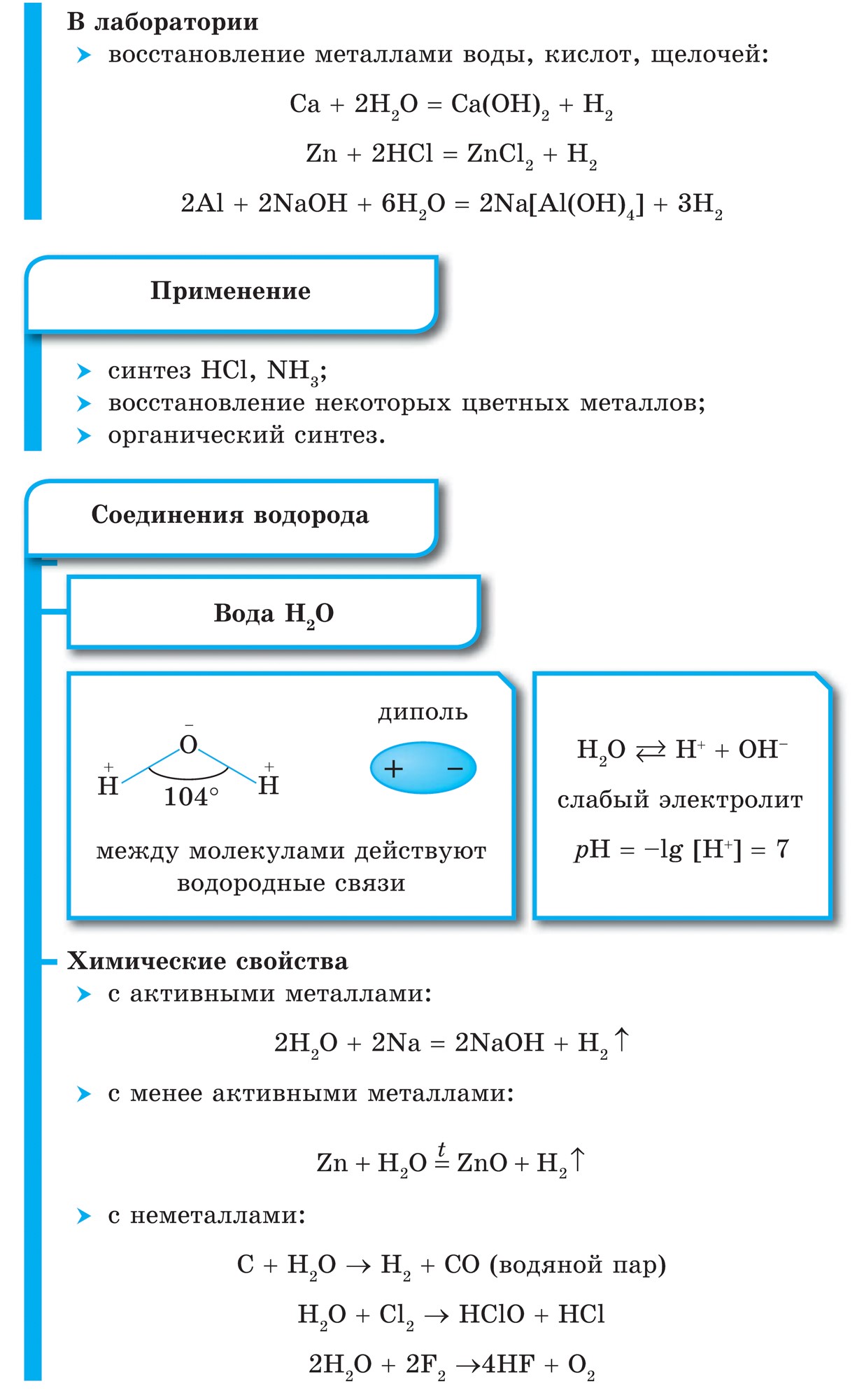
2. При звичайних температурах водень вступає в реакцію з активними металами:
Ca + H 2 \u003d CaH 2,
утворюючи гідрид кальцію, і з F 2, утворюючи фтороводород:
F 2 + H 2 \u003d 2HF
3. При високих температурах отримують аміак:
N 2 + 3H 2 \u003d 2NH 3
і гідрид титану (метал в порошку):
Ti + H 2 \u003d TiH 2
4. При підпалюванні водень реагує з киснем:
2H 2 + O 2 \u003d 2H 2 O + 484 кДж
5. Водень володіє відновлювальною здатністю:
CuO + H 2 \u003d Cu + H 2 O

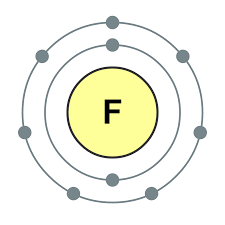
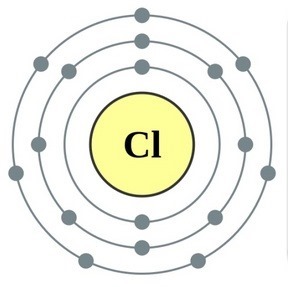
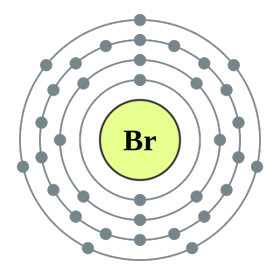
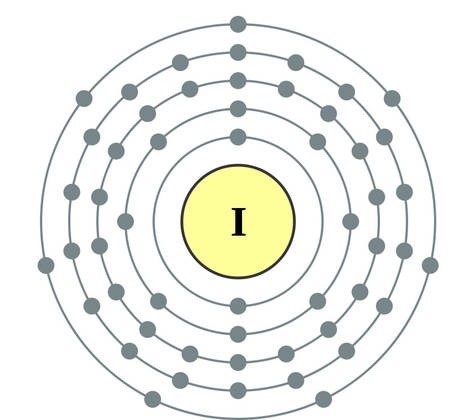
Елементи головної підгрупи VII групи періодичної системи, об'єднані під загальною назвою галогени, Фтор (F), хлор (Cl), бром (БГ), йод (I), астат (At) (рідко зустрічається в природі) - типові неметали. Це і зрозуміло, адже їх атоми містять на зовнішньому енергетичному рівні сім електронів, І їм бракує лише одного електрона, щоб завершити його. Атоми цих елементів при взаємодії з металами приймають електрон від атомів металів. При цьому виникає іонний зв'язок і утворюються солі. Звідси загальна назва «галогени», т. Е. «Народжують солі».
дуже сильні окислювачі. Фтор в хімічних реакціях виявляє тільки окисні властивості, і для нього характерна ступінь окислення -1. Решта галогени можуть проявляти і відновні властивості при взаємодії з більш електронегативними елементами - фтором, киснем, азотом, при цьому ступеня їх окислення можуть набувати значень +1, +3, +5, +7. Відновлювальні властивості галогенів посилюються від хлору до йоду, що пов'язано з ростом радіусів їх атомів: атомів хлору приблизно вдвічі менше, ніж у йоду.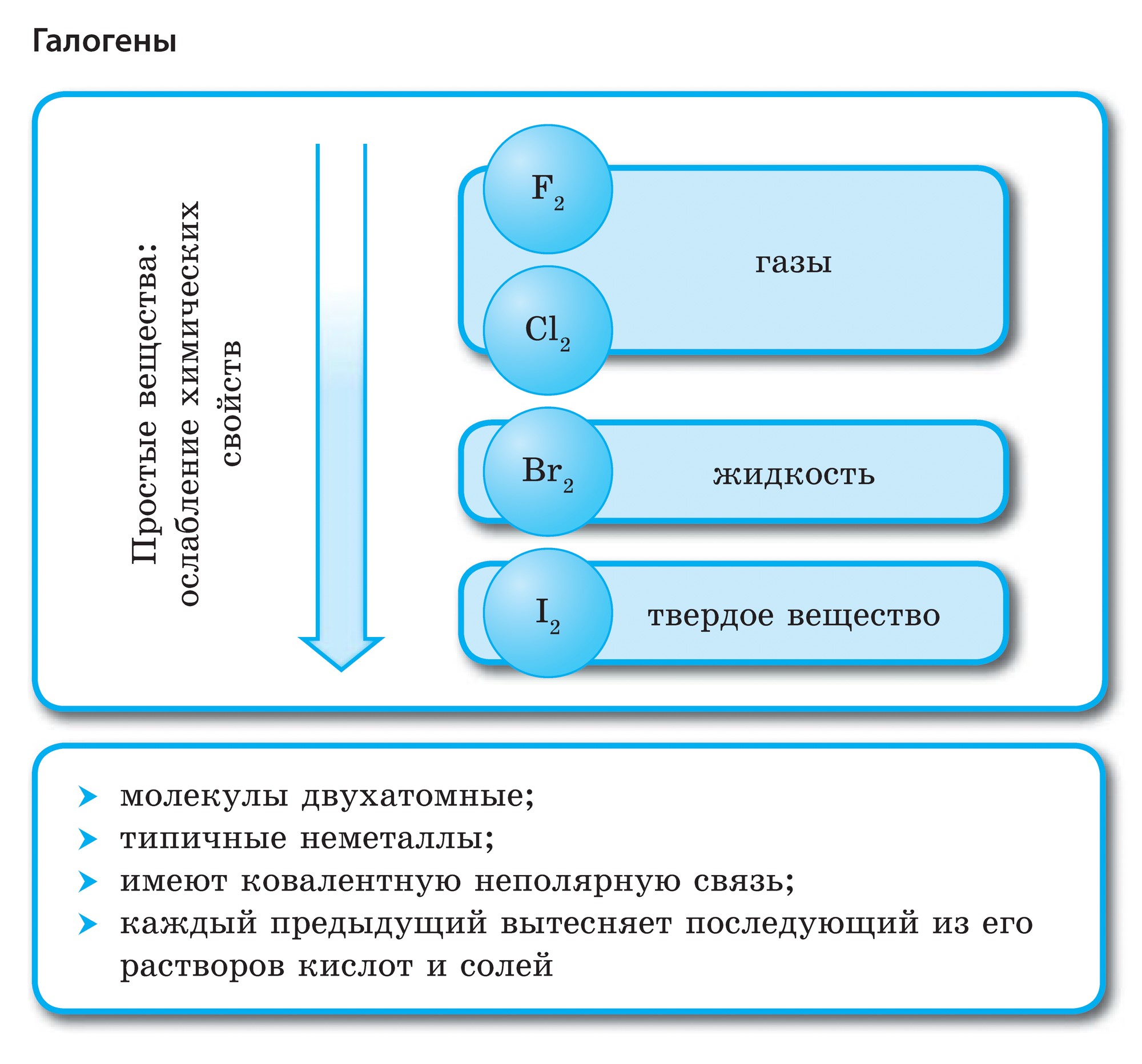
Галогени - прості речовини
Всі галогени існують у вільному стані у вигляді двохатомних молекул з ковалентним неполярной хімічним зв'язком між атомами. У твердому стані F 2, Cl 2, Br 2, I 2 мають молекулярні кристалічні решітки, Що і підтверджується їх фізичними властивостями.
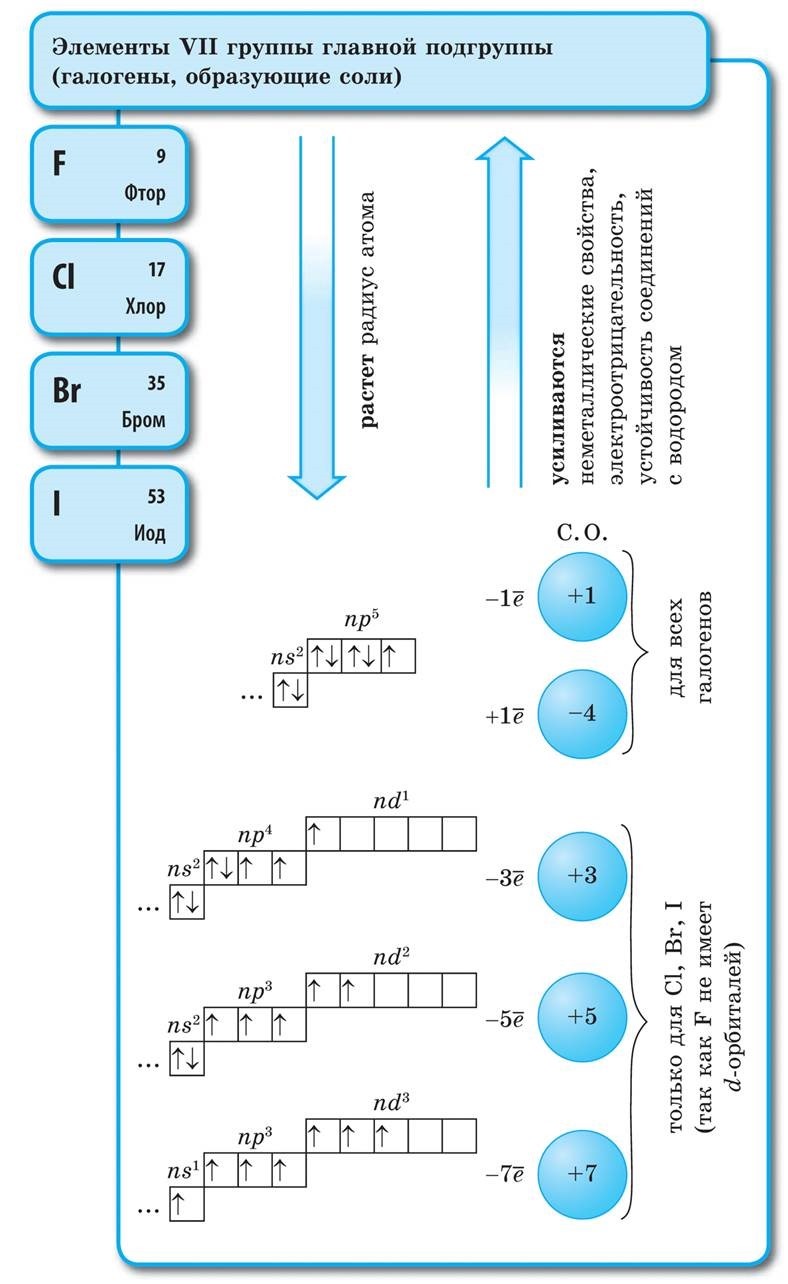
Зі збільшенням молекулярної маси галогенів температури плавлення і кипіння підвищуються, зростають щільності: бром - рідина, йод - тверда речовина, фтор і хлор - гази. Це пов'язано з тим, що зі збільшенням розмірів атомів і молекул галогенів зростають сили міжмолекулярної взаємодії між ними. Від F 2 до I 2 посилюється інтенсивність забарвлення галогенів.
Хімічна активність галогенів, як неметалів, від фтору до йоду слабшає, У кристалів йоду з'являється металевий блиск. Кожен галоген є найсильнішим окислювачем в своєму періоді. Окисні властивості галогенів виразно проявляються при їх взаємодії з металами. При цьому утворюються солі. Так, фтор вже при звичайних умовах реагує з більшістю металів, а при нагріванні і з золотом, сріблом, платиною, відомими своєю хімічною пасивністю. Алюміній і цинк в атмосфері фтору спалахують:
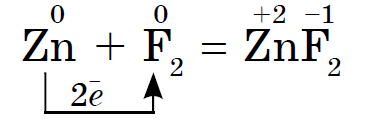
Решта галогени реагують з металами при нагріванні. Нагріте порошок заліза також загоряється при взаємодії з хлором. Досвід можна провести, як з сурмою, але тільки залізну тирсу потрібно попередньо загострити в залізній ложечці, а потім висипати їх невеликими порціями в колбу з хлором. Так як хлор є сильним окислювачем, то в результаті реакції утворюється хлорид заліза (III):
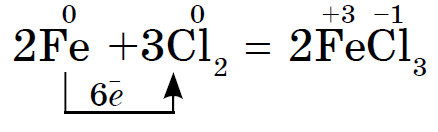
У парах брому згорає розпечена мідний дріт:
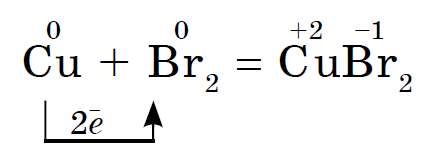
Йод окисляє метали повільніше, Але в присутності води, яка є каталізатором, реакція йоду з порошком алюмінію протікає дуже бурхливо:
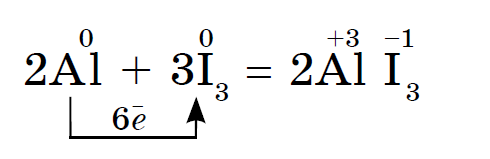
Реакція супроводжується виділенням фіолетових парів йоду.
Про зменшення окислювальних і збільшенні відновлювальних властивостей галогенів від фтору до йоду можна судити і по їх здатності витісняти один одного з розчинів їх солей, А також воно наочно проявляється при взаємодії їх з воднем. Рівняння цієї реакції можна записати в загальному вигляді так:
Якщо фтор взаємодіє з воднем в будь-яких умовах з вибухом, то суміш хлору з воднем реагує лише при підпалюванні або опроміненні прямим сонячним світлом, бром взаємодіє з воднем при нагріванні і без вибуху. Ці реакції - екзотермічні. Реакція ж з'єднання йоду з воднем слабо ендотермічна, вона протікає повільно навіть при нагріванні.
В результаті цих реакцій утворюються відповідно фтороводород HF, хлороводень HCl, бромоводород HBr і иодоводорода HI.
Хімічні властивості хлору в таблицях

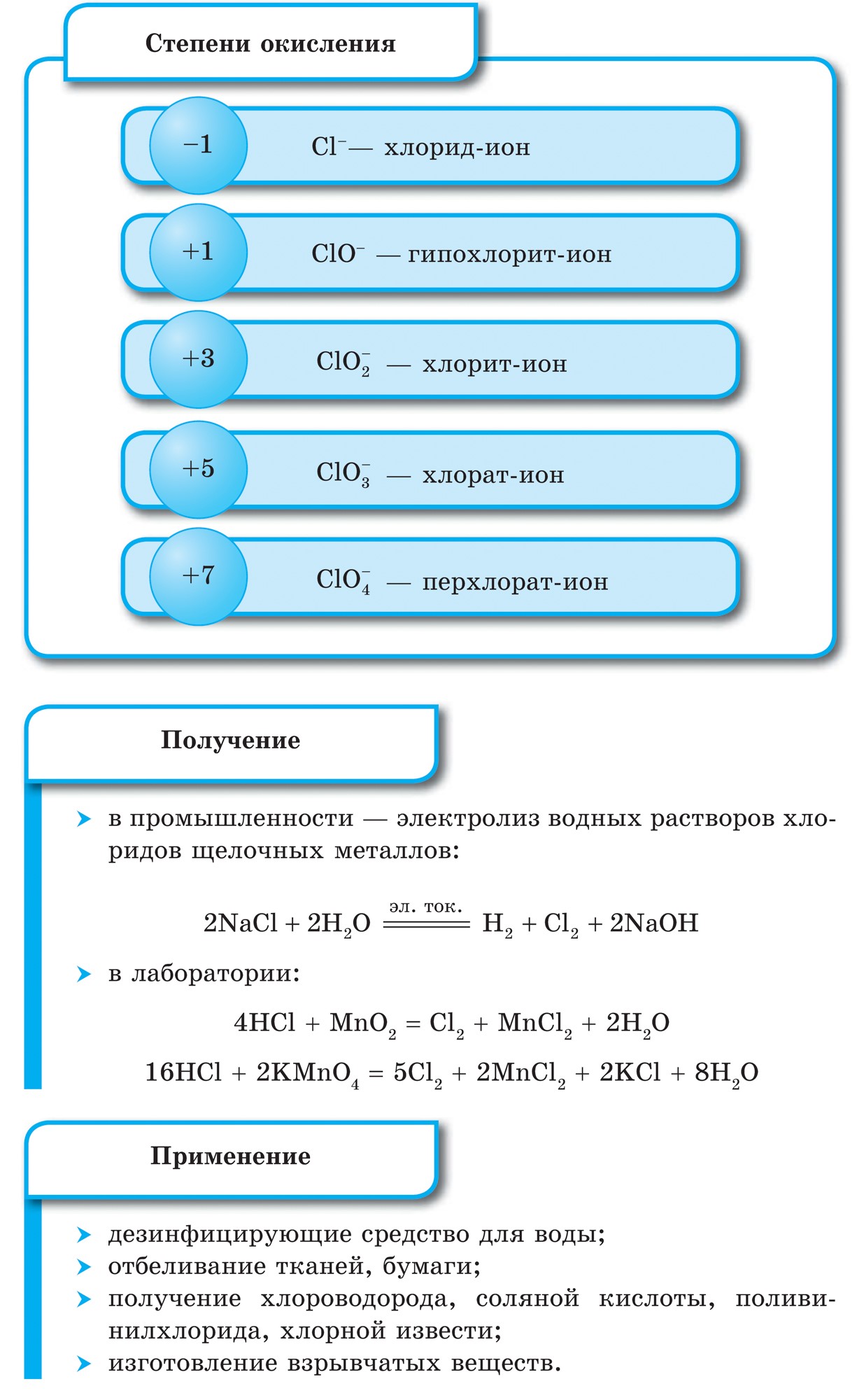
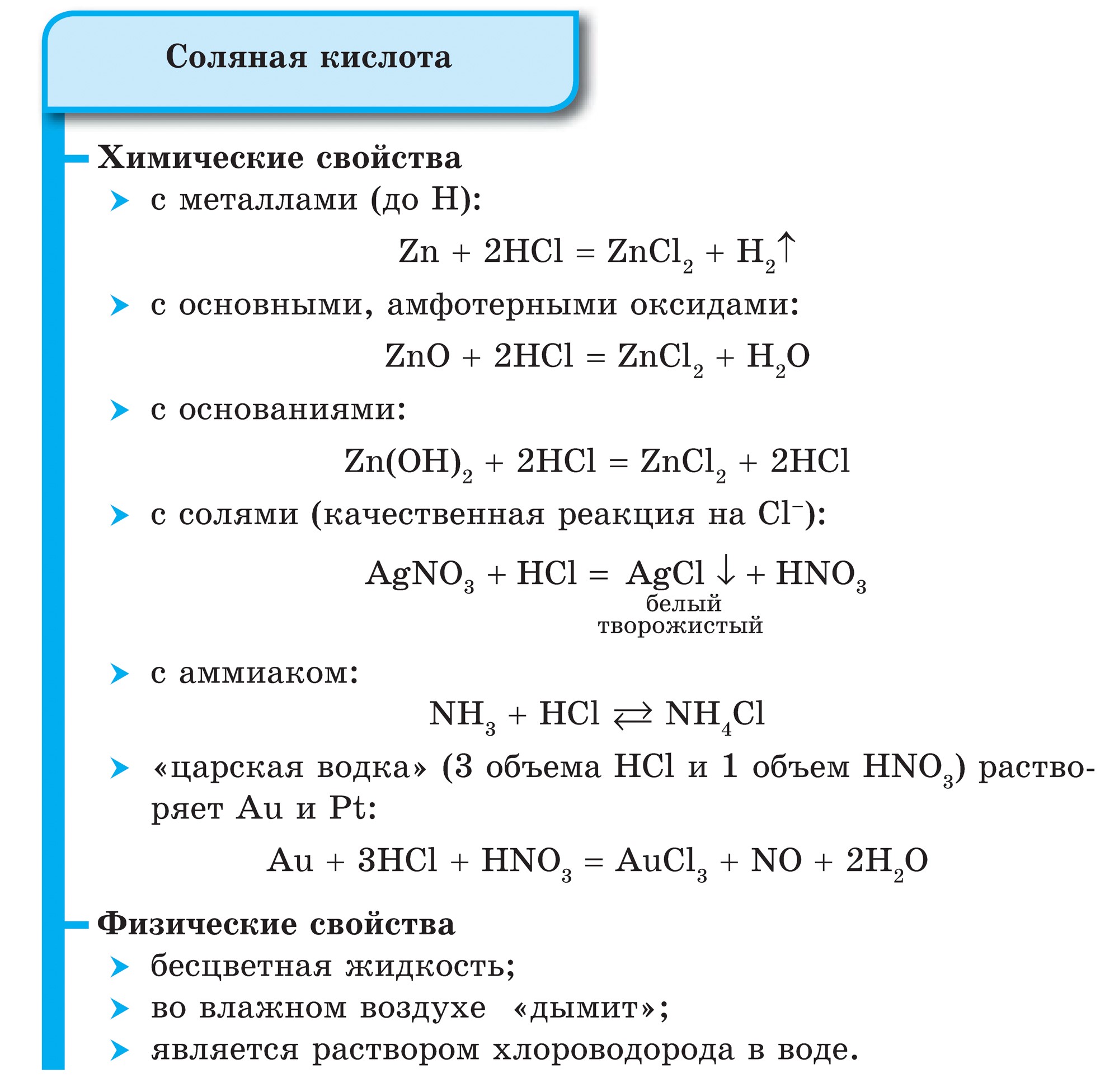
отримання галогенів
Фтор і хлор отримують електролізом розплавів або розчинів їх солей. Наприклад, процес електролізу розплаву хлориду натрію можна відобразити рівнянням:
При отриманні хлору електролізом розчину хлориду натрію крім хлору утворюється також водень і гідроксид натрію:
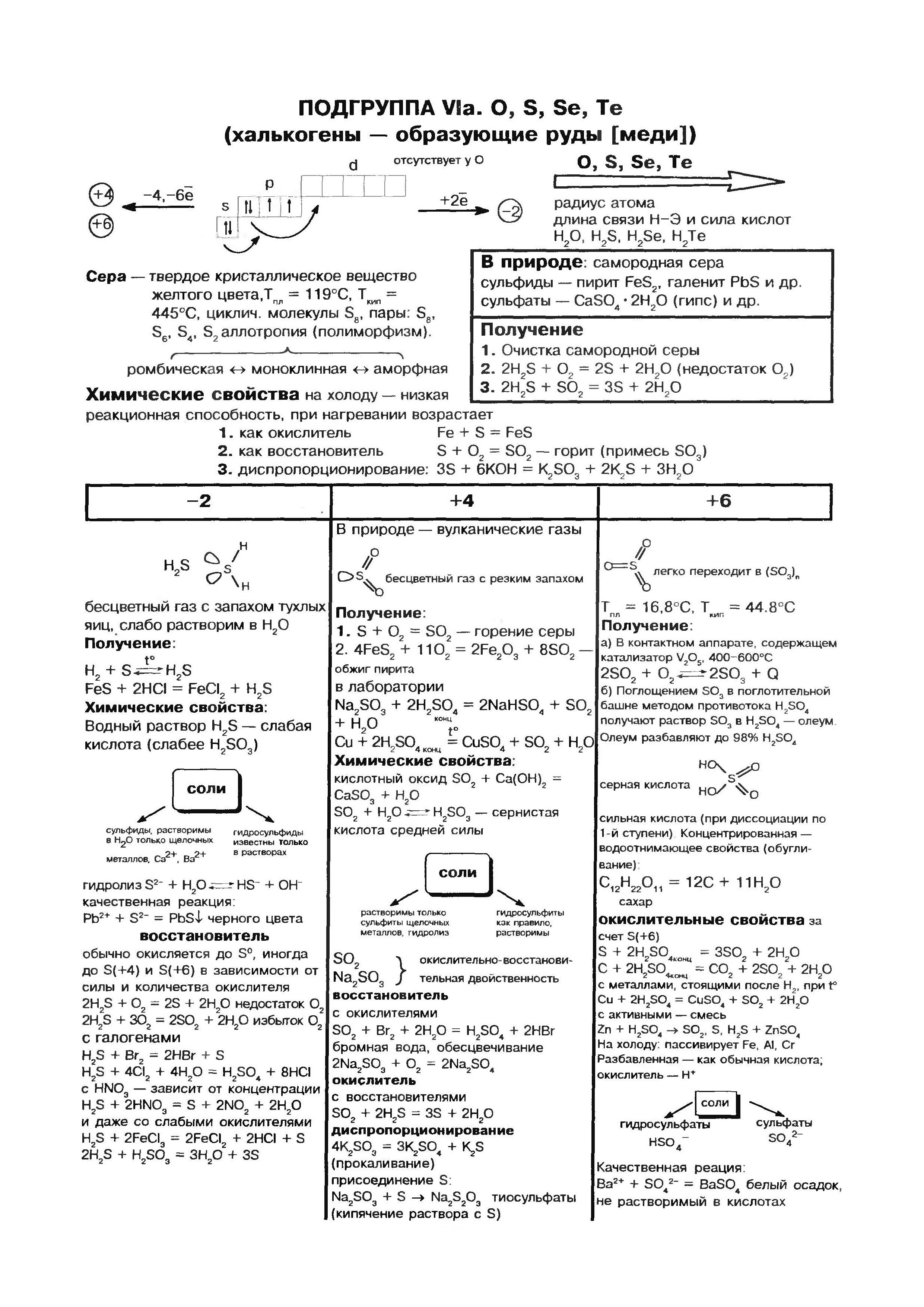
Кисень (О) - родоначальник головної підгрупи VI групи Періодичної системи елементів. Елементи цієї підгрупи - кисень О, сірка S, селен Se, телур Ті, полоній Ро - мають загальну назву «халькогена», що означає «народжують руди».
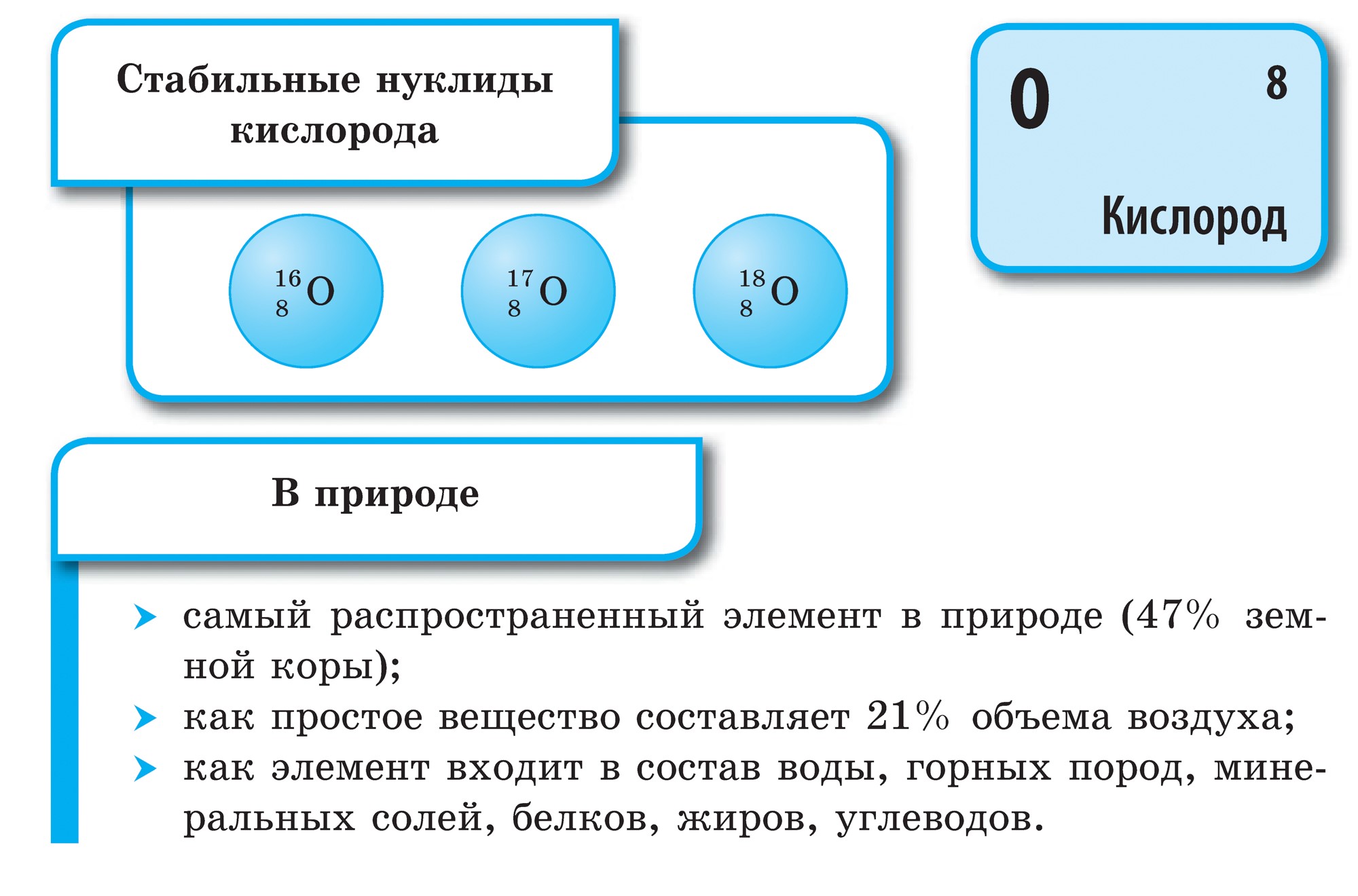
Кисень - найпоширеніший елемент на нашій планеті. Він входить до складу води (88,9%), але ж вона покриває 2/3 поверхні земної кулі, створюючи його водну оболонку - гідросферу. Кисень - друга за кількістю і перша за значенням для життя складова частина повітряної оболонки Землі - атмосфери, де на його частку припадає 21% (за об'ємом) і 23,15% (по масі). Кисень входить до складу численних мінералів твердої оболонки земної кори - літосфери: з кожних 100 атомів земної кори на частку кисню припадає 58 атомів.
Звичайний кисень існує в формі О2. Це газ без кольору, запаху і смаку. У рідкому стані має світло-блакитне забарвлення, в твердому - синю. У воді газоподібний кисень розчинний краще, ніж азот і водень.
Кисень взаємодіє майже з усіма простими речовинами, крім галогенів, благородних газів, золота і платинових металів. Реакції неметалів з киснем протікають дуже часто з виділенням великої кількості тепла і супроводжуються запаленням - реакції горіння. Наприклад, горіння сірки з утворенням SO 2, фосфору - з утворенням P 2 O 5 або вугілля - з утворенням СО2. Майже всі реакції за участю кисню екзотермічні. Виняток становить взаємодія азоту з киснем: це ендотермічною реакція, яка протікає при температурі вище 1200 ° С або при електричному розряді:
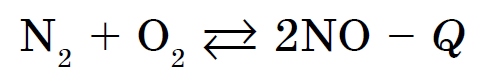
Кисень енергійно окисляє не тільки прості, але і багато складних речовини, при цьому утворюються оксиди елементів, з яких вони побудовані:
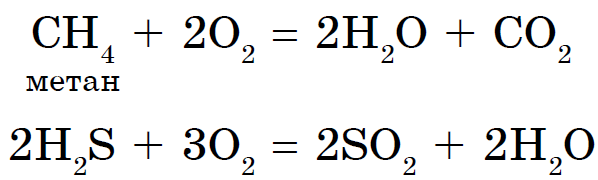
Висока окислювальна здатність кисню лежить в основі горіння всіх видів палива.
Кисень бере участь і в процесах повільного окислення різних речовин при звичайній температурі. Виключно важлива роль кисню в процесі дихання людини і тварин. Рослини також поглинають атмосферний кисень. Але якщо в темряві йде тільки процес поглинання рослинами кисню, то на світлі протікає ще один протилежний йому процес - фотосинтез, в результаті якого рослини поглинають вуглекислий газ і виділяють кисень.
У промисловості кисень одержують з рідкого повітря, а в лабораторії - шляхом розкладання пероксиду водню в присутності каталізатора діоксиду марганцю MnO 2 :
![]()
а також розкладанням перманганату калію KMnO 4 при нагріванні:
Хімічні властивості кисню в таблицях

застосування кисню
Кисень застосовують у металургійній та хімічній промисловості для прискорення (інтенсифікації) виробничих процесів. Чистий кисень застосовують також для отримання високих температур, наприклад, при газовій зварці і різанні металів. У медицині кисень застосовують у випадках тимчасового утруднення дихання, пов'язаного з деякими захворюваннями. Також кисень застосовують в металургії як окислювач ракетного палива, в авіації для дихання, для різання металів, для зварювання металів, при вибухових роботах. Кисень зберігають в сталевих балонах, пофарбованих у блакитний колір, під тиском 150 атм. У лабораторних умовах кисень зберігають у скляних приладах - газометр.
атоми сірки (S), Як і атоми кисню і всіх інших елементів головної підгрупи VI групи, містять на зовнішньому енергетичному рівні 6 електронів, з яких два електрона неспарені. Однак у порівнянні з атомами кисню атоми сірки мають більший радіус, менше значення електронегативності, тому проявляють виражені відновні властивості, утворюючи з'єднання зі ступенями окислення +2, +4, +6. По відношенню до менш негативних елементів (водень, метали) сірка виявляє окисні властивості і набуває ступінь окислення -2 .
Сірка - проста речовина
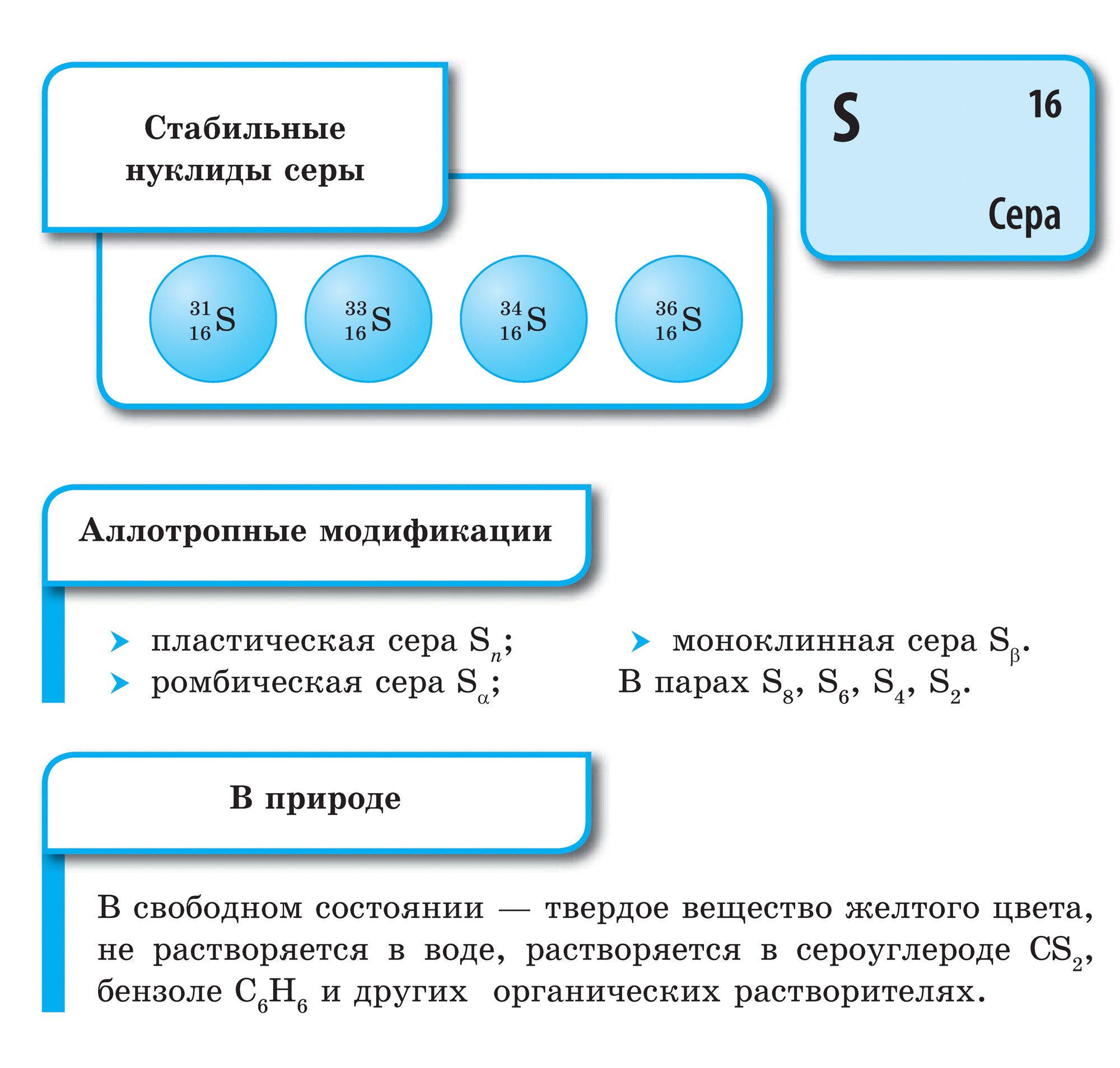
Для сірки, як і для кисню, характерна аллотропия. Відомо багато модифікацій сірки з циклічним або лінійною будовою молекул різного складу.
Найбільш стійка модифікація, відома під назвою ромбічної сірки, що складається з молекул S 8. Її кристали мають вигляд октаедрів зі зрізаними кутами. Вони пофарбовані в лимонно-жовтий колір і напівпрозорі, температура плавлення 112,8 ° С. У цю модифікацію при кімнатній температурі перетворюються всі інші модифікації. При кристалізації з розплаву спочатку виходить моноклінна сірка (голчасті кристали, температура плавлення 119,3 ° С), яка потім переходить в ромбічну. При нагріванні шматочків сірки в пробірці вона плавиться, перетворюючись на рідину жовтого кольору. При температурі близько 160 ° С рідка сірка починає темніти, стає густою і в'язкою, не виливається з пробірки, при подальшому нагріванні перетворюється в легкорухливою рідиною, але зберігає колишній темно-коричневий колір. Якщо її вилити в холодну воду, Вона застигає у вигляді прозорої резінообразной маси. Це пластична сірка. Її можна отримати і в вигляді ниток. Через кілька днів вона також перетворюється на ромбічну сірку.
Сірка не розчиняється у воді. Кристали сірки у воді тонуть, а ось порошок плаває на поверхні води, т. К. Дрібні кристалики сірки водою не змочуються і підтримуються на плаву дрібними бульбашками повітря. Це процес флотації. Сірка малорастворима в етиловому спирті і діетиловому ефірі, добре розчиняється в сірковуглеці.
При звичайних умовах сірка реагує з усіма лужними і лужноземельними металами, міддю, ртуттю, сріблом, Наприклад:
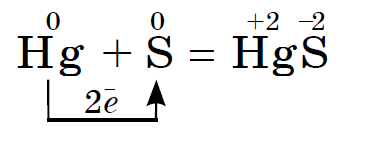
Ця реакція лежить в основі видалення та знешкодження розлитої ртуті, наприклад, з розбитого термометра. Видимі краплі ртуті можна зібрати на аркуш паперу або на мідну пластику. Ту ртуть, яка потрапила в щілини, потрібно засипати порошком сірки. Такий процес називається демеркуризацію.
При нагріванні сірка реагує і з іншими металами (Zn, Al, Fe), і тільки золото не взаємодіє з нею ні за яких умов. Окисні властивості сірка виявляє і з воднем, з яким реагує при нагріванні:
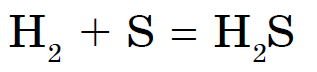
З неметалів з сіркою не реагує тільки азот, йод і благородні гази. Сірка горить синюватим полум'ям, утворюючи оксид сірки (IV):
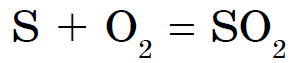
Це з'єднання широко відомо під назвою сірчистий газ.
Хімічні властивості сірки в таблицях

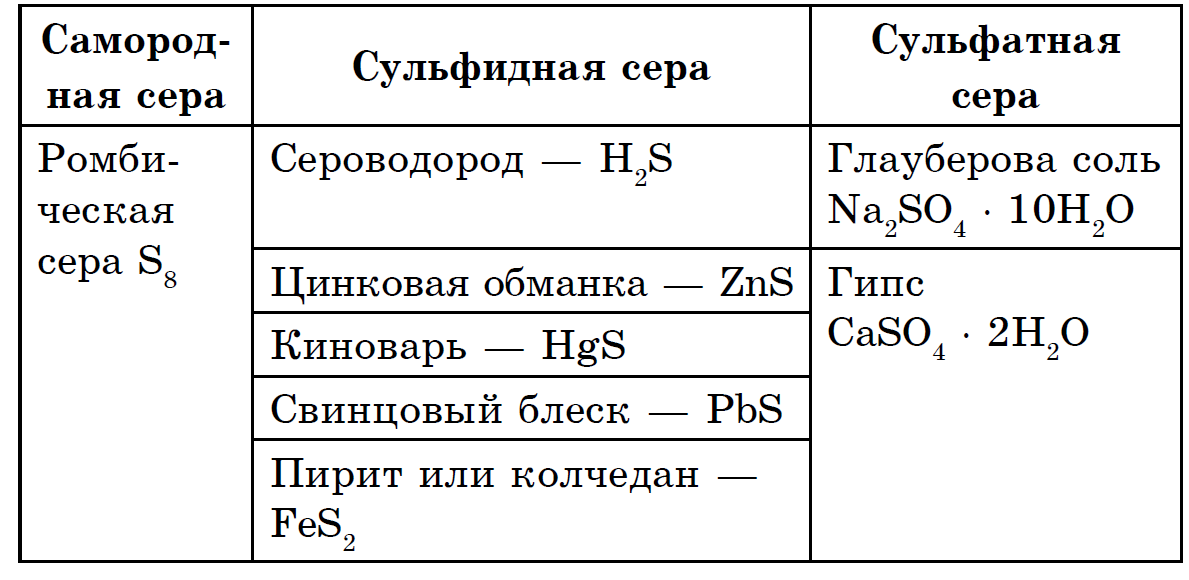
Сірка відноситься до вельми поширеним елементам: земна кора містить 4,7 · 10-2% сірки за масою (15-е місце серед інших елементів), а Земля в цілому - багато більше (0,7%). Головна маса сірки знаходиться в глибинах землі, в її мантії-шарі, розташованому між земною корою і ядром Землі. Тут, на глибині приблизно 1200-3000 км залягає потужний шар сульфідів і оксидів металів. У земній корі сірка зустрічається як у вільному стані (самородна), так і, головним чином, у вигляді сполук сульфідів і сульфатів. З сульфідів в земній корі найпоширеніші пірит FeS2, халькопірит FeCuS2, свинцевий блиск (галеніт) PbS, цинкова обманка (сфалерит) ZnS. Великі кількості сірки зустрічаються в земній корі у вигляді важкорозчинних сульфатів - гіпсу CaSO4 · 2H2O, бариту BaSO4, в морській воді поширені сульфати магнію, натрію і калію.
Цікаво, що в стародавні часи геологічної історії Землі (близько 800 млн. Років тому) сульфатів в природі не було. Вони утворилися як продукти окислення сульфідів, коли в результаті життєдіяльності рослин виникла киснева атмосфера. У вулканічних газах виявляють сірководень H2S і сірчистий ангідрид SO2. тому самородна сірка, яка трапляється в районах, близьких до діючих вулканів (Сицилія, Японія) могла утворитися при взаємодії цих двох газів:
2H 2 S + SO 2 \u003d 3S + 2H 2 O.
Інші поклади самородної сірки пов'язані з життєдіяльністю мікроорганізмів.
Мікроорганізми беруть участь у багатьох хімічних процесах, Які в цілому складають круговорот сірки в природі. За їх сприяння сульфіди окислюються до сульфатів, сульфати поглинаються живими організмами, де сірка відновлюється і входить до складу білків та інших життєво важливих речовин. При гнитті відмерлих залишків організмів білки руйнуються, і виділяється сірководень, який далі окислюється або до елементарної сірки (так і утворюються поклади сірки), або до сульфатів. Цікаво, що бактерії і водорості, що окислюють сірководень до сірки збирають її в своїх клітинах. Клітини таких мікроорганізмів можуть на 95% складатися з чистої сірки.
Встановити походження сірки можна по наявності в ній її аналога - селену: якщо в самородної сірки зустрічається селен, то сірка вулканічного походження, якщо немає - біогенного, так як мікроорганізми уникають включати селен в свій життєвий цикл, також біогенна сірка містить більше ізотопу 32S, ніж тяжчого 34S.
Біологічне значення сірки
Життєво важливий хімічний елемент. Вона входить до складу білків - одних з основних хімічних компонентів клітин всіх живих організмів. Особливо багато сірки в білках волосся, рогів, вовни. Крім цього, сірка є складовою частиною біологічно активних речовин організму: вітамінів і гормонів (наприклад, інсуліну). Сірка бере участь в окисно-відновних процесах організму. При нестачі сірки в організмі спостерігається крихкість і ламкість кісток і випадання волосся.
Сірої багаті бобові рослини (горох, сочевиця), вівсяні пластівці, яйця.
застосування сірки
Сірка використовується у виробництві сірників і паперу, гуми та фарб, вибухових речовин і ліків, пластмаси та косметичних препаратів. У сільському господарстві її використовують для боротьби з шкідниками рослин. Однак основний споживач сірки - хімічна промисловість. Близько половини що добувається в світі сірки йде на виробництво сірчаної кислоти.
азот
![]()
Азот (N)- перший представник головної підгрупи V групи Періодичної системи. Його атоми містять на зовнішньому енергетичному рівні п'ять електронів, з яких три електрона неспарені. Звідси випливає, що атоми цих елементів можуть приєднувати три електрони, завершуючи зовнішній енергетичний рівень.
Атоми азоту можуть віддавати свої зовнішні електрони більш електронегативний елементів (фтору, кисню) і купувати при цьому ступеня окислення +3 і +5. Атоми азоту виявляють відновні властивості і в ступенях окислення +1, +2, +4.
У вільному стані азот існує в воді двоатомних молекули N 2. У цій молекулі два атоми N пов'язані дуже міцною потрійний ковалентним зв'язком, ці зв'язки можна позначити так:

Азот - безбарвний газ без запаху і смаку.
При звичайних умовах азот взаємодіє тільки з літієм, утворюючи нітрид Li 3 N:
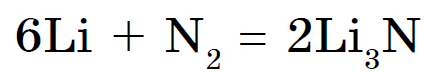
З іншими металами він взаємодіє тільки при високих температурах.
Також при високих температурах і тиску в присутності каталізатора азот реагує з воднем, утворюючи аміак:
При температурі електричної дуги він з'єднується з киснем, утворюючи оксид азоту (II):
Хімічні властивості азоту в таблицях

застосування азоту
Азот, отриманий перегонкою рідкого повітря, в промисловості застосовують для синтезу аміаку та виробництва азотної кислоти. У медицині чистий азот застосовується в якості інертного середовища для лікування туберкульозу легенів, а рідкий азот - при лікуванні захворювань хребта, суглобів і ін.
фосфор
Хімічний елемент фосфор утворює кілька аллотропних модифікацій. Дві з них - прості речовини: білий фосфор і червоний фосфор. Білий фосфор має молекулярну кристалічну решітку, що складається з молекул Р4. Нерозчинні у воді, добре розчиняються в сірковуглеці. На повітрі легко окислюється, а в порошкоподібному стані навіть запалюється. Білий фосфор дуже отруйний. Особливою властивістю є здатність світитися в темряві внаслідок окислення. Зберігають його під водой.Красний фосфор являє собою темно-малиновий порошок. Чи не розчиняється ні у воді, ні в сероуглероде. На повітрі окислюється повільно і не займається. Неядовіт і не світиться в темряві. При нагріванні червоного фосфору в пробірці він перетворюється в білий фосфор (концентровані пари).
Хімічні властивості червоного і білого фосфору близькі, але білий фосфор хімічно активний. Так, обидва вони взаємодіють з металами, утворюючи фосфіди:
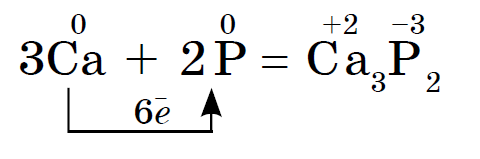
Білий фосфор самозаймається на повітрі, а червоний горить при підпалюванні. В обох випадках утворюється оксид фосфору (V), що виділяється у вигляді густого білого диму:
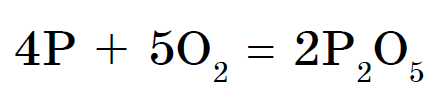
C воднем фосфор безпосередньо не реагує, фосфін РН 3 можна отримати побічно, наприклад, з фосфидов:
Фосфін - дуже отруйний газ з неприємним запахом. Легко запалюється на повітрі. Це властивість фосфіну і пояснює появу болотних блукаючих вогнів.
Хімічні властивості фосфор в таблицях


застосування фосфору
Фосфор є найважливішим біогенним елементом і в той же час знаходить дуже широке застосування в промисловості. Червоний фосфор застосовують у виробництві сірників. Його разом з тонко подрібненим склом і клеєм наносять на бічну поверхню коробки. При терті сірникової головки, до складу якої входять хлорат калію і сірка, відбувається займання.
Мабуть, перша властивість фосфору, яке людина поставила собі на службу, - це горючість. Горючість фосфору дуже велика і залежить від аллотропическими модифікації.
Найбільша активність хімічно, токсичний і горючий білий ( «жовтий») фосфор, тому він дуже часто застосовується (в запалювальних бомбах та ін.).
Червоний фосфор - основна модифікація, вироблена і споживана промисловістю. Він застосовується у виробництві сірників, вибухових речовин, запальних складів, різних типів палива, а також протизадирних мастильних матеріалів, як газовбирачів у виробництві ламп розжарювання.
Фосфор (у вигляді фосфатів) - один з трьох найважливіших біогенних елементів, бере участь в синтезі АТФ. Велика частина виробленої фосфорної кислоти йде на отримання фосфорних добрив - суперфосфату, преципітату, аммофоскі і ін.
Фосфати широко використовуються:
- в якості комплексоутворювачів (кошти для пом'якшення води),
- в складі Пасиватор поверхні металів (захист від корозії, наприклад, т. зв. склад «мажеф»).
Здатність фосфатів формувати міцну тривимірну полімерну сітку використовується для виготовлення фосфатних і алюмофосфатного зв'язок.
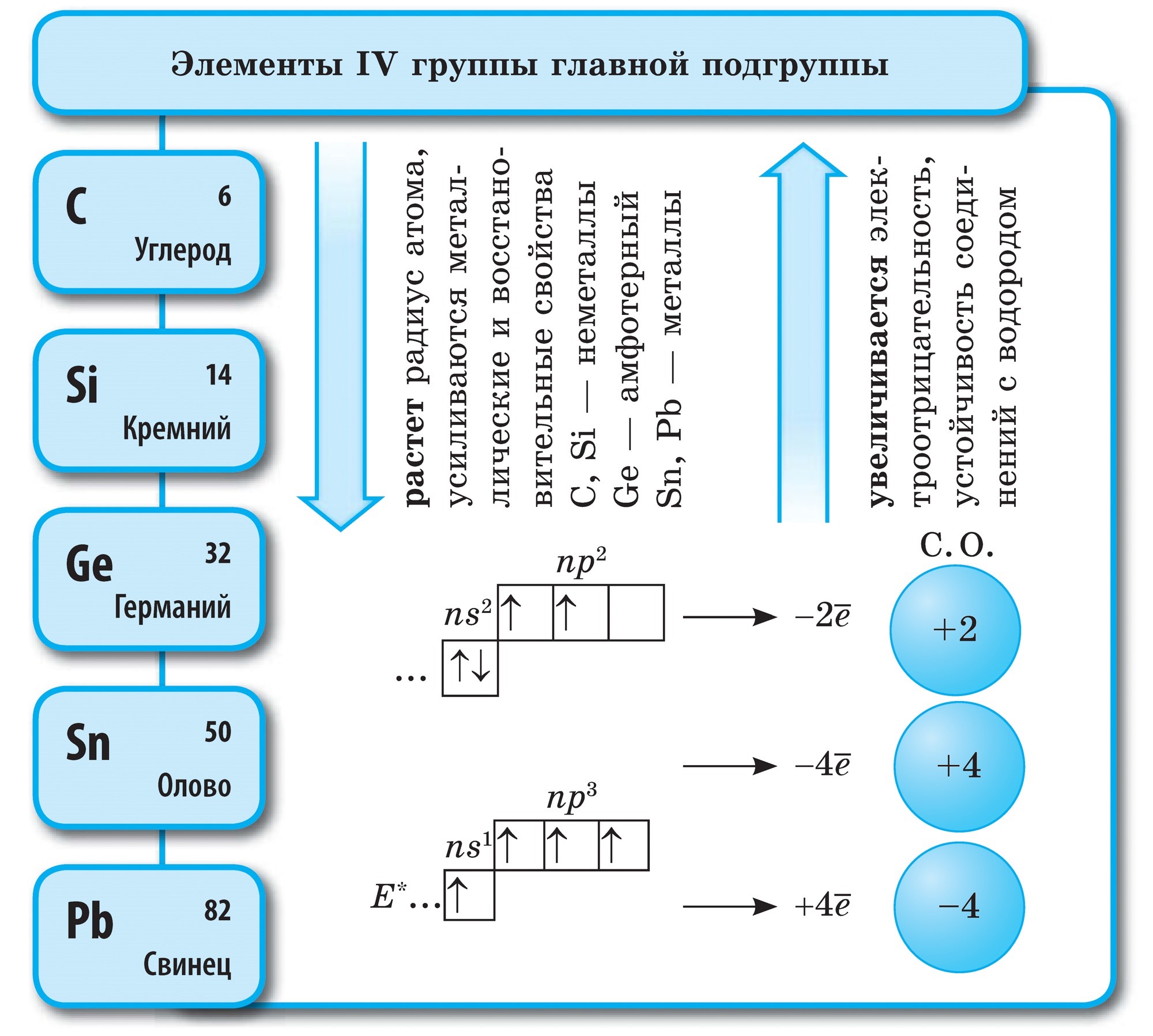
вуглець
Вуглець (С) - перший елемент головної підгрупи VI групи Періодичної системи. Його атоми містять на зовнішньому рівні 4 електрона, тому вони можуть приймати чотири електрона, набуваючи при цьому ступінь окислення -4 , Т. Е. Виявляти окисні властивості і віддавати свої електрони більш електронегативний елементів, т. Е. Виявляти відновні властивості, набуваючи при цьому ступінь окислення +4.
Вуглець - проста речовина
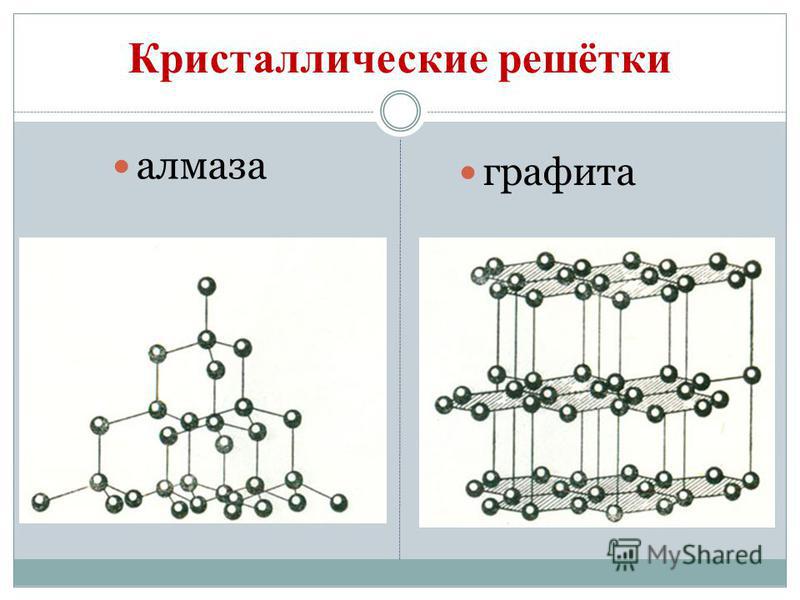
Вуглець утворює аллотропние модифікації алмаз і графіт. Алмаз - прозоре кристалічна речовина, найтвердіша з усіх природних речовин. Він служить еталоном твердості, яка за десятибальною системою оцінюється найвищим балом 10. Така твердість алмазу обумовлена \u200b\u200bособливою структурою його атомної кристалічної решето. У ній кожен атом вуглецю оточений такими ж атомами, розташованими в вершинах правильного тетраедра.
Кристали алмаза зазвичай безбарвні, але бувають синього, блакитного, червоного і чорного кольорів. Вони мають дуже сильний блиск завдяки високій светопреломляющей і світловідбиваючої здатності. А завдяки виключно високій твердості, вони застосовуються для виготовлення бурів, свердел, шліфувальних інструментів, Різання скла.
Найбільші родовища алмазів знаходяться в Південній Африці, а в Росії їх видобувають в Якутії.
Графіт - темно-сіре, жирне на дотик кристалічна речовина з металевим блиском. На відміну від алмаза графіт м'який (залишає слід на папері) і непрозорий, добре проводить тепло і електричний струм. М'якість графіту обумовлена \u200b\u200bшаруватою структурою. У кристалічній решітці графіту атоми вуглецю, що лежать в одній площині, міцно пов'язані в правильні шестикутники. Зв'язки між шарами Маломіцні. Він дуже тугоплавок. З графіту виготовляють електроди, тверді мастила, сповільнювачі нейтронів в ядерних реакторах, стрижні для олівців. При високих температурах і тиску з графіту одержують штучні алмази, які широко застосовуються в техніці.
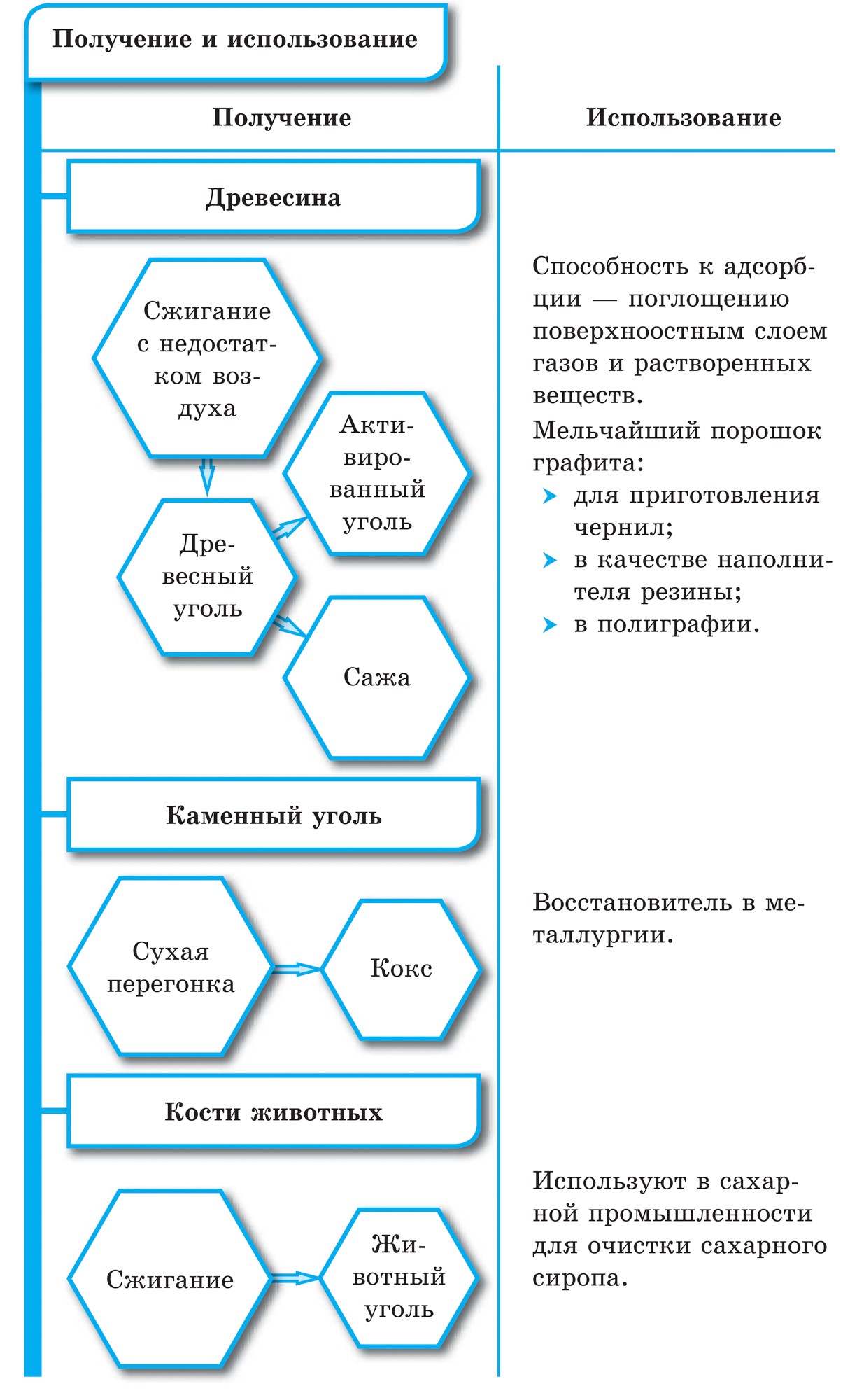
Подібне з графітом будова мають сажа і деревне вугілля. Деревне вугілля отримують при сухій перегонці деревини. Це вугілля завдяки своїй пористій поверхні має чудову здатність поглинати гази і розчинені речовини. Це властивість називається адсорбцією. Чим більше пористість деревного вугілля, тим ефективніше адсорбція. Щоб збільшити поглинальну здатність, деревне вугілля обробляють гарячим водяною парою. Оброблений таким способом вугілля називають активованим або активним. В аптеках його продають у вигляді чорних таблеток карболену.
Хімічні властивості вуглецю
Алмаз і графіт з'єднуються з киснем при дуже високій температурі. Сажа і вугілля взаємодіють з киснем набагато легше, згораючи в ньому. Але в будь-якому випадку результат такої взаємодії один - утворюється вуглекислий газ:
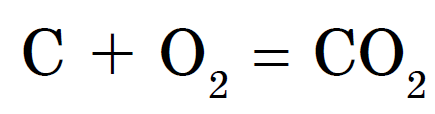
З металами вуглець при нагріванні утворює карбіди:
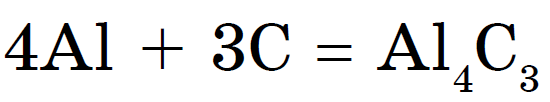
карбід алюмінію - світло-жовті прозорі кристали. Відомий карбід кальцію Сас 2 у вигляді шматків сірого кольору. Його застосовують газосварщики для отримання ацетилену:
ацетиленвикористовують для різання і зварювання металів, спалюючи його за допомогою кисню в спеціальних пальниках.
Якщо водою подіяти на карбід алюмінію, то вийде інший газ - метанСН 4:
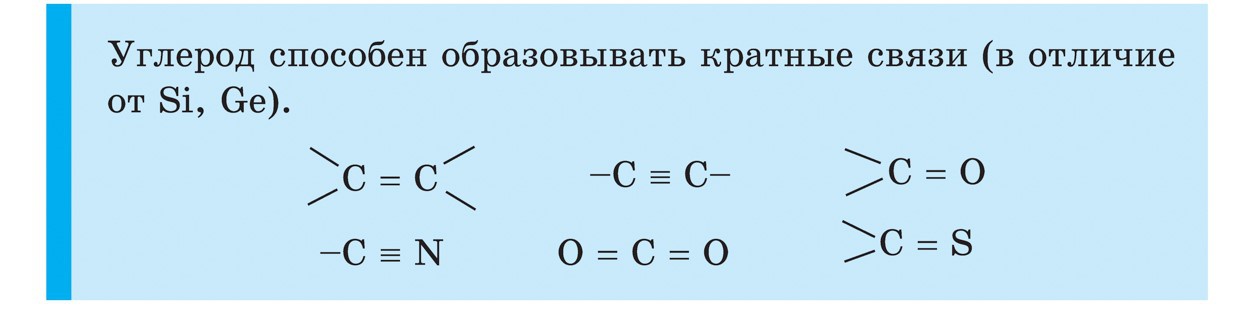
кремній
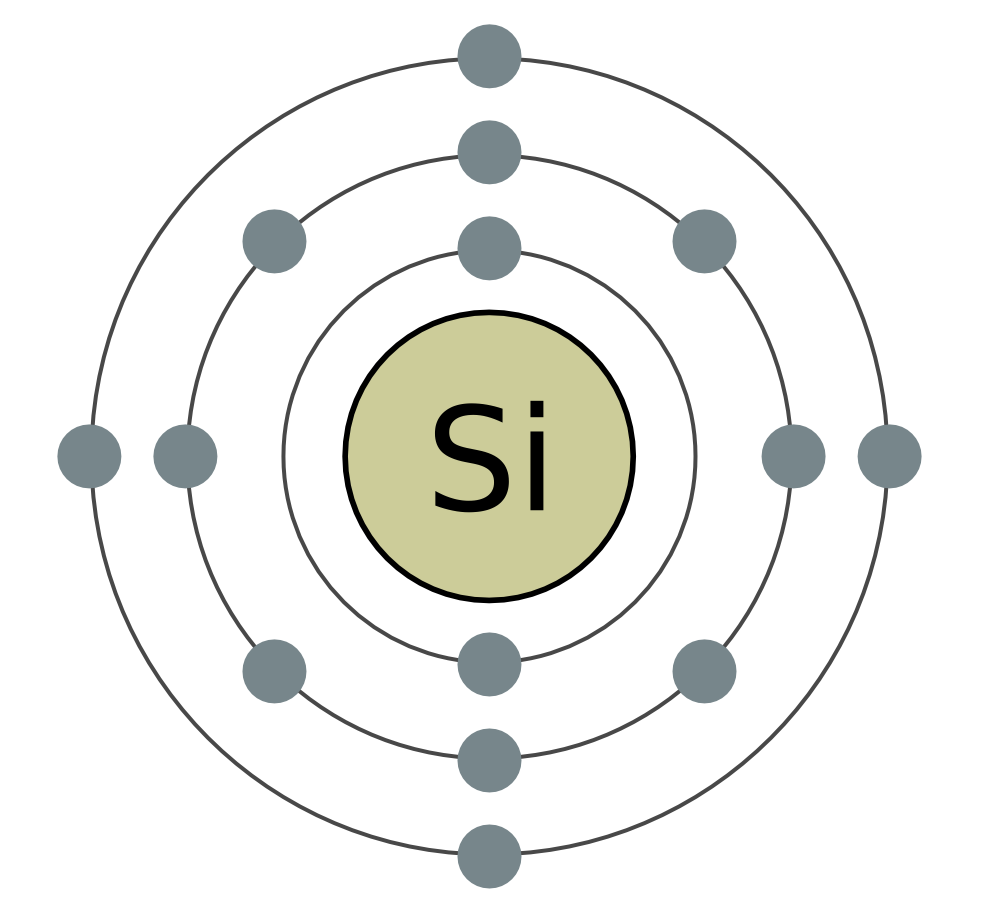
Кремній (Si) - другий елемент головної підгрупи IV групи періодичної системи. У природі кремній - другий за поширеністю після кисню хімічний елемент. Земна кора більш ніж на чверть складається з його сполук. Найбільш поширеним з'єднанням кремнію є його діоксид SiO 2 - кремнезем. У природі він утворює мінерал кварц і багато різновидів, такі як гірський кришталь і його знаменита лиловая форма - аметист, а також агат, опал, яшма, халцедон, сердолік. Діоксид кремнію - це також звичайний і кварцовий пісок. Другий тип природних сполук кремнію - це силікати. Серед них найбільш поширені алюмосилікати - граніт, різні види глин, слюди. Силікатом, що не містить алюміній, є, наприклад, азбест. Оксид кремнію необхідний для життя рослин і тварин. Він додає міцність стебел рослин і захисних покриттів тварин. Кремній додає гладкість і міцність кісток людини. Кремній входить до складу нижчих живих організмів - діатомових водоростей і радіолярій.
Хімічні властивості кремнію
Кремній горить в кисні, утворюючи діоксид кремнію або оксид кремнію (IV):
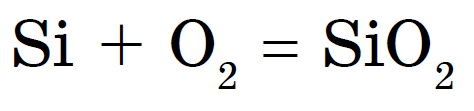
Будучи неметаллом, при нагріванні він з'єднується з металами з утворенням силіцидів:
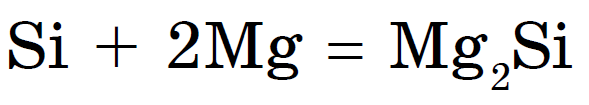
Силіциди легко розкладаються водою або кислотами, при цьому виділяється газоподібний водневе з'єднання кремнію - силан:
4HCl + Mg 2 Si → SiH 4 + 2MgCl 2
На відміну від вуглеводнів силан на повітрі самозаймається і згоряє з утворенням діоксиду кремнію і води:
Підвищена реакційна здатність силана в порівнянні з метаном СН4 пояснюється тим, що у кремнію більший розмір атома, ніж у вуглецю, тому хімічні зв'язки Si-H слабкіше зв'язків С-Н.
Кремній взаємодіє з концентрованими водними розчинами лугу, утворюючи силікати і водень:
Кремній одержують, відновлюючи його з діоксиду магнієм або вуглецем:
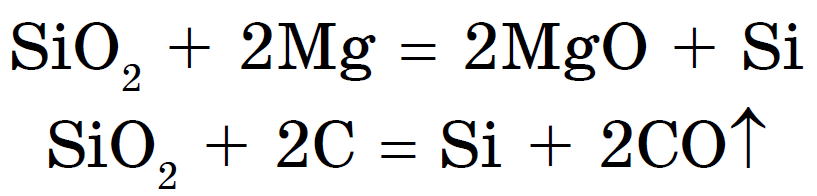
Оксид кремнію (IV), або діоксид кремнію, або кремнезем SiO 2, як і СО 2, є кислотним оксидом. Однак, на відміну від СО 2, має не молекулярну, а атомну кристалічну решітку. Тому SiO 2 - тверде і тугоплавка речовина. Він не розчиняється у воді і кислотах, крім плавикової, але взаємодіє при високих температурах з лугами з утворенням солей кремнієвої кислоти - силікатів:
Силікати можна отримати також сплавом діоксиду кремнію з оксидами металів або з карбонатами:
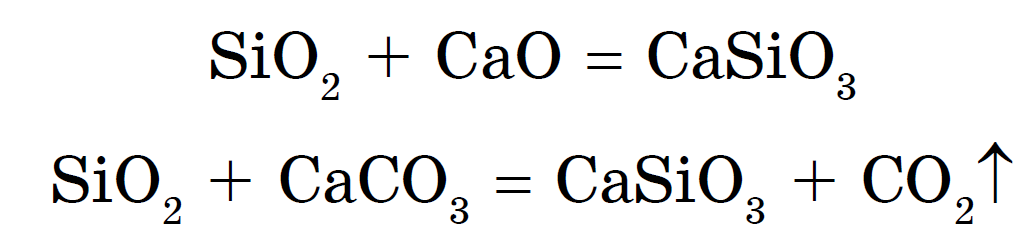
Силікати натрію і калію називають розчинним склом. їх водні розчини - це добре відомий силікатний клей. З розчинів силікатів дією на них більш сильних кислот - соляної, сірчаної, оцтової і навіть вугільної - виходить кремнієва кислота H 2 SiO 3 :
отже, H 2 SiO 3 - дуже слабка кислота. Вона нерастворима в воді і випадає з реакційної суміші у вигляді драглистого осаду, іноді заповнює компактно весь обсяг розчину, перетворюючи його в напівтверду масу, схожу на холодець, желе. При висиханні цієї маси утворюється високопористого речовина - силікагель, широко застосовуваний в якості адсорбенту - поглинача інших речовин.



Довідковий матеріал для проходження тестування:
таблиця Менделєєва
Таблиця розчинності