Неметали - це хімічні елементи, які утворюють в вільному вигляді прості речовини, що не володіють фізичними властивостями металів. з 114 хімічних елементів 92 відносяться до металів, 22 є неметалами. Неметали - прості речовини, при звичайних умовах можуть бути газами, рідинами і твердими речовинами (рис. 46).
Мал. 46.
Прості речовини - неметали
Лабораторний дослід № 6
Ознайомлення з колекцією неметалів
Ознайомтеся з колекцією неметалів. Запишіть хімічні формули виданих вам неметалів, розташуйте їх у порядку зростання:
- щільності;
- твердості;
- блиску;
- інтенсивності зміни кольору.
Для виконання завдання використовуйте додатки 1 і 2, додаткові джерела інформації.
Газами є гелій Не, неон Ne, аргон Аr, криптон Кr, ксенон Хе, радон Rn. Їх називають інертними газами. Молекули інертного газу складаються з одного атома. На зовнішньому електронному шарі у атомів інертних газів (за винятком гелію) вісім електронів. У гелію - два. Своєю хімічною стійкістю інертні гази нагадують благородні метали - золото і платину, і у них є друга назва - благородні гази. Ця назва більш підходить до інертних газів, які все-таки вступають іноді в хімічні реакції і утворюють сполуки. У 1962 р з'явилося повідомлення про те, що отримано з'єднання ксенону з фтором. Зараз відомо вже більше 150 з'єднань ксенону, криптону, радону з фтором, киснем, хлором і азотом.
Подання про хімічну винятковості благородних газів виявилося не дуже заможним, і тому замість передбачуваної нульової групи інертні гази були поміщені в VIII групу (VIIIA групу) таблиці Д. І. Менделєєва.
Гелієм, за легкістю поступається тільки водню, але, на відміну від останнього, негорючим, т. Е. Не представляють пожежної небезпеки, заповнюють аеростати та дирижаблі (рис. 47).

Мал. 47.
Повітряні кулі і дирижаблі заповнюють гелієм
Неон використовують для виготовлення світлової реклами (рис. 48). Згадайте образний вислів «вулиці міста були залиті неоном».

Гази водень, кисень, азот, хлор, фтор утворюють двохатомних молекул, відповідно - Н 2, O 2, N 2, Cl 2, F 2.
Склад речовини зображують на листі, використовуючи хімічні знаки і цифри - індекси, за допомогою хімічної формули. За хімічною формулою, як ви вже знаєте, обчислюють відносну молекулярну масу речовини (Мr). Відносна молекулярна маса простого речовини дорівнює добутку відносної атомної маси на число атомів в молекулі, наприклад кисню O 2:
Мr (02) \u003d Аr (0) × 2 \u003d 16 × 2 \u003d 32.
Однак елемент кисень утворює ще одне газоподібне проста речовина - озон, до складу молекул якого входять вже три атома кисню. Хімічна формула озону 0 3, а його відносна молекулярна маса: Мr (03) \u003d 16 × 3 \u003d 48.
Властивості аллотропних модифікацій хімічного елемента кисню - простих речовин кисню O 2 і озону O 3 - різні. Кисень не має запаху, а озон пахне (звідси і його назва - в перекладі з грецького озон означає «пахне»). Цей запах, аромат свіжості, можна відчути під час грози, так як озон утворюється в малих кількостях в повітрі в результаті електричних розрядів.
Кисень - газ без кольору, а озон має блідо-фіолетовий колір. Озон більш бактерициден (лат. Цідао - вбивати), ніж кисень. Тому озон застосовують для знезараження питної води. Озон здатний утримувати ультрафіолетові промені сонячного спектра, згубні для всього живого на Землі, і тому озоновий шар, що розташовується в атмосфері на висоті 20-35 км, захищає життя на нашій планеті (на малюнку 49 ви бачите фотографію, зроблену з космосу за допомогою штучного супутника землі, де області зниженого вмісту озону в атмосфері ( «озонові діри») позначені білим кольором).
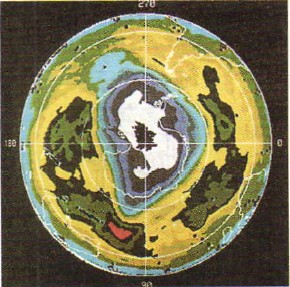
Мал. 49.
«Озонові діри» в атмосфері Землі
З простих речовин - неметалів при звичайних умовах рідиною є тільки бром, молекули якого двоатомний. Формула брому Вr 2. Це важка бура, з неприємним запахом рідина (звідси і назва, так як бромос з давньогрецької перекладається як «смердючий»).
Деякі тверді речовини - неметали відомі з найдавніших часів - це сірка і вуглець (у формі деревного вугілля, алмазу і графіту).
У твердих речовин - неметалів також спостерігається явище аллотропии. Так, елемент вуглець утворює такі різні за зовнішнім виглядом прості речовини, як алмаз, графіт (рис. 50). Причина відмінності властивостей алмазу і графіту полягає в будові кристалічних решіток цих речовин, які ви розглянете декілька пізніше.
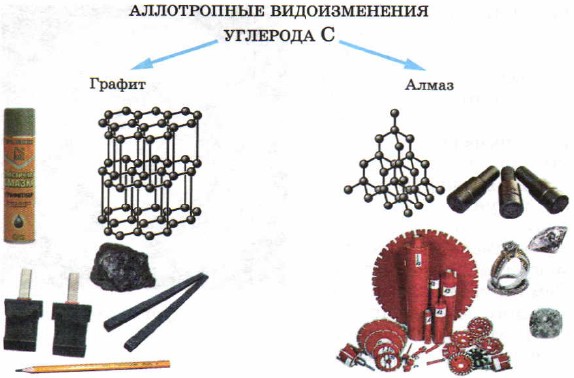
Мал. 50.
Алотропні видозміни вуглецю і області їх застосування
Елемент фосфор має дві аллотропние модифікації: фосфор червоний (їм покривають бічну сторону сірникової коробки) і фосфор білий. Останній має чотириатомні молекулу, склад його відбивається формулою Р 4.
Твердою речовиною - неметаллом є кристалічний йод з двухатомной молекулою I 2. Не плутайте його з спиртовим розчином йоду - йодною настойкою, яка є в кожній домашній аптечці.
Кристалічний йод і графіт не схожі на інші прості речовини - неметали, вони мають металевий блиск.
Щоб показати відносність поділу простих речовин на підставі їх фізичних властивостей на метали і неметали, розглянемо алотропія хімічного елемента олова Sn. При кімнатній температурі зазвичай існує бета-олово (β-Sn). Це всім відоме біле олово - метал, з якого раніше відливали олов'яних солдатиків (рис. 51, а) (згадайте казку X. К. Андерсена «Стійкий олов'яний солдатик»). Оловом покривають зсередини консервні банки (рис. 51, б). Воно входить до складу такого відомого сплаву, як бронза, а також припою (рис. 51, в).

Мал. 51.
Області застосування олова:
а - іграшки; б - виробництво консервних банок; в - припій
При температурі нижче +13,2 ° С стійкіше альфа-олово (α-Sn) - сірий мелкокристаллический порошок, який має скоріше властивості неметалла. Процес перетворення білого олова в сіре швидше за все йде при температурі, яка дорівнює -33 ° С. Це перетворення отримало образну назву «олов'яна чума».
Порівняємо тепер прості речовини - метали і неметали за допомогою таблиці 3.
Таблиця 3
прості речовини

Ключові слова і словосполучення
- Благородні гази.
- Аллотропия і аллотропние видозміни, або модифікації.
- Кисень і озон.
- Алмаз і графіт.
- Фосфор червоний і білий.
- Біле і сіре олово.
- Відносність поділу простих речовин на метали і неметали.
Робота з комп'ютером
- Зверніться до електронного додатком. Вивчіть матеріал уроку і виконайте запропоновані завдання.
- Знайдіть в Інтернеті електронні адреси, які можуть служити додатковими джерелами, що розкривають зміст ключових слів і словосполучень параграфа. Запропонуйте вчителю свою допомогу в підготовці нового уроку - зробіть повідомлення за ключовими словами і словосполученнями наступного параграфа.
Запитання і завдання
- Розгляньте етимологію назв окремих благородних газів.
- Чому хімічно невірно поетичне вираження «У повітрі пахло грозою»?
- Запишіть схеми утворення молекул: Na 2, Br 2, O 2, N 2. Який тип хімічного зв'язку в цих молекулах?
- Який тип хімічного зв'язку повинен бути в металевому водні?
- Експедиція полярного дослідника Р. Скотта до Південного полюса в 1912 р загинула через те, що втратила весь запас пального: воно знаходилося в запаяних оловом баках. який хімічний процес лежав в основі цього?
Лекція 3. Неметали
1. Загальна характеристика елементів-неметалів
Хімічних елементів-неметалів всього 16, але два з них, кисень і кремній складають 76% від маси земної кори. Неметали складають 98,5% від маси рослин і 97,6% від маси людини. З вуглецю, водню, кисню, сірки, фосфору й азоту складаються всі найважливіші органічні речовини, вони є елементами життя. Водень і гелій - основні елементи Всесвіту з них складаються всі космічні об'єкти, включаючи наше Сонце. Без з'єднань неметалів неможливо уявити наше життя, особливо якщо згадати, що життєво важливе хімічне з'єднання - вода - складається з водню і кисню.
Неметали - це хімічні елементи, атоми яких беруть електрони для завершення зовнішнього енергетичного рівня, утворюючи при цьому негативно заряджені іони.
Практично всі неметали мають порівняно малі радіуси і велике число електронів на зовнішньому енергетичному рівні від 4 до 7, для них характерні високі значення електронегативності і окисні властивості.
1.1. Положення елементів-неметалів в Періодичній системі хімічних елементів Менделєєва
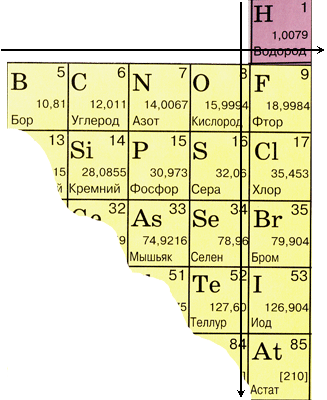
Якщо в Періодичній системі провести діагональ від бору до астату, то справа вгору по діагоналі будуть знаходитися елементи-неметали, а зліва знизу - метали, до них же відносяться елементи всіх побічних підгруп, лантаноїди і актиноїди. Елементи, розташовані поблизу діагоналі, наприклад, берилій, алюміній, титан, германій, сурма, мають двоїстим характером і відносяться до Металоїди. Елементи-неметали: s-елемент - водень; р-елементи 13 групи - бор; 14 групи - вуглець і кремній; 15 групи - азот, фосфор і миш'як, 16 групи - кисень, сірка, селен і телур і все елементи 17 групи - фтор, хлор, бром, йод і астат. Елементи 18 групи - інертні гази, займають особливе становище, вони мають повністю завершений зовнішній електронний шар і займають проміжне положення між металами і неметалами. Їх іноді відносять до неметалів, але формально, за фізичними ознаками.
1.2. Електронна будова елементів-неметалів
Практично всі елементи-неметали на зовнішньому енергетичному рівні мають велике число електронів - від 4 до 7. Елемент бор - аналог алюмінію, у нього всього 3 електрона на зовнішньому енергетичному рівні, але він має малий радіус, міцно утримує свої електрони і має властивості неметалла. Особливо відзначимо електронна будова водню. Це s-елемент, але він досить легко приймає один електрон, утворює гідрид-іон і виявляє окисні властивості металу.
Електронні конфігурації валентних електронів елементів-неметалів наведені в таблиці:
1.3. Закономірності в зміні властивостей елементів-неметалів
Розглянемо деякі закономірності в зміні властивостей елементів-неметалів, що належать одному періоду і одній групі на підставі будови їх атомів.
У періоді:
Заряд ядра збільшується,
Радіус атома зменшується,
Число електронів на зовнішньому енергетичному рівні збільшується,
Електронегативність збільшується,
Окисні властивості посилюються,
Неметалічні властивості посилюються.
В групі:
Заряд ядра збільшується,
Радіус атома збільшується,
Число електронів на зовнішньому енергетичному рівні не змінюється,
Електронегативність зменшується,
Окисні властивості слабшають,
Неметалічні властивості слабшають.
Таким чином, чим правіше і вище стоїть елемент в Періодичній системі, тим яскравіше виражені його неметалеві властивості.
- це здатність поляризувати хімічний зв'язок, Відтягувати до себе загальні електронні пари.
До неметаллам відносять 22 елементи.
Положення неметалічних елементів у періодичній системі хімічних елементів
| Група | I | III | IV | V | VI | VII | VIII |
| 1-й період | Н | He | |||||
| 2-й період | В | З | N | O | F | Ne | |
| 3-й період | Si | P | S | CL | Ar | ||
| 4-й період | As | Se | Br | Kr | |||
| 5-й період | Te | I | Xe | ||||
| 6-й період | At | Rn |
Будова атомів неметалів
Характерною особливістю неметалів є більше (в порівнянні з металами) число електронів на зовнішньому енергетичному рівні їх атомів. Це визначає їх велику здатність до приєднання додаткових електронів і прояву більш високою окисної активності, ніж у металів. Особливо сильні окислювальні властивості, т. Е. Здатність приєднувати електрони, виявляють неметали, що знаходяться в 2-му і 3-му періодах VI-VII груп. Якщо порівняти розташування електронів по орбіталях в атомах фтору, хлору та інших галогенів, то можна судити і про їх відмінні властивості. У атома фтору вільних орбіталей немає. Тому атоми фтору можуть проявити лише валентність I і ступінь окислення - 1. Найсильнішим окислювачем є фтор . В атомах інших галогенів, наприклад в атомі хлору, на тому ж енергетичному рівні є вільні d-орбіталі. Завдяки цьому розпарювання електронів може відбутися трьома різними шляхами. У першому випадку хлор може проявити ступінь окислення +3 і утворити хлористую кислоту HClO 2, якій відповідають солі - хлорити, наприклад хлорит калію KClO 2. У другому випадку хлор може утворити з'єднання, в яких ступінь окислення хлору +5. До таких сполук відносяться хлоратна кислота HClO 3 і її солі - хлорати, наприклад хлорат калію КClO 3 (бертолетової сіль). У третьому випадку хлор проявляє ступінь окислення +7, наприклад в хлорним кислоті HClO 4 і в її солях, - перхлорати (в перхлорат калію КClO 4).Будівлі молекул неметалів. Фізичні властивості неметалів
У газоподібному стані при кімнатній температурі знаходяться:· водень - H 2;
· азот - N 2;
· кисень - O 2;
· фтор - F 2;
· хлор - CI 2.
І інертні гази:· гелій - He;
· неон - Ne;
· аргон - Ar;
· криптон - Kr;
· ксенон - Xe;
· радон - Rn).
В рідкому - бром - Br.В твердому:
· Телур - Te;
· йод - I;
· астат - At.
Набагато багатше у неметалів і спектр кольорів: червоний - у фосфору, бурий - у брому, жовтий - у сірки, жовто-зелений - у хлору, фіолетовий - у пари йоду і т. Д.Найтиповіші неметали мають молекулярну будову, а менш типові - немолекулярное. Цим і пояснюється відмінність їх властивостей.
Склад і властивості простих речовин - неметалів
Неметали утворюють як одноатомні, так і двоатомних молекули. До одноатомних неметаллам відносяться інертні гази, практично не реагують навіть з самими активними речовинами. Інертні гази розташовані в VIII групі періодичної системи, а хімічні формули відповідних простих речовин наступні: He, Ne, Ar, Kr, Xe і Rn.
Деякі неметали утворюють двоатомні молекули. Це H 2, F 2, Cl 2, Br 2, Cl 2 (елементи VII групи періодичної системи), а також кисень O 2 і азот N 2. з трьохатомних молекул складається газ озон (O 3). Для речовин неметалів, що знаходяться в твердому стані, скласти хімічну формулу досить складно. Атоми вуглецю в графіті з'єднані один з одним по-різному. Виділити окрему молекулу в наведених структурах важко. при написанні хімічних формул таких речовин, як і в випадку з металами, вводиться припущення, що такі речовини складаються тільки з атомів. Хімічні формули, при цьому, записуються без індексів: C, Si, S і т. Д. Такі прості речовини, як озон і кисень, що мають однаковий якісний склад (обидва складаються з одного і того ж елемента - кисню), але різняться за кількістю атомів в молекулі, мають різні властивості. Так, кисень запаху не має, в той час як озон має різким запахом, який ми відчуваємо під час грози. Властивості твердих неметалів, графіту і алмазу, мають також однаковий якісний склад, але різну будову, різко відрізняються (графіт крихкий, алмаз твердий). Таким чином, властивості речовини визначаються не тільки його якісним складом, але і тим, скільки атомів міститься в молекулі речовини і як вони пов'язані між собою. Неметали у вигляді простих тіл знаходяться в твердому або газоподібному стані (виключаючи бром - рідина). Вони не мають фізичних властивостей, властивих металам. Тверді неметали не володіють характерним для металів блиском, вони зазвичай тендітні, погано проводять електричний струм і тепло (за винятком графіту). Кристалічний бор В (як і кристалічний кремній) має дуже високою температурою плавлення (2075 ° С) і високу стійкість. Електрична провідність бору з підвищенням температури сильно збільшується, що дає можливість широко застосовувати його в напівпровідниковій техніці. Добавка бору до сталі і до сплавів алюмінію, міді, нікелю та ін. Покращує їх механічні властивості. Бориди (сполуки бору з деякими металами, наприклад з титаном: TiB, TiB 2) необхідні при виготовленні деталей реактивних двигунів, лопаток газових турбін. Як видно зі схеми 1, вуглець - С, кремній - Si, бор - В мають схожу будову і володіють деякими загальними властивостями. Як прості речовини вони зустрічаються в двох видозмінах - в кристалічному і аморфному. Кристалічні видозміни цих елементів дуже тверді, з високими температурами плавлення. Кристалічний кремній має напівпровідниковими властивостями. Всі ці елементи утворюють сполуки з металами - карбіди, силіциди та бориди (CaC 2, Al 4 C 3, Fe 3 C, Mg 2 Si, TiB, TiB 2). Деякі з них мають більшу твердість, наприклад Fe 3 C, TiB. Карбід кальцію використовується для отримання ацетилену.
\u003e\u003e Хімія: Прості речовини - неметали
Неметали - це хімічні елементи, які утворюють у вільному вигляді прості речовини, що не володіють фізичними властивостями металів. З 109 хімічних елементів 87 ставляться до металам, 22 є неметалами.
6. Відносність поділу простих речовин на метали і неметали.
Розгляньте етимологію назв окремих благородних металів.
Чому хімічно невірно поетичне виражена: «У повітрі пахло грозою»?
Запишіть схеми утворення молекул: Nа2, Вr2, О2, N2. Який тип зв'язку в цих молекулах?
зміст уроку конспект уроку опорний каркас презентація уроку акселеративного методи інтерактивні технології Практика завдання і вправи самоперевірка практикуми, тренінги, кейси, квести домашні завдання дискусійні питання риторичні питання від учнів ілюстрації аудіо-, відео- та мультимедіа фотографії, картинки графіки, таблиці, схеми гумор, анекдоти, приколи, комікси притчі, приказки, кросворди, цитати додатки реферати статті фішки для допитливих шпаргалки підручники основні і додаткові словник термінів інші Удосконалення підручників та уроків виправлення помилок в підручнику оновлення фрагмента в підручнику елементи новаторства на уроці заміна застарілих знань новими Тільки для вчителів ідеальні уроки календарний план на рік методичні рекомендації програми обговорення інтегровані уроки