сторінка 1
Кристалічна решітка алюмінію - гранецентрированную-ний куб, яка стійка при температурі від 4 К до точки плавлення.
Кристалічна решітка алюмінію складається, як і у багатьох інших металів, з гра-нецентрованого кубів (див. Стор. Теплопровідність алюмінію вдвічі більше теплопровідності заліза і дорівнює половині теплопровідності міді. Його електропровідність набагато вище електропровідності заліза і досягає 60% електропровідності міді.
Спотворення кристалічної решітки алюмінію внаслідок її перенасичення міддю призводить до підвищення міцності і твердості сплаву. Коли загартований сплав знаходиться на повітрі, в ньому мимоволі протікають процеси, що змінюють структуру. Атоми міді, прагнучи виділитися з кристалічної решітки алюмінію, групуються в окремих її ділянках, рівномірно розподілені по всьому об'єму сплаву. Це збільшує спотворення кристалічної решітки і підвищує твердість і міцність сплаву. У місцях скупчення атомів міді утворюється кристалічна решітка СіА12, в якій атоми А1, що знаходяться по межі, одночасно входять в структуру кристалічної решітки CuAls і кристалічної решітки алюмінію. Утворення такої структури веде до подальшого спотворення кристалічної решітки алюмінію і, як наслідок, до зміцнення сплаву.
Так, кристалічна решітка алюмінію, міді, срібла має форму гранецентрированного куба; натрію, калію, барію - об'ємно-центрованої куба, а магній, цинк і кадмій кристалізуються в гексагональної решітці. Деякі метали кристалізуються в двох або декількох поліморфних формах.
Ці елементи, розчиняючись в кристалічній решітці алюмінію, істотно його зміцнюють і лише незначно зменшують пластичність, забезпечуючи хорошу деформованість сплавів.
Оскільки мідь володіє великим атомним радіусом (/ GU 1 275 А), це спотворює кристалічну решітку алюмінію (rAi 1 43 А) і підвищує механічні властивості сплаву. Витримка при 150 - 180 С викликає штучне старіння, що супроводжується розпадом твердого розчину з виділенням в місцях концентрації міді проміжної 0 -фази, що не відрізняється за хімічним складом від стабільної фази СіА12, але має перекручену тетрагональную грати.
Оскільки мідь володіє великим атомним радіусом (г сі 1 275 А), це спотворює кристалічну решітку алюмінію / А1 1 43 А) і підвищує механічні властивості сплаву. Витримка при 150 - 180 С викликає штучне старіння, що супроводжується розпадом твердого розчину з виділенням в місцях концентрації міді проміжної б - фази, яка не вирізняється за хімічним складом від стабільної фази СіА12, але має перекручену тетрагональную грати.
Активність А1 обумовлена \u200b\u200bне тільки участю в утворенні зв'язків d - орбіталей, а й меншою в порівнянні з бором міцністю кристалічної решітки алюмінію.
Активність алюмінію обумовлена \u200b\u200bне тільки участю в утворенні зв'язків rf - орбіталей, а й меншою в порівнянні з бором міцністю кристалічної решітки алюмінію.
Електронний пучок, що падає на алюмінієву пластинку, дає при відображенні дифракційну картину, причому кутове відхилення (від центру цієї картини) дифракційного максимуму другого порядку в Г Період кристалічної решітки алюмінію (відстань між атомними площинами) d 0 405 нм.
Так, кристалічна решітка алюмінію, міді і срібла має форму гранецентрированного куба; натрію, калію і барію - об'ємно-центрованого куба, а магнію, цинку і кадмію - гексагональну решітку. Деякі метали кристалізуються в двох або декількох поліморфних формах.
На повітрі алюміній швидко покривається тонкою окісної плівкою. Перші шари цієї плівки відтворюють кристалічну решітку алюмінію, утворюючи дуже міцне з'єднання. За останні 15 років механізм зростання окисної плівки вдалося використати для створення виключно жароміцних сплавів, усталених дисперсними частинками окису алюмінію. Спеціально вирощуючи хімічним або електрохімічним способом стовщену плівку і вводячи в неї різні наповнювачі, можна надати їй будь-який колір.
Свежезакаленний дуралюмин має низьку міцність і високу пластичність, незважаючи на наявність пересичені твердого розчину міді в алюмінії. Це пов'язано з тим, що будова кристалічної решітки алюмінію і міді однакове (ГЦК), а параметри решіток відрізняються незначно. Високі міцнісні властивості дуралюмин набуває лише в результаті подальшого старіння. Старінням називається процес зміни будови і властивостей загартованих сплавів, що відбувається мимовільно при кімнатній або підвищеній температурі.
Силуміни, зміцнюючих після термічної обробки, наприклад, після гарту при 520 - 530 і тривалого штучного старіння протягом 10 - 30 год. Їх висока міцність після старіння пояснюється викривленням кристалічної решітки алюмінію і виділенням зон Гинье - Престона.
«Кристалічні решітки хімія» - Молекулярними називають кристалічні решітки, у вузлах яких розташовуються молекули. Оцінка власного просування. Тверда речовина. У природі зустрічається трохи речовин з атомної кристалічною решіткою. Металеві. Атомні. Іонні кристалічні решітки мають солі, деякі оксиди і гідроксиди металів.
«Кристалічні і аморфні тіла» - Друза Маріона. Нобелівські лауреати. Установка для вирощування оптичних кристалів. Аморфне тіло. Полікристал металу. Друза кристалів гірського кришталю. Н.Г. Басов. Перша установка для вирощування кристалів ПРОМІНЬ. Полікристал аметисту (різновид кварцу). Крупнозернистий кристал сірки. Властивості твердих тіл.
«Властивості алюмінію» - Алюміній як проста речовина: отримання. Алюміній як проста речовина: хімічні властивості: Непарний. Ar \u003d 27. Розгляньте діаграму. Що стосується труднощі поставте знак питання навпроти відповідного властивості. Алюмосилікати складають основну масу земної кори. Зробіть висновок про поширеність алюмінію в земній корі в порівнянні з іншими металами.
«Кристалічні ґрати» - Завдання: Визначте тип хімічного зв'язку в даних сполуках: Характеристика основних типів кристалічних решіток. тема уроку кристалічною решіткою. Класифікація твердих речовин. HCl, Cl2, H2O, NaBr, BaCl2, CaS, O2, NH3, CO2, C.
«9 клас Алюміній» - Отримання алюмінію. Амфотерность алюмінію. Метали. Положення алюмінію в періодичній системі Д. І. Менделєєва. Урок хімії в 9 класі по темі «Алюміній». 3. З підставами. AL. Фізичні властивості алюмінію. Хімічні властивості алюмінію. 2. З кислотами (з сірчаної і соляної (розведеної). Електроліз - основний спосіб отримання алюмінію сьогодні.
«Метал алюміній» - Застосування. Має амфотерні властивості. Взаємодія з водою. Фізичні властивості. Вперше був отриманий датським фізиком Ерстед в 1925 році. Здатний до взаємодії під дією температури з сіркою, азотом і вуглецем. Найпоширеніший метал у природі. Взаємодія з кислотами. Алюмінат барію - для очищення води від сульфат, карбонатіонов і іонів кальцію.





![]()








 Назад вперед
Назад вперед
Увага! Попередній перегляд слайдів використовується виключно в ознайомлювальних цілях і може не давати уявлення про всі можливості презентації. Якщо вас зацікавила дана робота, будь ласка, завантажте повну версію.
Тип урокуКомбінований.
Основна мета уроку: Дати учням конкретні уявлення про аморфних і кристалічних речовинах, типах кристалічних решіток, встановити взаємозв'язок між будовою і властивостями речовин.
Завдання уроку.
Освітня: сформувати поняття про кристалічному і аморфному стані твердих тіл, ознайомити учнів з різними типами кристалічних решіток, встановити залежність фізичних властивостей кристала від характеру хімічного зв'язку в кристалі і типу кристалічної решітки, дати учням основні уявлення про вплив природи хімічного зв'язку і типів кристалічних решіток на властивості речовини, дати учням уявлення про закон сталості складу.
Виховна: продовжити формування світогляду учнів, розглянути взаємний вплив компонентів целого- структурних частинок речовин, в результаті якого з'являються нові властивості, виховувати вміння організувати свій навчальний працю, дотримуватися правил роботи в колективі.
Розвиваюча: розвивати пізнавальний інтерес школярів, використовуючи проблемні ситуації; удосконалювати вміння учнів встановлювати причинно-наслідковий залежність фізичних властивостей речовин від хімічного зв'язку і типу кристалічної решітки, передбачати тип кристалічної решітки на основі фізичних властивостей речовини.
Обладнання: Періодична система Д. І. Менделєєва, колекція "Метали", неметали: сірка, графіт, червоний фосфор, кисень; Презентація "Кристалічні решітки", моделі кристалічних решіток різних типів (кухонної солі, алмазу і графіту, вуглекислого газу і йоду, металів), зразки пластмас і виробів з них, скло, пластилін, смоли, віск, жувальна гумка, шоколад, комп'ютер, мультимедійна установка, відеопит "Сублімація бензойної кислоти".
Хід уроку
1. Організаційний момент.
Учитель вітає учнів, фіксує відсутніх.
Потім повідомляє тему уроку і мета уроку. Учні записують тему уроку в зошит. (Cлайд 1, 2).
2. Перевірка домашнього завдання
(2 учні біля дошки: Визначити вид хімічного зв'язку для речовин з формулами:
1) NaCl, CO 2, I 2; 2) Na, NaOH, H 2 S (записують відповідь на дошці і включаються в опитування).
3. Аналіз ситуації.
Учитель: Що вивчає хімія? Відповідь: Хімія - це наука про речовинах, їх властивості та перетвореннях речовин.
Учитель: Що ж таке речовина? Відповідь: Речовина - це те, з чого складається фізичне тіло. (Cлайд 3).
Учитель: Які агрегатні стани речовин ви знаєте?
Відповідь: Існує три агрегатних стани: тверде, рідке і газоподібне. (Cлайд 4).
Учитель: Наведіть приклади речовин, які при різних температурах можуть існувати у всіх трьох агрегатних станах.
Відповідь: Вода. при звичайних умовах вода знаходиться в рідкому стані, при зниженні температури нижче 0 0 С вода переходить в твердий стан - лід, а при підвищенні температури до 100 0 С ми отримаємо водяна пара (газоподібний стан).
Учитель (доповнення): Будь-яка речовина можна отримати в твердому, рідкому і газоподібному вигляді. Крім води - це метали, які при нормальних умовах перебувають в твердому стані, при нагріванні починають розм'якшуватися, і при певній температурі (t пл) переходять в рідкий стан - плавляться. При подальшому нагріванні, до температури кипіння, метали починають випаровуватися, тобто переходити в газоподібний стан. Будь газ можна перевести в рідкий і твердий стан, знижуючи температуру: наприклад, кисень, який при температурі (-194 0 С) перетворюється в рідину блакитного кольору, а при температурі (-218,8 0 С) твердне в снегообразную масу, що складається з кристалів синього кольору. Сьогодні на уроці ми будемо розглядати твердий стан речовини.
Учитель: Назвіть, які тверді речовини знаходяться у вас на столах.
Відповідь: Метали, пластилін, кухонна сіль: NaCl, графіт.
Учитель: Як ви думаєте? Яке з цих речовин зайве?
Відповідь: Пластилін.
Учитель: Чому?
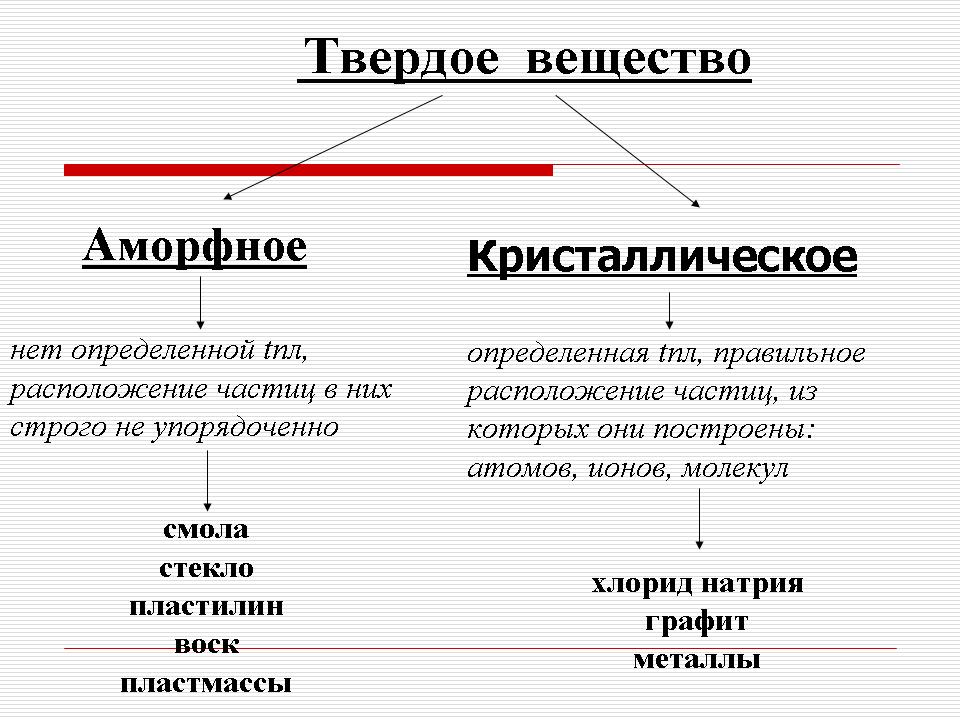
Робляться припущення. Якщо учні не можуть, то за допомогою вчителя приходять до висновку, що пластилін на відміну від металів і хлориду натрію не має певної температури плавлення - він (пластилін) поступово розм'якшується і в текучий стан. Такий, наприклад, шоколад, який тане в роті, або жувальна гумка, а також скло, пластмаси, смоли, віск (при поясненні вчитель демонструє класу зразки цих речовин). Такі речовини називають аморфними. (Слайд 5), а метали і хлорид натрію - кристалічні. (Cлайд 6).
Таким чином, розрізняють два види твердих речовин : аморфні і кристалічні. (Слайд7).
1) У аморфних речовин немає певної температури плавлення і розташування частинок в них строго не впорядковано.
Кристалічні речовини мають строго певну температуру плавлення і, головне, характеризуються правильним розташуванням частинок, з яких вони побудовані: атомів, молекул та іонів. Ці частинки розташовані в строго визначених точках простору, і, якщо ці вузли з'єднати прямими лініями, то утворюється просторовий каркас - кристалічна решітка.
учитель задає проблемні питання
Як пояснити існування твердих речовин з настільки різними властивостями?
2) Чому кристалічні речовини при ударі розколюються в певних площинах, а аморфні речовини цієї властивості не мають?
Вислухати відповіді учнів і підвести їх до висновку:
Властивості речовин в твердому стані залежать від типу кристалічної решітки (перш за все від того, які частки знаходяться в її вузлах), що, в свою чергу, обумовлено типом хімічного зв'язку в даній речовині.
Перевірка домашнього завдання:
1) NaCl - іонна зв'язок,
СО 2 - ковалентний полярна зв'язок
I 2 - ковалентний неполярний зв'язок
2) Na - металева зв'язок
NаОН - іонна зв'язок між Na + іон - (О і Н ковалентная)
Н 2 S - ковалентний полярна
Фронтальне опитування.
- Який зв'язок називається іонної?
- Який зв'язок називається ковалентним?
- Який зв'язок називається ковалентним полярної? неполярной?
- Що називається електронегативні?
Висновок: Простежується логічна послідовність, взаємозв'язок явищ в природі: Будова атома-\u003e ЕО\u003e Види хімічної зв'язку-\u003e Тип кристалічної решеткі-\u003e Властивості речовин . (Слайд 10).
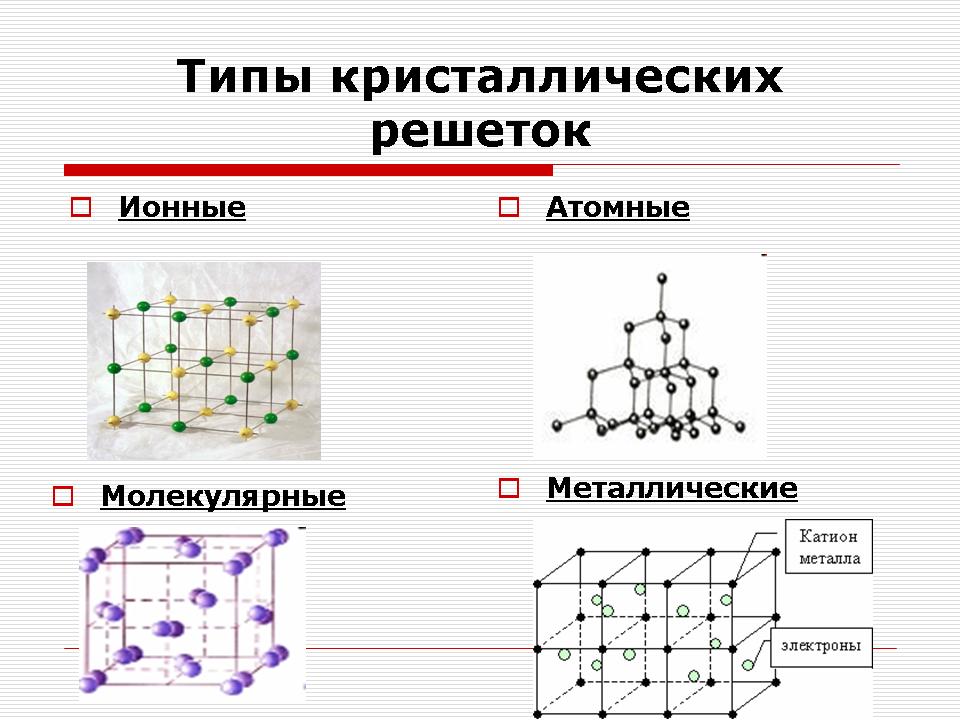
Учитель: Залежно від виду частинок і від характеру зв'язку між ними розрізняють чотири типи кристалічних решіток: іонні, молекулярні, атомні і металеві. (Cлайд 11).
Результати оформляються в наступну таблицю-зразок таблиці в учнів на парті. (Див. Додаток 1). (Cлайд 12).
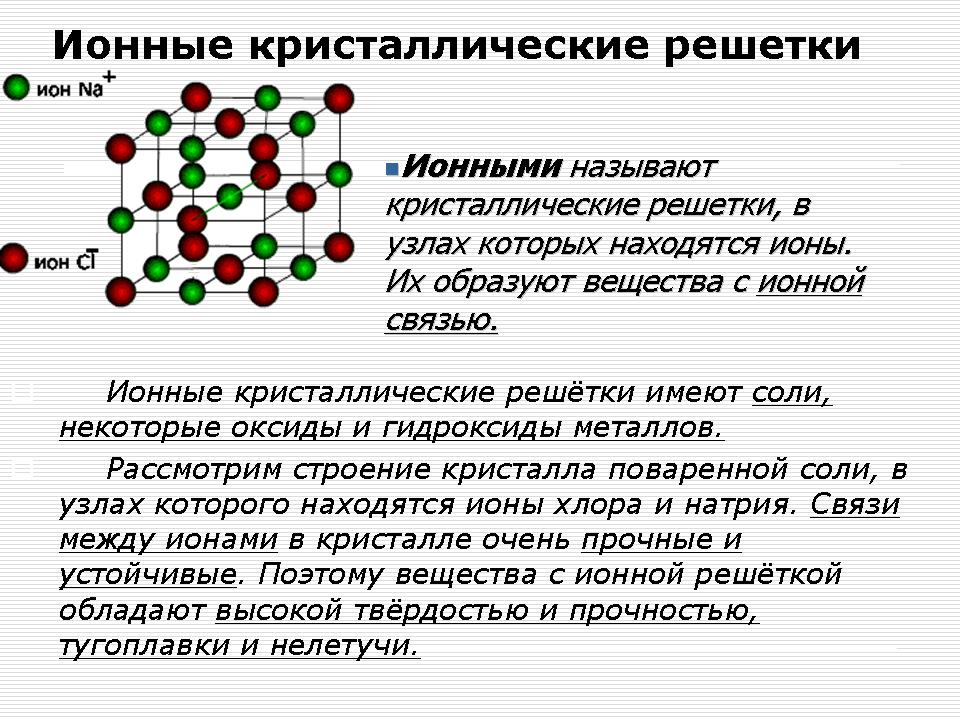
Іонні кристалічні решітки
Учитель: Як ви думаєте? Для речовин з яким видом хімічного зв'язку буде характерний такий вид решітки?
Відповідь: Для речовин з іонним хімічним зв'язком буде характерна іонна решітка.
Учитель: Які частинки будуть знаходитися в вузлах решітки?
Відповідь: Іони.
Учитель: Які частинки називаються іонами?
Відповідь: Іони-це частинки, які мають позитивний або негативний заряд.
Учитель: Які іони бувають за складом?
Відповідь: Прості і складні.
Демонстрація - модель кристалічної решітки хлориду натрію (NaCl).
Пояснення вчителя: У вузлах кристалічної решітки хлориду натрію знаходяться іони натрію і хлору.

У кристалах NaCl окремих молекул хлориду натрію не існує. Весь кристал слід розглядати як гігантську макромолекулу, що складається з рівної кількості іонів Na + і Cl -, Na n Cl n, де n - велике число.
Зв'язки між іонами в такому кристалі дуже міцні. Тому речовини з іонним гратами мають порівняно високу твердість. Вони тугоплавкі, нелеткі, тендітні. Розплави їх проводять електричний струм (Чому?), Легко розчиняються у воді.
Іонні сполуки - це бінарні сполуки металів (I А і II A), солі, луги.
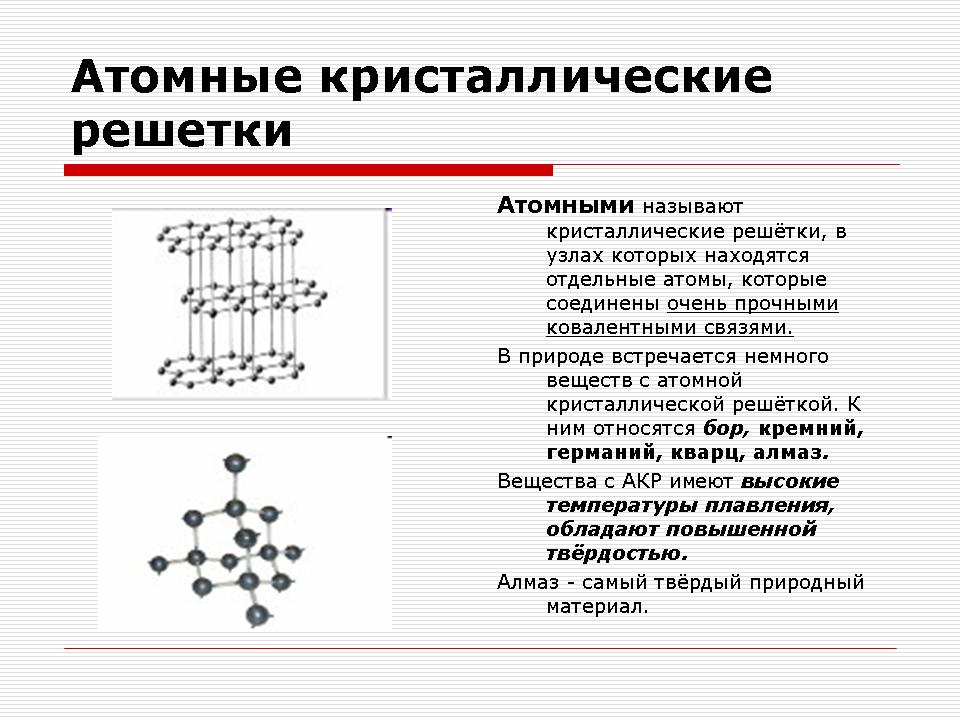
Атомні кристалічні решітки
Демонстрація кристалічних решіток алмазу і графіту.
В учнів на столі зразки графіту.
Учитель: Які частинки будуть знаходитися в вузлах атомної кристалічної решітки?
Відповідь: В вузлах атомної кристалічної решітки знаходяться окремі атоми.
Учитель: Який хімічний зв'язок між атомами виникатиме?
Відповідь: Ковалентний хімічний зв'язок.
Пояснення вчителя.
Дійсно, в вузлах атомних кристалічних решіток знаходяться окремі атоми, пов'язані між собою ковалентними зв'язками. Так як атоми, подібно іонів, можуть по-різному розташовуватися в просторі, то утворюються кристали різної форми.
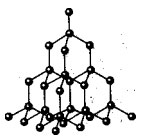
Атомна кристалічна решітка алмаза
В даних решітках молекули відсутні. Весь кристал слід розглядати як гігантську молекулу. Прикладом речовин з таким типом кристалічних решіток можуть служити аллотропние модифікації вуглецю: алмаз, графіт; а також бор, кремній, червоний фосфор, германій. Питання: Які ці речовини за складом? Відповідь: Прості за складом.
Атомні кристалічні решітки мають не тільки прості, але і складні. Наприклад, оксид алюмінію, оксид кремнію. Всі ці речовини мають дуже високі температури плавлення (у алмазу понад 3500 0 С), міцні і тверді, нелеткі, практично нерозчинні в рідинах.
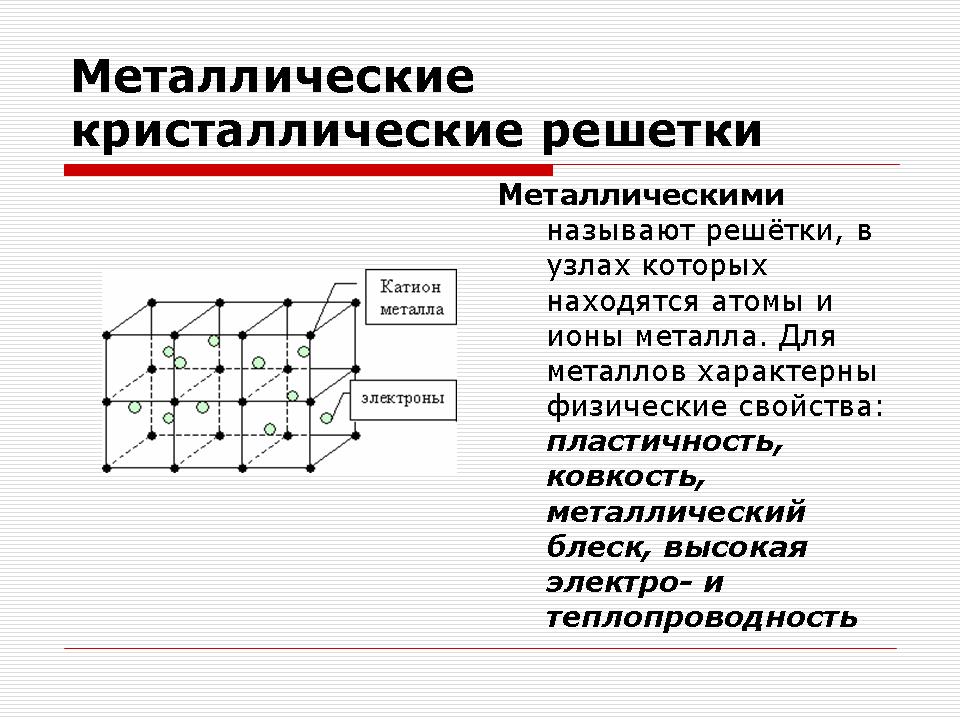
Металеві кристалічні решітки
Учитель: Хлопці, у вас на столах колекція металів, розглянемо ці зразки.
Питання: Який хімічний зв'язок характерна для металів?
Відповідь: Металева. Зв'язок в металах між позитивними іонами за допомогою обобществленних електронів.
Питання: Які загальні фізичні властивості для металів характерні?
Відповідь: Блиск, електропровідність, теплопровідність, пластичність.
Питання: Поясніть, у чому причина того, що у такого числа різноманітних речовин однакові фізичні властивості?
Відповідь: Метали мають єдине будова.
Демонстрація моделей кристалічних решіток металів.
Пояснення вчителя.
Речовини з металевою зв'язком мають металеві кристалічні решітки
У вузлах таких грат знаходяться атоми і позитивні іони металів, а в об'ємі кристала вільно переміщаються валентні електрони. Електрони електростатично притягують позитивні іони металів. Цим пояснюється стабільність решітки.
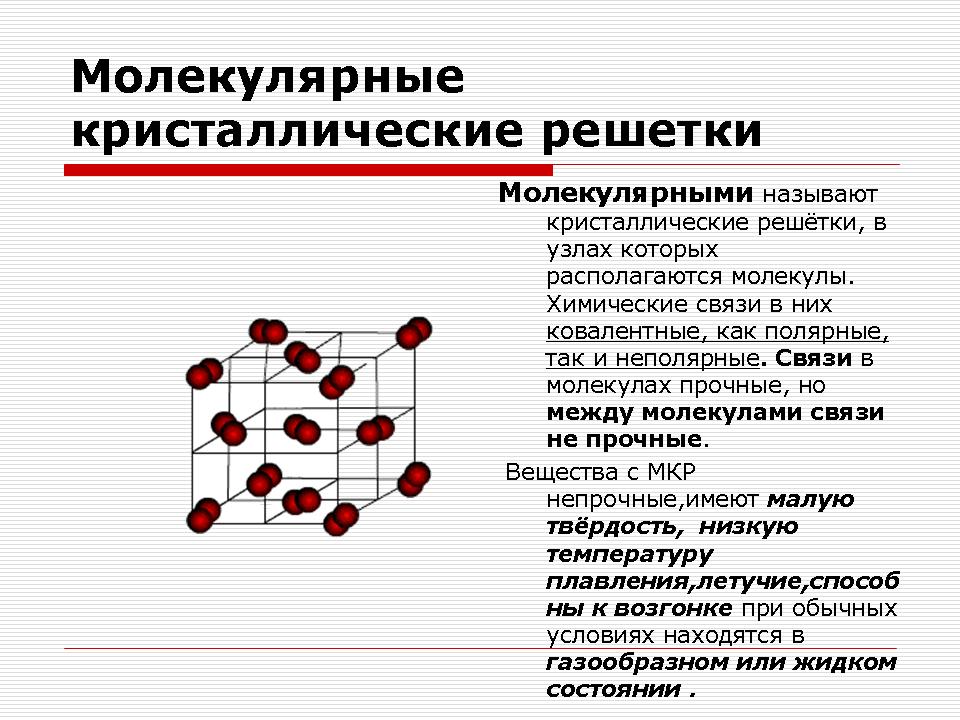
Молекулярні кристалічні решітки
Учитель демонструє і називає речовини: йод, сірка.
Питання: Що об'єднує ці речовини?
Відповідь: Ці речовини є неметалами. Прості за складом.
Питання: Який хімічний зв'язок всередині молекул?
відповідь: Хімічна зв'язок всередині молекул ковалентная неполярная.
Питання: Які фізичні властивості для них характерні?
Відповідь: Летючі, легкоплавкі, малорозчинні у воді.
Учитель: Давайте порівняємо властивості металів і неметалів. Учні відповідають, що властивості принципово відрізняються.
Питання: Чому властивості неметалів сильно відрізняються від властивостей металів?
Відповідь: У металів зв'язок металева, а у неметалів ковалентная неполярная.
Учитель: Отже, і тип решітки інший. Молекулярна.
Питання: Які частинки знаходяться в вузлах решітки?
Відповідь: Молекули.
Демонстрація кристалічних решіток вуглекислого газу і йоду.
Пояснення вчителя.
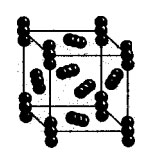
Молекулярна кристалічна решітка
Як бачимо, молекулярну кристалічну решітку можуть мати не тільки тверді прості речовини: благородні гази, H 2, O 2, N 2, I 2, O 3, білий фосфор Р 4, але і складні: Тверда вода, тверді хлороводород і сірководень. Більшість твердих органічних сполук мають молекулярні кристалічні решітки (нафталін, глюкоза, цукор).
У вузлах решіток знаходяться неполярні або полярні молекули. Незважаючи на те, що атоми всередині молекул пов'язані міцними ковалентними зв'язками, між самими молекулами діють слабкі сили міжмолекулярної взаємодії.
висновок:Речовини неміцні, мають малу твердість, низьку температуру плавлення, летючий, здатні до сублімації.
питання : Який процес називається сублімацією або сублімацією?
відповідь : Перехід речовини з твердого агрегатного стану відразу в газоподібний, оминаючи рідкий, називається сублімацією або сублімацією.
Демонстрація досвіду: сублімація бензойної кислоти (відеоопит).
Робота із заповненою таблицею.
Додаток 1. (Слайд 17)
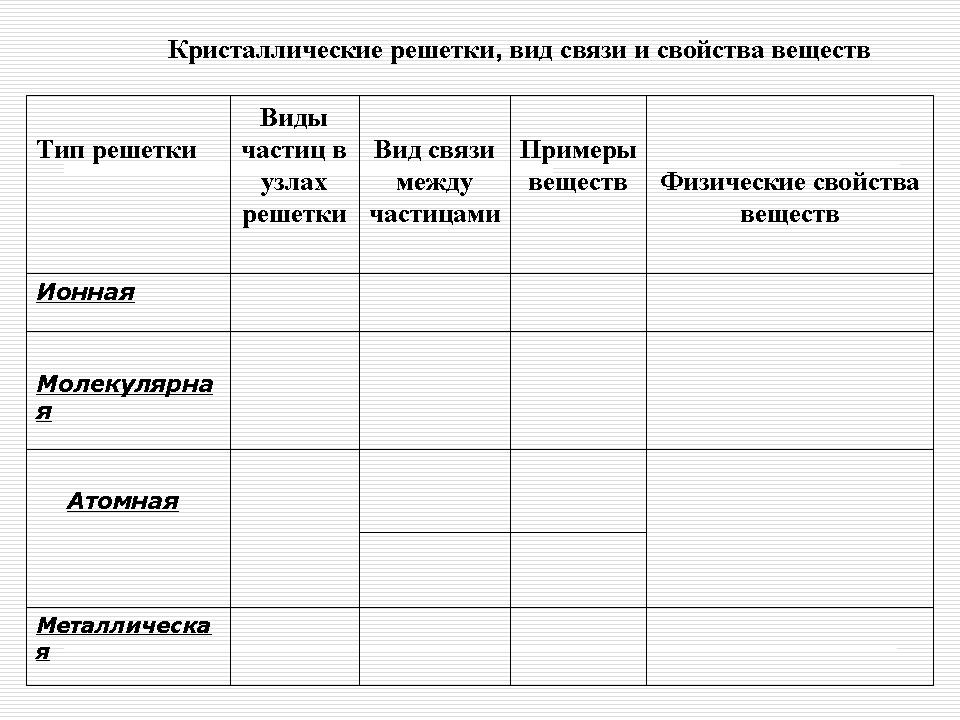
Кристалічні решітки, вид зв'язку та властивості речовин
| Тип решітки | Види частинок у вузлах решітки |
Вид зв'язку між частинками | приклади речовин | Фізичні властивості речовин |
| іонна | Іони | Іонна - зв'язок міцна | Солі, нітрати (IA, IIA), оксиди і гідроксиди типових металів | Тверді, міцні, нелеткі, тендітні, тугоплавкі, багато розчинні у воді, розплави проводять електричний струм |
| атомна | атоми | 1. Ковалентний неполярний - зв'язок дуже міцна 2. Ковалентний полярна - зв'язок дуже міцна |
прості речовина: Алмаз (C), графіт (C), бор (B), кремній (Si).
Складні речовини: оксид алюмінію (Al 2 O 3), оксид кремнію (IY) -SiO 2 |
Дуже тверді, дуже тугоплавкі, міцні, нелеткі, не розчинні у воді |
| молекулярна | молекули | Між молекумі- слабкі сили міжмолекулярної тяжіння, а ось всередині молекулпрочная ковалентний зв'язок | Тверді речовини при особливих умовах, які при обичних- гази або рідини (О 2, Н 2, Cl 2, N 2, Br 2, H 2 O, CO 2, HCl); сірка, білий фосфор, йод; органічні речовини |
Неміцні, летючі, легкоплавкі, здатні до сублімації, мають невелику твердість |
| металева | Атом-іони | Металліческаяразной міцності | Метали і сплави | Ковкі, мають блиском, пластичністю, тепло- і електропровідні |
Питання: Який тип кристалічної решітки з розглянутих вище не зустрічається в простих речовинах?
Відповідь: Йонні кристалічні решітки.
Питання: Які кристалічні решітки характерні для простих речовин?
Відповідь: Для простих речовин-металів-металева кристалічна решітка; для неметалів - атомна або молекулярна.
Робота з Періодичної системою Д. І. Менделєєва.
Питання: Де в Періодичній системі присутні елементи-метали і чому? Елементи-неметали і чому?
Відповідь: Якщо провести діагональ від бору до астату, то в нижньому лівому кутку від цієї діагоналі будуть знаходитися елементи-метали, тому що на останньому енергетичному рівні вони містять від одного до трьох електронів. Це елементи I A, II A, III A (крім бору), а також олово і свинець, сурма і всі елементи побічних підгруп.
Елементи-неметали знаходяться в верхньому правому куті від цієї діагоналі, тому що на останньому енергетичному рівні містять від чотирьох до восьми електронів. Це елементи IY A, Y A, YI A, YII A, YIII A і бор.
Учитель: Давайте знайдемо елементи неметали, у яких прості речовини мають атомну кристалічну решітку (Відповідь: С, В, Si) і молекулярну ( Відповідь: N, S, O , галогени і благородні гази ).
Учитель: Сформулюйте висновок, як можна визначити тип кристалічної решітки простого речовини в залежності від положення елементів в Періодичній системі Д. І. Менделєєва.
Відповідь: Для елементів-металів, які знаходяться в I A, II A, IIIA (крім бору), а також олова і свинцю, і всіх елементів побічних підгруп в простому речовині тип решітки-металева.
Для елементів-неметалів IY A і бору в простому речовині кристалічна решітка атомна; а у елементів Y A, YI A, YII A, YIII A в простих речовинах кристалічна решітка молекулярна.
Продовжуємо працювати із заповненою таблицею.
Учитель: Подивіться уважно на таблицю. Яка закономірність простежується?
Уважно слухаємо відповіді учнів, після чого разом з класом робимо висновок:
Існує наступна закономірність: якщо відомо будова речовин, то можна передбачити їх властивості, або навпаки: якщо відомі властивості речовин, то можна визначити будову. (Cлайд 18).
Учитель: Подивіться уважно на таблицю. Яку ще класифікацію речовин ви можете запропонувати?
Якщо учні не можуть, то вчитель пояснює, що речовини можна розділити на речовини молекулярного і немолекулярного будови. (Cлайд 19).
Речовини молекулярної будови складаються з молекул.
Речовини немолекулярного будови складаються з атомів, іонів.
Закон сталості складу
Учитель: Сьогодні ми познайомимося з одним з основних законом хімії. Це закон сталості складу, який був відкритий французьким хіміком Ж.Л.Прустом. Закон справедливий тільки для речовин молекулярної будови. В даний час закон читається так: "Молекулярні хімічні сполуки незалежно від способу їх отримання мають постійний склад і властивості". Але для речовин з немолекулярное будовою цей закон не завжди справедливий.
Теоретичне і практичне значення закону полягає в тому, що на його основі складу речовин можна виразити за допомогою хімічних формул (для багатьох речовин немолекулярного будови хімічна формула показує склад не реально існуючої, а умовної молекули).
висновок: хімічна формула речовини містить в собі велику інформацію. (Cлайд 21)
Наприклад, SO 3:
1. Конкретне речовина - сірчаний газ, або оксид сірки (YI).
2.Тіпи речовини - складне; клас - оксид.
3. Якісний склад - складається з двох елементів: сірки і кисню.
4. Кількісний склад - молекула складається із1 атома сірки і 3 атомів кисню.
5.Относительно молекулярна маса - M r (SO 3) \u003d 32 + 3 * 16 \u003d 80.
6. Молярна маса - М (SO 3) \u003d 80 г / моль.
7. Багато іншої інформації.
Закріплення і застосування отриманих знань
(Слайд 22, 23).
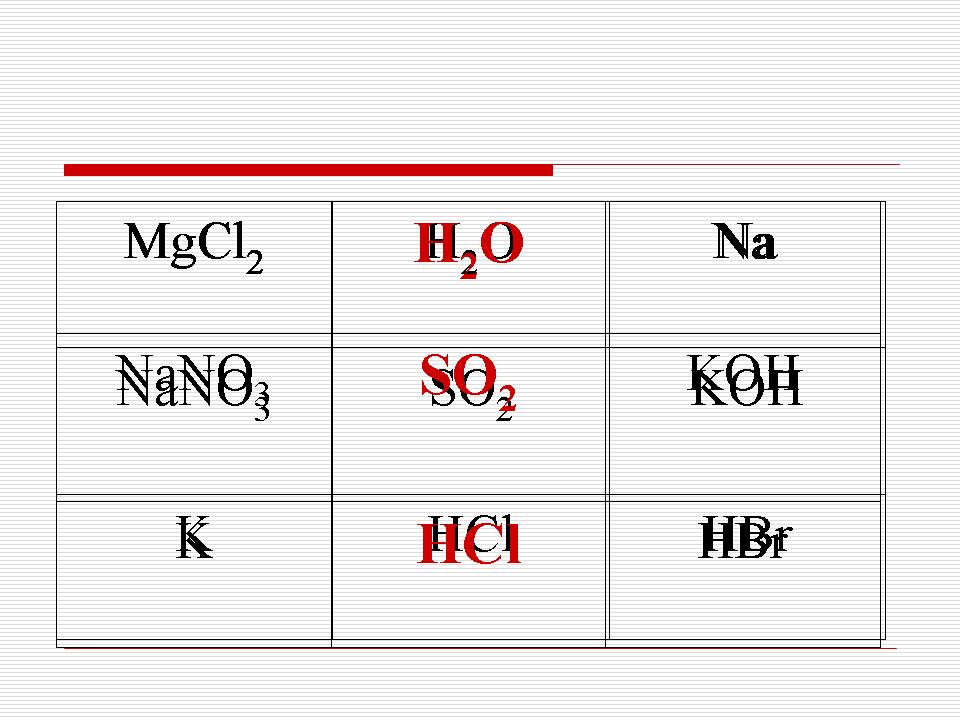
Гра в хрестики-нулики: закресліть по вертикалі, горизонталі, діагоналі речовини, що мають однакову кристалічну решітку.
Рефлексія.
Учитель задає питання: "Хлопці, що нового ви дізналися на уроці?".
Підведення підсумків заняття
Учитель: Хлопці, давайте підведемо основні підсумки нашого уроку - дайте відповідь на питання.
1. Які класифікації речовин ви дізналися?
2. Як ви розумієте термін кристалічна решітка.
3. Які типи кристалічних решіток ви тепер знаєте?
4. Про яку закономірності будови і властивостей речовин ви дізналися?
5. В якому агрегатному стані речовини мають кристалічні решітки?
6. З якими основними законом хімії ви познайомилися на уроці?
Домашнє завдання: §22, конспект.
1. Складіть формули речовин: хлорид кальцію, оксид кремнію (IY), азот, сірководень.
Визначте тип кристалічної решітки і спробуйте прогнозувати: якими мають бути температури плавлення у цих речовин.
2. Творче завдання -\u003e скласти питання до параграфу.
Учитель дякує за урок. Виставляє оцінки учням.
