ГІДРИДИ, З'єднання водню з металами або менш електронегативними, ніж водень, неметалами. Іноді до ГІДРИДИ відносять з'єднання всіх хімічний елементів з воднем. Розрізняють прості, або бінарні, ГІДРИДИ, комплексні (див., Наприклад, алюмогідрідом, борогідріда металів) і ГІДРИДИ інтерметалліч. з'єднань. Для більшості перехідних металів відомі також комплексні сполуки, Що містять атом Н поряд з ін. Лигандами в координац. сфері металу-комплексоутворювача.
Прості гідриди.Відомі для всіх елементів, крім благородних газів, платинових металів (виняток -Pd), Ag, Au, Cd, Hg, In, Tl. Залежно від природи зв'язку елемента (Е) з воднем підрозділяються на ковалентні, іонні (солеобразние) і металлоподобниє (металеві), проте ця класифікація умовна, т. К. Між різні типами простих ГІДРИДИ різких кордонів немає.
До нековалентним відносять ГІДРИДИ неметалів, Al, Be, Sn, Sb. Гідриди SiH 4, GeH 4, SnH 4, PH 3, AsH 3, SbH 3, H 2 S, H 2 Se, H 2 Te (див. Табл. 1) і нижчі Бороводні-гази. Ковалентні ГІДРИДИ мають високу реакційний здатністю. Ефективний покладе. заряд атома Е в молекулі зростає в межах однієї групи періодичної системи зі збільшенням його порядкового номера. Елементи Si і Ge утворюють вищі ГІДРИДИ загальної формули Е n Н 2n + 2 (п2), стабільність яких швидко зменшується зі збільшенням числа атомів Е. Гідриди елементів підгрупи S добре розчинний у воді (розчини мають кислу реакцію), підгрупи Р-незначно. ГІДРИДИ елементів підгрупи Si взаємодія з водою з утворенням ЕО 2 і Н 2. Всі ці ГІДРИДИ розчинний в неполярних або малополярних органічних розчинниках. Ковалентні ГІДРИДИ-сильні відновники. Легко вступають в обмінні реакції, наприклад з галогенідами металів. При 100-300 ° С (H 2 S ок. 400 ° С) розкладаються практично необоротно до Е і Н 2.
Табл. 1.-властивості ПРОСТИХ ковалентних І ІОННИХ гідридів 
* Т-ра розкладання. ГІДРИДИ підгрупи фосфору отримують реакцією ЕCl 3 з Li в ефірі при 25 ° С; SiH 4 і GeH 4-взаємодія Мg 2 Е з водою або з В2 Н 6 в рідкому NH 3; H 2 S, H 2 Se і Н 2 Те-кислотним гідролізом сульфідів, селенидов або теллуридов металів (H 2 S-також взаємодія Н, і S). Всі згадані Г., особливо AsH 3 і РН 3, високотоксичні. Гідриди Ge, Si, As використовують для отримання напівпровідникових матеріалів. Див. Також миш'як гідрид, Сірководень, Сілани, фосфін.
Гідриди вен 2 і AlН 3, існуючі в полімерному стані, а також вкрай нестійкий термічно Ga 2 H 6 по природі хімічної зв'язку Е-Н близькі до бороводородов: для них характерний дефіцит електронів, в зв'язку з чим освіту молекул або кристалів відбувається за участю двухелектронних трехцентрових мостікових (Е-Н-Е) і багатоцентрових зв'язків. Для цих ГІДРИДИ характерні дуже високі ентальпії згоряння. Вони взаємодія з водою, виділяючи Н 2. З донорами електронів, наприклад з NR 3, PR 3, утворюють аддукти, з В2 Н 6 в середовищі апротонних органічне розчинників-відповідно Аl [ВН 4] 3 і Ве [ВН 4] 2. Отримують гідриди Al і Be по реакціях: 
До іонним відносять ГІДРИДИ лужних і щел.-зем. металів (крім Mg). Ці з'єднання-структурні аналоги відповідних галогенідів. Являють собою кристали, які в розплавлений. стані проводять електричні. ток, причому Н 2 виділяється на аноді. Чи не розчинний в органічних розчинниках, добре розчинний в розплавах галогенідів лужних металів. Мають високу хімічний активністю, бурхливо реагують з О2 і вологою повітря. Взаимод. з водою (наприклад, МН + Н 2 О -\u003e МОН + Н 2) супроводжується виділенням тепла. В ефірі, дігліме, ТГФ легко (особливо LiH і NaH) реагують з галогенідами або гідридами В і Al, утворюючи відповідно борогідріда М [ВН 4] n і алюмогідрідом М n. При 700-800 ° С відновлюють оксиди до металів. З СО 2 дають солі мурашиної кислоти. Взаимод. з N 2, наприклад 3СаН 2 + + N 2 -\u003e Ca 3 N 2 + ЗН 2.
Отримують іонні ГІДРИДИ зазвичай взаємодія Н 2 з розплавом відповідного металу під тиском. Їх використовують в якості сильних відновників (наприклад, для отримання металів з їх оксидів або галогенідів, видалення окалини з поверхонь виробів із сталі і тугоплавких металів). Багато ГІДРИДИ-джерела Н 2, перспективне ракетне паливо. Дейтериду і трітіегідріди - можливе пальне для ядерних реакторів. Див. Також Літія гідрид.
Гідрид Mg за властивостями і природу хімічного зв'язку займає проміжні положення між ковалентними і іонними ГІДРИДИ; кристали з гратами типу ТiO 2; при високому тиску (~ 7 МПа) зазнає поліморфні перетворення. З водою і водними розчинами кислот і лугів MgH 2 взаємодія з виділенням Н 2, однак менш енергійно, ніж ГІДРИДИ лужних і ін. Щел.-зем. металів. М. б. отримано взаємодія Mg з Н 2 при 200-250 ° С і тиску 10 МПа (швидкість реакції мала) або обмінної реакцією MgHal 2 з МН або М, де М-Li, Na, в середовищі органічне розчинника. Легко утворюється при гідруванні сплавів Mg, що містять невеликі добавки РЗЕ і перехідних металів, при 150-180 ° С і 1-5 МПа, причому реакція оборотна. У зв'язку з цим такі сплави-перспективні хімічний акумулятори Н 2 для потреб малої енергетики, металургії та хімічний технології.
До металоподібними відносять ГІДРИДИ перехідних металів і РЗЕ. Формально такі з'єднання можуть розглядатися як фази впровадження водню в метал. Їх утворення завжди передує адсорбція Н 2 на поверхні металу.
Адсорбована молекула дисоціює на атоми Н, в результаті дифузії яких в кристалічних. решітку відбувається утворення т.н.раствора водню в металі; процес не супроводжується перебудовою кристалічної. решітки. При досягненні певної концентрації Н 2 врастворе утворюється власне ГІДРИДИ металу, як правило, стехіометріч. складу (МН 3 для металів III гр., МН 2 для IV гр. і ванадію). Взаимод. Н 2 з зазначеними металами (крім Pd) завжди супроводжується перебудовою кристалічної. решітки. Для опису природи хімічного зв'язку водню з металеві. матрицею використовують уявлення про тип зв'язку, проміжному між іонної і металевою; електрони водню в більшій чи меншій мірі беруть участь у формуванні зони провідності ГІДРИДИ Мабуть, внесок іонної складової зв'язку М + Н - Наїб. великий для EuH 2, YbH 2 і трігідрідов лантаноїдів і мінімальний для PdH 0,6, а також для гідридів Mn, Fe, Co, Ni, існуючих при високому тиску Н 2 і містять менше одного атома Н на атом металу.
Металлоподобниє ГІДРИДИ (див. Табл. 2) -светло- і темно-сірі кристали з металеві. блиском, стійкі на повітрі при кімнатній температурі. З О2, водою і водяною парою реагують повільно. М.б. отримані взаємодія металу з Н 2 при звичайній температурі або при нагріванні; наприклад, TiH 2 і LaH 3 синтезують при 150-200 ° С. Отримання ГІДРИДИ стехіометріч. складу в більшості випадків пов'язане зі значною труднощами через високу чутливості Гідрований до наявності домішок в металі і особливо О2 і водяної пари в Н 2. Металлоподобниє ГІДРИДИ обмежено застосовують в якості джерел Н 2 високої чистоти (використовуваних, наприклад, в паливних елементах) і для поглинання Н 2 з газових сумішей. Гідриди Pd-каталізатори гідрування, ізомеризації, орто- і парапревращенія Н 2.
Табл. 2.-властивості металоподібними гідридів 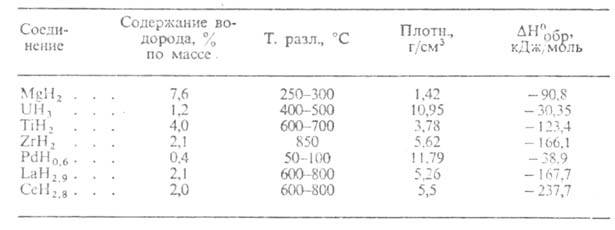
Гідриди інтерметалічних сполук.Містять зазвичай атоми РЗЕ, Mg, Ca, Ti, Al, Fe, Co, Ni, Сі. Легко утворюються при взаємодії інтерметалідів навіть з техн. Н 2 (містить до 1-2% домішок О2 і водяної пари) при 25-200 ° С і тисках Н 2 0,1-1 МПа; швидкість поглинання Н 2 дуже велика. Реакції характеризуються малими тепловими ефектами (20-30 кДж на 1 моль Н 2, для індивідуальних металів-100-120 кДж) і не призводять до значної зміни в структурі вихідної металеві. матриці; в більшості випадків відбувається лише збільшення її обсягу на 10-30%. Для ГІДРИДИ цього типу характерна висока рухливість водню і велика хімічний активність (про властивості див. Також табл. 3).
При 200-500 ° С і тиску Н2 10 4 -10 5 Па відбувається гидрогенолиз интерметаллидов: мн х + м »н у<- мм» n + н 2 -> мн х + пМ »
Дана реакція характерна для з'єднання, утворених РЗЕ і Mg, а також РЗЕ і Fe, Ni або З. Так, гідрид РЗЕ, що утворюється при гідрогенолізу интерметаллида, що містить Mg, каталізує як гідрування Mg, так і дегидрирование MgH 2 при 150-180 ° С: МН 2 + nMg + (n + 0,5) Н 2 МН 3 + nMgH 2
Завдяки високому вмісту Н 2, можливості значною зміщення рівноваги в ту або ін. Сторону за допомогою невеликих змін температури і тиску Н 2, здатності поглинати Н 2 при низьких температурах і стійкості до дії О2 і вологи повітря, ГІДРИДИ інтерметалліч. з'єднань може бути використані як хімічний акумулятори слабозв'язаного водню. Перспективно їх застосування як джерел палива для автономних енергосистем, наприклад автомобільного транспорту (див. Воднева енергетика), а також для отримання високодисперсних металеві. порошків і каталізаторів гетерог. гідрування.
Табл. 3.-властивості гідридів інтерметалічних сполук 
Хімічна енциклопедія. Том 1 \u003e\u003e
З'єднання зі ступенем окислення -1.Найважливішими неорганічними сполуками водню є гідриди - бінарні сполуки водню в ступені окислення -1. "Класичні" гідриди можуть утворювати лише ті елементи, електронний торгівельний у яких значно менше, ніж у водню. Це лужні і лужноземельні метали, а також магній і берилій. Вони утворюють типові солеподібні гідриди, при електролізі розплавів яких водень виділяється на аноді:
2H - - 2e - ® H 2 0
При взаємодії гідридів даного типу з водою також виділяється водень:
NaH -1 + H 2 +1 O \u003d NaOH + H 2 0
Елементи, електронний торгівельний яких незначно відрізняється від водню, утворюють ковалентні гідриди (B 2 H 6, SiH 4). Відомо невелике число комплексних гідридів, наприклад, Li, Na, які широко застосовуються в органічному синтезі як відновників.
З'єднання зі ступенем окислення +1. З бінарних сполук водню в ступені окислення +1 в даному розділі буде розглянуто оксид водню (вода).
Хімічно чиста вода є безбарвною рідиною без смаку і запаху. Молекула води - Н 2 О - має кутову будову. Освіта молекули води відбувається за участю sp 3 -гібрідних орбіталей атома кисню, дві з яких зайняті неподіленими електронними парами і тому вкладу в геометрію молекули не вносять. Перекриття двох гібридних орбіталей кисню і 1s-орбіталей двох атомів водню призводить до утворення уголковой молекули. Відразливі дію двох неподіленого пар електронів зменшує валентний кут HOH від 109,5 ° до 104,5 °.
Хімічна зв'язок H-O полярна: загальна електронна пара зміщена до кисню, як більш електронегативного елементу. У зв'язку з цим молекула води являє собою диполь - електронейтральної частку, центр ваги позитивного і негативного заряду в якій не збігаються. У молекулі води частковий позитивний заряд зосереджений на атомах водню, негативний полюс диполя локалізована на атомі кисню.
У кристалічному стані кожна молекула води оточена чотирма сусідами і утворює з ними міцні водневі зв'язку. Згідно клатратного теорії в рідкій воді існують мікроскопічні фрагменти кристалічної структури льоду - клатрати, що знаходяться в рівновазі з рідкою фазою. Наявність міцних водневих зв'язків пояснює аномально високі температури кристалізації (0 ° С) і кипіння (100 ° С).
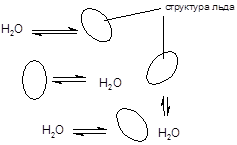
Вода є добрим розчинником для багатьох типів органічних і неорганічних сполук. Здатність молекул води утворювати водневі зв'язку, а також координаційні сполуки (Аквакомплекси) призводить до утворення адуктів розчинених речовин з молекулами води - гідратів. Багато речовин виділяються з розчинів у вигляді кристалогідратів, зберігаючи міцні зв'язки з молекулами води. Можна виділити три типи кристаллогидратов:
1. Клатрати - мають кристалічну структуру льоду, порожнини якої зайняті частинками речовини. Така будова мають кристалогідрати солей лужних металів, що містять велику кількість води, наприклад, Na 2 SO 4 × 10H 2 O, а також кристалогідрати, утворені галогенами та інертними газами - Cl 2 × 8H 2 O, або Ar × 6H 2 O.
2. Аквакомплекси, що містять воду, координовану катіоном металу, найчастіше перехідного, наприклад, CoCl 2 × 6H 2 O, точніше Cl 2.
3. Кристалогідрати, що містять воду, пов'язану з частинками речовини водневими зв'язками. Часто цей тип зв'язування води реалізується в кристалогідратів органічних речовин.
Нагрівання кристаллогидратов призводить до видалення кристалізаційної води. Зазвичай цей процес звернемо і додавання води призводить до утворення початкової сполуки, наприклад:
CuSO 4 × 5H 2 O ¾® CuSO 4 ¾® CuSO 4 × 5H 2 O
З хімічної точки зору вода досить реакційно речовина, що вступає у взаємодію з різними простими і складними речовинами, в тому числі з органічними сполуками. Так, лужні та лужноземельні метали бурхливо реагують з водою з виділенням водню і утворенням лугів:
2Na + 2H 2 O \u003d 2NaOH + H 2; Ca + 2H 2 O \u003d Ca (OH) 2 + H 2
Вода активно взаємодіє з оксидами лужних і лужноземельних металів, а також з багатьма кислотними оксидами:
Н 2 О + СаО \u003d Са (ОН) 2; Н 2 О + SO 2 H 2 SO 3
При високих температурах вода може виступати в якості окислювача як простих, так і складних речовин, Наприклад:
2Fe + 3H 2 O Fe 2 O 3 + 3H 2; CH 4 + 2H 2 O CO 2 + 4H 2
До важливих хімічних властивостях води відноситься її здатність вступати в реакції гідролізу. Причому гідролізу можуть піддаватися не тільки солі, але і інші неорганічні і органічні сполуки, наприклад:
PCl 3 + 3H 2 O \u003d H 3 PO 3 + 2HCl;
Са 3 P 2 + 6H 2 O \u003d 3Са (OH) 2 + 2PH 3;

Приєднання молекули води за кратними зв'язками (гідратація) - одна з найбільш важливих реакцій ненасичених вуглеводнів:
H 2 C \u003d CH 2 + H 2 O CH 3 -CH 2 -OH
Незважаючи на те, що 71% поверхні Землі займає Світовий океан, перед нашою цивілізацією дуже гостро стоїть проблема прісної води, оскільки є для використання не більше 0,3% гідросфери. При загальному дефіциті прісної води потреба в ній щороку зростає. Вона широко використовується не тільки в побуті і в сільському господарстві, а й в промисловості як реагент, розчинник, теплоносій і холодоагент. широкомасштабне використання чистої води супроводжується інтенсивним її забрудненням твердими відходами та різноманітними хімічними речовинами антропогенного походження - мінеральними добривами, пестицидами, миючими засобами, фенолами і целюлозою, сполуками важких металів, хлор і фосфорорганічними сполуками, а також нафтою і нафтопродуктами. Забруднення водойм становить безпосередню загрозу для здоров'я, а часом і життя людей. Основний шлях вирішення проблеми чистої води полягає в розробці та впровадженні високоефективних методів очищення промислових, сільськогосподарських і побутових стоків, а також використання замкнутих технологій. Для очищення води використовується ряд фізичних і хімічних методів, основними з яких є:
Ø відстоювання і фільтрація;
Ø коагуляція і адсорбція домішок хімічними сорбентами;
Ø виморожування і дистиляція;
Ø аерірованіе (насичення повітрям) і хімічна дезінфекція (хлорування або озонування);
Ø біохімічне руйнування забруднень під дією мікроорганізмів.
Крім оксиду водню добре вивчений його аналог - оксид дейтерію - D 2 O, більш відомий під назвою "важка вода". Важка вода широко застосовується в атомній енергетиці як сповільнювач нейтронів. Реакції за участю важкої води йдуть повільніше, а температура її кипіння (101,4 ° С) трохи вище в порівнянні з H 2 O, тому при проведенні електролізу або дистиляції великої кількості води важка вода накопичується в залишку.
Література: с. 330 - 338, с. 411 - 415, с. 262 - 270
Лекція № 2. Елементи VII-A-підгрупи (галогени)
Елементи VIIA-підгрупи: фтор - F, хлор - Cl, бром - Br, йод - I (галогени) і радіоактивний астат - At. Фтор і йод представлені в природі одними ізотопами - 19 F і 127 I, хлор і бром мають по два природних ізотопу: 35 Cl (75,5%) і 37 Cl (24,5%); 79 Br (50,5%) і 82 Br (49,5%). Радіоактивний ізотоп 131 I (період напіврозпаду 8 діб) - один з найбільш небезпечних продуктів поділу урану, оскільки накопичується в щитовидній залозі. Астат в природі практично не зустрічається, його отримують штучним шляхом. Самий долгоживущий ізотоп 211 At має період напіврозпаду 8,3 години.
Загальна електронна формула галогенів - ns 2 np 5 - обумовлює прояв у більшості їх з'єднань ступеня окислення -1. Для фтору, що володіє найвищою електронегативні (4,0 по Полингу), дана ступінь окислення є єдиною. Хлор, бром і йод можуть проявляти вищі ступені окислення (в основному +1, +3, +5 і +7) за рахунок використання вакантних орбіталей d-підрівні, як показано на схемі для атома хлору:
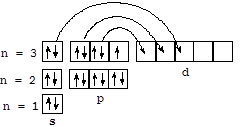
Фтор і хлор - поширені елементи земної кори (0,03 і 0,02 мол.% Відповідно). Кларки брому і йоду виражаються значно скромнішими числами (8,5 × 10 -5 і 4 × 10 -6 мовляв.%). Основні мінерали фтору і хлору: CaF 2 - плавиковий шпат (флюорит), Na 3 - кріоліт, Ca 5 (PO 4) 3 F - фторапатит, NaCl - кам'яна сіль (галіт), KCl - сильвин, NaCl × KCl - сильвініт, KCl × MgCl 2 × 6H 2 O - карналлит. Бром і йод самостійних мінералів не утворюють і зазвичай супроводжують хлору. Йод накопичується деякими морськими водоростями.
Всі галогени грають важливу біологічну роль. Фтор входить до складу зубної емалі. Знижений вміст фтору в питній воді (менше 0,5 мг / л) сприяє розвитку карієсу. Однак, підвищений вміст фтору призводить до іншого захворювання зубів - флюорозу. Хлор надходить в організм людини в основному у вигляді кухонної солі (Денна норма становить 4 - 8 г) і бере участь в утворенні шлункового соку, що містить 0,3% хлороводню. Йод концентрується в основному в щитовидній залозі і входить до складу тироксину - гормону щитовидної залози. Недостатнє надходження йоду в організм призводить до порушення обміну речовин, уповільнення росту і ослаблення розумового розвитку (кретинізм), а також до розвитку базедової хвороби. Зміст брому в організмі середньої людини (маса тіла 70 кг) становить 260 мг, але біологічна роль даного елемента в даний час ще не вивчена.
Фізичні властивості . Галогени утворюють прості речовини з двохатомними молекулами: F 2 - світло-жовтий газ, т.кіп. -188 ° С, т.пл. -220 ° С, Cl 2 - жовто-зелений газ, т.кіп. -34 ° С, т.пл. -101 ° С, Br 2 - важка червоно-бура рідина, т.кіп. 59 ° С, I 2 - чорно-фіолетові кристали з металевим блиском, легко переходять в газоподібний стан, минаючи рідкий (сублімація або сублімація). Хлор легко зріджується при тиску понад 6 атм. і кімнатній температурі, обмежено розчиняється в воді (в одному об'ємі води 2 обсягу хлору). Бром і йод погано розчинні у воді (3,6 г брому або 0,03 г йоду на 100 г води), але добре розчинні в деяких органічних розчинниках. Фтор з водою реагує.
Фтор і хлор надзвичайно токсичні, викликають глибоке ураження органів дихання, набряк слизових і легких. Бром сильно роз'їдає шкіру і гуму. Йод у великих концентраціях токсичний і може викликати ураження органів дихання (йодним нежить), в помірних концентраціях має дезінфікуючу дію.
Отримання і застосування галогенів . Фтор отримують електролізом розчину фториду калію в рідкому фтористому водні. Хлор в промисловості зазвичай отримують електролізом розчину хлориду натрію або калію:
ел.ток
2КСl + 2H 2 O ® H 2 + Cl 2 + 2КОН
катод анод розчин
Лабораторним методом отримання хлору є окислення концентрованої соляної кислоти при нагріванні. наприклад:
2KMnO 4 + 16HCl \u003d 2MnCl 2 + 2KCl + 5Cl 2 + 8H 2 O;
MnO 2 + 4HCl \u003d MnCl 2 + Cl 2 + 2H 2 O
Бром і йод одержують дією окислювачів (KMnO 4, MnO 2, РbO 2, K 2 Cr 2 O 7, KClO 3) на розчини бромидов або хлоридів. У промислових умовах дешевим і зручним окислювачем є хлор:
2KI + Cl 2 \u003d 2KCl + I 2
Фтор використовується для розділення ізотопів урану, як окислювач ракетного палива, для синтезу хладоагентов і полімерних матеріалів - фторопластов, наприклад, фреону CF 2 Cl 2 або тефлону (С 2 F 4) n. Хлор застосовують для знезараження питної води, Для отримання соляної кислоти, використовується в синтезі хлорорганічних похідних, в металургії. Бром використовується для отримання лікарських препаратів і отрутохімікатів. Йод застосовують у кольоровій металургії, ракетній техніці, в медицині.
Хімічні властивості . У вигляді простих речовин галогени виключно активні неметали. Особливо активний фтор, що обумовлено малою енергією дисоціації молекули F 2 (159 кДж / моль) і низькою енергією активації реакцій з її участю (менше 4 кДж / моль). З воднем фтор реагує вже при -252 ° С.
При температурі -190 ° С фтор реагує з сіркою і фосфором:
S + 3F 2 \u003d SF 6; 2P + 5F 2 \u003d 2PF 5
Активність фтору настільки висока, що при високих температурах він окисляє платину і важкі інертні гази:
Pt + 2F 2 \u003d PtF 4; Xe + 2F 2 \u003d XeF 4
Безпосередньо зі фтором не взаємодіють тільки гелій, неон, аргон, азот і вуглець у вигляді алмазу.
Легко взаємодіє фтор з оксидами. У його атмосфері горять навіть скло і вода:
SiO 2 + 2F 2 \u003d SiF 4 + O 2; 2H 2 O + 2F 2 \u003d 4HF + O 2
Хлор за активністю незначно поступається фтору. Чи не взаємодіє тільки з інертними газами, киснем і азотом. При незначному нагріванні реагує з фосфором, миш'яком, сурмою, кремнієм, натрієм і магнієм.
2Fe + 3Cl 2 2FeCl 3; Cu + Cl 2 CuCl 2;
Si + 2Cl 2 SiCl 4
Фосфор і сірка реагують з хлором східчасто:
2S + Cl 2 S 2 Cl 2; 2P + 3Cl 2 2PCl 3;
дихлорид Дисер хлорид фосфору (III)
S 2 Cl 2 + Cl 2 2SCl 2; PCl 3 + Cl 2 PCl 5
хлорид сірки (II) хлорид фосфору (V)
При розчиненні в воді хлор частково з нею реагує, діспропорціоніруя:
Cl 2 + H 2 O HCl + HOCl
У розчинах лугів дане рівновагу зміщується вправо, при цьому склад продуктів реакції визначається температурою:
Cl 2 + 2NaOH ¾® NaCl + NaClO + H 2 O;
3Cl 2 + 6NaOH ¾® 5NaCl + NaClO 3 + 3H 2 O
Хімічна активність брому і йоду в порівнянні з хлором знижена, але цілком достатня для взаємодії з більшістю неметалів і металів. У той же час бром і йод, так само як і хлор, окислюються фтором. наприклад:
Br 2 + 3F 2 \u003d 2BrF 3
Йод окислюється також азотною кислотою:
I 2 + 10HNO 3 (конц) \u003d 2HIO 3 + 10NO 2 + 4H 2 O
Так як активність хлору як окислювача вище, ніж у брому і йоду, він витісняє їх з водних розчинів відповідних солей:
Сl 2 + 2KBr \u003d Br 2 + 2KCl; Cl 2 + 2KI \u003d I 2 + 2KCl
Хлор і бром досить легко заміщають атоми водню в органічних сполуках і приєднуються за кратними зв'язками вуглець - вуглець:
CH 4 + Cl 2 ® CH 3 Cl + HCl; HCºCH + 2Cl 2 ® Cl 2 HC-CHCl 2
Фтор зазвичай руйнує органічні сполуки з виділенням сажі і фтористого водню. Реакції органічних речовин з йодом ускладнюються нестійкістю іодорганіческіх з'єднань.
p-Елементи з воднем утворюють з'єднання з ковалентно-полярними зв'язками.
Ступінь полярності зв'язку легко оцінити за різницею електроотріцательностей елементів (ΔЕО). Так, для B, C, P, Si, Ge, As, Sn, Sb) зв'язок в з'єднаннях з воднем практично ковалентная.
З розгляду зміни в групах і періодах електронегативності відповідних p-елементів та радіусів їх атомів (іонів) можна зробити наступне узагальнення: в межах кожної підгрупи елементів зазвичай зменшується міцність водневих з'єднань; в межах кожного періоду зростає їх кислотність. Валентний кут в групі з ростом Z зменшується (табл. 8.6). Це пояснюється послабленням здатності валентних орбіталей елементів до sp3-гібридизації через збільшення різниці енергії s- і p-підрівнів.
|
||||||||||||||||||||
|
Таблиця 8.6. Зміна валентного кута в з'єднаннях ЕH3 і H2Е. |
Крім загальних закономірностей, водневі з'єднання p-елементів виявляють аномалію в прояві деяких властивостей, зокрема, в температурах кипіння (рис. 8.6) і плавлення.
Зазвичай зі збільшенням молекулярної маси температури кипіння і плавлення сполук збільшуються. Очікуваний хід кривої спостерігається тільки для водневих з'єднань IVА групи (CH4, SiH4, CeH4, SnH4), в трьох інших розглянутих групах виявляються аномально високі точки кипіння для NH3, H2O, NF. Це пояснюється утворенням з молекул цих речовин ассоциатов -H-F ... H-F ... за рахунок водневого зв'язку *). Цікаво відзначити, що найбільш міцною є воднева зв'язок між молекулами HF, т. К. Фтор - найбільш електронегативний елемент, однак, як видно з рис. 8.6, сама висока температура кипіння у води. Пояснюється це тим, що кожна молекула води може утворити дві водневі зв'язку, тоді як молекула фтористого водню - тільки одну.
*) Нагадаємо, що Н-зв'язок виникає за донорно-акцепторного механізму між молекулами Н-Е, де Е - сильно електронегативний елемент, який має неподіленого електронні пари (O, N, F, S, Cl). Енергія Н-зв'язку H ... F дорівнює 34 кДж, Н ... О - 25,5 кДж і H ... N - 8 кДж.
Серед водневих з'єднань p-елементів особливе місце належить з'єднанням бору (бороводородов, боранів) B2H6, B4H10, B6H10, B5H11 і ін. Вони цікаві тим, що відносяться до електронодефіцітним з'єднанням - число електронів в цих з'єднаннях менше, ніж потрібно для утворення двухелектронних двухцентрових зв'язків . У діборане B2H6 дванадцять валентних електронів беруть участь у восьми зв'язках. У двох кінцевих групах BH2, які лежать в одній площині, атоми бору і водню пов'язані двухцентровие двохелектронними зв'язками. Два ж центральних атома водню розташовані симетрично над цією площиною і під нею і об'єднані з атомами бору трехцентровимі мостіковимі зв'язками (ріс.8.7а), добре описуються з позицій ММО. На рис. 8.7б зображена схема трехцентрових МО диборана (фрагмент По-Н-В). Тут дві атомні sp3-гібридні орбіталі бору (по одній від кожного атома) з одним електроном перекриваються з 1s-орбиталью атома водню, яка дає ще один електрон, утворюючи зв'язує, несвязивающую і розпушують електронні орбіталі. Пара електронів займає зв'язує орбіталь, що забезпечує стійкість цих мостікових зв'язків в молекулі B2H6.
ГІДРИДИ, З'єднання водню з металами або менш електронегативними, ніж водень, неметалами. Іноді до Г. відносять сполуки. всіх хім. елементів з воднем. Розрізняють прості, або бінарні, Г., комплексні (див., Напр., Алюмогідрідом, борогідріда металів) І Г. інтерметалліч. з'єднань. Для більшості перехідних металів відомі також комплексні сполуки., Що містять атом Н поряд з ін. Лигандами в координац. сфері металу-комплексоутворювача.
Прості гідриди.Відомі для всіх елементів, крім благородних газів, платинових металів (виняток -Pd), Ag, Au, Cd, Hg, In, Tl. Залежно від природи зв'язку елемента (Е) з воднем підрозділяються на ковалентні, іонні (солеобразние) і металлоподобниє (металеві), проте ця класифікація умовна, т. К. Між разл. типами простих Г. різких кордонів немає.
До нековалентним відносять Г. неметалів, Al, Be, Sn, Sb. Гідриди SiH 4, GeH 4, SnH 4, PH 3, AsH 3, SbH 3, H 2 S, H 2 Se, H 2 Te (див. Табл. 1) і нижчі бороводні-гази.Ковалентні Г. мають високу реакц. здатністю. Ефективний покладе. заряд атома Е в молекулі зростає в межах однієї групи періодичної. системи зі збільшенням його порядкового номера. Елементи Si і Ge утворюють вищі Г. загальної ф-ли Е n Н 2n + 2 ( п2), стабільність яких брало швидко зменшується зі збільшенням числа атомів Е. Гідриди елементів підгрупи S добре розчин. в воді (розчини мають кислу р-цію), підгрупи Р-незначно. Г. елементів підгрупи Si взаємодій. з водою з утворенням ЕО 2 і Н 2. Всі ці Г. розчин. в неполярних або малополярних орг. р-телеглядачам. Ковалентні Г.-сильні відновники. Легко вступають в обмінні р-ції, напр. з галогенідами металів. При 100-300 ° С (H 2 S ок. 400 ° С) розкладаються практично необоротно до Е і Н 2.
Табл. 1.-властивості ПРОСТИХ ковалентних І ІОННИХ гідридів

* Т-ра розкладання.
Г. підгрупи фосфору отримують р-цією ЕС1 3 з Li в ефірі при 25 ° С; SiH 4 і GeH 4 -взаімод. Мg 2 Е з водою або з В2 Н 6 в рідкому NH 3; H 2 S, H 2 Se і Н 2 Те-кислотним гідролізом сульфідів, селенидов або теллуридов металів (H 2 S-також взаємодій. Н, і S). Всі згадані Г., особливо AsH 3 і РН 3, високотоксичні. Гідриди Ge, Si, As використовують для отримання напівпровідникових матеріалів. Див. також Миш'яку гідрид, Сірководень, Сілани, фосфін.
Гідриди вен 2 і А1Н 3, існуючі в полімерному стані, а також вкрай нестійкий термічно Ga 2 H 6 по природі хім. зв'язку Е-Н близькі до бороводородов: для них характерний дефіцит електронів, в зв'язку з чим освіту молекул або кристалів відбувається за участю двухелектронних трехцентрових мостікових (Е-Н-Е) і багатоцентрових зв'язків. Для цих Г. характерні дуже високі ентальпії згоряння. Вони взаємодій. з водою, виділяючи Н 2. З донорами електронів, напр. з NR 3, PR 3, утворюють аддукти, з В2 Н 6 в середовищі апротонних орг. р-телеглядачам-соотв. Аl [ВН 4] 3 і Ве [ВН 4] 2. Отримують гідриди А1 і Be по р-ціям: 
До іонним відносять Г. лужних і щел.-зем. металів (крім Mg). Ці соед.-структурні аналоги відповідних галогенідів. Являють собою кристали, к-які в розплавлений. стані проводять електричні. ток, причому Н 2 виділяється на аноді. Не розчин. в орг. р-телеглядачам, добре розчин. в розплавах галогенідів лужних металів. Мають високу хім. активністю, бурхливо реагують з О2 і вологою повітря. Взаимод. з водою (напр., МН + Н 2 О -\u003e МОН + Н 2) супроводжується виділенням тепла. В ефірі, дігліме, ТГФ легко (особливо LiH і NaH) реагують з галогенідами або гідридами В і А1, утворюючи соотв. борогідріда М [ВН 4] n і алюмогідрідом М [А1Н 4] n. При 700-800 ° С відновлюють оксиди до металів. З СО 2 дають солі мурашиної к-ти. Взаимод. з N 2, напр. 3СаН 2 + + N 2 -\u003e Ca 3 N 2 + ЗН 2.
Отримують іонні Г. зазвичай взаємодій. Н 2 з розплавом відповідного металу під тиском. Їх використовують в кач-ве сильних відновників (напр., Для отримання металів з їх оксидів або галогенідів, видалення окалини з пов-стей виробів зі сталі та тугоплавких металів). Багато Г.-джерела Н 2, перспективне ракетне паливо. Дейтериду і трітіегідріди - можливе пальне для ядерних реакторів. Див. також Літія гідрид.
Гідрид Mg по св-вам і природі хім. зв'язку займає промежут. становище між ковалентними і іонними Г .; кристали з гратами типу ТiO 2; при високому тиску (~ 7 МПа) зазнає поліморфні перетворення. З водою і водними розчинами к-т і лугів MgH 2 взаємодій. з виділенням Н 2, однак менш енергійно, ніж Г. лужних і ін. щел.-зем. металів. М. б. отримано взаємодій. Mg з Н 2 при 200-250 ° С і тиску 10 МПа (швидкість р-ції мала) або обмінної р-цією MgHal 2 з МН або М [А1Н 4], де М-Li, Na, в середовищі орг. р-розчинника. Легко утворюється при гідруванні сплавів Mg, що містять невеликі добавки РЗЕ і перехідних металів, при 150-180 ° С і 1-5 МПа, причому р-ція оборотна. У зв'язку з цим такі сплави-перспективні хім. акумулятори Н 2 для потреб малої енергетики, металургії та хімічної. технології.
До металоподібними відносять Г. перехідних металів і РЗЕ. Формально такі сполуки. можуть розглядатися як фази впровадження водню в метал. Їх утворення завжди передує адсорбція Н 2 на пов-сті металу.
Адсорбована молекула дисоціює на атоми Н, в результаті дифузії яких брало в кристалічних. решітку відбувається утворення т.н.раствора водню в металі; процес не супроводжується перебудовою кристалічної. решітки. При досягненні певної концентрації Н 2 врастворе утворюється власне Г. металу, як правило, стехіометріч. складу (МН 3 для металів III гр., МН 2 для IV гр. і ванадію). Взаимод. Н 2 з зазначеними металами (крім Pd) завжди супроводжується перебудовою кристалічної. решітки. Для опису природи хім. зв'язку водню з металеві. матрицею використовують уявлення про тип зв'язку, проміжному між іонної і металевою; електрони водню в більшій чи меншій мірі беруть участь у формуванні зони провідності Г. Мабуть, внесок іонної складової зв'язку М + Н - Наїб. великий для EuH 2, YbH 2 і трігідрідов лантаноїдів і мінімальний для PdH 0,6, а також для гідридів Mn, Fe, Co, Ni, існуючих при високому тиску Н 2 і містять менше одного атома Н на атом металу.
Металлоподобниє Г. (див. Табл. 2) -светло- і темно-сірі кристали з металеві. блиском, стійкі на повітрі при кімнатній т-рі. З О2, водою і водяною парою реагують повільно. М.б. отримані взаємодій. металу з Н 2 при звичайній т-ре або при нагр .; напр., TiH 2 і LaH 3 синтезують при 150-200 ° С. Отримання Г. стехіометріч. складу в більшості випадків пов'язане зі означає. труднощами через високу чутливості Гідрований до наявності домішок в металі і особливо О2 і водяної пари в Н 2. Металлоподобниє Г. обмежено застосовують в кач-ве джерел Н 2 високої чистоти (використовуваних, напр., В паливних елементах) і для поглинання Н 2 з газових сумішей. Гідриди Pd-каталізатори гідрування, ізомеризації, орто- і парапревращенія Н 2.
Табл. 2.-властивості металоподібними гідридів

Гідриди інтерметалічних сполук.Містять зазвичай атоми РЗЕ, Mg, Ca, Ti, Al, Fe, Co, Ni, Сі. Легко утворюються при взаємодій. интерметаллидов навіть з техн. Н 2 (містить до 1-2% домішок О2 і водяної пари) при 25-200 ° С і тисках Н 2 0,1-1 МПа; швидкість поглинання Н 2 дуже велика. Р-ції характеризуються малими тепловими ефектами (20-30 кДж на 1 моль Н 2, для індивідуальних металів-100-120 кДж) і не призводять до значить. змінам в структурі вихідної металеві. матриці; в більшості випадків відбувається лише збільшення її обсягу на 10-30%. Для Г. цього типу характерна висока рухливість водню і велика хім. активність (про св-вах см. також табл. 3).
При 200-500 ° С і тиску Н2 10 4 -10 5 Па відбувається гидрогенолиз интерметаллидов: мн х + м "н у<- мм" n + н 2 -> мн х + пМ "
Дана р-ція характерна для сполуки., Утворених РЗЕ і Mg, а також РЗЕ і Fe, Ni або З. Так, гідрид РЗЕ, що утворюється при гідрогенолізу интерметаллида, що містить Mg, каталізує як гідрування Mg, так і дегидрирование MgH 2 при 150-180 ° С: МН 2 + nMg + (n + 0,5) Н 2 МН 3 + nMgH 2
Завдяки високому вмісту Н 2, можливості значить. зміщення рівноваги в ту або ін. сторону за допомогою невеликих змін т-ри і тиску Н 2, здатності поглинати Н 2 при низьких т-рах і стійкості до дії О2 і вологи повітря, Г. інтерметалліч. з'єднань м.б. використані як хім. акумулятори слабозв'язаного водню. Перспективно їх застосування як джерел палива для автономних енергосистем, напр. автомобільного транспорту (див. Воднева енергетика),а також для отримання високодисперсних металеві. порошків і каталізаторів гетерог. гідрування.
Табл. 3.-властивості гідридів інтерметалічних сполук

===
Ісп. література для статті «ГІДРИДИ»: Гідриди металів, пров. з англ., М., 1973; Дев'ятих ГГ., Зорін А. Д., Летючі неорганічні гідриди особливої \u200b\u200bчистоти, М., 1974; Антонова А. М., Морозова Р. А., Препаративна хімія гідридів. К., 1976; Водень в металах, пров. з англ., т. 2, М., 1981. К.М. Семененко.
сторінка «ГІДРИДИ» підготовлена \u200b\u200bза матеріалами хімічної енциклопедії.
