Ky paragraf do t'ju ndihmojë:
· Drejton prapanicat e fjalimeve të thjeshta të metaleve dhe jometaleve;
· Ndani metalet dhe jometalet, metalet elemente jo metalike;
· Përdorni një sistem periodik si një sistem parafazor për vendosjen e materialeve të ndryshme jometalike dhe metalike në të elementet kimike.
ÇFARË REHOVINI DUHET TË DERDHET DERI TË LEHTË? Specialitetet e çdo shkence janë ato që hetojnë objektet që i nënshtrohen klasifikimit. Shkenca kimike nuk ka faj dhe është e pamundur të shkruash fjalime pa klasifikimin e duhur.
mbrapa depo yakisny Fjalimet ndahen në të thjeshta dhe komplekse.
Fjalë të thjeshta - një seri e tërë fjalësh e krijuar nga atomet e një elementi kimik
Në përzierjen e induktuar të formulave: Fe, O2, H2O, NaHCO 3, NaCl, H 2 SO 4, N 2, Al 2 O 3, Al, O 3, janë të njohura formulat e fjalëve të thjeshta. Nisur nga rëndësia e fjalëve të thjeshta do të përdorim këto formula: Fe, O 2, N 2, Al, B 3. Formula të tjera për krijimin e atomeve të elementeve të ndryshme kimike. Siç e dini nga shkenca natyrore, këto janë fjalime komplekse.
Atomet e një elementi kimik mund të krijojnë një numër fjalësh të thjeshta. Për shembull, molekulat e oksigjenit O 2 formohen nga atomet Kisnu dhe formulat e tyre kimike ndahen në ozon dhe një numër atomesh Kisnu. I njëjti imazh është përshtatur për fëmijën 55.
I vogël 55. Modelet e molekulave të acidit (a) dhe ozonit (6)
* Mbante diçka pas tabelave të këndimit.

I vogël 56. Diamanti (a) dhe grafiti (c) dhe modelet e strukturave të tyre (6. d)
Karboni është bërë nga substanca më e fortë natyrore, diamanti, dhe sipërfaqja e butë, e cila e bën të vështirë shkrimin në letër, është grafiti. formulat kimike Megjithatë, këto fjalime janë të shkruara - S. Rëndësia e autoriteteve në diamant dhe grafit nuk është formuar nga një lloj tjetër depoje karboni ose jak, por edhe nga hapësira të ndryshme të vendosjes së atomeve në karbon në të folur, padyshim një nga një. (Fig. 56). Në grafit, hapësirat janë të rregulluara në topa, dhe distanca midis atomeve në mes të një topi është dukshëm më e vogël se midis topave (Fig. 56d, prandaj, është e mundur që të shtypet lehtë në sipërfaqe dhe integriteti ndërmjet). topat është thyer largohuni. Tek diamanti, atomet dhe karboni janë të rregulluar në atë mënyrë që ata janë të vendosur në të njëjtën anë, njëri pas tjetrit, dhe lidhjet ndërmjet tyre janë drejt në majat e tetraedrit (Fig. 56b). Kjo siguron fortësinë e lartë të të folurit.
Pavarësisht nga drejtimi i prapanicës, mendoni për atë që është më shumë - elemente kimike apo fjalë të thjeshta.
Sipas nomenklaturës aktuale kimike të Ukrainës, emrat e disa fjalëve të thjeshta nuk ndryshojnë nga emrat e elementëve kimikë nga të cilët krijohet era e keqe. Tabela përmban shembuj të fjalimeve të tilla. Njihuni me ta.
Gjeni në tabelë dhe shkruani në formë emrat dhe formulat e fjalimeve të thjeshta. në të cilën molekula përbëhet nga dy ose më shumë atome.
Tabela 4
Formulat dhe emrat e fjalimeve të thjeshta
|
vetëm një fjalim |
Emri i kimikatit element |
vetëm një fjalim |
Emri i kimikatit element |
||
|
Emri |
Emri |
||||
|
Argentum |
|||||
|
kisen |
|||||
|
Mërkuri |
grafit, diamant |
||||
Rritni respektin tuaj! Emrat e fjalimeve të thjeshta shkruhen me shkronja të vogla, emrat e elementeve kimike me shkronja të mëdha.
Metalet dhe jometalet. Fjalët e thjeshta ndahen në metale dhe jometale. Para metaleve ka zink Zn, kalium K, kalcium Ca, magnez Mg, kallaj Sn, plumb Pb, bakër Cu, hekur Fe, alumin Al, argjend Ag, ari A e të tjera (Fig. 57).
Shembuj të jometaleve përfshijnë ujin H 2 oksid O 2 dhe ozonin O3, azotin N 2, helium He, neoni Ne, argon Ar, karbon C (një përzierje kaq e fortë në realitet për të gjitha fjalët e thjeshta të karbonit), sirka S, fosfor P, klor Cl 2, jod I 2 dhe të tjera (Fig. 58).
Ndër elementët kimikë, metalet janë më të rëndësishëm. Nga elementët kimikë të njohur sot tek elementet jometalike 22.
Në paragrafët 6 dhe 7 u shqyrtuan fuqitë kryesore fizike të fjalimeve. Duke u ndalur në këtë, ne përmbledhim karakteristikat e përbërjeve të thjeshta të metaleve dhe jometaleve.
Karakteristikat kryesore të të gjitha metaleve janë përçueshmëria e lartë termike dhe përçueshmëria elektrike; gri, ngjyrë gri argjendi (të pasmet: ari - e verdhë, bakri - e gjithë-e kuqe); prania e erës; plasticitet - ato janë të lehta për t'u rrokullisur, shtrirë, rrotulluar pllaka. Të gjitha metalet në temperaturën e dhomës gjenden në gjendje të ngurtë agregate, përveç merkurit (radina).
Fuqia e mbiekspozuar nuk është tipike për jometalet. Kështu që ju mund të thoni për ta me falni fjalet, Ata nuk shkelin autoritetet e majta. Pra, jometalet nuk përçojnë, ose përçojnë keq, nxehtësinë dhe elektricitetin, dhe janë të brishtë dhe jo plastikë. Uji, gazi i thartë, azoti, fluori, klori, heliumi, argoni dhe të tjera mbahen në një agregat të ngjashëm me gazin në temperaturën e dhomës. Fosfori, karboni, squfuri, jodi dhe substancat e ngurta, bromi - i lëngët. Jometalet kanë më shumë preferencë ngjyrash sesa metalet. Pra, i thartë dhe uji janë pa elb, kosi është i verdhë, klori është i verdhë-jeshile, bromi është kafe e errët.
I vogël 57. Llojet e metaleve: a - zink; b - alumini, c - metali, d - bakri

I vogël 58. Llojet e jometaleve: a - jod, sirka, c - fosfor, d - klor.
Duhet të theksohet se numri i fjalimeve të thjeshta vetëm pas autoriteteve fizike në metal dhe jometal është i pasaktë. Për shembull, jodi jometal ka një shkëlqim metalik, dhe grafiti jometal ka përçueshmëri të lartë elektrike. Në orët e ardhshme do të zgjeroni njohuritë tuaja për ndarjen e fjalimeve të thjeshta në metale dhe jometale në bazë të sublimitetit të atomeve dhe fuqive kimike të tyre.
SHPËRNDARJA E ELEMENTEVE METALORE DHE JOMETALORE NË SISTEMIN PERIODIK. Elementet kimike atomet e të cilëve janë të përbëra nga lënda e thjeshtë quhen metale, kurse elementet kimike atomet e të cilëve janë të përbërë nga lëndë e thjeshtë quhen jometale - jometalike.
Në paragrafin 12 keni mësuar fillimisht për tabelën periodike të elementeve kimike. Tani ju e dini se elementët kimikë vendosen nën një ngarkesë më të lartë të bërthamave atomike dhe se një qelizë është e lidhur pa ndryshim me elementin e lëkurës. Cili është modeli kryesor në vendosjen e elementeve metalikë dhe jometalë në sistemin periodik? Për të gjetur përgjigjen e zinxhirit ushqimor, referojuni tabelës. Zgjidhni për rishikim periudhat 1, 2 dhe 3. Në periudhën e parë, elementët metalikë ishin të zakonshëm. Periudha tjetër fillon me elementin metalik litium Li. Elementi fyes Beryllium mund të arrijë edhe metalet. Elementë të tjerë të kësaj periudhe janë jometalike.
Periudha e tretë gjithashtu fillon me elementin metalik Natrium Na, pas vendosjes së dy elementeve të tjera metalike - Magnezi Mg dhe Alumini Al. Më tej, si në një periudhë tjetër, vendosen elementë jo metalikë.
Lexoni me zë të lartë emrat e elementeve të periudhave 1, 2 dhe 3.
Në një mënyrë tjetër, elementët metalikë dhe jometalë vendosen në kolonat vertikale të tabelës - grupe të numëruara me numra romakë nga i në VIII. Kështu, të gjithë elementët e mesëm të grupit I dhe II (përfshirë grupin e parë I) janë të mbushura me elementë metalikë. Elementet jometalike vendosen në fillim të grupeve të tjera, dhe metalet në fund.
Zbuloni me mësuesin tuaj dhe lexoni me zë të lartë emrat e elementeve jometalike që formojnë grupet III-VIII.
Shembujt e konsideruar ilustrojnë rregullin bazë për vendosjen e elementeve metalike dhe jometalike në periudha dhe grupe të sistemit periodik:
Elementet metalike vendosen në një sistem periodik të elementeve kimike D. I. Mendelev në fillim të periudhave dhe në fund të grupeve, dhe jometalet - në fund të periudhave dhe në fillim të grupeve.
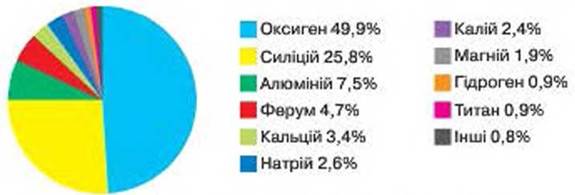
I vogël 59. Zgjerimi i elementeve kimike në Tokë (nga pesha)
ELEMENTET E Zgjeruara NË NATYRË. Edhe pse në natyrë ka afër 90 elementë kimikë në ruajtjen e substancave të ndryshme, era e keqe zgjerohet në mënyrë të pabarabartë. Elementet-udhëheqës, dhe gjithashtu të tillë, në vend të atyre edhe të vegjël.
Për fig. 59 Shpjegoni se tre elementë metalikë dhe tre jometalë janë më të shumtët në Tokë. A janë elementë kimikë metalikë apo jometalë të rëndësishëm në ruajtjen e materialeve në planetin Tokë?
thesari i një polimate
Ndër fjalimet më të thjeshta ka "kampionët" e tyre nga këta dhe të tjerët autoritetet fizike. Kështu, diamanti është metali më i fortë, metali i tungstenit është më i fortë. Metali më i lehtë është litiumi, dhe jometali më i lehtë është uji. Ndër metalet që kanë përçueshmërinë më të madhe termike janë argjendi, bakri dhe alumini. Përçueshmëri e ulët termike e bismutit dhe merkurit. Ka metale të buta që mund të priten me thikë, për shembull, natriumi, kaliumi, kalciumi, dhe ngurtësia më e lartë e metaleve është kromi - mund të pritet fort. Ari ka plasticitet të lartë. Kjo ju lejon të prodhoni nga kjo shkrirje diçka më pak se 0,003 mm material.
1. Cilat fjalime quhen të falura? Trego prapanicën.
2. Në cilat grupe bëjnë pjesë fjalimet e thjeshta? Cili grup ka më shumë përfaqësues?
3. Emërtoni fuqitë fizike të fshehura të metaleve.
4. Çfarë dini për shpërndarjen e elementeve metalike dhe jometalike në sistemin periodik?
5. Cili element metalik fillon periudha e 4-të?
6. Me cilin element jometalik fillon grupi V?
7. Emërtoni tre lloje të elementeve kimike jometalike dhe metalike në Tokë.
8. Nga përzierja e elementeve kimike zgjidhen ato jometalike dhe shpërndahen sipas radhës së masës atomike më të madhe të lëngët: Magnezi, Kisen, Uji, Salmoni, Azoti, Klori.
9. Në bazë të sistemit periodik të elementeve kimike, emërtoni elementin kimik që ndodhet në periudhën e 3-të dhe grupin VIII. Çfarë duhet të bëjmë me elementët metalikë apo jo metalikë? Sa protone dhe elektrone ka në ruajtjen e këtij atomi?
10. Plotësoni boshllëqet në propozimet me fjalët "metalike", "jometalike" dhe emrat e elementeve të ngjashëm dhe një periudhë tjetër e tabelës periodike fillon me elementin _________ dhe mbaron me elementin ________ __________.
Grupi i fundit i tabelës periodike fillon me elementin _________ dhe përfundon me elementin ________,
11. Shprehni sa më shumë shenjën pas së cilës ka rreshta fjalësh të thjeshta:
a) kislen, nitrogjen, ujë;
6) i copëtuar, i prerë, alumini?
Krijoni një projekt me temën "Elementet kimike në depon e trupave të ndryshëm qiellorë".
Me temën: Metalet. jometalet
HYRJA
I gjithë diversiteti i mjedisit tonë natyror vjen nga kombinimi i një numri po aq të vogël elementësh kimikë.
Në periudha të ndryshme historike, koncepti i "elementit" ka kuptime të ndryshme. Filozofët e lashtë grekë i shihnin "elementet" si "elemente" - nxehtësia, të ftohtit, thatësia dhe lagështia. Duke ardhur në çifte, erërat krijuan "fillimet" e të gjitha fjalimeve - zjarri, era, uji dhe dheu. Në shekullin e mesëm, këtyre kallinjve iu shtua kripë, kosi dhe zhiva. Në shekullin e 17-të, R. Boyle vuri në dukje se të gjithë elementët janë të natyrës materiale dhe numri i tyre mund të jetë i madh.
Në 1787, kimisti francez A. Lavoisier krijoi "Tabela e trupave të thjeshtë". Të gjithë elementët e njohur në atë kohë kishin shkuar përpara saj. Nën pjesën tjetër kuptoheshin trupa të thjeshtë, të cilët nuk mund të ndaheshin me metoda kimike në më të thjeshtë. Me kalimin e viteve është bërë e qartë se disa fjalime bisedore kanë hyrë në tavolinë.
Në ditët e sotme koncepti i "elementit kimik" është përcaktuar saktësisht.
Një element kimik përbëhet nga atome me një ngarkesë bërthamore megjithatë pozitive. (Data e mbetur është në lidhje me numrin rendor të elementit në tabelën periodike.)
Në këtë kohë njihen 107 elementë. Rreth 90 prej tyre gjenden në natyrë. Rashta u hoq pjesë-pjesë për reaksione shtesë bërthamore. 104-107 elementë u sintetizuan nga fizikanët në Institutin e Përbashkët për Kërkime Bërthamore në Dubna. Aktualisht, robotët po punojnë në nxjerrjen individuale të elementeve kimike me elementë të rendit më të lartë.
Të gjithë elementët ndahen në metale dhe jometale. Para metaleve vendosen 3 107 elementë 85. Elementët e mëposhtëm përfshihen në jometalet: helium, neoni, argon, kripton, ksenon, radoni, fluor, klor, brom, jod, astatine, kisen, sirka, selen, teluri, azot, fosfor, hi, karbon, silikon, bor, Voden. Megjithatë, nuk është një çështje mendore. Me mendje të mirë, veprat metalike mund të shfaqin fuqi jometalike, dhe veprat jometalike mund të shfaqin fuqi metalike.
jometalet
Pozicionet e elementeve jometalike në sistemin periodik të elementeve kimike. I njohur në natyrë. Fuqia e jashtme kimike dhe fizike
Ekziston një mungesë e konsiderueshme e elementeve jometalike në përzierje të reduktuara në elemente metalike. Vendosja e tyre në sistemin periodik të elementeve kimike D.I. Mendelev është paraqitur në tabelën nr. 1.
Vendosja e elementeve jometalike ne sistemet periodike tema sipas grupeve |
||||||||
VIII (gazrat fisnikë) |
||||||||
Tabela nr. 1.
Siç shihet nga tabela nr. 1, elementët jometalë janë të shpërndarë kryesisht në pjesën e sipërme të djathtë të sistemit periodik. Meqenëse në periudhat e zhvendosjes djathtas ngarkesat bërthamore të atomeve elementare rriten dhe rrezet atomike ndryshojnë, dhe në grupe në rënie rriten edhe rrezet atomike, është e kuptueshme që tërheqja e atomeve jometalike është më e fortë se ajo e atomeve të metaleve janë elektronikë të jashtëm. Në jometalet, lidhja me cym është më e rëndësishme oksidet e fuqisë. Fuqia oksiduese veçanërisht e fortë, e cila rezulton me shtimin e elektroneve, zbulon jometale që janë në periudhën e 2-të dhe të tretë të grupit VI-VII. Oksiduesi më i fortë është fluori. Përmbajtja e oksidit të jometaleve rritet në vlerat numerike të vlerave elektronegative në rendin vijues: Si, B, H, P, C, S, I, N, Cl, O, F. Më pas, energjia e ndërveprimi me ujin dhe metalet e fluorit:
Mensch reagon energjikisht ndaj puthjes:
2H2 + O2 dhe 2H2 Pro
Fluori është një jometal i shkallës së lartë që nuk karakterizohet nga fuqia ekstreme dhe mund të prodhojë elektrone në reaksionet kimike.
Kisen, duke gjykuar nga efekti i tij në fluor, mund të zbulojë një fazë pozitive të oksidimit, duke qenë kështu një agjent primordial.
Të gjithë jometalet e tjerë zbulojnë fuqitë kryesore. Për më tepër, këto fuqi gradualisht rriten nga aciditeti në silikon: O, Cl, N, I, S, C, P, H, B, Si. Kështu, për shembull, klori nuk ndërvepron drejtpërdrejt me aciditetin, por oksidet e tij (Cl2O, ClO2, Cl2O2) mund të ndahen në mënyrë indirekte, në të cilën klori shfaq një fazë pozitive oksidimi. Azoti në temperatura të larta kombinohet menjëherë me acidin dhe, për rrjedhojë, shfaq fuqi ekstreme. Squfuri reagon edhe më lehtë me thartirën: tregon oksidet e fuqisë.
Le të kalojmë duke parë molekulat aktuale të jometaleve. Jometalet formojnë molekula monotomike dhe diatomike.
Jometalet monoatomike janë të ekspozuar ndaj gazeve inerte, të cilat praktikisht nuk reagojnë me substancat më aktive. Gazrat inerte klasifikohen në Grupin VIII të Sistemit Periodik dhe formulat kimike të përbërjeve të thjeshta përkatëse janë: He, Ne, Ar, Kr, Xe dhe Rn.
Veprimet e jometaleve krijojnë molekula diatomike. Këto janë H2, F2, Cl2, Br2, I2 (elementë të grupit VII të sistemit periodik), si dhe oksigjen O2 dhe azoti N2. Gazi i ozonit (O3) formohet nga molekulat triatomike.
Për komponimet jometalike që janë të pranishme në gjendje të ngurtë, është e vështirë të formulohet një formulë kimike. Atomet e karbonit në grafit lidhen njëri me tjetrin në mënyra të ndryshme. Është e rëndësishme të shihet struktura e molekulës në strukturat udhëzuese. Kur shkruhet formula kimike për fjalë të tilla si në lidhje me metalet, supozohet se fjalë të tilla përbëhen vetëm nga atome. Formulat kimike, pra, shkruhen pa indekse - C, Si, S, etj.
Fjalë të tilla të thjeshta si ozoni dhe thartësia, të cilat formojnë një depo të re acidike (të dyja janë të përbëra nga një dhe i njëjti element - thartirë), por luftojnë për numrin e atomeve në një molekulë, mund të jenë ndryshimi i fuqisë. Pra, thartira nuk mban erë, ndërsa ozoni ka një erë të mprehtë, të cilën e ndjejmë në orën e një stuhie. Fuqia e jometaleve të ngurta, grafitit dhe diamantit, gjendet gjithashtu në një depo të re hiri, si dhe diamanteve, dhe ndryshon ndjeshëm (grafiti është i fortë, diamanti është i fortë). Kështu, fuqia e të folurit tregohet jo vetëm nga struktura e tij e qartë, por edhe nga sa atome ndodhen në molekulat e të folurit dhe si janë të lidhura me njëri-tjetrin.
Jometalet duket se gjenden në trupa të thjeshtë në gjendje të ngurtë ose të ngjashme me gaz (përfshirë bromin). Erë e keqe nuk qëndron në fuqitë fizike, metalet e fuqishme. Lëndët e ngurta jo metalike nuk shfaqin nxehtësinë karakteristike të metaleve, ato marrin erë të keqe dhe priren të përçojnë dobët elektricitetin dhe ngrohjen (përtej grafitit).
Fuqia kimike nëntokësore e jometaleve.
Oksidet e jometaleve sillen në okside acidike, të cilat janë acide. Uji nuk krijoi substanca të ngjashme me gazin (për shembull, HCl, H2S, NH3). Llojet e ujit të këtyre (për shembull, halogjenet e hidrogjenit) janë acide të forta. Metalet dhe jometalet tipike kombinohen me një lidhje jonike (për shembull, NaCl). Jometalet mund të reagojnë me njëri-tjetrin, duke formuar lidhje me lidhje polare kovalente (H2O, HCl) dhe lidhje jopolare (CO2).
Me ujë, përbërjet jometalike përdoren për të tretur lëngjet vdekjeprurëse, të tilla si, për shembull, fluori i hidrogjenit HF, uji blu H2S, amoniaku NH3, metani CH4. Kur halogjenet, squfuri, seleniumi dhe teluri treten në ujë, treten acidet me të njëjtën formulë si vetë përbërjet e ujit: HF, HCl, HCl, HBr, HI, H2S, H2Se, H2Te.
Kur amoniaku tretet në ujë, formohet uji amoniak, i cili përcaktohet me formulën NH4OH dhe quhet hidroksid amoniumi. Përcaktohet gjithashtu me formulën NH3 H2O dhe quhet hidrat i amonit.
Oksidet jometale shpërndajnë oksidet acide. Në disa okside, era e keqe shfaq një fazë maksimale oksidimi që është e ngjashme me numrin e grupit (për shembull, SO2, N2O5), dhe në të tjera është shumë më e ulët (për shembull, SO2, N2O3). Oksidet acidike karakterizohen nga acidet dhe dy acide acidike të një jometali janë më të fortë se ai në të cilin vera shfaq një fazë më të lartë oksidimi. për shembull, acid nitrik HNO3 është më i fortë se HNO2 azotik, dhe acidi sulfurik H2SO4 është më i fortë se acidi sulfurik H2SO3.
Budova dhe fuqia e fjalimeve të thjeshta - jometale.
Gjeni më së shumti jometale që të jenë molekularë dhe më pak llojet që të jenë jomolekulare. Kjo shpjegon arrogancën e autoriteteve të tyre. Kjo ilustrohet qartë në diagramin nr. 2.
Tabela nr. 2
Bori kristalor B (si dhe silikoni kristalor) ka një pikë shkrirjeje shumë të lartë (2075 ° C) dhe rezistencë të lartë. Përçueshmëria elektrike Rezistenca ndaj ndryshimeve të temperaturës rritet shumë, gjë që bën të mundur izolimin e gjerë të saj në teknologjinë e përcjellësit. Shtimi i borit në çelik dhe në lidhjet e aluminit, bakrit, nikelit, etj. Unë do të përmirësoj fuqinë e tyre mekanike.
Boridet (gjysmë bor nga metale të caktuara, për shembull nga titani: TiB, TiB2) janë të nevojshëm në prodhimin e pjesëve për motorët reaktivë dhe tehët e turbinave me gaz.
Siç mund të shihet nga diagramet nr. 2, qymyr C, silic Si, bor Në maj, unë do të shkoj në ferr dhe do të jem në krye të autoriteteve të tilla të korruptuara. Ashtu si fjalët e thjeshta, erëra e keqe vjen në dy forma - kristalore dhe amorfe. Format kristalore të këtyre elementeve janë edhe më të forta, me temperaturat e larta shkrirja Silikoni kristalor ka fuqi udhëzuese.
Të gjithë këta elementë kombinohen me metale - karbide, silicide dhe boride (CaC2, Al4C3, Fe3C, Mg2Si, TiB, TiB2). Ata kanë fortësi më të madhe, për shembull Fe3C, TiB. Karbidi i kalciumit vikorizohet për të hequr acetilenin.
Sapo shpërndarja e elektroneve në orbitale në atomet e fluorit, klorit dhe halogjenëve të tjerë të barazohet, atëherë mund të gjykojmë për to autoritetet administrative. Atomi i fluorit nuk ka orbitale të lira. Kështu, atomet e fluorit mund të shfaqin një valencë më të lartë të I dhe fazën e oksidimit - 1. Në atomet e halogjenëve të tjerë, për shembull në atomin e klorit, në të njëjtin nivel energjie ka d-orbitale të lira. Prandaj, shkëputja e elektroneve mund të ndodhë në tre mënyra të ndryshme.
Në fazën e parë, klori mund të shfaqë një fazë oksidimi prej +3 dhe të krijojë acid klorik HClO2, i cili përfaqësohet nga kripërat - kloritet, për shembull, kloriti i kaliumit KClO2.
Në raste të tjera, klori mund të kombinohet, në të cilin faza e oksidimit të klorit është +5. Këto komponime përmbajnë acidin perklorik HClO3 dhe kripërat e tij - klorat, për shembull klorat kaliumi KClO3 (kripa bertolle).
Në llojin e tretë, klori shfaq një fazë oksidimi prej +7, për shembull në acidin perklorik HClO4 dhe në kripërat e tij - perklorat, për shembull në perkloratin e kaliumit KClO4.
Gjysmetalet njollosëse dhe ujore të jometaleve. Një përshkrim i shkurtër i autoriteteve të tyre.
Oksidet jometale shpërndajnë oksidet acide. Në disa okside, era e keqe shfaq një fazë maksimale oksidimi që është e ngjashme me numrin e grupit (për shembull, SO2, N2O5), dhe në të tjera është shumë më e ulët (për shembull, SO2, N2O3). Oksidet acidike karakterizohen nga acidet dhe dy acide acidike të një jometali janë më të fortë se ai në të cilin vera shfaq një fazë më të lartë oksidimi. Për shembull, acidi nitrik HNO3 është më i fortë se acidi azotik HNO2, dhe acidi sulfurik H2SO4 është më i fortë se acidi sulfurik H2SO3.
Karakteristikat e komponimeve jo metalike të njollosura:
1. Forca e oksideve të larta (ato okside që përfshijnë një element të një grupi të caktuar me një fazë më të lartë oksidimi) gjatë periudhave të oksidimit gradualisht ndryshon nga bazike në acid në të djathtë.
2. Në grupe poshtë, fuqia acidike e oksideve të larta dobësohet gradualisht. Procesi mund të gjykohet nga forca e acideve, të cilat janë të ngjashme me këto okside.
3. Rritja e fuqisë acidike të të gjitha oksideve të elementeve thelbësore gjatë periudhave të ndryshimit në të djathtë shpjegohet me rritjen e vazhdueshme të ngarkesës pozitive të joneve të këtyre elementeve.
4. Në nëngrupet kryesore të sistemit periodik të elementeve kimike, fuqia acidike e oksideve jometale ndryshon drejtpërsëdrejti poshtë.
Formulat e përgjithshme të përbërjeve të ujit sipas grupeve të sistemit periodik të elementeve kimike janë dhënë në tabelën nr.3.
Tabela nr. 3.
Uji bashkohet me metalet (në fund të fundit) me ndihmën e substancave të ngurta të substancave jo molekulare. Kjo është arsyeja pse temperaturat e tyre të shkrirjes janë mjaft të larta.
Me jometalet, uji krijon vrima në strukturën gjysmë molekulare. Mendjet më të mëdha kanë ose gaz ose shpirtra fluturues.
Në periudhat e së keqes në të djathtë, fuqia acide e ujërave të verës kombinon jometalet problemet e ujit bëhu më i fortë. Kjo shpjegohet me faktin se ato janë acide në avujt e elektroneve të lira, dhe ato janë në ujë në një orbital të lirë, atëherë vërehet një proces që duket si hapi tjetër:
H2O + HF a H3O + F
Fluori i hidrogjenit në ujë shton jone pozitive në ujë, kështu që shfaq veti acidike. Ky proces është i pajtueshëm me kushtet e mëposhtme: joni acid ka një çift elektronik të vetëm, dhe joni ujor ka një orbital të lirë, prandaj krijohen lidhjet dhurues-pranues.
Kur amoniaku tretet në ujë, ndodh një proces i zgjatur. Dhe meqenëse ato i japin azotit një çift elektronik të vetëm, dhe i japin ujit një orbital të lirë, lind një lidhje shtesë dhe krijohen jonet e amoniumit NH4 + dhe jonet hidroksid OH. Si pasojë e trazirave po dalin autoritetet kryesore. Ky proces mund të shprehet duke përdorur formulën:
H2O + NH3 a NH4 + OH
Molekulat e amoniakut në ujë kanë jone pozitive në ujë, kështu që amoniaku ushtron fuqitë e tij kryesore.
Tani le të shohim pse fluori formohet në ujë - fluori i hidrogjenit HF - në ujë është një acid, më i dobët, më pak klorhidrik. Kjo shpjegohet me faktin se rrezet e joneve të fluorit janë dukshëm më të vogla se ato të joneve të klorit. Prandaj, fluori dhe uji tërheqin ujin më fort se klori. Në lidhje me këtë, shkalla e disociimit të acidit fluorik është dukshëm më e ulët se ajo e acidit fluorik, e cila është më e ulët se ajo e acidit klorhidrik të dobët.
Duke drejtuar prapanicat, mund të krijoni armët e mëposhtme të fshehura:
1. Gjatë periudhave të së keqes në të djathtë, ngarkesa pozitive e joneve të elementeve rritet. Në lidhje me këtë fuqi acidike të elementeve të ujit të verës, elementët në ujë do të bëhen më të fortë.
2. Në grupe, anioni i ngarkuar negativisht në rënie tërheq ujin jonik të ngarkuar pozitivisht H + gjithnjë e më pak. Në lidhje me këtë, procesi i ndarjes së joneve nga uji H + lehtësohet dhe rritet fuqia acidike e përbërjeve të ujit.
3. Në livadhe reagojnë gjysmëpërçuesit me bazë uji të jometaleve, të cilët çojnë në forca acidike në zonat ujore. Uji është një kombinim i jometaleve që ndodhin në zonat ujore nga autoritetet kryesore dhe reagojnë me acidet.
4. Aktiviteti oksidativ i jometaleve të ujit në grupet në rënie rritet shumë. Për shembull, oksidoni fluorin lidhje me ujë HF nuk është e mundur me kimikate, por klori mund të oksidohet nga HCl ujore me agjentë të ndryshëm oksidues. Kjo shpjegohet me faktin se në grupe në rënie, rrezet atomike rriten ndjeshëm, si rezultat i së cilës furnizimi i elektroneve bëhet më i lehtë.
Aktualisht njihen 105 elemente kimike, shumica prej tyre janë metale. Këto janë shumë të përhapura në natyrë dhe shfaqen në forma të ndryshme në sipërfaqen e tokës, ujërat e lumenjve, liqeneve, deteve, oqeaneve, trupave të kafshëve, bimëve dhe jetës në atmosferë.
Për shkak të fuqisë së tyre, metalet ndryshojnë ndjeshëm nga jometalet. Para së gjithash, ky ndryshim midis metaleve dhe jometaleve u theksua nga M. V. Lomonosov. "Metalet," shkroi ai, "janë trupa të fortë, ato të lakueshme janë me shkëlqim".
Duke siguruar këtë apo atë element tjetër në kategorinë e metaleve, ne mund të respektojmë qartësinë e secilit që i është caktuar një kompleksi autoritetesh:
1. Struktura e fortë kristalore.
2. Vezullim karakteristik i metalit.
3.Përçueshmëri e lartë termike dhe përçueshmëri elektrike.
4. Ndryshimet në përçueshmërinë elektrike me rritjen e temperaturës.
5. Vlerat e ulëta të potencialit jonizues, në mënyrë që të jetë e lehtë për të prodhuar elektrone.
6. Fleksibiliteti dhe duktiliteti.
7. Data e miratimit të lidhjeve.
Të gjitha metalet dhe lidhjet që mund të ngurtësohen në teknologji në këtë kohë mund të ndahen në dy grupe kryesore. Para së parës, prej tyre sillen metale me ngjyra - lidhje dhe lidhje, në të cilat përbëhet pjesa kryesore. Këto lidhje janë chavun dhe çeliku. Teknikët shpesh përdorin të ashtuquajturin aliazh çeliku. Ata janë të ekspozuar ndaj çeliqeve që përmbajnë krom, nikel, tungsten, molibden, vanadium, kobalt, titan dhe metale të tjera. Ndonjëherë çeliku i lidhur përmban 5-6 metale të ndryshme. Duke përdorur metodën e petëzimit, mund të merren çeliqe prej hekuri të farkëtuar, të cilët në disa raste kanë një forcë të lartë, në të tjera - rezistencë të lartë në tërheqje deri në gërryerje, në të tjera - rezistencë ndaj korrozionit, në mënyrë që të mos shkërmohem nën ndikimin e mjedisit të jashtëm. .
Grupi tjetër përfshin metalet me ngjyrë dhe lidhjet e tyre. Erë e keqe e hoqi një emër të tillë për kasaphanën e shthurjes. Për shembull, bakri është i kuq i lehtë, nikeli, kallaji, argjendi - i bardhë, plumbi - i bardhë i errët, ari - i verdhë. Në praktikë, lidhjet janë bërë shumë të ndenjura: bronzi është një aliazh bakri me kallaj dhe metale të tjera, bronzi është një aliazh bakri me zink, babit është një aliazh kallaji me antimon dhe metale të tjera.
Ky buzë ishte i metalizuar në të zezë dhe me ngjyra. Së bashku me metalet me ngjyra dhe me ngjyra mund të shihen edhe një grup metalesh fisnike: argjendi, ari, platini, ruteniumi etj. Erërat janë quajtur kështu sepse praktikisht nuk oksidohen në ajër në temperatura të larta dhe nuk vuajnë nga veprimi i acideve dhe livadheve mbi to.
II. Fuqia fizike e metaleve.
Nga jashtë, metalet, me sa duket, karakterizohen nga një shkëlqim i veçantë "i ngjashëm me metalin", gjë që e bën të qartë se pamja e tyre ndikohet fuqishëm nga ndryshimi i dritës. Sidoqoftë, kjo qasje duhet të jetë veçanërisht e kujdesshme vetëm në rast se metali krijon një masë plotësisht kompakte. Vërtetë, magnezi dhe alumini ruajnë shkëlqimin e tyre kur treten në pluhur, por shumica e metaleve në një pamje të grimcuar imët kanë një ngjyrë të zezë ose gri të errët. Pastaj, metalet tipike kanë përçueshmëri të lartë termike dhe elektrike, dhe sipas aftësisë së tyre për të përcjellë nxehtësinë dhe rrjedhën, ato formohen në të njëjtin rend: përçuesit më të mirë janë argjendi dhe bakri, përçuesit më të këqij janë plumbi dhe mërkuri. Me rritjen e temperaturës, përçueshmëria elektrike zvogëlohet në temperatura më të ulëta, megjithatë, rritet;
Një avantazh tjetër i rëndësishëm i metaleve është deformueshmëria e tyre e lehtë mekanike. Metalet janë plastike, erërat janë të mira për farkëtim, tërhiqen në llum, migrojnë në gjethe, etj.
Fuqitë fizike karakteristike të metaleve lidhen me karakteristikat e strukturës së tyre të brendshme. Me sa duket, deri më sot, kristalet metalike përbëhen nga jone të ngarkuar pozitivisht dhe elektrone të lira, të ndarë në atome nënatomike. I gjithë kristali mund të shihet si një rrjetë e gjerë, nyjet e së cilës janë të zëna nga jone, dhe në hapësirat midis joneve ka elektrone lehtësisht të brishtë. Këto elektrone kalojnë gradualisht nga një atom në tjetrin dhe mbështillen rreth bërthamës së një atomi apo tjetrit. Meqenëse elektronet nuk janë të lidhura me jonet aktive, atëherë edhe nën fluksin e një ndryshimi të vogël në potencial, jonet fillojnë të lëvizin në drejtim të kundërt, kështu që lind një rrymë elektrike.
Prania e elektroneve të larta rezulton në përçueshmëri të lartë termike të metaleve. Duke lëvizur vazhdimisht pandërprerë, elektronet vazhdimisht ndërveprojnë me jonet dhe shkëmbejnë energji me to. Prandaj, dridhja e joneve që janë grumbulluar në këtë pjesë të metalit si rezultat i ngrohjes kalon menjëherë në jonet e enës, prej tyre në ato sulmuese etj., dhe gjendja termike e metalit përshpejtohet shpejt; E gjithë masa metalike merr të njëjtën temperaturë.
Në bazë të trashësisë së tyre, metalet ndahen në dy grupe të mëdha: metale të lehta, trashësia e të cilave nuk është më shumë se 5 g/cm3, dhe metale të rëndësishme - të gjithë të tjerët.
Pjesët e metaleve që gjenden në gjendje të ngurtë dhe të rralla janë të lidhura nga një lloj i veçantë i lidhjes kimike - e ashtuquajtura lidhje metalike. Tregohet nga prania e menjëhershme e lidhjeve kovalente primare midis atomeve neutrale dhe tendosjeve të Kulombit midis joneve dhe elektroneve të lira. Kështu, një lidhje metalike nuk ka fuqinë e grimcave të vetme, por të agregatit të tyre.
III. Fuqia kimike e metaleve.
Fuqia kryesore kimike e metaleve është se atomet e tyre heqin dorë lehtësisht nga elektronet e valencës dhe bëhen jone të ngarkuar pozitivisht. Metalet tipike nuk thithin elektrone; Ata janë gjithmonë të ngarkuar pozitivisht.
Duke hequr dorë lehtësisht nga elektronet e tyre valente në reaksionet kimike, të tilla si metalet dhe burimet e energjisë. Prania e elektroneve para furnizimit me elektrone gjendet në disa metale, shumë larg të qenit rasti në botë. Sa më i lehtë metali të heqë dorë nga elektronet e tij, aq më aktiv është ai, aq më energjik është në ndërveprim me të folurit e tjerë. Le të shtojmë pak zink përveç kripës së plumbit. Zinku fillon të përkeqësohet, dhe plumbi shfaqet si rezultat i përkeqësimit. Reagimi u shpreh bashkëmoshatarëve:
Zn + Pb (NO3) 2 \u003d Pb + Zn (NO3) 2
Është e qartë se ky reaksion është një reaksion tipik oksidim-ripërtëritës. Thelbi i tij zbret në faktin se atomet e zinkut japin elektronet e tyre të valencës në jonet dyvalente të plumbit, duke u shndërruar kështu në jone zinku, dhe ato shndërrohen në plumb dhe shfaqen si plumb metalik. Nëse zhytni aksidentalisht një copë plumbi në kripën e zinkut, atëherë nuk do të ketë asnjë reagim. Kjo tregon se zinku është më aktiv se plumbi, se atomet e tij janë më të lehta për t'u hequr, dhe është më e rëndësishme për ta të pranojnë elektrone, më pak atome dhe jone sesa plumbi.
Depozitimi i disa metaleve nga homologët e tyre nga metale të tjera u raportua për herë të parë nga shkencëtari rus Beketov, i cili i klasifikoi metalet sipas aktivitetit të tyre kimik në të ashtuquajturat "seri metalike". Në këtë kohë, rreshti vitisnyuvalny i Beketovit quhet rreshti naprug.
Metalet, të rritura sipas radhës së rritjes së atyre standarde
potencialet elektrokimike dhe krijojnë një gamë elektrokimike të metaleve të tensionit: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb,
H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Një numër stresesh karakterizojnë fuqinë kimike të metaleve:
- Sa më i ulët të jetë potenciali i elektrodës së metalit, aq më e madhe është qëndrueshmëria e tij.
- Lëkura metalike e ndërtesës hiqet (përforcohet) nga nivelet e kripërave dhe metaleve që qëndrojnë në linjë me tensionin pas atij të ri.
- Të gjitha metalet që shfaqin një potencial negativ standard të elektrodës janë në rangun e tensionit më të lartë se uji, dhe për këtë arsye e largojnë atë nga acidet.
Është e nevojshme të theksohet se një sërë idesh karakterizojnë reagimin e metaleve dhe kripërave të tyre vetëm në ujë dhe në temperaturën e dhomës.
Përveç kësaj, duhet të jeni të vetëdijshëm se aktiviteti i lartë elektrokimik i metaleve nuk nënkupton gjithmonë aktivitet të lartë kimik. Për shembull, një numër tensionesh fillojnë me litium, pasi rubidi dhe kaliumi janë më aktivë në reaksionin kimik dhe janë gjetur të jenë në të djathtë të litiumit. Kjo është për shkak të energjisë relativisht të lartë të procesit të hidratimit të joneve të litiumit të barabartë me jonet e metaleve të tjera bazë.
IV. Korrozioni i metaleve.
Shumica e metaleve, të cilat vijnë në kontakt me një pjesë të madhe të lëndës së tyre të mesme të ngjashme me gazin dhe të rrallë, pak a shumë shpejt i nënshtrohen shkatërrimit nga sipërfaqja. Arsyeja për këtë është ndërveprimi kimik i metaleve me gazrat e tretur në ajër, si dhe ujin dhe substancat e tretura në të.
Çdo proces i shkatërrimit kimik të metaleve nën ndikimin e mediave të tepërta quhet korrozioni.
Korrozioni ndodh më thjesht kur metalet kombinohen me gazrat. Në sipërfaqen e metalit krijohen përbërësit e mëposhtëm: oksidet, përbërjet e squfurit, kripërat bazë të acidit karbonik, të cilat shpesh mbulojnë sipërfaqen me një top të trashë, i cili mbron metalin nga infuzioni i mëvonshëm i të njëjtit gaz.
Tjetri në të djathtë është një kombinim i metalit me një substancë të mesme të rrallë - ujë dhe lumenj të tretur në të.
Në këtë rast, produktet mund të dështojnë, si rezultat i së cilës korrozioni përhapet më tej në metal. Përveç kësaj, uji, i cili parandalon prishjen e të folurit, është një përcjellës i rrymës elektrike, si rezultat i së cilës gradualisht ndodhin proceset elektrokimike, të cilat janë një nga faktorët kryesorë që zhvillojnë dhe përshpejtojnë korrozionin.
Metalet e pastra në shumicën e rasteve nuk i nënshtrohen korrozionit. Ky lloj metali, si salz, në një pamje absolutisht të pastër mund të mos ndryshket. Gjithashtu, metalet primare teknike shkatërrojnë gjithmonë shtëpi të ndryshme, gjë që krijon një mjedis të favorshëm për korrozion.
etj...................
jometalet emërtoni elementët kimikë që veprojnë duket e mirë E thënë thjesht, era e keqe nuk nxitet nga fuqitë fizike të metaleve. Nga 109 elementët kimikë, 87 mund t'i shtohen metaleve, 22 є jometale.
në në mendjet më të mëdha jometalet mund të gjenden në si gaz, e rrallë, si dhe qëndrojnë të vendosur.
gazetє helium He, neoni Ne, argon Ar, krypton Kr, ksenon Xe, radon Rn. Kjo eshte e gjitha Gazet inerte. Molekula e lëkurës së një gazi inert përbëhet nga një atom. Në tregun aktual elektronik, atomet e gazeve inerte (përveç heliumit) kanë humbur të gjitha elektronet e tyre. Heliumi ka vetëm dy. Për shkak të rezistencës së tyre kimike, gazrat inertë mund të krahasohen me metale të çmuara - ari dhe platini, ato gjithashtu kanë një emër tjetër - gazra fisnikë. Është më mirë t'i afroheni gazeve inerte siç quhen, pasi aromat mund të hyjnë reaksionet kimike dhe krijoni Produkte kimike. Në vitin 1962, u bë e qartë se ksenoni dhe fluori mund të kurojnë sëmundjet. Që atëherë, janë identifikuar më shumë se 150 komponime kimike: ksenon, kripton, radon me fluor, acid, klor dhe azot.
Informacioni për vetitë kimike të gazeve fisnike dhe inerte doli të mos ishte plotësisht i saktë, kështu që në vend të grupit zero të identifikuar të gazeve inerte, ato u transferuan në grupin e tetë të sistemit periodik.
Gazrat si uji, kosi, azoti, klori dhe fluori shpërndajnë molekulat diatomike, tashmë të njohura për ne: H 2, O 2, N 2, CL 2, F 2.
Ju mund të përcaktoni llojin e të folurit duke përdorur simbole shtesë kimike dhe matematikore - një formulë kimike. Siç e dimë tashmë, formula kimike mund të përdoret për të llogaritur masën molekulare të reniumit (Mr). Masa molekulare ujore e një përbërjeje të thjeshtë është shtimi i lashtë i masës atomike ujore për numrin e atomeve në një molekulë, për shembull, acid: O 2
Mr (O 2) \u003d Ar (O) · 2 \u003d 16 · 2\u003d 32
Prote, kisen mund të krijohet nga një substancë tjetër e ngjashme me gazin - ozoni, përpara se molekula e ozonit të përmbajë tre atome kisen. Formula kimike O 3.
Aftësia e atomeve të një elementi kimik për të krijuar një numër përbërjesh të thjeshta quhet alotropia Dhe këto janë fjalë të thjeshta - alotropike ndaj gjarpërinjve, Quhen edhe ato modifikimet.
Fuqia e modifikimeve alotropike të elementit kimik të thartë: përbërjet e thjeshta O 2 dhe ozoni O 3 ndryshon shumë.
Kisen nuk ka një erë karakteristike kur zëvendësohet me ozon (këtej vjen emri ozon - në greqisht, ozon do të thotë "erë"). Një aromë e ngjashme mund të zbulohet gjatë një stuhie, gazi krijohet në erë për shkak të shkarkimeve elektrike.
Kisen nuk ndryshon ngjyrën kur zëvendësohet nga ozoni, i cili mund të identifikohet nga nuanca e tij e zbehtë vjollce. Ozoni ka fuqi baktericid. Vin përdoret gjithashtu për mosinfektim ujë i pijshëm. Ozoni mund të ndërhyjë në kalimin e rrezatimit ultravjollcë në spektrin diellor, i cili është i dëmshëm për të gjithë organizmat e gjallë në Tokë. Ekrani i ozonit (topi), i cili ndodhet në një lartësi prej 20-35 km, mbron të gjitha gjallesat nga ndryshimet e dëmshme të përgjumjes.
3 22 të folur të thjeshtë-jometale me mendje të jashtëzakonshme në të lëngshmeËshtë vetëm brom, i cili është një molekulë diatomike. Formula e bromit: Br 2.
Bromi i jep rëndësinë e boraksit, erë e pakëndshme rіdina (bromos nga gjuha e lashtë greke përkthehet si "erë e keqe").
Fjalë të tilla të forta, jo metalike si sirka dhe qymyr janë parë që nga kohërat e lashta (në fshatin Vugilla).
kupa qiellore Fjalimet jometalike janë gjithashtu po aq delikate sa manifestimi i alotropisë. Qymyri mund të krijojë gjëra të tilla të thjeshta si diamanti, grafiti, etj. Dallimi midis diamantit dhe grafitit qëndron në grilat kristalore.
I ka mbaruar ushqimi? Nuk dini si të bëni detyrat e shtëpisë?
Për të marrë ndihmë nga një mësues, regjistrohu.
Mësimi i parë - pa dëm!
www.site, me kopjim të plotë ose të pjesshëm të materialit, dërguar në Pershodzherel ob'yazkov.
Jometale, elementë kimikë, të cilët nuk vuajnë nga fuqitë karakteristike të metaleve. Jometalet zakonisht marrin erë të keqe si përçues nxehtësie dhe komponentë elektrikë (ato kundërmojnë si izolues nxehtësie dhe komponentë elektrikë). Jometalet janë të ekspozuar ndaj karbonit, ... ... Fjalor enciklopedik shkencor dhe teknik
Elemente kimike që formojnë trupa të thjeshtë pa iu nënshtruar fuqive karakteristike të metaleve. Jometalet përfshijnë 22 elemente: gazet: uji, azoti, gazi i thartë, fluori, klori dhe gazrat inerte; Ridina brom; të ngurta bor, ... ... Fjalori i madh Enciklopedik
jometalet- kim. elementet që krijohen në gjendje të lirë janë fjalë të thjeshta që nuk ndikojnë në gjendjen fizike. i kim. autoritetet (div.); Emri metaloid është i vjetëruar. N. pranohet të përfshihen 22 elementë të Tabelës Periodike të Elementeve D. I. Mendeleva (div.): Uji... Enciklopedia e Madhe Politeknike
Elemente kimike që formojnë trupa të thjeshtë pa iu nënshtruar fuqive karakteristike të metaleve. Jometalet përfshijnë 22 elemente: gazet: uji, azoti, gazi i thartë, fluori, klori dhe gazrat inerte; Ridina brom; të ngurta bor, ... ... fjalor enciklopedik
jometalet- elemente kimike që krijojnë trupa të thjeshtë pa iu nënshtruar fuqive karakteristike të metaleve. Jometalet përmbajnë 22 elemente. Prej tyre, në temperaturën e dhomës, H, N, O, F, Cl ... gjenden në një gjendje të ngjashme me gazin ... Fjalor Enciklopedik i Metalurgjisë
Elemente kimike që formojnë trupa të thjeshtë pa iu nënshtruar fuqive karakteristike të metaleve (Div. Metalet). Emri është Metaloids, që janë burimi i amullisë për N., për të dalë nga jeta. Janë 22 elementë të dukshëm për N. Me ta...... Enciklopedia e Madhe Radyanska
Më vjen keq që nuk i lini metalet tuaja të bien në duart tuaja. Megjithëse nuk është e mundur të vizatohen kufij të qartë midis metaleve dhe N., gazet fisnike, uji, halogjenet, oksidi, kalkogjeni, azoti, fosfori, arseniku, karboni, silikoni dhe bor zakonisht sillen në N. ... Fjalori i Madh Enciklopedik Politeknik
Kimik. elemente që ende krijojnë trupa të thjeshtë pa iu nënshtruar fuqive karakteristike të metaleve. Në N. ka 22 elemente: gaze: ujë, azoti, gaz i thartë, fluor, klor dhe gazra inerte; brom rida; TV bor i ngurtë, karboni, silikoni, fosfori, ... ... Studimet e natyrës. fjalor enciklopedik
jometalet- Thjesht thuaj, mos u lëkund nga fuqia e metaleve: era e keqe nuk krijon një shkëlqim metalik, nuk është i lakueshëm, është keq të përçosh nxehtësinë dhe energjinë elektrike. Nuk ka dallim të mprehtë midis jometaleve dhe metaleve. Jometalet përmbajnë 22 elemente. Me ta në normale ... ... fjalor metalurgjik
Kimia inorganike, ndarjet e kimisë, lidhjet me reaksionet kimike, vetitë e reaksionit dhe fuqitë e të gjithë elementëve kimikë dhe të tyre rezultatet inorganike. Kjo zonë është e mbuluar me të gjitha substancat kimike, me një nuancë organike... ... Wikipedia
librat
- Komplet tavoline. Kimia. Jometalet (Tabela 18). Albumi fillestar me 18 arkushin. Art. 5-8688-018 Halogjen. Kimia e halogjeneve. Sirka. Alotropia. Kimia e sirkës. Acidi sirganik. Kimia e azotit. Oksidet e azotit. Acidi nitrik është një oksidues. Fosfori. ...
- Kimia. Hodhi. Ata nuk kanë bërë metal. klasa e 9-të Punëtorja qep, Antonina Stepanivna Koroshchenko. Punëtori dëshiron të kryejë një numër të madh detyrash që mund të përdoren për të arritur rezultate lëndore, meta-lëndore dhe të veçanta të mësimdhënies së kimisë në klasën e 9-të. Pos_bnik…
- Testet e kimisë: klasa e 9-të. : Jometalet. Njohuri të avancuara të kimisë për kursin e shkollës bazë. Përgatitja për Testin Kryesor të Sovranit. Standardi Federal i Arsimit Shtetëror, Ryabov, Mikhailo Oleksiyovich. Ky manual përputhet plotësisht me standardin e ndriçimit të qeverisë federale (një gjeneratë tjetër). Posіbnik për t'u hakmarrë ndaj vjehrrit, i cili betohet për dy temat e ndihmësit të O. S. Gabrielyan...
MNOU "Liceu"
Abstrakt nga kimia me temë:
"jo metale"
viconali:
nxënësit 11 klasa “A”.
Kucherenko Maria,
Shadrina Ksenia.
ri-verifikuar:
mësues i kimisë
Shcherbakova Marina
Oleksandrivna.
Kemerovë - 2002
Prezantimi ................................................. .... ................................ ..3
§1. Pozicionet e elementeve jometalike në sistemin periodik të elementeve kimike. I njohur në natyrë. Fuqia e jashtme kimike dhe fizike ...................................... ........ 4
§2. Fuqia kimike negative e jometaleve ........................... ..6
§3. Budova dhe fuqia e fjalimeve të thjeshta - jometale ......... 7
§4. Gjysmetalet njollosëse dhe ujore të jometaleve. Përshkrim i shkurtër Autoritetet e tyre ..................................................... ... ... 9
provë
Lista e Wikilistëve
Hyni .
I gjithë diversiteti i mjedisit tonë natyror vjen nga kombinimi i një numri po aq të vogël elementësh kimikë.
Në periudha të ndryshme historike, koncepti i "elementit" ka kuptime të ndryshme. Filozofët e lashtë grekë i shihnin "elementet" si "elemente" - nxehtësia, të ftohtit, thatësia dhe lagështia. Duke ardhur në çifte, erërat krijuan "fillimet" e të gjitha fjalimeve - zjarri, era, uji dhe dheu. Në shekullin e mesëm, këtyre kallinjve iu shtua kripë, kosi dhe zhiva. Në shekullin e 17-të, R. Boyle vuri në dukje se të gjithë elementët janë të natyrës materiale dhe numri i tyre mund të jetë i madh.
Në 1787, kimisti francez A. Lavoisier krijoi "Tabela e trupave të thjeshtë". Të gjithë elementët e njohur në atë kohë kishin shkuar përpara saj. Nën pjesën tjetër kuptoheshin trupa të thjeshtë, të cilët nuk mund të ndaheshin me metoda kimike në më të thjeshtë. Me kalimin e viteve është bërë e qartë se disa fjalime bisedore kanë hyrë në tavolinë.
Në ditët e sotme koncepti i "elementit kimik" është përcaktuar saktësisht.
Një element kimik përbëhet nga atome me një ngarkesë bërthamore megjithatë pozitive. (Data e mbetur është në lidhje me numrin rendor të elementit në tabelën periodike.)
Në këtë kohë njihen 107 elementë. Rreth 90 prej tyre gjenden në natyrë. Rashta u hoq pjesë-pjesë për reaksione shtesë bërthamore. 104-107 elementë u sintetizuan nga fizikanët në Institutin e Përbashkët për Kërkime Bërthamore në Dubna. Aktualisht, robotët po punojnë në nxjerrjen individuale të elementeve kimike me elementë të rendit më të lartë.
Të gjithë elementët ndahen në metale dhe jometale. Para metaleve vendosen 3 107 elementë 85. Elementët e mëposhtëm përfshihen në jometalet: helium, neoni, argon, kripton, ksenon, radoni, fluor, klor, brom, jod, astatine, kisen, sirka, selen, teluri, azot, fosfor, hi, karbon, silikon, bor, Voden. Megjithatë, nuk është një çështje mendore. Me mendje të mirë, veprat metalike mund të shfaqin fuqi jometalike, dhe veprat jometalike mund të shfaqin fuqi metalike.
§1. Pozicionet e elementeve jometalike në sistemin periodik të elementeve kimike. I njohur në natyrë. Fuqia e tepërt kimike dhe fizike.
Ekziston një mungesë e konsiderueshme e elementeve jometalike në përzierje të reduktuara në elemente metalike. Vendosja e tyre në sistemin periodik të elementeve kimike D.I. Mendelev është paraqitur në tabelën nr. 1.
Tabela nr. 1.
Siç shihet nga tabela nr. 1, elementët jometalë janë të shpërndarë kryesisht në pjesën e sipërme të djathtë të sistemit periodik. Meqenëse në periudhat e zhvendosjes djathtas ngarkesat bërthamore të atomeve elementare rriten dhe rrezet atomike ndryshojnë, dhe në grupe në rënie rriten edhe rrezet atomike, është e kuptueshme që tërheqja e atomeve jometalike është më e fortë se ajo e atomeve të metaleve janë elektronikë të jashtëm. Në lidhje me këtë, jometalet favorizohen nga oksidet e fuqisë. Fuqia oksiduese veçanërisht e fortë, e cila rezulton me shtimin e elektroneve, zbulon jometale që janë në periudhën e 2-të dhe të tretë të grupit VI-VII. Oksiduesi më i fortë është fluori. Përmbajtja e oksidit të jometaleve rritet në vlerat numerike të vlerave elektronegative në rendin vijues: Si, B, H, P, C, S, I, N, Cl, O, F. Më pas, energjia e ndërveprimi me ujin dhe metalet e fluorit:
Mensch reagon energjikisht ndaj puthjes:
Fluori është një jometal i shkallës së lartë që nuk karakterizohet nga fuqia ekstreme dhe mund të prodhojë elektrone në reaksionet kimike.
Kisen, duke gjykuar nga efekti i tij në fluor, mund të zbulojë një fazë pozitive të oksidimit, duke qenë kështu një agjent primordial.
Të gjithë jometalet e tjerë zbulojnë fuqitë kryesore. Për më tepër, këto fuqi gradualisht rriten nga aciditeti në silikon: O, Cl, N, I, S, C, P, H, B, Si. Kështu, për shembull, klori nuk ndërvepron drejtpërdrejt me aciditetin, por oksidet e tij (Cl2O, ClO2, Cl2O2) mund të ndahen në mënyrë indirekte, në të cilën klori shfaq një fazë pozitive oksidimi. Azoti në temperatura të larta kombinohet menjëherë me acidin dhe, për rrjedhojë, shfaq fuqi ekstreme. Squfuri reagon edhe më lehtë me thartirën: tregon oksidet e fuqisë.
Le të kalojmë duke parë molekulat aktuale të jometaleve. Jometalet formojnë molekula monotomike dhe diatomike.
Jometalet monoatomike janë të ekspozuar ndaj gazeve inerte, të cilat praktikisht nuk reagojnë me substancat më aktive. Gazrat inerte klasifikohen në Grupin VIII të Sistemit Periodik dhe formulat kimike të përbërjeve të thjeshta përkatëse janë: He, Ne, Ar, Kr, Xe dhe Rn.
Veprimet e jometaleve krijojnë molekula diatomike. Këto janë H2, F2, Cl2, Br2, I2 (elementë të grupit VII të sistemit periodik), si dhe oksigjen O2 dhe azoti N2. Gazi i ozonit (O3) formohet nga molekulat triatomike.
Për komponimet jometalike që janë të pranishme në gjendje të ngurtë, është e vështirë të formulohet një formulë kimike. Atomet e karbonit në grafit lidhen njëri me tjetrin në mënyra të ndryshme. Është e rëndësishme të shihet struktura e molekulës në strukturat udhëzuese. Kur shkruhet formula kimike për fjalë të tilla si në lidhje me metalet, supozohet se fjalë të tilla përbëhen vetëm nga atome. Formulat kimike, pra, shkruhen pa indekse - C, Si, S, etj.
Fjalë të tilla të thjeshta si ozoni dhe thartësia, të cilat formojnë një depo të re acidike (të dyja janë të përbëra nga një dhe i njëjti element - thartirë), por luftojnë për numrin e atomeve në një molekulë, mund të jenë ndryshimi i fuqisë. Pra, thartira nuk mban erë, ndërsa ozoni ka një erë të mprehtë, të cilën e ndjejmë në orën e një stuhie. Fuqia e jometaleve të ngurta, grafitit dhe diamantit, gjendet gjithashtu në një depo të re hiri, si dhe diamanteve, dhe ndryshon ndjeshëm (grafiti është i fortë, diamanti është i fortë). Kështu, fuqia e të folurit tregohet jo vetëm nga struktura e tij e qartë, por edhe nga sa atome ndodhen në molekulat e të folurit dhe si janë të lidhura me njëri-tjetrin.
Jometalet duket se gjenden në trupa të thjeshtë në gjendje të ngurtë ose të ngjashme me gaz (përfshirë bromin). Erë e keqe nuk qëndron në fuqitë fizike, metalet e fuqishme. Lëndët e ngurta jo metalike nuk shfaqin nxehtësinë karakteristike të metaleve, ato marrin erë të keqe dhe priren të përçojnë dobët elektricitetin dhe ngrohjen (përtej grafitit).
§2. Fuqia kimike nëntokësore e jometaleve.
Oksidet e jometaleve sillen në okside acidike, të cilat janë acide. Uji nuk krijoi substanca të ngjashme me gazin (për shembull, HCl, H2S, NH3). Llojet e ujit të këtyre (për shembull, halogjenet e hidrogjenit) janë acide të forta. Metalet dhe jometalet tipike kombinohen me një lidhje jonike (për shembull, NaCl). Jometalet mund të reagojnë me njëri-tjetrin, duke formuar lidhje me lidhje polare kovalente (H2O, HCl) dhe lidhje jopolare (CO2).
Me ujë, përbërjet jometalike përdoren për të tretur lëngjet vdekjeprurëse, të tilla si, për shembull, fluori i hidrogjenit HF, uji blu H2S, amoniaku NH3, metani CH4. Kur halogjenet, squfuri, seleniumi dhe teluri treten në ujë, treten acidet me të njëjtën formulë si vetë përbërjet e ujit: HF, HCl, HCl, HBr, HI, H2S, H2Se, H2Te.
Kur amoniaku tretet në ujë, formohet uji amoniak, i cili përcaktohet me formulën NH4OH dhe quhet hidroksid amoniumi. Përcaktohet gjithashtu me formulën NH3 H2O dhe quhet hidrat i amonit.
Oksidet jometale shpërndajnë oksidet acide. Në disa okside, era e keqe shfaq një fazë maksimale oksidimi që është e ngjashme me numrin e grupit (për shembull, SO2, N2O5), dhe në të tjera është shumë më e ulët (për shembull, SO2, N2O3). Oksidet acidike karakterizohen nga acidet dhe dy acide acidike të një jometali janë më të fortë se ai në të cilin vera shfaq një fazë më të lartë oksidimi. Për shembull, acidi nitrik HNO3 është më i fortë se acidi azotik HNO2, dhe acidi sulfurik H2SO4 është më i fortë se acidi sulfurik H2SO3.
§3. Budova dhe fuqia e fjalimeve të thjeshta - jometale.
Gjeni më së shumti jometale që të jenë molekularë dhe më pak llojet që të jenë jomolekulare. Kjo shpjegon arrogancën e autoriteteve të tyre. Kjo ilustrohet qartë në diagramin nr. 2.
Tabela nr. 2
Bori kristalor B (si dhe silikoni kristalor) ka një pikë shkrirjeje shumë të lartë (2075 ° C) dhe rezistencë të lartë. Përçueshmëria elektrike e borit rritet shumë me rritjen e temperaturës, gjë që bën të mundur përdorimin e gjerë të tij në teknologjinë e përcjellësve. Shtimi i borit në çelik dhe në lidhjet e aluminit, bakrit, nikelit, etj. Unë do të përmirësoj fuqinë e tyre mekanike.
Boridet (gjysmë bor nga metale të caktuara, për shembull nga titani: TiB, TiB2) janë të nevojshëm në prodhimin e pjesëve për motorët reaktivë dhe tehët e turbinave me gaz.
Siç mund të shihet nga diagramet nr. 2, qymyr C, silic Si, bor Në maj, unë do të shkoj në ferr dhe do të jem në krye të autoriteteve të tilla të korruptuara. Ashtu si fjalët e thjeshta, erëra e keqe vjen në dy forma - kristalore dhe amorfe. Format kristalore të këtyre elementeve janë më të forta, me pika shkrirjeje të larta. Silikoni kristalor ka fuqi udhëzuese.
Të gjithë këta elementë kombinohen me metale - karbide, silicide dhe boride (CaC2, Al4C3, Fe3C, Mg2Si, TiB, TiB2). Ata kanë fortësi më të madhe, për shembull Fe3C, TiB. Karbidi i kalciumit vikorizohet për të hequr acetilenin.
Meqenëse shpërndarja e elektroneve në orbitalet e atomeve të fluorit, klorit dhe halogjenëve të tjerë barazohet, atëherë mund të gjykohet për autoritetet e tyre administrative. Atomi i fluorit nuk ka orbitale të lira. Kështu, atomet e fluorit mund të shfaqin një valencë më të lartë të I dhe fazën e oksidimit - 1. Në atomet e halogjenëve të tjerë, për shembull në atomin e klorit, në të njëjtin nivel energjie ka d-orbitale të lira. Prandaj, shkëputja e elektroneve mund të ndodhë në tre mënyra të ndryshme.
Në fazën e parë, klori mund të shfaqë një fazë oksidimi prej +3 dhe të krijojë acid klorik HClO2, i cili përfaqësohet nga kripërat - kloritet, për shembull, kloriti i kaliumit KClO2.
Në raste të tjera, klori mund të kombinohet, në të cilin faza e oksidimit të klorit është +5. Këto komponime përmbajnë acid kloronik HClO3 dhe kripërat e tij - klorat, për shembull klorat kaliumi KClO3 (kripë bertolle).
Në llojin e tretë, klori shfaq një fazë oksidimi prej +7, për shembull në acidin perklorik HClO4 dhe në kripërat e tij - perklorat, për shembull në perkloratin e kaliumit KClO4.
§4. Gjysmetalet njollosëse dhe ujore të jometaleve. Një përshkrim i shkurtër i autoriteteve të tyre.
Oksidet jometale shpërndajnë oksidet acide. Në disa okside, era e keqe shfaq një fazë maksimale oksidimi që është e ngjashme me numrin e grupit (për shembull, SO2, N2O5), dhe në të tjera është shumë më e ulët (për shembull, SO2, N2O3). Oksidet acidike karakterizohen nga acidet dhe dy acide acidike të një jometali janë më të fortë se ai në të cilin vera shfaq një fazë më të lartë oksidimi. Për shembull, acidi nitrik HNO3 është më i fortë se acidi azotik HNO2, dhe acidi sulfurik H2SO4 është më i fortë se acidi sulfurik H2SO3.
Karakteristikat lidhjet e njollosura të jometaleve:
1. Forca e oksideve të larta (ato okside që përfshijnë një element të një grupi të caktuar me një fazë më të lartë oksidimi) gjatë periudhave të oksidimit gradualisht ndryshon nga bazike në acid në të djathtë.
2. Në grupe poshtë, fuqia acidike e oksideve të larta dobësohet gradualisht. Procesi mund të gjykohet nga forca e acideve, të cilat janë të ngjashme me këto okside.
3. Rritja e fuqisë acidike të të gjitha oksideve të elementeve thelbësore gjatë periudhave të ndryshimit në të djathtë shpjegohet me rritjen e vazhdueshme të ngarkesës pozitive të joneve të këtyre elementeve.
4. Në nëngrupet kryesore të sistemit periodik të elementeve kimike, fuqia acidike e oksideve jometale ndryshon drejtpërsëdrejti poshtë.
Formulat e përgjithshme të përbërjeve të ujit sipas grupeve të sistemit periodik të elementeve kimike janë dhënë në tabelën nr.3.
Tabela nr. 3.
Uji bashkohet me metalet (në fund të fundit) me ndihmën e substancave të ngurta të substancave jo molekulare. Kjo është arsyeja pse temperaturat e tyre të shkrirjes janë mjaft të larta.
Me jometalet, uji krijon vrima në strukturën gjysmë molekulare. Mendjet më të mëdha kanë ose gaz ose shpirtra fluturues.
Gjatë periudhave të së keqes në të djathtë, fuqia acidike e ujërave të verës dhe jometaleve në zonat ujore do të bëhet më e fortë. Kjo shpjegohet me faktin se ato janë acidike në avujt e elektroneve të lira, dhe ato janë në orbitale të lirë nga uji, atëherë ndodh një proces që duket se është i afërt:
H2O + HF - H3O + F
Fluori i hidrogjenit në ujë shton jone pozitive në ujë, kështu që shfaq veti acidike. Ky proces është i pajtueshëm me kushtet e mëposhtme: joni acid ka një çift elektronik të vetëm, dhe joni ujor ka një orbital të lirë, prandaj krijohen lidhjet dhurues-pranues.
Kur amoniaku tretet në ujë, ndodh një proces i zgjatur. Dhe meqenëse ato i japin azotit një çift elektronik të vetëm, dhe i japin ujit një orbital të lirë, lind një lidhje shtesë dhe krijohen jonet e amoniumit NH4 + dhe jonet hidroksid OH. Si pasojë e trazirave po dalin autoritetet kryesore. Ky proces mund të shprehet duke përdorur formulën:
H2O + NH3- NH4 + OH
Molekulat e amoniakut në ujë kanë jone pozitive në ujë, kështu që amoniaku ushtron fuqitë e tij kryesore.
Tani le të shohim pse fluori formohet në ujë - fluori i hidrogjenit HF - në ujë është një acid, më i dobët, më pak klorhidrik. Kjo shpjegohet me faktin se rrezet e joneve të fluorit janë dukshëm më të vogla se ato të joneve të klorit. Prandaj, fluori dhe uji tërheqin ujin më fort se klori. Në lidhje me këtë, shkalla e disociimit të acidit fluorik është dukshëm më e ulët se ajo e acidit fluorik, e cila është më e ulët se ajo e acidit klorhidrik të dobët.
Duke treguar të pasmet mund të krijoni një sulm visnovki nëntokësore:
1. Gjatë periudhave të së keqes në të djathtë, ngarkesa pozitive e joneve të elementeve rritet. Në lidhje me këtë fuqi acidike të elementeve të ujit të verës, elementët në ujë do të bëhen më të fortë.
2. Në grupe, anioni i ngarkuar negativisht në rënie tërheq ujin jonik të ngarkuar pozitivisht H + gjithnjë e më pak. Në lidhje me këtë, procesi i ndarjes së joneve nga uji H + lehtësohet dhe rritet fuqia acidike e përbërjeve të ujit.
3. Në livadhe reagojnë gjysmëpërçuesit me bazë uji të jometaleve, të cilët çojnë në forca acidike në zonat ujore. Uji është një kombinim i jometaleve që ndodhin në zonat ujore nga autoritetet kryesore dhe reagojnë me acidet.
4. Aktiviteti oksidativ i jometaleve të ujit në grupet në rënie rritet shumë. Për shembull, nuk është e mundur të oksidohet fluori nga një tretësirë ujore HF me një zgjidhje kimike, por ju mund të oksidoni klorin nga një tretësirë ujore HCl me agjentë të ndryshëm oksidues. Kjo shpjegohet me faktin se në grupe në rënie, rrezet atomike rriten ndjeshëm, si rezultat i së cilës furnizimi i elektroneve bëhet më i lehtë.
Lista e Literaturës në Wikipedia.
1. Rudzitis G.E., Feldman F.G. Khimiya-11 - M.: Arsimi, 1992.
2. Kremenchutska M., Vasilyev S. Udhëzues për studentin - M.: AST, 1999..
3. Khomchenko G.P. Kimia për studentët deri në VNZ - M.: Shkolla Vishcha, 1993.
