
Jepni këshilla për të ushqyerit: 1. Sa atome përbëjnë një molekulë lëkure të një gazi inert? 2. Shikoni etimologjinë dhe quajeni “gaze inerte”. 3. Si quhet shoku juaj? 4. Cila është mënyra më e shpejtë për të arritur tek gazet inerte? nga një duarartë



Zgjedhja e neonit Neoni është lloji më efikas i reklamave ndjellëse. Reklamat neoni dhe kutitë e lehta janë të njohura në të gjitha vendet e botës. Tubi i qelqit, i mbushur me neon ose argon, ishte endur në një kuti të lehtë dhe fitues në një vivienne ose me një letër për të grabitur reklamat e lehta, përkujtimore, efektive dhe efektive.


Allotropia - ndërtesa e dhjakëve XE për të vendosur një spërkatje fjalimesh të thjeshta, të cilat ndahen për të përditshmen dhe fuqinë. Z - diamant, grafit, fullerene. O - kissen, ozon. S - rombike, monoklinike, plastike. P - e bardhë, e kuqe, e zezë. Fenomeni i alotropisë është për shkak të 2 arsyeve: 1) një numri të ndryshëm atomesh në një molekulë, për shembull, oksigjeni O2 dhe ozoni O3. 2) adoptimet e formave të ndryshme kristalore, për shembull, diamanti dhe grafiti.



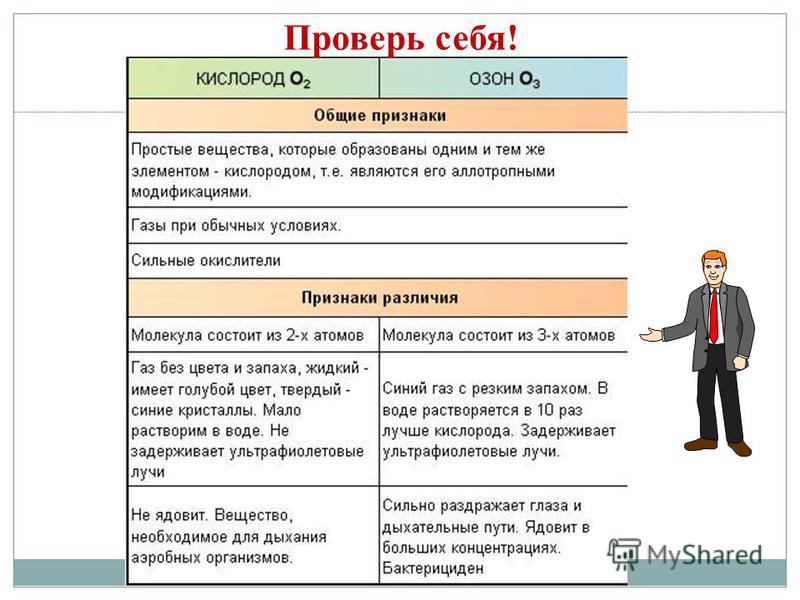






Nga ndryshimi i propozuar, zgjidhni karakteristikën e fuqisë së diamantit dhe grafitit: 1. të folurit të pastër kristal 2. të përçojë nxehtësinë dhe strumbullarin 3. mund të ketë një shkëlqim të fortë 4. gri të errët, më të trashë për të folurit kristal dotik 5. më i vështiri i të folurit natyror 6 .Mos përçoni nxehtësinë dhe strumin
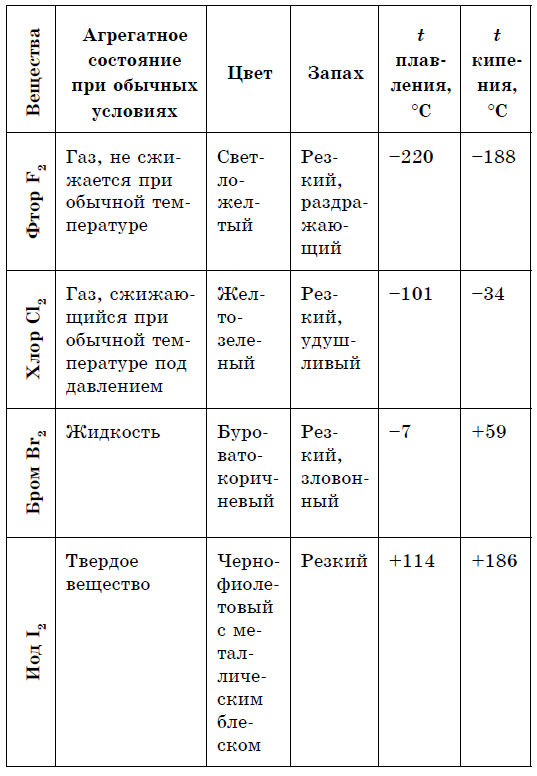
 Metalet Jometalet 1. Të folurit e ngurtë (crimmercury Hg) 1, Të folurit e vështirë (sirka S, fosfori chervonium dhe fosfori i bardhë P 4, jodi I 2, diamanti dhe grafiti C), të folurit si gaz (oksigjen O2, ozoni O3, azot N 2 , ujë H 2, klor C1 2, fluor F 2, gaze fisnike) dhe rіdina (bromin Br 2) 2. bëni shkëlqim metalik 2. Mos lani shkëlqimin e metalit (për të bërë jod I 2, grafit C) 3. Elektrik dhe përçueshmëri termike 3. Më shumë për të mos përçuar një strum elektrik (përçuesit є, për shembull, silic, grafit)
Metalet Jometalet 1. Të folurit e ngurtë (crimmercury Hg) 1, Të folurit e vështirë (sirka S, fosfori chervonium dhe fosfori i bardhë P 4, jodi I 2, diamanti dhe grafiti C), të folurit si gaz (oksigjen O2, ozoni O3, azot N 2 , ujë H 2, klor C1 2, fluor F 2, gaze fisnike) dhe rіdina (bromin Br 2) 2. bëni shkëlqim metalik 2. Mos lani shkëlqimin e metalit (për të bërë jod I 2, grafit C) 3. Elektrik dhe përçueshmëri termike 3. Më shumë për të mos përçuar një strum elektrik (përçuesit є, për shembull, silic, grafit)
![]()
Jepni këshilla për të ushqyerit Çfarë është alotropia? Jepni emërtimin e modifikimeve alotropike. Pse manifestimi i alotropisë është viklikano? Pse ka një nga arsyet e diversitetit të fjalimeve? Pse është shprehja kimikisht jovirtuoze poetike: “Në dritare kishte një erë stuhie”? Pse u rozpodіl për të hedhur dhe jo hedhur? Pse u rozpodіl për të hedhur dhe jo hedhur?


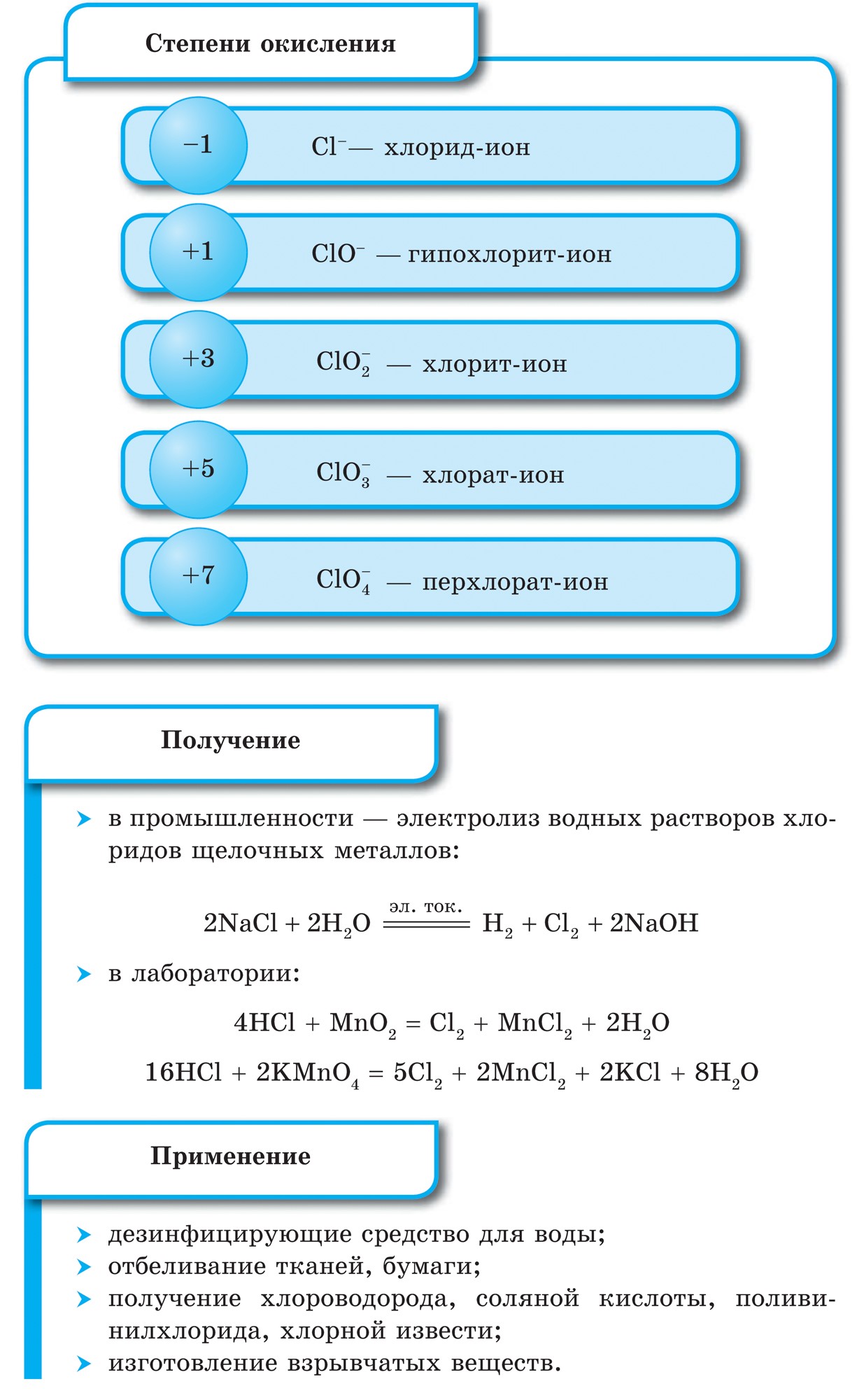
Elementet kimike - johedhës
Janë gjithsej 16 elementë kimikë-jometalë, dhe dy prej tyre, karburanti oksigjen dhe silikoni, përbëjnë 76% të masës së fruthit të tokës. Jo-hedhësit janë palosur 98,5% në masën e roslin dhe 97,6% në masën e njerëzve. Me qymyrin, ujin, thartirën, sirkën, fosforin dhe azotin, i shtohet gjithë fjalimi organik më i rëndësishëm, erë e keqe është elementi i jetës. Uji dhe heliumi janë elementët kryesorë të Gjithë Botës, të gjitha objektet kozmike, duke përfshirë Diellin tonë, përbëhen prej tyre. Pa ngarkesën e jometaleve, është e pamundur të zbulohet jeta jonë, veçanërisht të merret me mend se çfarë është e rëndësishme jeta fabrikë kimike- ujë - i palosur në ujë dhe i thartë.
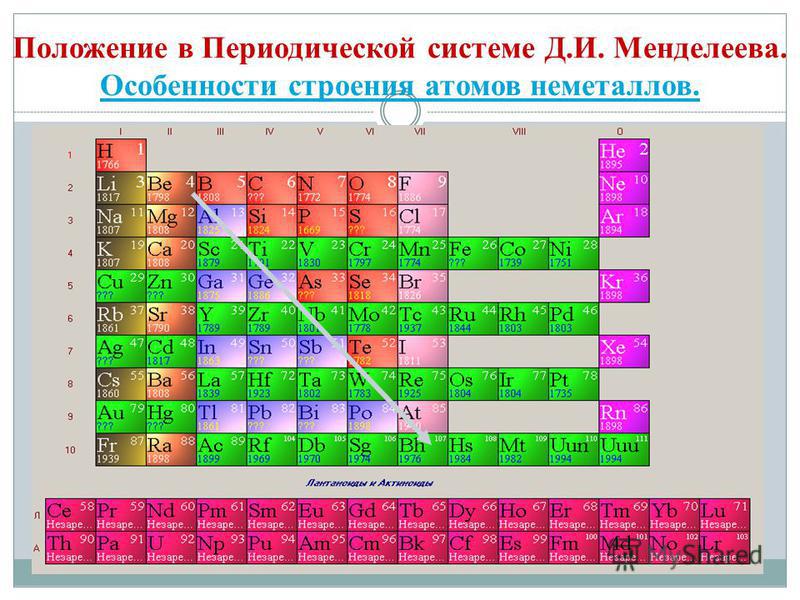
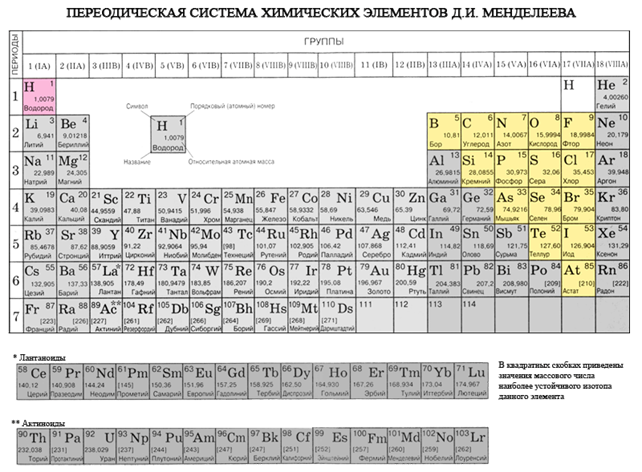
Nëse në sistemin periodik vizatoni një diagonale nga beriliumi në astatin, atëherë në të djathtën përpjetë përgjatë diagonales do të ketë elementë jo metalikë, dhe në fund - metale, deri në to elementët e të gjitha grupeve anësore, lantanide dhe aktinide. , do të shihet. Elementet, të përhapur pranë diagonales, për shembull, berilium, alumin, titan, germanium, antimoni, mund të kenë karakter të dyfishtë dhe mund të shihen deri në Metaloid. Elementi-johedhës: s-element - përmbytje; r-elementi 13 groupi - bor; 14 grupe - qymyr dhe silikon; grupi 15 - nitrogjen, fosfor dhe mish'yak, 16 grupe - kissen, sirka, selen dhe telur dhe të gjithë elementët e grupit të 17-të - fluor, klor, brom, jod dhe astatine. Elementi 18 groupi - gazet inerte, Zënë një kamp të veçantë, erë e keqe mund të jetë plot me kompletime të topit të jashtëm të elektronit dhe të zërë një pozicion të ndërmjetëm midis metaleve dhe jometaleve. Ato nganjëherë referohen si jometale, por formalisht, pas shenjave fizike.
Nemetali- ce elementet kimike, Atomet që marrin elektrone për të plotësuar nivelin e përsosur të energjisë, duke i kënaqur ato kur janë të ngarkuar negativisht.
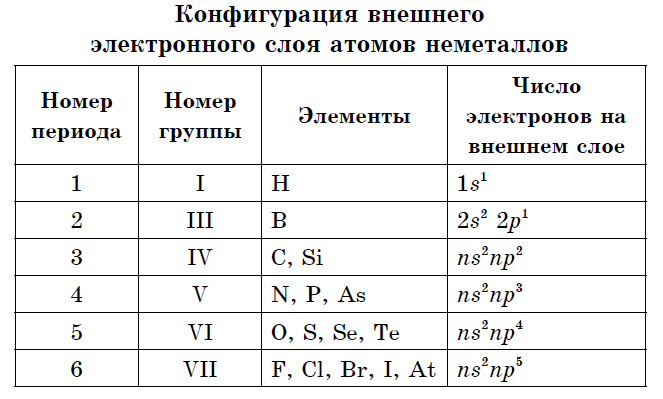
Ka tre deri në tetë elektrone në topin e jashtëm elektronik të atomeve jometal.
Praktikisht të gjithë johedhësit mund të kenë rreze po aq të vogla dhe një numër të madh elektronesh në nivelin e jashtëm të energjisë nga 4 deri në 7, ato karakterizohen nga vlera të larta të elektronegativitetit dhe oksidet e fuqisë. Kjo është arsyeja pse, në lidhje me atomet e metaleve, jometalet karakterizohen nga:
· Rreze më e vogël atomike;
· Chotiri dhe më shumë elektrone në nivelin e jashtëm të energjisë;
Yjet dhe një fuqi kaq e rëndësishme e atomeve të jometaleve - një tendencë për të marrë deri në 8 elektrone në ditë, që është oksidi i fuqisë. Si një karakteristikë e atomeve të jometaleve, që është bota e tyre e jometalitetit, tregtia elektronike mund të shërbejë, që fuqia e atomeve në elementët kimikë polarizon lidhjen kimike, nxjerr në vetvete një bast elektronik me zë të lartë;
Klasifikimi më i madh shkencor i elementeve kimike u nda në metal dhe jometal. Klasifikimi Tsya nuk e ka humbur rëndësinë e tij në këtë orë. Jometalet janë elementët kryesorë kimikë, për atomet e të cilëve është karakteristikë se pranojnë elektrone deri në përfundimin e topit të jashtëm të dukshmërisë, si rregull, në topin e jashtëm të elektroneve gjithnjë e më shumë elektrone dhe një rreze të vogël prej atomet në rastin e atomeve të metaleve.
Tse vyznachennya jashtë elementeve të grupit VIII të nëngrupit kryesor - gazet, atomet inerte ose fisnike dhe disa nga mbaresat e topit të jashtëm elektronik. Konfigurimi elektronik i atomeve të këtyre elementeve është i tillë që ato nuk mund t'i atribuohen as metaleve dhe as jometaleve. Erë e keqe e këtyre objekteve, si shtimi i elementeve në metal dhe jometal, duke zënë pozicionin e kordonit midis tyre. Gazi inert, përndryshe fisnik, (“fisnikëria” shprehet në inertitet) ndonjëherë mund të sillet tek jometalet, ose edhe më formalisht, pas shenjave fizike. Cі rechovina zberіgayut mulli gazopodіbny deri në harkun e temperaturave të ulëta. Pra, helium Chi nuk kalon në një gjendje të rrallë në t ° \u003d -268.9 ° С.
Inertiteti në aplikimin kimik të këtyre elementeve është i dukshëm. Për ksenon dhe kripton në kombinim me fluorin dhe acidin: KrF 2, XeF 2, XeF 4 dhe in. Pa dyshim, në dritën e këtyre ditëve, gazet inerte kanë vepruar si kontribuues. Emërtimi i gjurmëve jometalike, të cilat për atomet e tyre karakterizohen nga një vlerë e lartë e elektronegativitetit. Ai ndryshon në kufijtë midis 2 dhe 4. Nemetalet janë elementet e nëngrupeve të kokës, elementët p janë më të rëndësishëm, hardhitë bëhen ujë - elementi s.
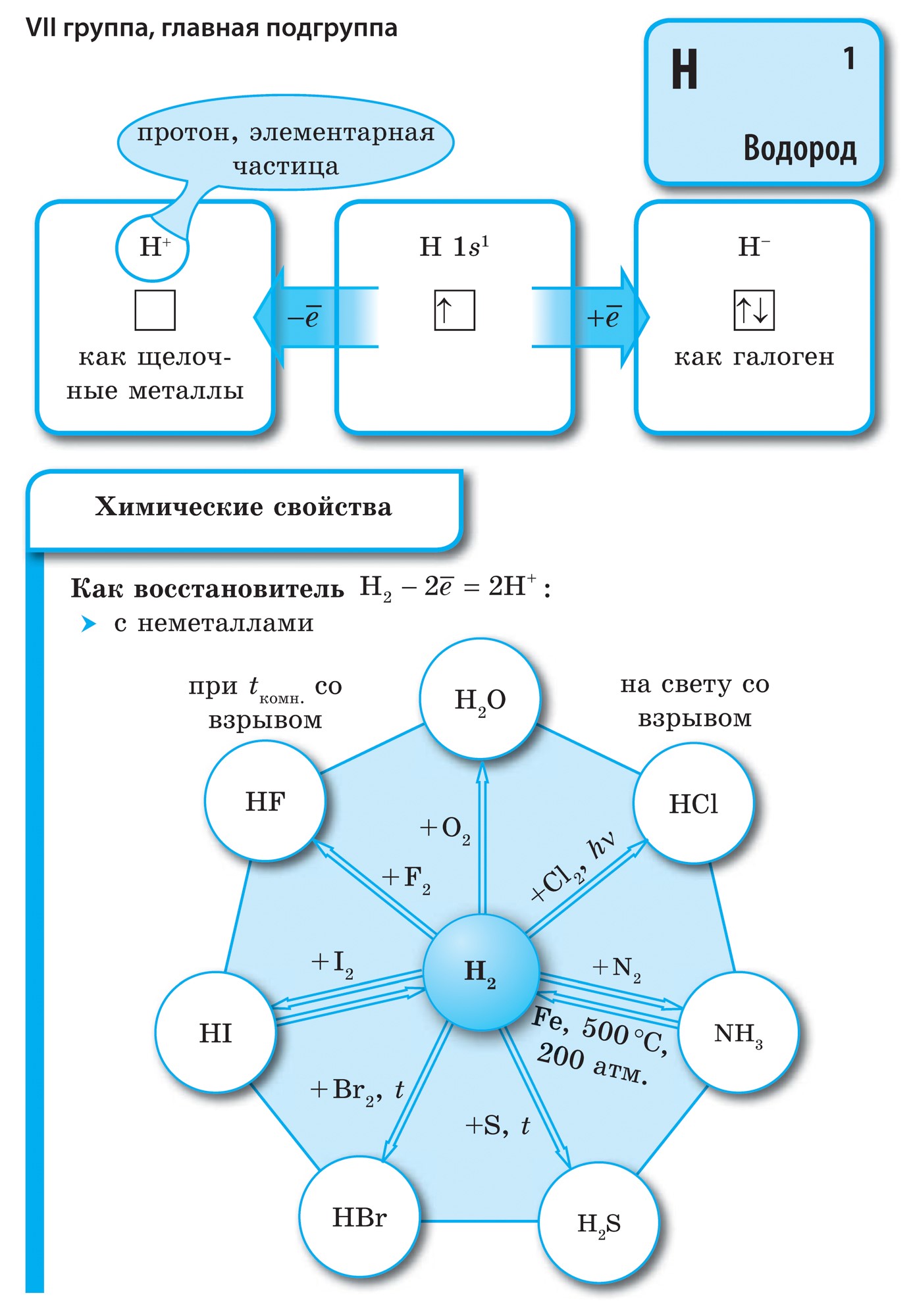
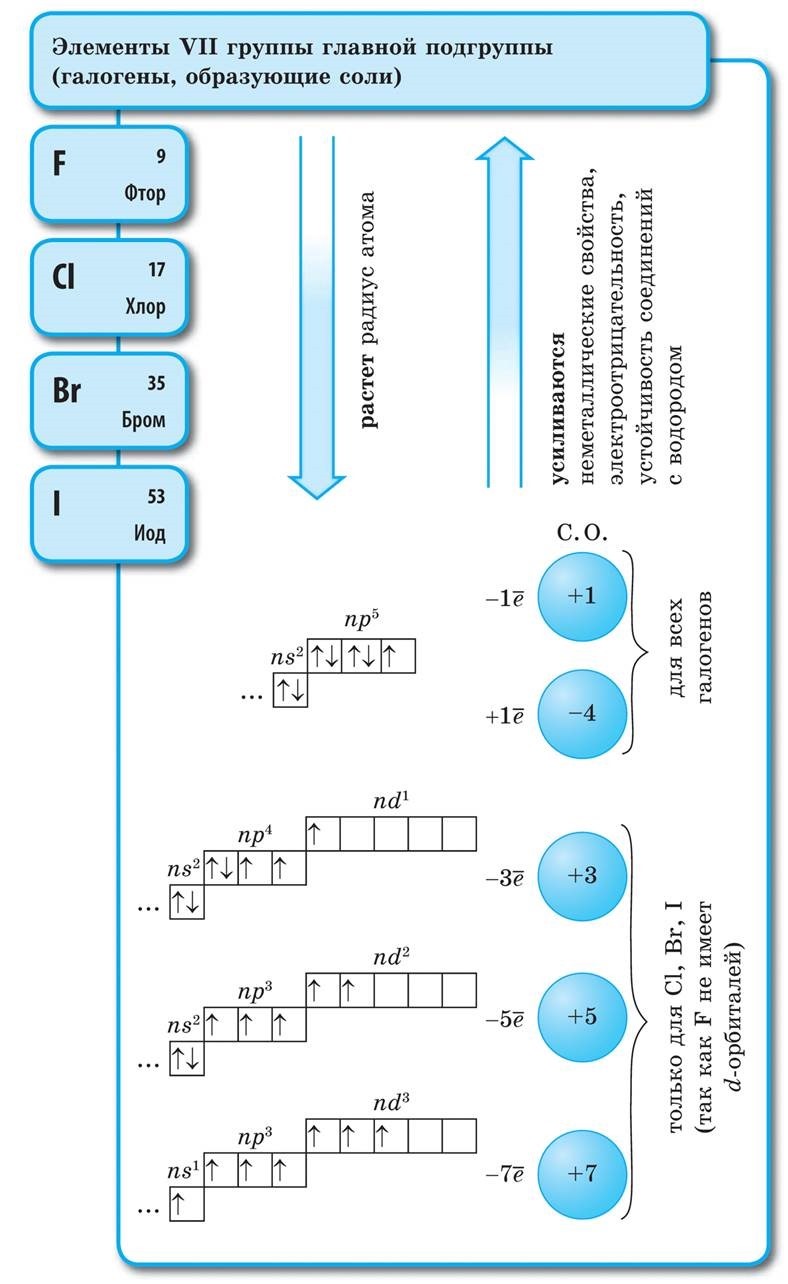
Të gjithë elementët jometalë (ujë krem) janë të zënë në sistemin periodik të elementeve kimike D. I. Kuti i sipërm djathtas i Mendelievit, utvoryuyuchi tricutnik, pjesa e sipërme e së cilës është fluor F, dhe mbështetja është diagonalja B - At. Megjithatë, ka një fokus të veçantë në stacionin e paqartë të ujit në sistemin periodik: në nëngrupet kryesore të grupeve I dhe VII. Tse nuk është vipadkovo. Nga njëra anë, atomi i ujit është si atomet e metaleve të pellgjeve, në pjesën e jashtme (dhe të vetme për topin e ri) elektronik, një elektron (konfigurimi elektronik 1s 1), që është fuqia e ndërtesës, që tregon fuqinë e liderit. .
Shumica e ditëve të tyre kanë ujë, si pellgje, duke treguar një nivel oksidimi +1. Ale, dhënia e një elektroni një atomi është më e rëndësishme se uji, më i ulët në atome të metaleve hënore. Nga ana tjetër, atomi i ujit, ashtu si atomet e halogjeneve, për të përfunduar topin ovale të elektronit refuzon një elektron, ai atom uji mund të pranojë një elektron, duke treguar fuqinë e oksidimit dhe karakteristikë e fazës së oksidimit halogjen -1 in. hidridet (me metale, metale të ngjashme bashkuese me halogjene - halogjene). Megjithatë, shtimi i një elektroni në një atom është më i rëndësishëm se ai i halogjenëve.
në mendjet ujë H 2 - gaz. Molekula e Yogos, si halogjenet, është diatomike. Në atomet e jometaleve, oksidet e fuqisë janë më të rëndësishme, d.m.th., aftësia për të shtuar elektrone. Ndërtesa Qiu karakterizon vlerën e elektronegativitetit, pasi ndryshon natyrshëm në periudha dhe nëngrupe. Fluori është agjenti më i fortë oksidues dhe atomet e tij në reaksionet kimike nuk prodhojnë elektrone, d.m.th., ata tregojnë fuqi të konsiderueshme. Të tjerë johedhës mund të tregojnë fuqi të madhe, megjithëse janë dukshëm më të dobët në radhët me metale; në periudhat dhe nëngrupet e tyre, ndërtesa e rëndësishme ndryshon në rend të kundërt në rendin e oksidimit.
- Elementet-roztashovani jo te hedhur ne nengrupet koke III-VIII grupet PS D.I. Mendeliev, duke zënë këndin e sipërm të djathtë.
- Ka 3 deri në 8 elektrone në topin e jashtëm të elektroneve.
- Fuqitë jometalike të elementeve rriten në perioda dhe dobësohen në nëngrupe me rritjen e numrit rendor të elementit.
- Format më acide të jometaleve kanë karakter acid (oksidet dhe hidroksidet acide).
- Atomet e elementeve-jometaleve të ndërtesës, si pranimi i elektroneve, shfaqja e funksioneve të oksidit, pra ata, shfaqja e funksioneve thelbësore.
Budov dhe fuqia fizike e jometaleve
Në fjalimet e thjeshta, atomet e jometaleve janë të lidhura lidhje kovalente jopolare. Zavdyaki tsomu formojnë një shtresë më të madhe të sistemit elektronik, atome më të ulëta të izoluara. Në këtë rast, i vetëm (për shembull, në molekulat e ujit H 2, halogjenet F 2, Br 2, I 2), i varur (për shembull, në molekulat e rreth S 2), me humbje (për shembull, në molekulat e azotit N 2) lidhjet kovalente.
- gnuchkist vіdsutnya
- nuk ka verbim verbues
- Përçueshmëri termike (vetëm grafit)
- Skema e ngjyrave është e ndryshme: e verdhë, e verdhë-jeshile, e kuqe-kafe.
- Përçueshmëria elektrike (vetëm grafit dhe fosfor i zi.)
Mulliri agregat:
- atdheu - Br 2;
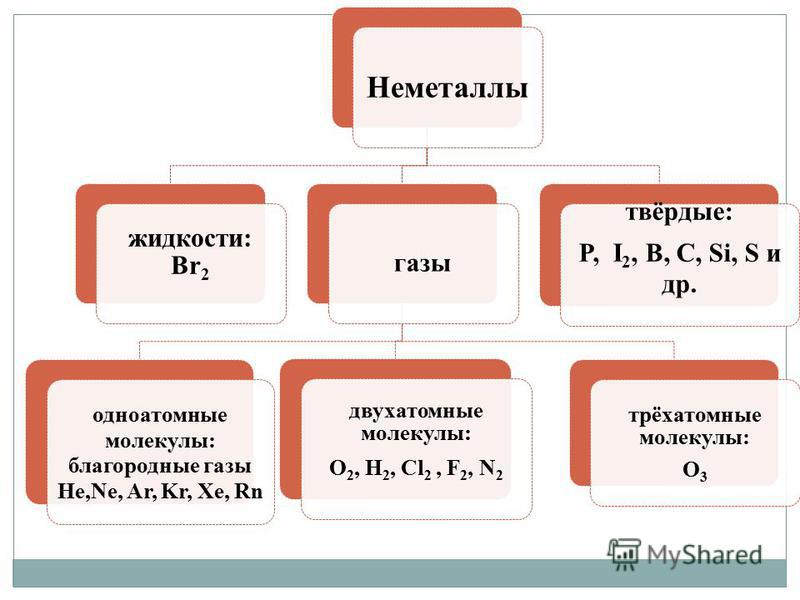
Në vіdmіnu vіd metalіv jo të hedhur - thjesht fol, Karakterizohet nga diversiteti i madh i autoriteteve. Nemetali mayut kampe të ndryshme grumbullimi në mendjet më të larta:
- gazrat - H2, O2, O3, N2, F2, Cl2;
- atdheu - Br 2;
- fjalim i vështirë - modifikime të sirkës, fosforit, silikonit, qymyrit dhe in.
Spektri i ngjyrave është më i pasur për jometalet: e kuqe - për fosfor, e kuqe-burium - për bromin, e verdhë - për sirka, e verdhë-jeshile - për klorin, vjollcë - për jod pari. Elementet - jometale të zdatnі më të mëdha, në çifte me metale, deri në alotropi.
Aftësia e atomeve të një elementi kimik për të bërë disa fjalime të thjeshta quhet alotropi, dhe numri i fjalimeve të thjeshta quhet specie alotropike.
Falni fjalimet - nënat nuk mund të hedhin:
1. Budov molekular. Me mendje të shkëlqyera, shumica e fjalimeve të tilla janë gaze (H 2, N 2, O 2, F 2, Cl 2, O 3) ose fjalime të forta (I 2, P 4, S 8) dhe më shumë se një brom (Br 2 ) është atdheu. Të gjitha fjalët e të folurit janë molekularisht budovu, duke fluturuar drejt kësaj. Në një gjendje të ngurtë, erëra e keqe është e shkrirë për shkak të një ndërveprimi të dobët ndërmolekular, i cili redukton molekulat në kristal dhe ndërton deri në sublimim.
2. Jeta atomike. Ngjyra e të folurit bëhet nga dy heshta atomesh (C n, B n, Si n, Se n, Te n). Nëpërmjet materialitetit të madh të lidhjeve kovalente, erëra e keqe, si rregull, bën një fortësi të lartë dhe ndryshon apo jo, lidh lidhjet kovalente në kristalet e tyre (shkrirje, avullim), me energji të madhe vitratoi. Fjalimet e tilla janë të pasura me temperatura të larta shkrirjeje dhe vlimi, dhe paqëndrueshmëria është edhe më e ulët.
Shumë elementë - jo-hedhës përbëjnë një spërkatje fjalimesh të thjeshta - modifikimet alotropike. Fuqia e atomeve quhet alotropi. Alotropia mund të shoqërohet me një depo të ndryshme molekulash (O 2, O 3) dhe me kristale të ndryshme të sythave. Modifikimet alotropike të karbonit dhe grafitit, diamantit, karabinës, fullerenit. Për të treguar karakteristikën e dominimit të të gjithë jometaleve, është e nevojshme t'i kushtohet vëmendje shpërndarjes së tyre në sistemin periodik të elementeve dhe të përcaktohet konfigurimi i topit të jashtëm të elektronit.
Në periudhën:
- ngarkesa e bërthamës rritet;
- rrezja e atomit ndryshon;
- numri i elektroneve në sferën e jashtme po rritet;
- tregtia elektronike po rritet;
- oksidet e autoritetit forcohen;
- fuqitë jometalike do të rriten.
Në nëngrupin kryesor:
- ngarkesa e bërthamës rritet;
- rrezja e atomit është rritur;
- numri i elektroneve në topin e jashtëm nuk ndryshon;
- ndryshimet e elektronegativitetit;
- oksidet e fuqisë dobësohen;
- fuqitë jometalike po dobësohen.
Për shumicën e metaleve, për një vinyatka të rrallë (ari, bakri dhe deaks іnshі), një zabarvlennia e bardhë argjendi është karakteristike. Dhe boshti i fjalimeve të thjeshta janë ngjyrat gama jo metalike, dukshëm të ndryshme: P, Se - e verdhë; B - kafe; O 2 (g) - blakytnium; Si, As (takuar) - сірі; P 4 - e verdhë e zbehtë; I - vjollcë-e zezë me një shkëlqim metalik; Br 2 (g) - boraks vendas; C1 2 (d) - verdhë-jeshile; F 2 (r) - zarzavate të zbehta; S 8 (TV) - Zhovta. Kristalet jometalë janë joplastikë dhe nëse deformimi çon apo jo në kolapsin e lidhjeve kovalente. Shumica e jometaleve nuk bëjnë një shkëlqim metalik.

Gjithsej janë 16 elemente kimike-jometale! Epo, nuk është e pasur, është si të gënjesh, se duken 114 elementë. Dy elementë jo të hedhur shtojnë deri në 76% të fruthit në tokë. Tse kisen (49%) dhe silic (27%). Në atmosferë ka 0.03% të masës së thartirës në koren e tokës. Nemetali të bëhet 98,5% e masës së roslin, 97,6% e masës së trupit të njeriut. Jometalet C, H, O, N, S janë elementë biogjenë që përbëjnë fjalimin organik më të rëndësishëm të qelizave të gjalla: proteinat, yndyrat, karbohidratet, acidet nukleike. Deri në magazinë përsëri, sikur mi dihaєmo, është e lehtë të hysh fjalime të palosshme, I tretur gjithashtu nga elementë jometalë (oksigjen O 2, azoti N 2, dioksid karboni CO 2, avujt e ujit H 2 O dhe brenda.)
Oksidet e fuqisë së fjalimeve të thjeshta - jometale
Për atomet e jometaleve, dhe më vonë, për ndriçimin e fjalimeve të thjeshta prej tyre, është karakteristik oksiduese, kështu unë frymëzues pushtetin.
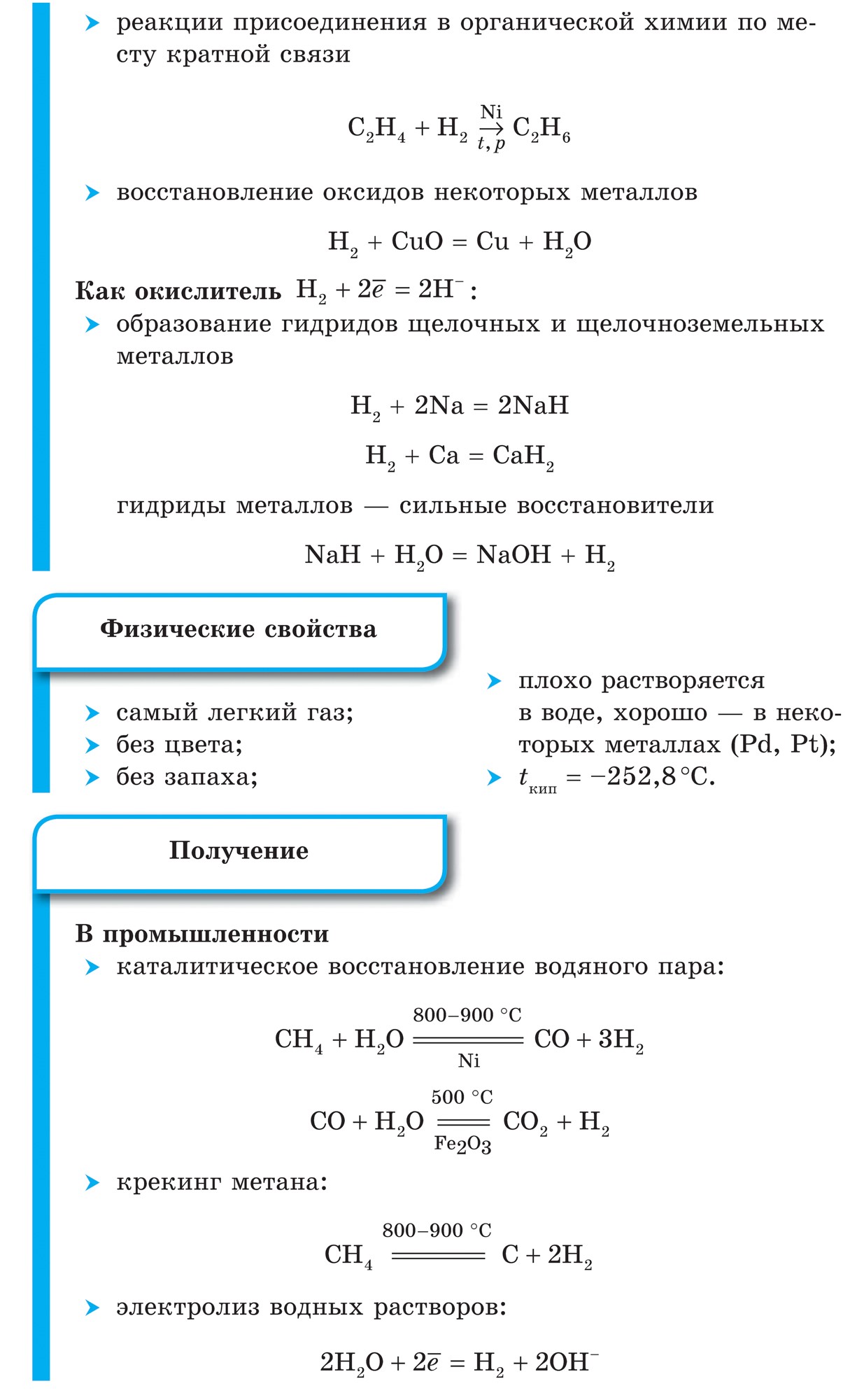
1. Oksidet e fuqisë së jometaleve shfaqen në rreshtin e parë me ndërveprimin e tyre me metalet(Metali zavzhdi vodnovniki):

Fuqia e oksidimit të klorit Cl 2 është më e fortë, më e ulët në sirka, ndaj atij metali Fe, i cili mund të jetë në të njëjtin kërcell të fazës së oksidimit +2 dhe +3, oksidohet prej tij në një fazë më të lartë të oksidimit.
1. Shumica e jometaleve tregojnë oksidet e fuqisë kur ndërvepron me ujin. Si rezultat, krijohen filiza të ujit fluturues.
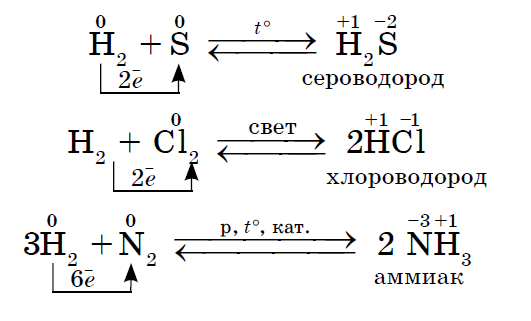
2. Nëse ndonjë jometal vepron si një agjent oksidues në reaksionet me këto jometale, ai mund të ketë një vlerë më të madhe të ulët të elektronegativitetit:
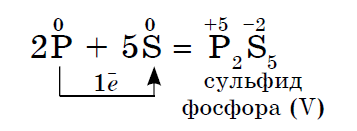
Elektronegativiteti i sirkës është më i madh, më i ulët në fosfor, kështu që tregon oksidet e fuqisë.
Elektronegativiteti i fluorit është më i madh, më i ulët në të gjithë elementët e tjerë kimikë, në atë që vin tregon fuqinë e agjentit oksidues. Fluori F 2 është agjenti oksidues më i fortë midis jometaleve, duke shfaqur vetëm fuqi oksiduese në reaksione.
3. Oksidet e fuqisë së jometalit shfaqen në reagimet me disa fjalime të palosshme.
Në mënyrë domethënëse në vijën e parë të oksidimit të fuqisë së aciditetit jometal në reagimet me fjalime të palosshme:
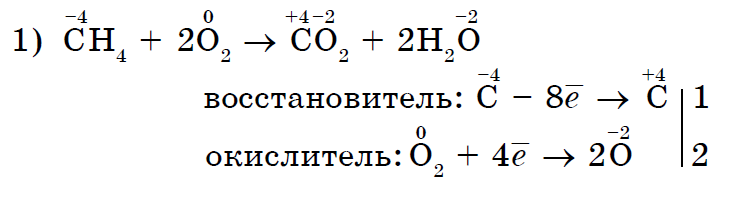
Jo vetëm kisen, por edhe të tjerë johedhës mund të jenë gjithashtu agjentë oksidues në reaksionet me fjalimin e palosshëm- inorganike (1, 2) dhe organike (3, 4):
Klori i fortë oksidues Cl 2 oksidon klorurin e kripës (II) në klorur të kripur (III);
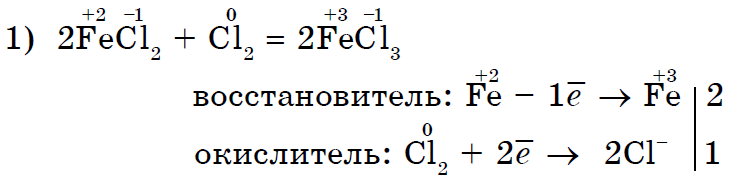
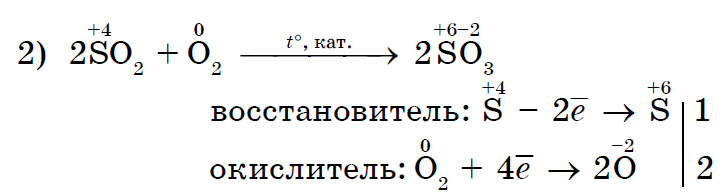
Klori Cl 2 si një agjent oksidues më i fortë, jodi I 2 është më i ngjashëm me jodidin e kaliumit;
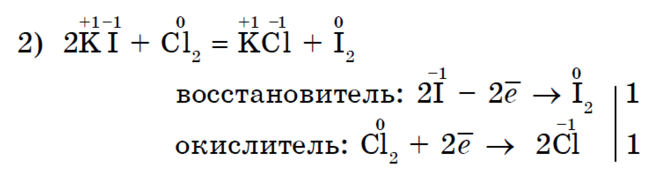
Halogjenimi në metan është një reaksion tipik për alkanet;
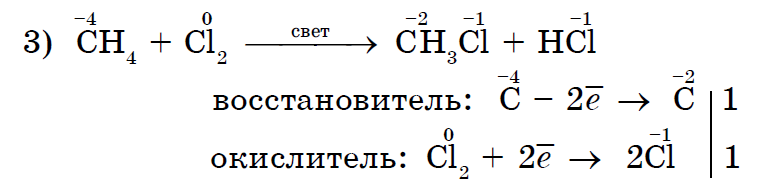
Reagimi Yakіsnoy ndaj spoluchy jo-ekzistente є znebarvlennya ato ujë brom.
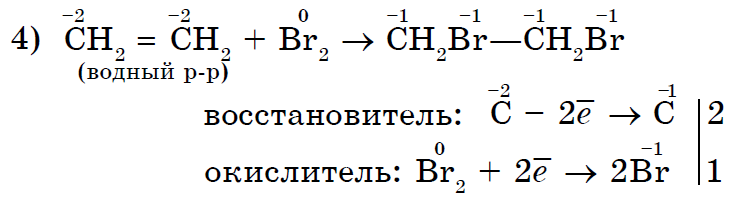
Vështrime të fuqisë së fjalimeve të thjeshta - jometaleve
kur shikon reaksionet e jometaleve një nga një, Por në rënie në vlerën e elektronegativitetit të tyre, njëri prej tyre tregon fuqinë e agjentit oksidues, dhe tjetri - fuqinë e agjentit.
1. Sipas hyrjes në fluor, të gjithë nuk hidhnin (navit kisen) tregojnë fuqinë e autoritetit.
2. Në mënyrë të arsyeshme, jometalet, kremi në fluor, shërbejnë si agjentë reduktues në ndërveprim me thartirën.

Si rezultat i reagimeve, ato krijohen oksid jometal: Acidet jokripformuese dhe kripeformuese. Unë dua halogjene pa thartirë pa thartë, në oksidet e tyre: Cl 2 +1 O -2, Cl 2 +4 O 2 -2, Cl 2 +7 O 7 -2, Br 2 +1 O -2, Br +4 O 2 -2, I 2 +5 O 5 -2, i in., yakі marrin një rrugë indirekte.
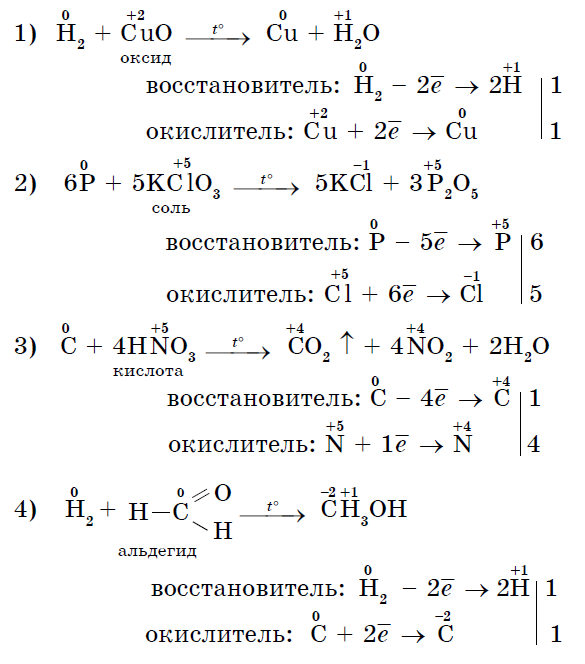
3. Jo-hedhësit Bagato mund të veprojnë si një udhëzues në reagimet me fjalimin e palosshëm - oksidues:
Іsnuyut dhe reagime të tilla, në të cilat një dhe i njëjti jo-metal oksidohet në të njëjtën kohë, dhe vodnovnik. Reaksionet e vetë-oksidimit-vetë-rinovimit (disproporcioni):
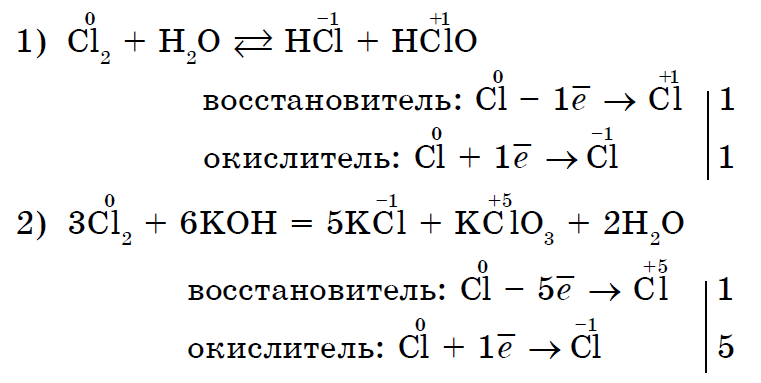
Në këtë mënyrë, shumica e jometaleve mund të veprojnë reaksionet kimike si në rolin e një agjenti oksidues, ashtu edhe në rolin e një drejtuesi (fuqia ndikuese që nuk lidhet vetëm me fluorin F 2).
Jo metale me bazë uji
Në vіdmіnu vіd metalіv nemetali utvoryuyut spoluki me ujë të ngjashëm me gaz. Їx magazinë për të depozituar në fazën e oksidimit jometal.
RH 4 → RH 3 → H 2 R → HR
Fuqia e shenjtë e të gjithë jometaleve є zgjidhja e ujërave verore z'єdnan, Në shumicën e rasteve, jometalet mund të kenë një shkallë më të ulët oksidimi. Ndër formulat e fjalimeve, ajo është e pasur me heshtje, dominim, zastosuvannya dhe otrimannya vyvchali më parë: CH 4, NH 3, H 2 O, H 2 S, HCl.
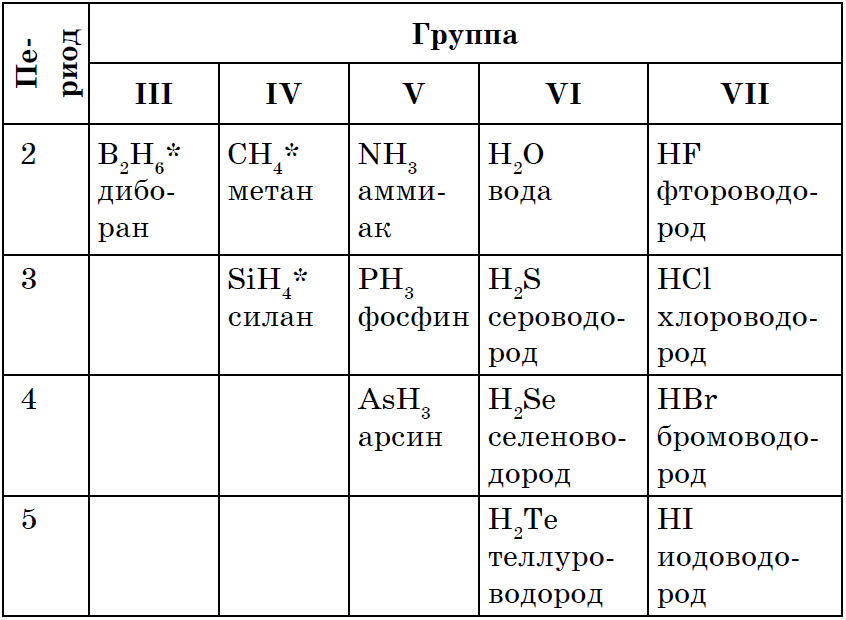
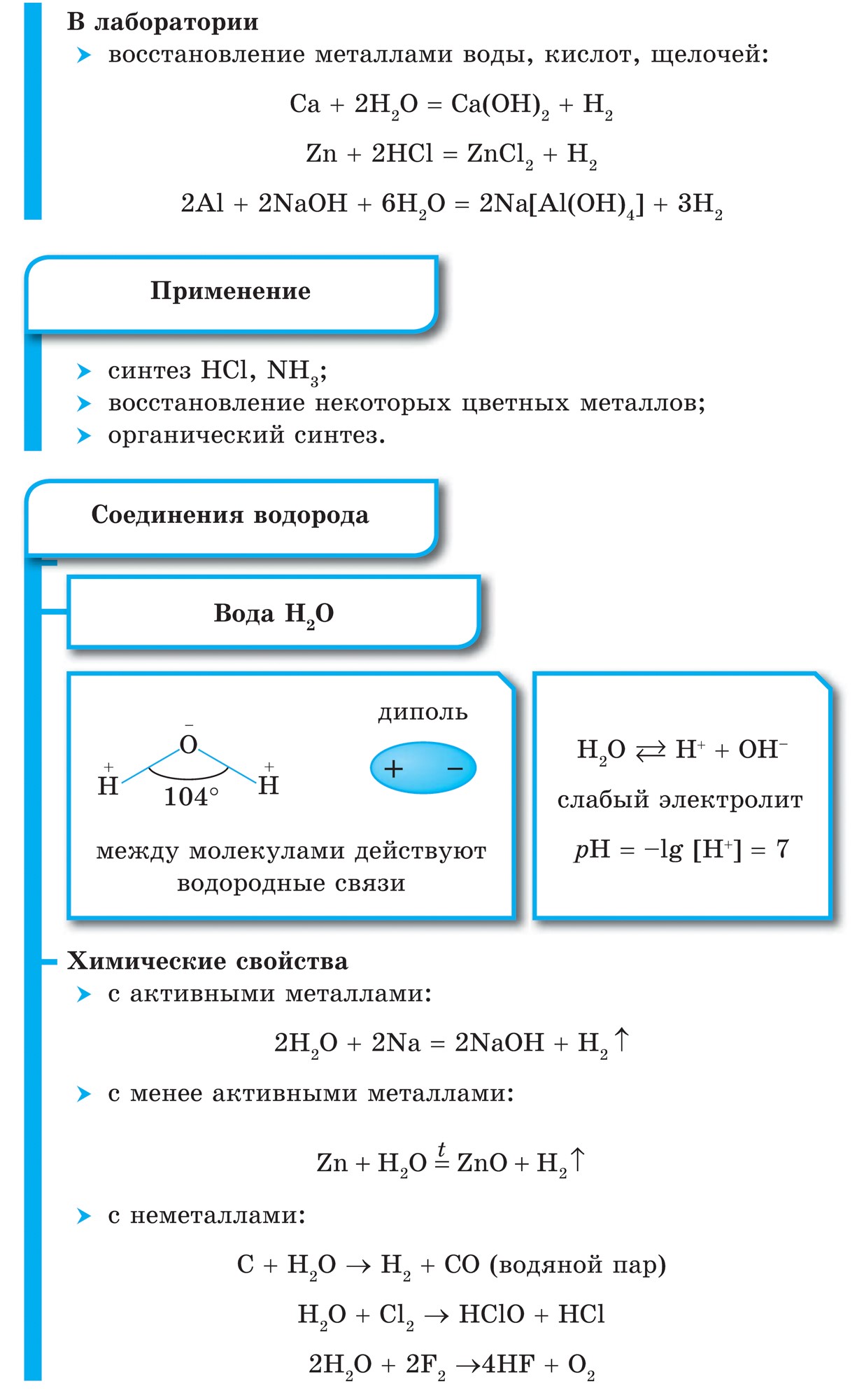
Vіdomo, karrierës më thjesht qі spoluky mund të merret pa një mes ndërveprimi i jometalit me ujin, Sinteza Tobto:
![]()
Të gjitha ujërat e jometaleve janë të mishëruara në lidhje polare kovalente; Për ujin z'ednan jometalet, është karakteristikë e ndryshimit në vendosjen e ujit. Metani dhe silani në të janë praktikisht të padallueshëm. Kur tretet në ujë, amoniaku tret një bazë të dobët të NH 3 H 2 O. Kur tretet në ujë, selenide hidrogjeni, teluridi i hidrogjenit, si dhe halogjenët e hidrogjenit, acidet treten me të njëjtën formulë, që janë vetë uji: H 2 S , H2Se, H2Te, HF, HCl, HBr, HI.
Për të balancuar fuqinë acido-bazike të ujërave, të vendosura nga jometalet e një periudhe, për shembull, tjetra (NH 3, H 2 O, HF) ose e treta (PH 3, H 2 S, HCl) , atëherë është e mundur të krijohen visnovka për ligjin e forcës їх dominimi acidik i, vіdpovіdno, ato bazike të dobësuara. Kjo është padyshim për shkak të faktit se polariteti rritet zv'azku E-N(De E është jometal).
Fuqia acido-bazike e jometaleve me bazë uji në një nëngrup gjithashtu sfidohet. Për shembull, në serinë e halogjeneve të hidrogjenit HF, HCl, HBr, HI, intensiteti i lidhjes E-H ndryshon, sepse lidhja rritet. Në nivele të ndryshme, HCl, HBr, HI shpërndahen praktikisht më shumë - acidet më të forta, dhe forca e tyre rritet nga HF në HI. Kur HF u shtohet acideve të dobëta, ajo kushtëzohet nga një faktor tjetër - ndërveprimi ndërmolekular, vendosja e lidhjeve ujore ... HF ... HF .... Atomet e ujit janë të lidhur me atomet e fluorit F jo vetëm molekulat e tij , por edhe gjyqësore.
Uzagalnyuyuchi karakteristikë e barabartë Fuqitë acido-bazike të ujërave të jometaleve, zrobimo vysnovok për forcimin e fuqive bazë acidike dhe të dobësuara të këtyre fjalimeve gjatë periudhave dhe nëngrupeve kryesore të numrit më të madh atomik të elementeve të tyre.
Gjatë periudhës në PS të elementeve kimike, rritja e numrit serik të elementit - jometal, rrit natyrën acidike të bimës së ujit.
SiH 4 → PH 3 → H 2 S → HCl
Krіm shikoi autoritetet, uji nga gjysma e jometaleve në reaksionet oksid-ujë tregon gjithmonë fuqinë e drejtuesve, edhe nëse jometali në to mund të ketë një shkallë më të ulët oksidimi.
përmbytje
ujë - elementi i kokës mbarëbotërore. Shumë objekte kozmike (errësira gazi, yje, duke përfshirë Diellin) më shumë se gjysma shtohen në ujë. Në Tokë, duke përfshirë atmosferën, hidrosferën dhe litosferën, vetëm 0.88%. Alece nga pesha, dhe pesha atomike e ujit është edhe më e vogël. Prandaj, një sasi e vogël e jogës hiqet vetëm, dhe nga lëkura e 100 atomeve në Tokë 17 - një atom uji.
Në një kamp të lirë, uji shihet në pamjen e molekulave H 2, atome të lidhura në një molekulë lidhje kovalente jopolare.
Voden (H 2) është gazi më i lehtë nga lumenjtë e thatë të ngjashëm me gazin. Mund të fitoj përçueshmëri nxehtësie dhe të ulim pikën e vlimit (pas heliumit). Pak i tretshëm në ujë. Në një temperaturë prej -252,8 ° C dhe presion atmosferik, uji kalon në një gjendje të rrallë.
1. Një molekulë uji është tashmë një mіtsna, çfarë të grabisni її joaktive:
H 2 \u003d 2H - 432 kJ
2. Në temperatura ekstreme, ujë reagon me metale aktive:
Ca + H 2 \u003d CaH 2,
shuarja e hidridit të kalciumit, i z F 2, shuarja e fluorit të hidrogjenit:
F 2 + H 2 \u003d 2HF
3. Kur temperaturat e larta hiqni amoniakun:
N 2 + 3H 2 \u003d 2NH 3
dhe hidridi i titanit (metal në pluhur):
Ti + H 2 \u003d TiH 2
4. Kur ujë podpalyuvanni reagojnë me të thartë:
2H 2 + O 2 \u003d 2H 2 O + 484 kJ
5. Voden volodіy vіdnovlyuvalnoyu zdatnist:
CuO + H 2 \u003d Cu + H 2 O

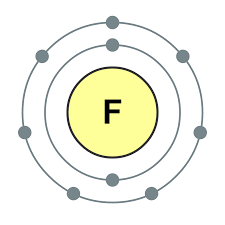
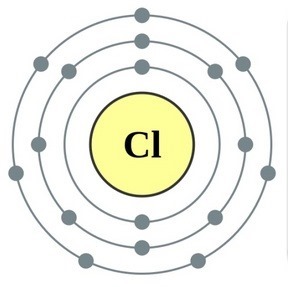
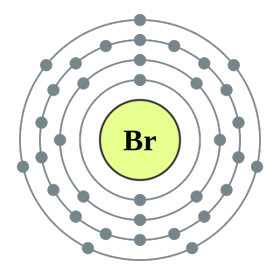
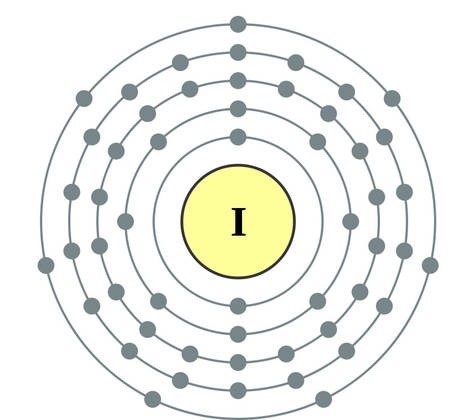
Elementet e nëngrupit kryesor të grupit VII të sistemit periodik, të bashkuar nën emrin e përbashkët halo, Fluor (F), klor (Cl), brom (BG), jod (I), astatinë (At) (rrallë i dukshëm në natyrë) - jometale tipike. Tse i zrozumilo, edhe їx atom për t'u hakmarrë në nivelin e jashtëm të energjisë së elektronikës SIM, Mua më mungon vetëm një elektron për të përfunduar jogën. Atomet e këtyre elementeve, kur bashkëveprojnë me metalet, marrin një elektron si atome të metaleve. Me këtë verë zgjidhet lidhja jonike dhe kripërat. Zvіdsi zagalna emri "halogeni", d.m.th. "kripë Narodzhuyut".
oksidues edhe më të fortë. Fluori në reaksionet kimike tregon vetëm fuqi oksidimi dhe karakterizohet nga faza e oksidimit -1. Halogjenët e Reshta mund të tregojnë dominim të konsiderueshëm kur ndërveprojnë me më shumë elementë elektronegativë - fluor, acid, azot, në të njëjtën fazë të oksidimit të tyre mund të fitojnë vlerën +1, +3, +5, +7. Dominimi i fuqisë së halogjeneve rritet nga klori në jod, i cili shoqërohet me një rritje të rrezeve të atomeve të tyre: atomet në klor janë afërsisht dy herë më të vogla, më të ulëta në jod.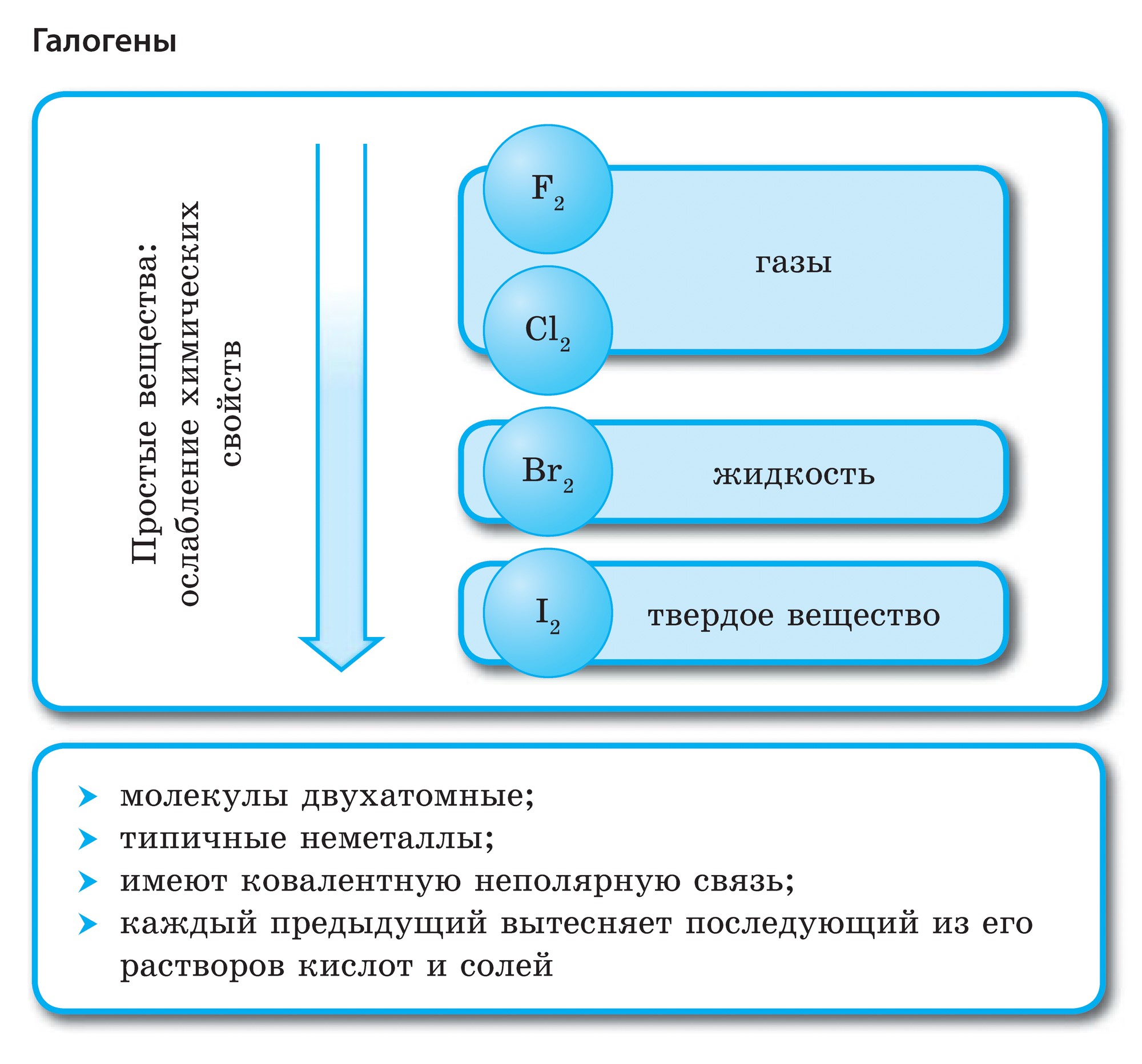
Halogjenet - vetëm fjalime
Të gjithë halogjenët gjenden në gjendje të lirë në formën e molekulave diatomike me një lidhje kimike kovalente jopolare midis atomeve. Në një çelik të ngurtë F 2, Cl 2, Br 2, I 2 grilat molekulare kristalore, e cila konfirmohet nga їх fuqitë fizike.
Me rritjen e peshës molekulare të halogjeneve në pikat e shkrirjes dhe vlimit, ato lëvizin, rrisin forcën: brom - rіdina, jod - fjalim i ngurtë, fluor dhe klor - gazra. Kjo për faktin se me rritjen e zgjerimit të atomeve dhe molekulave të halogjeneve, forcat e bashkëveprimit ndërmolekular midis tyre rriten. Në rastin e F 2 deri në I 2, intensiteti i ndotjes së halogjeneve rritet.
Aktiviteti kimik i halogjenëve, si jometalet, nga fluori në jod është i dobët Kristalet e jodit kanë një shkëlqim metalik. Halogjeni i lëkurës është oksiduesi më i fortë në periudhën e tij. Oksidet e fuqisë së halogjeneve manifestohen në mënyra të ndryshme kur ndërveprojnë me metalet. Në të cilat vendosen kripërat. Pra, fluori tashmë reagon me më shumë metale, dhe kur nxehet, me arin, argjendin, platinin, reagon me pasivitetin e tij kimik. Alumini dhe zinku në një atmosferë fluori shpërthen:
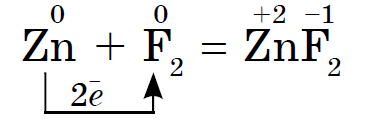
Halogjenet e Reshta reagojnë me metalet kur nxehen. Ngroheni pluhurin spërkatës dhe ai gjithashtu ndizet kur përzihet me klor. Dosvid mund të kryhet, si me antimonin, por vetëm nëse mbush tirsusin, është e nevojshme ta zagostrim në pjesën e përparme në lugën e hyrjes dhe më pas ta varni në pjesë të vogla në një balonë me klor. Meqenëse klori është një agjent i fortë oksidues, atëherë si rezultat i reagimit, kloruri (III) shpërndahet:
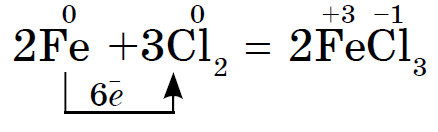
Në çifte brom djegur i pjekur medniy drіt:
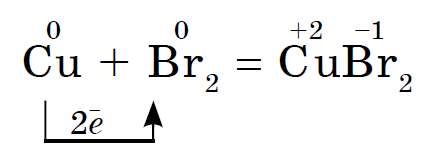
Jodi oksidon më shumë metalin, Ale në prani të ujit, si katalizator, reagimi i jodit me pluhur alumini vazhdon edhe gurgullues:
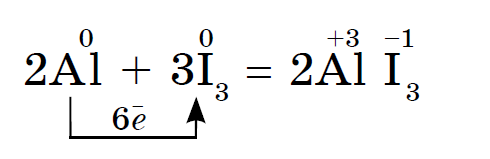
Reagimi shoqërohet me shikimin e avujve vjollcë të jodit.
Rreth ndryshimit në oksidimin dhe rritjen e fuqisë së halogjeneve nga fluori në jod mund të gjykohet nga aftësia e tyre ndërtuese për të marrë një nga një nga kripërat, Dhe gjithashtu manifestohet në të njëjtën kohë kur ato ndërveprojnë me ujin. Reagimet e Rivnyannya tsієї mund të shkruhen në një shpifje si kjo:
Ashtu si fluori ndërvepron me ujin në disa mendje me dridhje, atëherë shuma e klorit me ujë reagon më pak kur qetësohet ose hiqet nga drita e drejtpërdrejtë e përgjumur, bromi ndërvepron me ujin kur nxehet dhe pa dridhje. Reagimet janë ekzotermike. Reagimi i jodit me ujë është pak endotermik, ai vazhdon normalisht kur nxehet.
Si rezultat i këtyre reaksioneve, fluoridi i hidrogjenit HF, uji i klorit HCl, bromidi i hidrogjenit HBr dhe jodidi i hidrogjenit HI treten.
Mbizotërimi kimik i klorit në tabela

importi i halogjeneve
Fluori dhe klori eliminohen nga elektroliza e shkrirjes ose tretjes së kripërave të tyre. Për shembull, procesi i elektrolizës së shkrirjes së klorurit të natriumit mund të krahasohet me:
Kur hiqni klorit me elektrolizë, ndryshimi midis klorurit të natriumit dhe klorit shpërndahet gjithashtu në ujë dhe hidroksid natriumi:
Kisen (Oh)- paraardhësi i nëngrupit kryesor të grupit VI të sistemit periodik të elementeve. Elementet tsієї pіdgrupi - kisen O, sіrka S, selenium Se, telurium Ti, polonіy Rho - mund të kenë një emër të përbashkët "kalkogjen", që do të thotë "njerëz rudi".
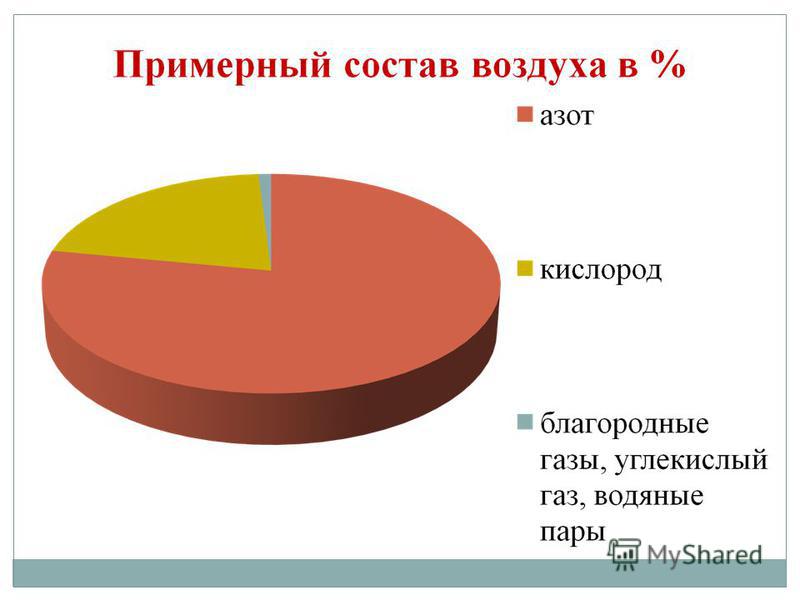
Kisen është elementi më i gjerë në planetin tonë. Vіn hyn në depon e ujit (88.9%), por ajo do të mbulojë 2/3 e sipërfaqes së bërthamës së tokës, duke krijuar guaskën e saj ujore - hidrosferën. Kisen - një mik për një kіlkіstyu dhe persha për kuptimet për jetën pjesa e magazinës Sipërfaqja e guaskës së Tokës është atmosfera, e cila përbën 21% (në vëllim) dhe 23,15% (në masë). Kisen hyn në magazinë e mineraleve numerike të guaskës së fortë të fruthit të tokës - litosferës: nga lëkura 100 atome të fruthit të tokës, 58 atome bien mbi një pjesë të acidit.
Kisen primar është në formën e O2. Gazi Tse pa ngjyrë, erë dhe shije. Në një gjendje të rrallë, ekziston një zabarvlennya dritë-blakitne, në një të ngurtë - blu. Në ujë, kisen-i gazit është më i bollshëm, më pak azot dhe ujë.
Kisen vzaєmodіє mayzhe z usima fjalime të thjeshta, krem halogjenesh, gaze fisnike, ari dhe metale platini. Reaksionet e jometaleve me thartirën vazhdojnë edhe më shpesh me shikimin e një sasie të madhe nxehtësie dhe shoqërohen me djegie - reagimet e malit. Për shembull, zjarri sirka me solucione SO 2, fosfor - me zgjidhje P 2 O 5, ose vougillya - me zgjidhje CO2. Le të jenë të gjitha reagimet ekzotermike. Vignatok të bëhet në kombinim me azotin dhe thartirën: reaksion endotermik, pasi zhvillohet në një temperaturë prej më shumë se 1200 ° C, ose me një shkarkesë elektrike:
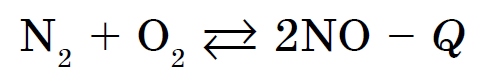
Kisen oksidon energjikisht jo vetëm fjalimin e thjeshtë, ale dhe të palosur mjaft, me të cilin treten oksidet e elementeve, nga një erë e keqe e tillë zgjohen:
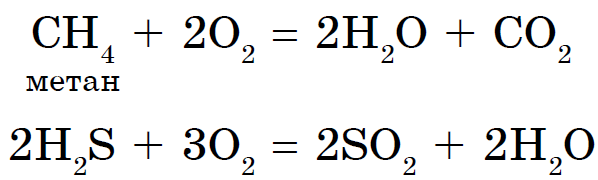
Ndërtimi i lartë oksidues i acidit qëndron në bazën e malit të të gjitha llojeve të zjarrit.
Kisen merr pjesë në proceset e oksidimit të plotë të lumenjve të ndryshëm në një temperaturë konstante. Roli i thartirës në procesin e frymëmarrjes së njerëzve dhe krijesave është jashtëzakonisht i rëndësishëm. Roslini gjithashtu poglyayut kisen atmosferike. Edhe pse në errësirë, vetëm procesi i argjilimit të rritjeve me thartirë, pastaj në dritë, vazhdon një proces tjetër - fotosinteza, si rezultat i së cilës rritja, dioksidi i karbonit argjilohet dhe sheh të thartën.
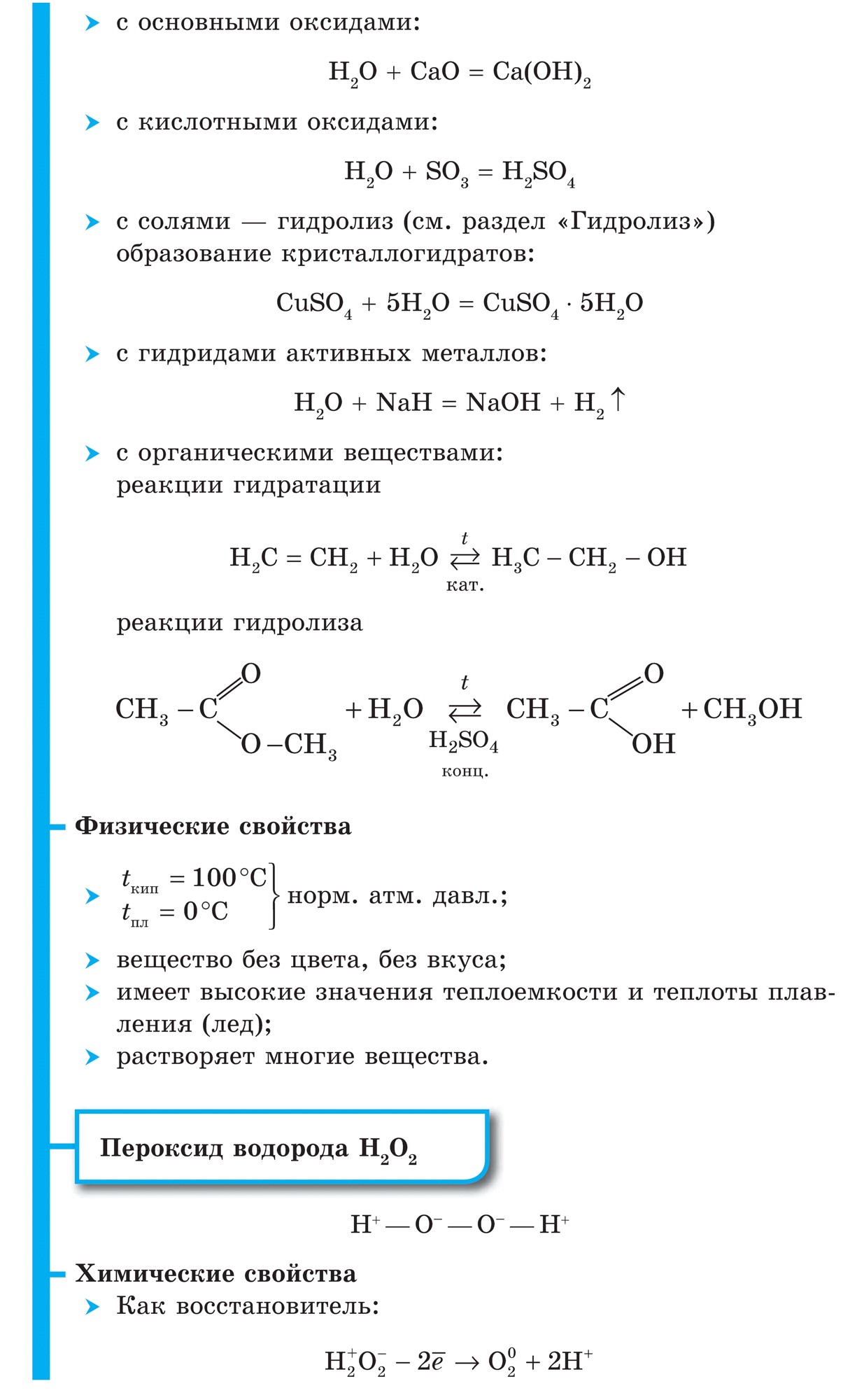
Në industrializëm, tymi merret nga një përsëritje e rrallë, dhe në laborator - me anë të shpërndarjes në peroksid uji në prani të një katalizatori ndaj dioksidit të manganit MnO 2 :
![]()
dhe gjithashtu shpërndarja e permanganatit të kaliumit KMnO 4 kur nxehet:
Mbizotërimi kimik i thartirës në tabela

zastosuvannya thartë
Kisen zastosovuyut në industrinë metalurgjike dhe kimike për përshpejtimin (intensifikimin) e proceseve të fermentimit. Zastosovuyt i pastër kisen edhe për temperatura të larta, për shembull, me zjarr me gaz dhe metal të prerë. Në mjekësi, thartira ngec në simptomat e vështirësisë në frymëmarrje të timchas, e lidhur me një lloj sëmundjeje. Gjithashtu, kisen zastosovuyt në metalurgji si oksidues për gjuajtjen e raketave, në aviacion për frymëmarrje, për prerjen e metaleve, për prodhimin e metaleve, me robotë vibrues. Kisen është marrë në cilindra çeliku, e bërë nga ngjyra e zezë, nën një presion prej 150 atm. Në mendjet laboratorike, kisen merret nga aksesorët e qelqit - një gazometër.
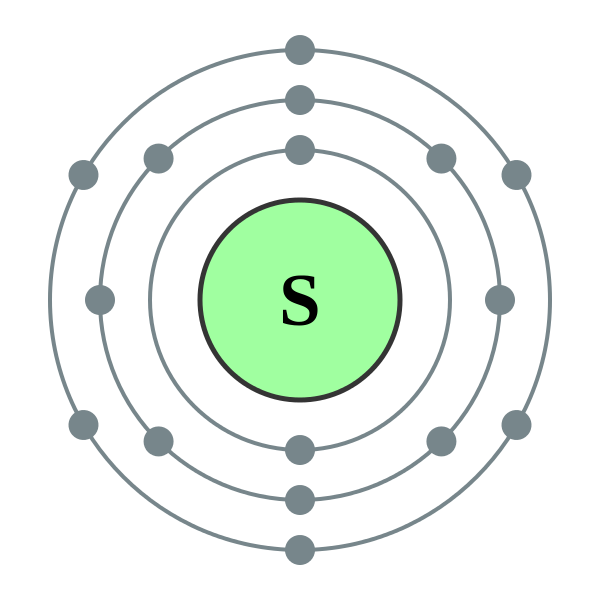
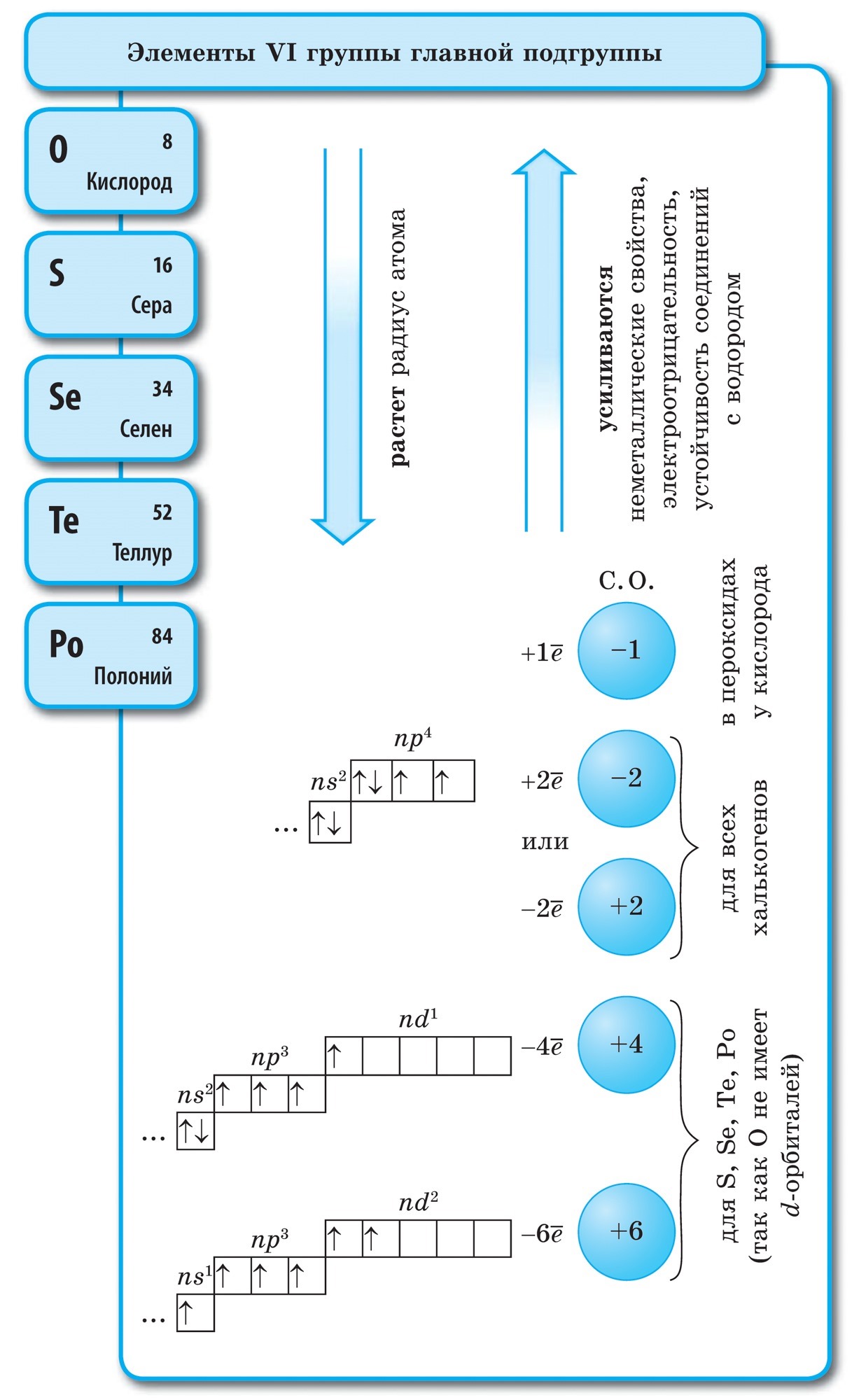
atomi Sirki (S), Ashtu si atomet e aciditetit dhe të gjithë elementët e tjerë të nëngrupit kryesor të grupit VI, hakmarrja në nivelin e jashtëm të energjisë 6 elektronikë, per cilin dy elektrone të paçiftuara. Megjithatë, në rastin e atomeve të oksigjenit, atomet e sirkës mund të kenë një rreze më të madhe, vlerë më pak elektronegative, ndaj së cilës ato shfaqin manifestime të fuqisë së madhe, duke përmbushur rendin e fazave të oksidimit. +2, +4, +6. Duke u rritur në elementë më pak negativë (ujë, metal), sirka tregon fuqi oksiduese dhe rrit nivelin e oksidimit. -2 .
Sirka - fjalim i thjeshtë
Për sirka, si për kisnyu, alotropia është karakteristike. Vіdomo modifikim i pasur i sirki me molekula budovaya ciklike ose lineare të magazinës së ndryshme.
Modifikimi më i qëndrueshëm, i njohur si një rreth rombik, i cili përbëhet nga molekula S 8. Erë e keqe është erëza në një ngjyrë të verdhë limoni dhe dehëse, pika e shkrirjes është 112,8 ° C. Në këtë modifikim në temperaturën e dhomës, të gjitha modifikimet e tjera transformohen. Gjatë kristalizimit, një sirka monoklinike del nga pika e shkrirjes (pjesa kryesore e kristalit, pika e shkrirjes 119.3 ° C), dhe më pas shndërrohemi në një rombike. Kur nxehet, shmatochkiv sirka në mostra do të shkrihet, duke u shndërruar në atdheun e një ngjyre të verdhë. Në një temperaturë prej afër 160 ° C, së shpejti fillon të errësohet, bëhet i trashë dhe viskoz, nuk dridhet nga provëza, kur nxehet më tej, shndërrohet në një atdhe të lehtë të shkërmoqur, por merr një ngjyrë të madhe kafe të errët. . Yakscho її turp në ujë të ftohtë, Vaughn-it i ra në sy një masë gome transparente. Vula është plastike. Mund ta merrni në pamjen e fijeve. Pas disa ditësh do të shndërrohet edhe në një rreth rombik.
Sirka nuk ndahet nga uji. Kristalet e sirkës fundosen pranë ujit dhe boshti i pluhurit noton në sipërfaqen e ujit, sepse kristalet e thata të sirkës nuk urinojnë me ujë dhe notojnë përsëri me llamba dribluese. Procesi i flotacionit. Sirka është pak i tretshëm në alkool etilik dhe eter dietil, shpërndahet mirë në qymyr squfuri.
Me mendje të mëdha sirka reagon me kallaj usima dhe metale luzhnotoke, medi, merkuri, argjend, Për shembull:
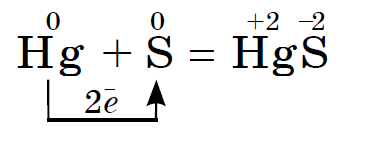
Ky reagim qëndron në bazën e shfaqjes së merkurit të derdhur, për shembull, nga një termometër i thyer. Pikat e dukshme të merkurit mund të merren në letër arkush ose në plastikë të mesme. Ai zhivë, që kam pirë në të çara, duhet të laget me pluhur sirka. Ky proces quhet demerkurizim.
Kur nxehet, sirka reagon me metale të tjera (Zn, Al, Fe), dhe vetëm ari nuk ndërvepron me të për asnjë arsye. Oksidet e fuqisë së sirkës shfaqen edhe me ujin, me një reagim të ngjashëm kur nxehet:
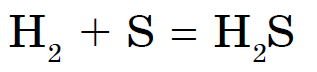
Jometalet me squfur nuk reagojnë vetëm me azotin, jodin dhe gazrat fisnikë. Sirka djeg gjysmëdritat e kaltërosh, duke shuar oksidin e squfurit (IV):
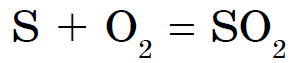
Tse z'ednannya është e njohur gjerësisht me emrin e gazit syrchisty.
Mbizotërimi kimik i sirkës në tabela

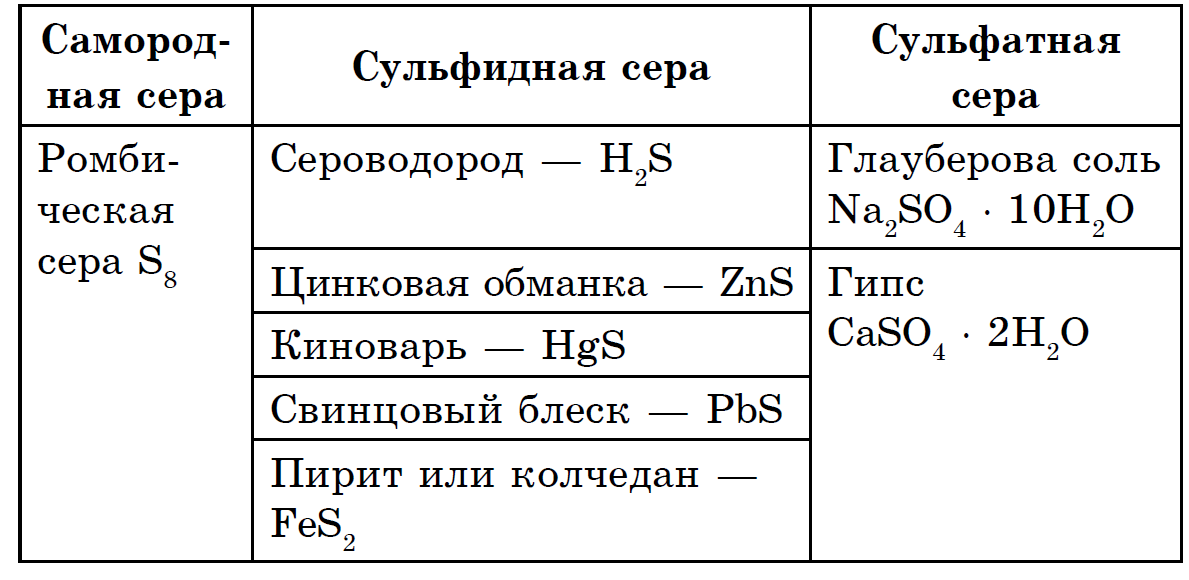
Perimetri është sjellë deri në elementë shumë të gjerë: korja e tokës hakmerret me 4,7 10-2% të tokës për masën (vendi i 15-të ndër elementët më të vegjël), dhe Toka në tërësi është më e pasur (0,7%). Masa e kokës së sirkës gjendet në thellësitë e tokës, në topat e mantelit її, të gërvishtura midis kores së tokës dhe bërthamës së Tokës. Këtu, në një thellësi prej përafërsisht 1200-3000 km, gjendet një top intensiv sulfidesh dhe oksidesh metali. Në lëvoren e tokës, sirka vija si në një kamp të lirë (vendase), kështu që, në rangun e kokës, duket si një gjysmë sulfidesh dhe sulfatesh. 3 sulfide në koren e tokës piriti më i gjerë FeS2, kalkopiriti FeCuS2, blisk i plumbit (galena) PbS, blende zinku (sfaleriti) ZnS. Sasi të mëdha sirka shpërndahen në koren e tokës pranë sulfateve të rëndësishme - gipsit CaSO4 · 2H2O, barit BaSO4, në ujin e detit, sulfat magnezi, natrium dhe kalium.
Tsikavo, se në kohët e lashta të historisë gjeologjike të Tokës (rreth 800 milion vjet më parë) nuk kishte sulfate në natyrë. Erë e keqe është qetësuar si produkt i oksidimit të sulfurit, nëse atmosfera është e thartë si rezultat i jetës së rritjes së vinilit. Në gazrat vullkanikë, zbulohet dita e H2S dhe anhidridit sulfurik SO2. Për këtë, sirka vendase, pasi kapet në zona afër vullkaneve të egra (Sicili, Japoni), mund të vendoset me ndërveprimin e dy gazeve:
2H 2 S + SO 2 \u003d 3S + 2H 2 O.
Shtresa të tjera të sirkës vendase janë të lidhura me jetën e mikroorganizmave.
Mikroorganizmat marrin fatin e të pasurve proceset kimike, Në tërësi, ato formojnë qarkullimin e sirkës në natyrë. Për їх priyannya sulfidet oksidohen në sulfide, sulfatet grumbullohen nga organizmat e gjallë, dehidratimi rikthehet dhe hyn në depon e proteinave dhe burimeve të tjera të rëndësishme jetësore. Në rast të kalbjes së tepricave në organizma, proteinat shemben dhe vjen një mesditë, e cila më tej oksidohet ose në një sirka elementare (kështu vendosen sirkat), ose në sulfate. Tsikavo, ato baktere dhe alga, që oksidojnë ditën aktuale deri në agim, mbledhin її në qelizat e tyre. Qelizat e mikroorganizmave të tillë mund të përbëhen 95% nga sirka e pastër.
Posnitii Poorzhni Sirki mund të jetë në dukje në analogun Niya їїn - Selena: Yakscho në Gamenno, pastaj Sirka Vulkaniki Parking, Yakschko Nemє - Bіogenic, kështu që Yak Mіkroorganizmi Ndiz në mënyrë unike Seleniumin në Sviy Lyttєzoviy Nі 3, Čicle.
Rëndësia biologjike e sirkës
Jeta është një element i rëndësishëm kimik. Fitoi për të hyrë në depon e proteinave - një nga përbërësit kryesorë kimikë të qelizave të të gjithë organizmave të gjallë. Veçanërisht i pasur me flokë të bardhë, brirë, jashtë. Krym tsgogo, sirka є ruajtja e pjesëve të fjalimeve biologjikisht aktive në trup: vitamina dhe hormone (për shembull, insulina). Sirka merr pjesë në proceset oksid-ujë të trupit. Kur ka mungesë të sirkës në trup, vërehen të qara dhe brishtësia e furçave dhe rënia e flokëve.
Siroi bimë të pasura të fasules (bizele, sytha), plastikë hardhie, vezë.
sirka
Sirka vikoristovuєtsya në shumëllojshmërinë e sirnikiv dhe letre, çamçakëz dhe farb, vibukhovy speechovin dhe likіv, plastikë dhe preparate kozmetike. Në fshatrat e fshatit, vikoristët përdoren për të luftuar kundër nxënësve të shkollës së roslyn. Sidoqoftë, shpëtimtari kryesor i sirkës është industria kimike. Gati gjysma e asaj që përftohet në botën e acidit sulfurik për prodhimin e acidit sulfurik.
nitrogjenit
![]()
Azoti (N)- përfaqësuesi i parë i nëngrupit kryesor të grupit V të sistemit periodik. Janë pesë elektrone, nga të cilat tre elektrone të paçiftuara, për t'u hakmarrë në nivelin e barabartë të energjisë. Duket sikur atomet e këtyre elementeve mund të bashkohen nga tre elektrone, duke plotësuar bilancin aktual të energjisë.
Atomet e azotit mund të japin elektronet e tyre në më shumë elementë elektronegativë (fluor, acid) dhe të lahen në këtë fazë oksidimi +3 dhe +5. Atomet e azotit tregojnë fuqinë më të rëndësishme në fazat e oksidimit +1, +2, +4.
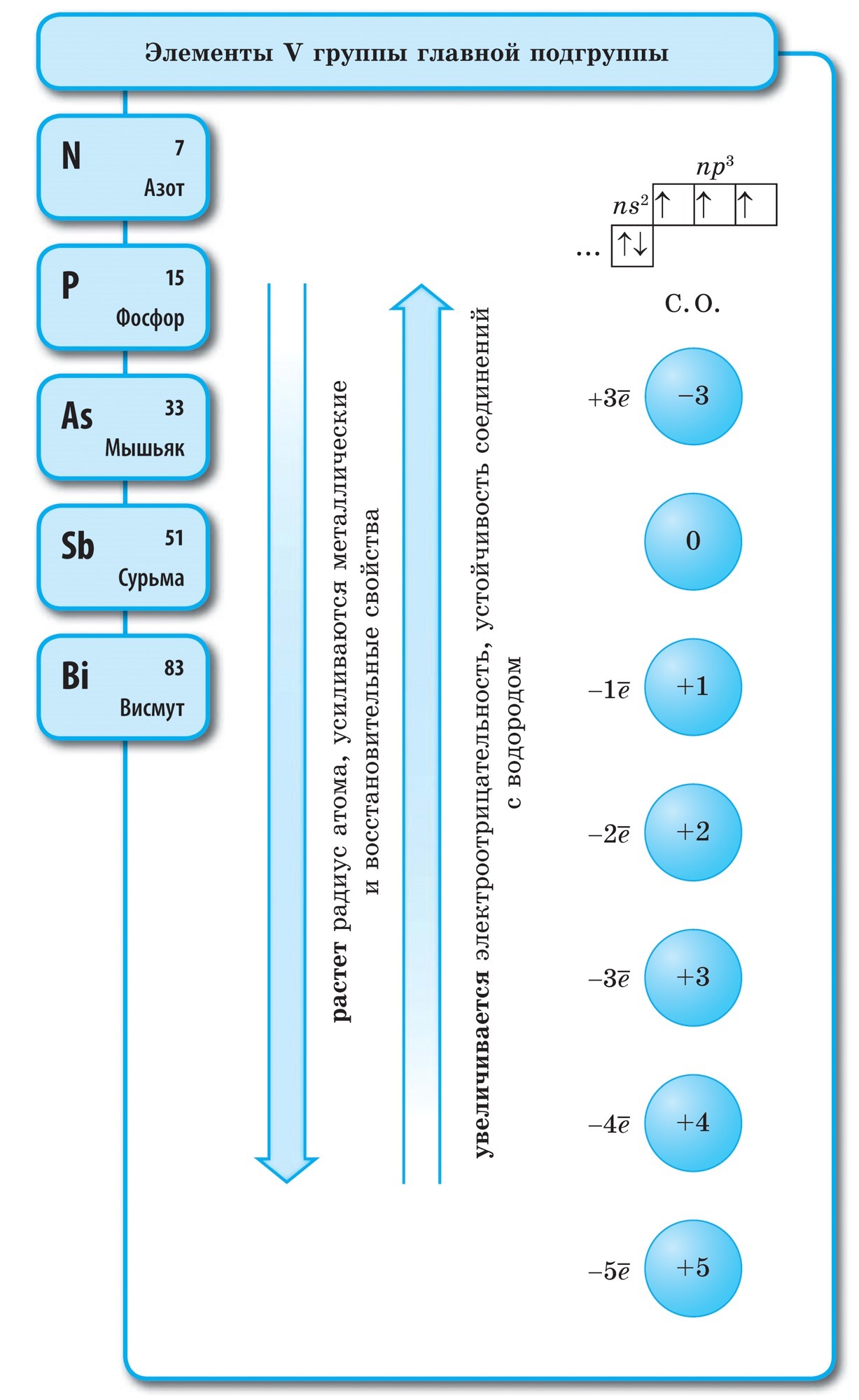
Në një çelik të lirë, azoti është i pranishëm në ujin e molekulave diatomike N 2. Në këtë molekulë, dy atome N janë të lidhur nga një lidhje kovalente pothuajse identike, lidhjet mund të njihen si më poshtë:

Azoti është një gaz pa bar, pa erë dhe shijshëm.
Me mendje të mëdha azoti vzaimodiє tіlki z lіtієm, utvoryuyuchi nitride Li 3 N:
Me metale të tjera vіn vzaєmodіє vetëm në temperatura të larta.
Gjithashtu në temperatura të larta dhe vise në prani të një katalizatori, azoti reagon me ujin, duke krijuar amoniak:
Në temperaturën e harkut elektrik, verërat fillojnë të thahen, duke tretur oksidin nitrik (II):
Mbizotërimi kimik i azotit në tabela

marrja e azotit
Azoti, i marrë nga distilimi i një rasti të rrallë, është i ndenjur në industri për sintezën e amoniakut dhe sintezën acid nitrik. Në mjekësi, azoti i pastër është i ndenjur në cilësinë e një mediumi inert për shërimin e tuberkulozit të mushkërive, dhe azoti i rrallë - kur shëron sëmundjen e kreshtës, borës dhe akullit.
fosforit
Elementi kimik fosfor bën një varg modifikimesh alotropike. Dy prej tyre janë fjalime të thjeshta: fosfor i bardhë dhe fosfor i kuq. Fosfori i bardhë ka një rrjetë kristalore molekulare, e cila përbëhet nga molekula P4. Mospërputhjet pranë ujit, shpërndani me mirësi në sirkovool. Në sipërfaqe oksidohet lehtësisht, dhe në një çelik si pluhur ndizet. Fosfori i bardhë është më i brishtë. Me fuqi të veçantë, ndërtesa shkëlqen në errësirë pas oksidimit. Merreni me ujë Fosfori i kuq është pluhur i kuq i errët. Chi nuk ndryshon as në ujë, as në disulfid karboni. Në sipërfaqe, oksidohet siç duhet dhe nuk funksionon. Nuk është helmues dhe nuk shkëlqen në errësirë. Kur nxehet, fosfori i kuq në mostrat e verës shndërrohet në fosfor të bardhë (përqendrimi i pari).
Fuqia kimike e fosforit të kuq dhe të bardhë është afër, por fosfori i bardhë është kimikisht aktiv. Pra, erërat fyese ndërveprojnë me metalet, duke kënaqur fosfidin:
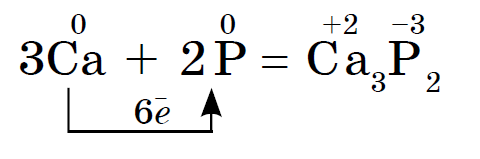
Fosfori i bardhë vetë-angazhohet në sipërfaqe, dhe fosfori i kuq digjet kur pështyhet. Në të dy vipadët, oksidi i fosforit (V) shpërndahet, i cili shihet në atë që duket si tym i trashë i bardhë:
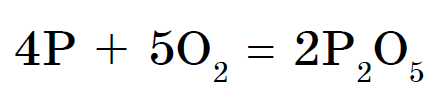
Fosfori nuk reagon pa ndërmjetësim me ujë, fosfina PH 3 mund të merret krah për krah, për shembull, nga fosfidet:
Fosfinë - duje gaz krunde h erë e papranueshme. Është e lehtë për të ndezur në sipërfaqe. Fuqia e fosfinës dhe shpjegon pamjen e zjarreve flakëruese të kënetës.
Mbizotërimi kimik i fosforit në tabela


marrja e fosforit
Fosfori është elementi biogjen më i rëndësishëm dhe në të njëjtën kohë që njihet më gjerësisht në industri. Chervoniy fosfor zastosovuyut dhe virobnitsvі sіrnikov. Aplikojeni në të njëjtën kohë me një palosje të prerë imët dhe ngjiteni në sipërfaqen e jashtme të kutisë. Kur tertі s_rnikovoї shkon, në magazinë, e cila përfshin klorat kaliumi dhe sirka, kërkohet huazim.
Mabut, fuqia e parë e fosforit, si një person që e vë veten në shërbim, është djegshmëria. Djegshmëria e fosforit është edhe më e madhe dhe depozitohet në modifikimet alotropike.
Fosfori më aktiv kimik, toksik dhe i djegshëm i bardhë ("i verdhë"), i cili shpesh vera zastosovuetsya (në bomba priming, etj.).
Chervoniy fosfor - modifikimi kryesor, viroblena dhe industria spozhivana. Vіn zastosovuєtsya në virobnitstvі sіrnikovіv, vybuhovyh chovina, magazina siguresash, tipe te ndryshme paliva, si dhe materialet kundër kapjes së naftës, si llambat me djegie gazi për llambat e ngrohjes.
Fosfori (si fosfatet) është një nga tre elementët biogjenë më të rëndësishëm, që merr pjesë në sintezën e ATP. Një pjesë e madhe e deformuar acid fosforik shkoni në përzgjedhjen e aditivëve fosforikë - superfosfat, precipitat, ammofosfat dhe në.
Fosfatet fitohen gjerësisht:
- në cilësinë e agjentëve kompleks formues (macet për zbutjen e ujit),
- në magazinë Pasivator prej metali sipërfaqësor (mbrojtja nga korrozioni p.sh. t. zv. magazina "mazhef").
Zdatnistst fosfativ për të formuar rrjetë polimer mіtsnu trivimіrny vikorivuєtsya për përgatitjen e lidhjeve fosfat dhe aluminofosfat.
qymyr druri
Vuglet (C)- elementi i parë i nëngrupit kryesor të grupit VI të sistemit periodik. Yogo atom dhe hakmarrje në nivelin e 4 elektroneve, kështu që erë e keqe mund të marrë një elektron chotiri, ënjtje në cilën fazë të oksidimit -4 , D.m.th.Tregoni oksidet e fuqisë dhe jepuni elektroneve të tyre më shumë elemente elektronegative, d.m.th. +4.
Vuglets - fjalim i thjeshtë
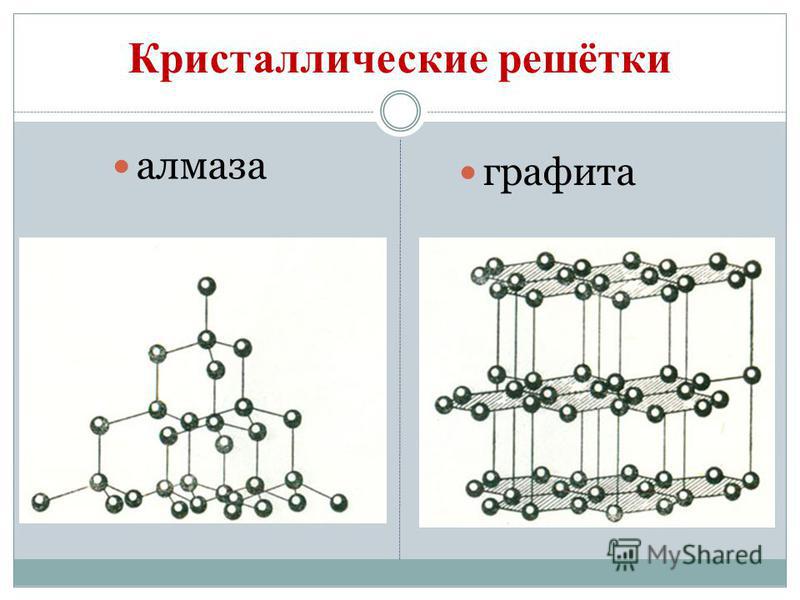
Qymyri plotëson modifikimet alotropike diamanti dhe grafiti. Diamanti është një fjalim i qartë kristal, më i vështiri nga të gjitha fjalimet natyrore. Vіn shërbejnë si një standard i fortësisë, pasi për sistemin me dhjetë pikë vlerësohet me topin më të lartë 10. Një fortësi e tillë e një diamanti është e lidhur nga një strukturë e veçantë e sitës së tij kristal atomike. Ajo ka një atom lëkure me prerje karboni nga të njëjtat atome, të gërvishtur në majat e një katërkëndëshi të rregullt.
Kristalet e diamantit unaza pa shirit, por ato janë ngjyra blu, e zezë, e kuqe dhe e zezë. Erë e keqe mund të jetë edhe një verbim i fortë i një shpërthimi dielli të një ndërtese me refraktues të lartë dhe lakues të dritës. Dhe erërat janë me fortësi jashtëzakonisht të lartë; mjete bluarëse, magazinë Rizannya.
Gjinitë më të mëdha të diamanteve gjenden në Afrikën Pivdenny, dhe në Rusi ato gjenden në Yakutia.
Grafit - gri e errët, e dhjamosur në të folur kristalor dotik me një shkëlqim metalik. Në faqen e një diamanti, grafiti është i butë (lë gjurmë në letër) dhe i errët, është mirë të përçojë nxehtësinë dhe energjinë elektrike. Butësia e grafitit është e veshur me një strukturë sferike. Në rrjetën kristalore të grafitit, atomet e karbonit, të cilët shtrihen në një plan, janë të lidhur me kujdes në gjashtë pjesët e duhura. Yjet midis balonave Malomitsnі. Vin është gjithashtu zjarrdurues. Grafiti është bërë nga elektroda, vajra të ngurta, ndërtues neutron në reaktorët bërthamorë dhe gërshërë për ullinj. Në temperatura të larta dhe një shtrëngim në grafit, fitohen diamante me copa, të cilat përdoren gjerësisht në teknologji.
Ngjashëm me grafitin e Budovit, bloza mund të derdhet në fshatin Vugillya. Fshati vugillya merret gjatë distilimit të thatë të fshatit. Tse vugіllya zavdjaki sipërfaqja e saj poroze mund ndërtimi i mrekullueshëm i gazit balte dhe të folurit. Qëllimi i fuqisë quhet adsorbim. Sa më i madh të jetë poroziteti i një vug druri, aq më efektiv është përthithja. Për të rritur ndërtesën prej balte, fshati Vugillya është kthyer në avull uji të nxehtë. Përditësimi në këtë mënyrë quhet aktiv ose aktiv. Në barnatore, yogo shitet në pamje si tableta të zeza të karbolenit.
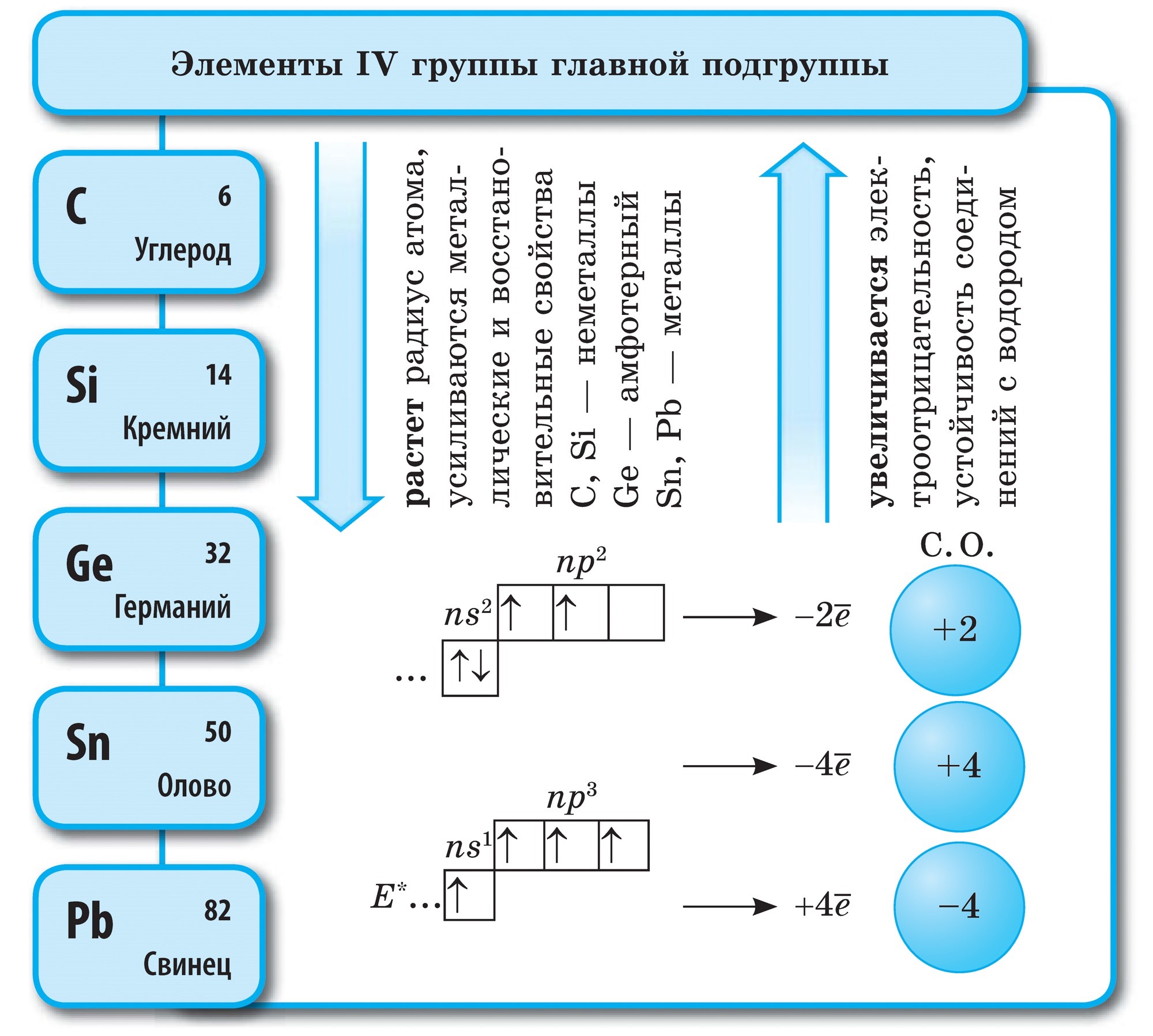
Fuqia kimike në qymyr
Diamanti dhe grafiti bëhen të thartë në temperatura të larta. Bloza dhe vugіllya vzaєmodіyut me kosi më lehtë, duke u djegur gjatë natës. Ale, në një humor të ngjashëm, rezultati i një ndërveprimi të tillë është i njëjtë - dioksidi i karbonit vendoset:
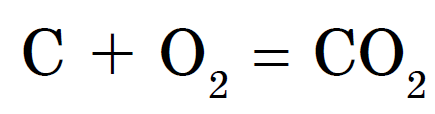
Me metale, qymyr kur nxehet karabit:
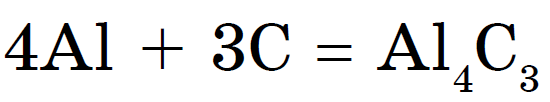
karabit alumini- pastrime kristalore në të verdhë të çelur. Vіdomy karbіd kaltsіyu Sas 2 duket si shmatkіv ngjyrë gri. Yogo stop saldatorët me gaz për të hequr acetilenin:
acetilen mbyll syrin për prerjen dhe zierjen e metaleve, djegien e jogës për thartirë shtesë në pantofla speciale.
Nëse ngrini ujë në karabit alumini, atëherë do të shihni më shumë gaz - metani CH 4:
silikoni
Siliconi (Si) është një tjetër element i nëngrupit kryesor të grupit IV të sistemit periodik. Në natyrë, silikoni është një tjetër element kimik për gjerësinë e acidit. Korja e tokës është më shumë se një e katërta e palosur nga një e katërta. Zgjerimi më i madh i silikonit është dioksidi i jodit SiO 2 - silicë. Në natyrë, verërat përbëhen nga kuarci mineral dhe shumëllojshmëria e pasur, kështu që forma e jargavanit - ametist, si dhe agat, opal, diaspër, kalcedoni, karnelian është i famshëm si një kristal girsky dhe yogo. Dioksidi i silikonit është i njëjtë me rërën më domethënëse dhe kuarc. Një lloj tjetër i materialeve natyrore për silikon është ce silikati. Midis tyre, aluminosilikatet më të gjera janë graniti, shih ndryshe balta, mikë. Silikat, i cili nuk hakmerret për aluminin, për shembull, asbestin. Oksidi i silikonit është i nevojshëm për jetën e roslin dhe krijesave. Vіn dodaє mіtsnіst kërcell roslinі і zahishnih pokrittiv krijesa. Siliconi shton butësi dhe butësi në kockat e njerëzve. Silikoni për të hyrë në magazinë e organizmave të gjallë më të ulët - diatomeve dhe radiolarëve.
Fuqia kimike e silikonit
Silikoni digjet në kosi, shuarja e dioksidit të silikonit ose oksidit të silikonit (IV):
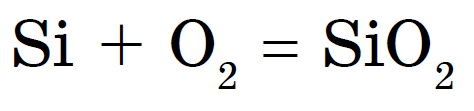
Duke qenë jometal, hardhitë kur nxehen bashkohen me metale dhe vula silicide:
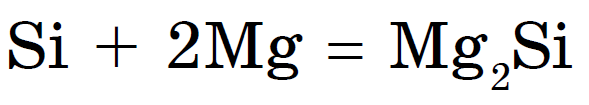
Silicidet përhapen lehtësisht me ujë ose acide, me të cilat shihet një ujë silikoni i ngjashëm me gazin - silani:
4HCl + Mg 2 Si → SiH 4 + 2 MgCl 2
Në vіdmіnu vіd vіd vuglevnіv silane në poіtry të vetëpunësuar dhe digjet me dioksid silikoni dhe ujë të miratuar:
Reagimi i shtuar i silanit në një përzierje me metan CH4 shpjegohet me faktin se silici ka një madhësi atomi më të madhe, karbon më të ulët, lidhjet kimike Si-H është më i dobët se S-H.
Ndërveprimi i silikonit me livadhin e trëndafilave me ujë të koncentruar, silikate qetësuese dhe ujë:
Silikoni fitohet, kombinimi i jogës me dioksid magnezi ose karbon:
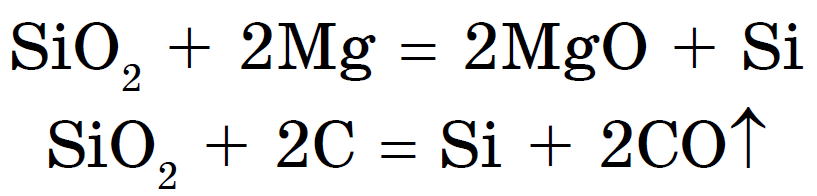
Oksid silikoni (IV), ose dioksidi i silikonit, ose silicë SiO 2, jak і CO 2, є oksid acid. Sidoqoftë, në vіdmіnu vіd CO 2, ai nuk mund të jetë molekular, por atomik rrjetë kristali. Prandaj, SiO 2 është një fjalim i fortë dhe refraktar. Vіn nuk ndryshon në ujë dhe acide, krem hidrofluorik dhe në temperatura të larta me livadhe me kripëra të acidit silicik - silikate:
Silica mund të hiqet gjithashtu me një aliazh të dioksidit të silikonit me okside metalike ose karbonate:
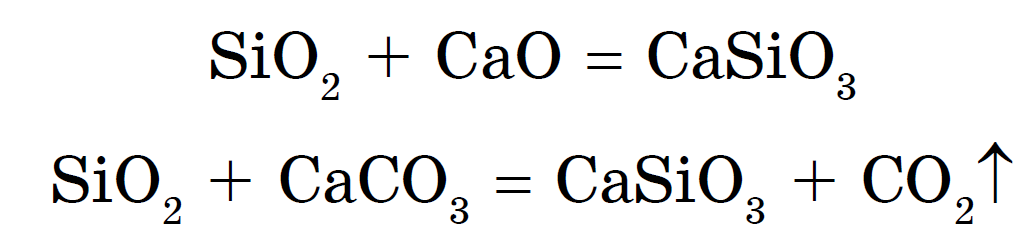
Silikatet e natriumit dhe kaliumit quhen skrap me pakicë. x Furnizim me ujë- është mirë të përdorni ngjitës silikat. Ka më shumë acide të forta në to - klorhidrik, sulfurik, oktovoik dhe navit karbonik - acid silicik H 2 SiO 3 :
otzhe, H 2 SiO 3 - acid shumë i dobët. Vaughn është i pazgjidhshëm në ujë dhe bie nga trazirat reaksionare në pamjen e një rrethimi të çmuar, ndonjëherë mbulon kompakt të gjithë gamën, duke e shndërruar atë në një masë të fortë, shkoj te pelte, pelte. Kur varur tsієї masi utvoryutsya fjalim shumë poroz - xhel silicë, gjerësisht zastosovuvaniya në cilësinë e adsorbent - balta іnshih speakovina.



Materiali Dovіdkovy për kalimin e testit:
tabelë periodike
Tabela e shitjes me pakicë