
පෝෂණය පිළිබඳ උපදෙස් දෙන්න: 1. නිෂ්ක්රීය වායුවක සම අණුවක් සෑදෙන්නේ පරමාණු කීයක් ද? 2. නිරුක්තිය දෙස බලා එය "නිෂ්ක්රිය වායු" ලෙස හඳුන්වන්න. 3. ඔබේ මිතුරාගේ නම කුමක්ද? 4. නිෂ්ක්රීය වායු වෙත යාමට වේගවත්ම ක්රමය කුමක්ද? අත්කම්කරුවෙකුගෙන්



නියොන් නියොන් තෝරාගැනීම වඩාත් කාර්යක්ෂම ආකාරයේ උද්වේගකර වෙළඳ දැන්වීම් වේ. Neon වෙළඳ දැන්වීම් සහ සැහැල්ලු පෙට්ටි ලෝකයේ සෑම රටකම ජනප්රියයි. නියොන් හෝ ආගන් වලින් පුරවා ඇති වීදුරු නළය, සැහැල්ලු පෙට්ටියකට වියන ලද අතර වික්ටෝරියානු ආකාරයෙන් ජයග්රාහීව හෝ සැහැල්ලු වෙළඳ දැන්වීම් කොල්ලකෑමට ලිපියක් සමඟ, සමරු, ඵලදායී හා ඵලදායී විය.


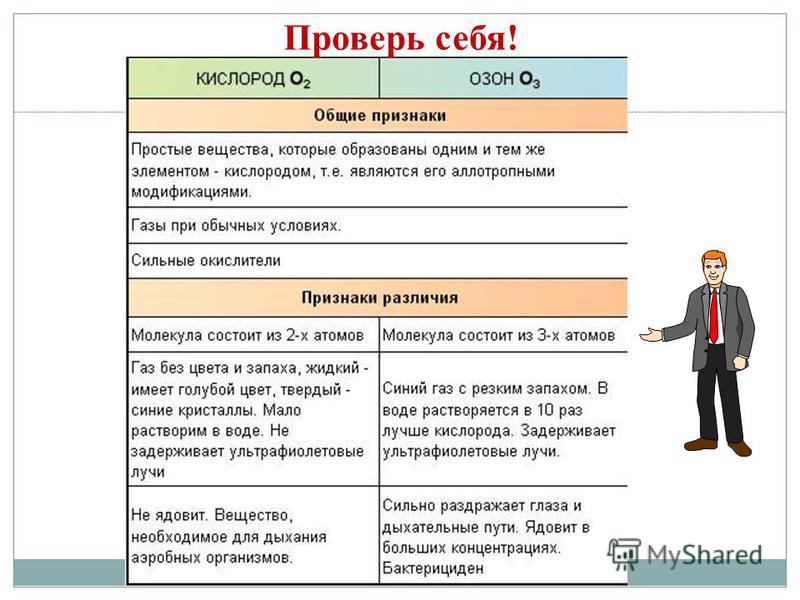
Allotropia - එදිනෙදා සහ බලය සඳහා බෙදී ඇති සරල කථා ඉසීමක් ස්ථාපිත කිරීම සඳහා උපස්ථායකයන් XE ගොඩනැගීම. Z - දියමන්ති, මිනිරන්, ෆුලරීන්. O - kissen, ඕසෝන්. S - රොම්බික්, මොනොක්ලිනික්, ප්ලාස්ටික්. P - සුදු, රතු, කළු. ඇලෝට්රොපි සංසිද්ධිය හේතු 2 ක් නිසා වේ: 1) අණුවක විවිධ පරමාණු සංඛ්යාවක්, උදාහරණයක් ලෙස ඔක්සිජන් O2 සහ ඕසෝන් O3. 2) විවිධ ස්ඵටිකරූපී ආකෘති, උදාහරණයක් ලෙස දියමන්ති සහ මිනිරන්.









යෝජිත මාරුවෙන්, දියමන්ති සහ මිනිරන් වල බල ලක්ෂණය තෝරන්න: 1. ස්ඵටික පැහැදිලි කථනය 2. තාපය සහ ස්ට්රම් සන්නයනය 3. ශක්තිමත් දිලිසීමක් තිබිය හැක 4. තද අළු, ඩොටික් ස්ඵටික කථාව සඳහා තරබාරු 5. ස්වාභාවික කථනයේ අමාරුම 6 තාපය හා ස්ට්රම් නොපවත්වන්න
 ලෝහ නොවන ලෝහ 1. ඝන කථනය (crimmercury Hg) 1, දැඩි කථනය (sirka S, chervonium පොස්පරස් සහ සුදු පොස්පරස් P 4, අයඩීන් I 2, දියමන්ති සහ මිනිරන් C), වායුව වැනි කථනය (ඔක්සිජන් O2, ඕසෝන් O3, නයිට්රජන් 2 . විදුලි හා තාප සන්නායකතාව 3. විදුලි ස්ට්රම් (සන්නායක є, උදාහරණයක් ලෙස, සිලිකන්, මිනිරන්) නොපැවැත්වීම
ලෝහ නොවන ලෝහ 1. ඝන කථනය (crimmercury Hg) 1, දැඩි කථනය (sirka S, chervonium පොස්පරස් සහ සුදු පොස්පරස් P 4, අයඩීන් I 2, දියමන්ති සහ මිනිරන් C), වායුව වැනි කථනය (ඔක්සිජන් O2, ඕසෝන් O3, නයිට්රජන් 2 . විදුලි හා තාප සන්නායකතාව 3. විදුලි ස්ට්රම් (සන්නායක є, උදාහරණයක් ලෙස, සිලිකන්, මිනිරන්) නොපැවැත්වීම
![]()
පෝෂණය පිළිබඳ උපදෙස් දෙන්න.ඇලෝට්රොපි යනු කුමක්ද? ඇලෝට්රොපික් වෙනස් කිරීම් නම් කරන්න. ඇලෝට්රොපි වික්ලිකානෝ ප්රකාශනය වන්නේ ඇයි? කථන විවිධත්වය සඳහා එක් හේතුවක් ඇත්තේ ඇයි? "කවුළුව තුළ ගිගුරුම් සහිත කුණාටුවක සුවඳක් ඇති විය" යනුවෙන් එය රසායනිකව නිර්ව්යාජ කාව්යමය ප්රකාශනයක් වන්නේ ඇයි? ඔබ විසි කිරීම සහ නොදැමීම පිළිබඳ rozpodіl කළේ ඇයි? ඔබ විසි කිරීම සහ නොදැමීම පිළිබඳ rozpodіl කළේ ඇයි?


රසායනික මූලද්රව්ය - නොවන විසි කරන්නන්
මුළු රසායනික මූලද්රව්ය 16ක් ඇත-ලෝහ නොවන අතර, ඒවායින් දෙකක්, ඔක්සි ඉන්ධන සහ සිලිකන්, පෘථිවි සරම්ප ස්කන්ධයෙන් 76% ක් වේ. විසි නොකරන අය රොස්ලින් ස්කන්ධයෙන් 98.5% ක් සහ මිනිසුන්ගේ ස්කන්ධයෙන් 97.6% ක් නැවී ඇත. ගල් අඟුරු, ජලය, ඇඹුල්, sirka, පොස්පරස් සහ නයිට්රජන් සමග, සියලු වැදගත් කාබනික කථාව එකතු වේ, දුගඳ ජීවිතයේ මූලද්රව්ය වේ. ජලය සහ හීලියම් යනු සමස්ත ලෝකයේ ප්රධාන මූලද්රව්ය වේ, අපගේ සූර්යයා ඇතුළු සියලුම විශ්වීය වස්තූන් ඒවායින් සෑදී ඇත. ලෝහ නොවන ආරෝපණයකින් තොරව, අපගේ ජීවිතය හෙළිදරව් කළ නොහැක, විශේෂයෙන් ජීවිතය වැදගත් වන්නේ කුමක්දැයි අනුමාන කිරීමට රසායනික බලාගාරය- ජලය - ජලය සහ ඇඹුල් බවට නැවී.
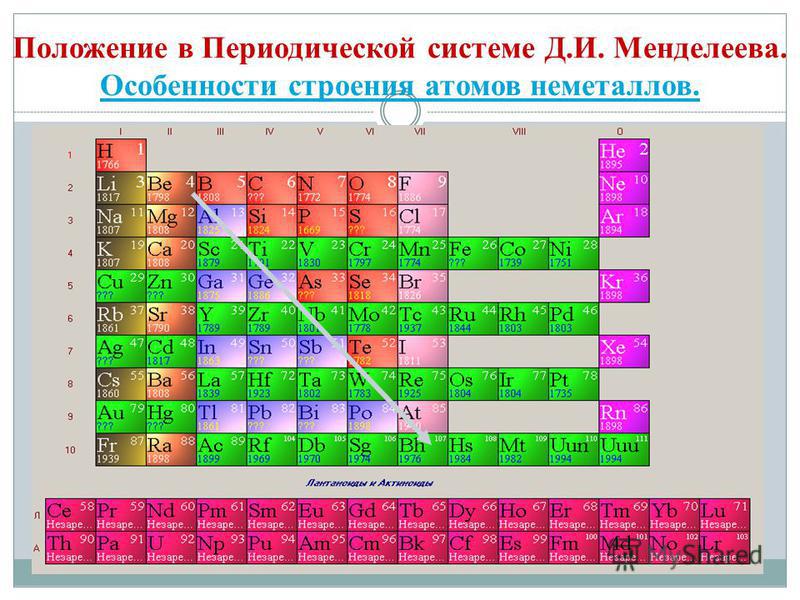
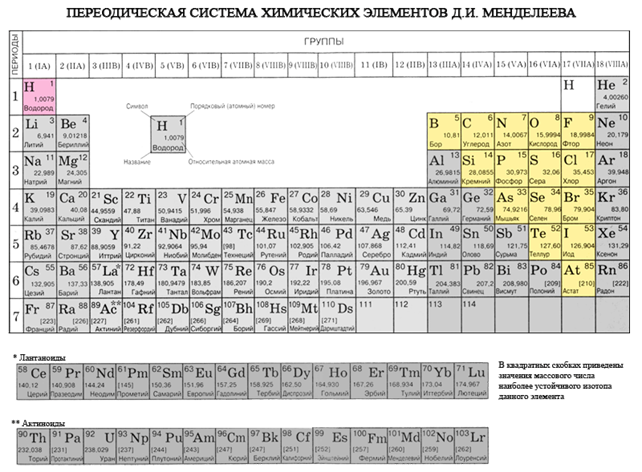
ඔබ ආවර්තිතා පද්ධතිය තුළ බෙරිලියම් සිට ඇස්ටැටීන් දක්වා විකර්ණයක් අඳින්නේ නම්, විකර්ණය දිගේ දකුණු පසින් ඉහළට ලෝහ නොවන මූලද්රව්ය ඇති අතර පතුලේ - ලෝහ සහ ඒවාට පෙර සියලුම පැති කාණ්ඩවල මූලද්රව්ය, ලැන්තනයිඩ සහ ඇක්ටිනයිඩ ඇත. , පෙනෙනු ඇත. මූලද්රව්ය, විකර්ණය අසල පැතිරී ඇත, උදාහරණයක් ලෙස, බෙරිලියම්, ඇලුමිනියම්, ටයිටේනියම්, ජර්මේනියම්, ඇන්ටිමනි, ද්විත්ව චරිතයක් තිබිය හැකි අතර මෙටලොයිඩ් දක්වා දැකිය හැකිය. Elementi-නො-විසිකරන්නන්: s-මූලද්රව්ය - ගංවතුර; r-elementi 13 groupi - බෝරෝන්; කණ්ඩායම් 14 - ගල් අඟුරු සහ සිලිකන්; 15 කණ්ඩායම - නයිට්රජන්, පොස්පරස් සහ මිෂ්යාක්, කණ්ඩායම් 16 - kissen, sirka, selenium සහ telurසහ 17 වන කණ්ඩායමේ සියලුම අංග - ෆ්ලෝරීන්, ක්ලෝරීන්, බ්රෝමීන්, අයඩීන් සහ ඇස්ටටින්. Elementi 18 groupi - නිෂ්ක්රිය වායු, විශේෂ කඳවුරක් වාඩිලාගෙන, දුර්ගන්ධය පිටත ඉලෙක්ට්රෝන බෝලයේ සම්පූර්ණ කිරීම් වලින් පිරී ඇති අතර ලෝහ සහ ලෝහ නොවන අතර අතරමැදි ස්ථානයක් හිමි වේ. ඒවා සමහර විට ලෝහ නොවන ලෙස හැඳින්වේ, නමුත් විධිමත් ලෙස, භෞතික සංඥා පිටුපස.
නෙමෙටලි- සී රසායනික මූලද්රව්ය, සෘණ ආරෝපණය වූ විට ඒවා තෘප්තිමත් කරමින් පරිපූර්ණ ශක්ති මට්ටම සම්පූර්ණ කිරීමට ඉලෙක්ට්රෝන ගන්නා පරමාණු.
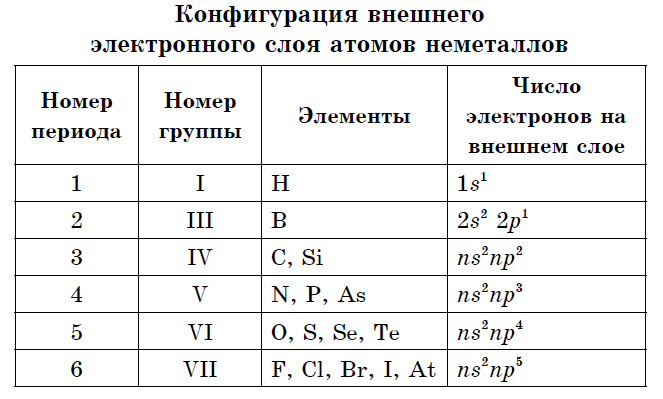
ලෝහ නොවන පරමාණුවල පිටත ඉලෙක්ට්රෝන බෝලයේ ඉලෙක්ට්රෝන තුනක් හෝ අටක් ඇත.
ප්රායෝගිකව සියලුම විසි නොකරන අයට සමානව කුඩා අරය සහ 4 සිට 7 දක්වා වූ බාහිර ශක්ති මට්ටමේ ඉලෙක්ට්රෝන විශාල සංඛ්යාවක් තිබිය හැක, ඒවා විද්යුත් සෘණතාවයේ ඉහළ අගයන් මගින් සංලක්ෂිත වේ. බල ඔක්සයිඩ. ලෝහ පරමාණු සම්බන්ධයෙන්, ලෝහ නොවන ඒවා මගින් සංලක්ෂිත වන්නේ එබැවිනි:
· කුඩා පරමාණුක අරය;
· චෝටිරි සහ බාහිර ශක්ති මට්ටමේ වැඩි ඉලෙක්ට්රෝන;
තරු සහ ලෝහ නොවන පරමාණු වල එවැනි වැදගත් බලයක් - දිනකට ඉලෙක්ට්රෝන 8 ක් දක්වා ලබා ගැනීමේ ප්රවණතාවක්, එනම් බලයේ ඔක්සයිඩ් වේ. ලෝහ නොවන පරමාණු වල ලක්ෂණයක් ලෙස, ලෝහමය නොවන ඔවුන්ගේම ලෝකය, ඉලෙක්ට්රොනික වාණිජ්යය සේවය කළ හැකි වන පරිදි, රසායනික මූලද්රව්යවල පරමාණුවල බලය රසායනික බන්ධනය ධ්රැවීකරණය වන පරිදි, ඉහළ ඉලෙක්ට්රෝන තමා වෙතට ඇද දමයි;
රසායනික මූලද්රව්යවල ශ්රේෂ්ඨතම විද්යාත්මක වර්ගීකරණය ලෝහ හා ලෝහ නොවන ලෙස බෙදා ඇත. Tsya වර්ගීකරණය මෙම පැය තුළ එහි වැදගත්කම නැති වී නැත. ලෝහ නොවන ප්රධාන රසායනික මූලද්රව්ය වන අතර, පරමාණු සඳහා බාහිර දෘශ්ය බෝලය සම්පූර්ණ වන තෙක් ඉලෙක්ට්රෝන පිළිගැනීම ලක්ෂණයක් වන අතර, රීතියක් ලෙස, පිටත ඉලෙක්ට්රෝන බෝලය මත වැඩි වැඩියෙන් ඉලෙක්ට්රෝන සහ පරමාණු වල කුඩා අරයක් පරමාණු ලෝහ.
නිෂ්ක්රිය, හෝ උච්ච, වායු, පරමාණු, සහ පිටත ඉලෙක්ට්රොනික පන්දුව අවසන් සමහර - ප්රධාන උප සමූහයේ VIII කාණ්ඩයේ මූලද්රව්ය පිටත Tse vyznachennya. මෙම මූලද්රව්යවල පරමාණුවල ඉලෙක්ට්රොනික වින්යාසය ලෝහ හෝ ලෝහ නොවන ඒවාට ආරෝපණය කළ නොහැක. මෙම වස්තූන්ගේ දුර්ගන්ධය, ලෝහයට සහ ලෝහයට මූලද්රව්ය එකතු කිරීම වැනි, ඒවා අතර රඳවන ස්ථානය අල්ලා ගනී. නිෂ්ක්රීය, නොඑසේ නම් උතුම්, ගාසි ("උතුම්භාවය" නිෂ්ක්රිය බවින් ප්රකාශ වේ) සමහර විට භෞතික සංඥා පිටුපස ලෝහ නොවන හෝ ඊටත් වඩා විධිමත් ලෙස ගෙන යා හැක. Cі rechovina zberіgayut gazopodіbny මෝල් අයිතිය අඩු උෂ්ණත්වයේ චාපය දක්වා. එබැවින්, හීලියම් චි t ° \u003d -268.9 ° C හි දුර්ලභ තත්වයකට නොයනු ඇත.
මෙම මූලද්රව්යවල රසායනික යෙදීමෙහි උදාසීන බව පැහැදිලිය. ෆ්ලෝරීන් සහ අම්ලය සමඟ සංයෝජිතව ඇති සෙනෝන් සහ ක්රිප්ටෝන් සඳහා: KrF 2, XeF 2, XeF 4 සහ in. නිසැකවම, මේ දිනවල ආලෝකයේ දී, නිෂ්ක්රිය වායු දායකයන් ලෙස ක්රියා කරයි. ලෝහ නොවන අංශු නම් කිරීම, ඒවායේ පරමාණු සඳහා විද්යුත් සෘණතාවයේ ඉහළ අගයක් මගින් සංලක්ෂිත වේ. එය 2 සහ 4 අතර මායිම් වෙනස් වේ. Nemetals යනු හිස උප සමූහවල මූලද්රව්ය වේ, p-මූලද්රව්ය වඩාත් වැදගත් වේ, වැල් ජලය බවට පත් වේ - s-මූලද්රව්යය.
සියලුම ලෝහ නොවන මූලද්රව්ය (ක්රීම් ජලය) රසායනික මූලද්රව්යවල ආවර්තිතා පද්ධතියේ වාසය කරයි D. I. Mendeliev ගේ ඉහළ දකුණු kut, utvoryuyuchi tricutnik, එහි ඉහළ කොටස ෆ්ලෝරීන් F වන අතර ආධාරකය විකර්ණ B - At. කෙසේ වෙතත්, ආවර්තිතා පද්ධතියේ ජල අපැහැදිලි ස්ථානය කෙරෙහි විශේෂ අවධානයක් යොමු කෙරේ: I සහ VII කාණ්ඩවල ප්රධාන උප කාණ්ඩවල. Tse vipadkovo නොවේ. එක් පැත්තකින්, ජල පරමාණුව පුඩිම ලෝහවල පරමාණුවලට සමාන වේ, නමුත් පිටත (සහ නව සඳහා තනි) ඉලෙක්ට්රොනික බෝලයක් මත, එක් ඉලෙක්ට්රෝනයක් (ඉලෙක්ට්රොනික වින්යාසය 1s 1), එය ගොඩනැගිල්ලේ බලය පෙන්නුම් කරයි. නායක.
ඔවුන්ගේ බොහෝ දිනවල ජලය, පොකුණු වැනි, ඔක්සිකරණ මට්ටම +1 පෙන්වයි. Ale, පරමාණුවකට ඉලෙක්ට්රෝනයක් ලබා දීම ජලයට වඩා වැදගත් වන අතර චන්ද්ර ලෝහවල පරමාණු වලින් අඩුය. අනෙක් අතට, හැලජන් පරමාණු මෙන් ජල පරමාණුව, ඕවලාකාර ඉලෙක්ට්රෝන බෝලය සම්පූර්ණ කිරීම සඳහා එක් ඉලෙක්ට්රෝනයක් ප්රතික්ෂේප කරයි, එම ජල පරමාණුවට එක් ඉලෙක්ට්රෝනයක් පිළිගත හැකි අතර, ඔක්සිකාරක බලය සහ හැලජන් ඔක්සිකරණ අදියර -1 හි ලක්ෂණ පෙන්නුම් කරයි. හයිඩ්රයිඩ් (ලෝහ සමග, හැලජන් සමග සමාන සම්බන්ධක ලෝහ - හේලයිඩ). කෙසේ වෙතත්, පරමාණුවකට එක් ඉලෙක්ට්රෝනයක් එකතු කිරීම හැලජන් වලට වඩා වැදගත් වේ.
හිදී සිත්ජලය H 2 - ගෑස්. යෝගෝ අණුව, හැලජන් වැනි, ද්වි පරමාණුක වේ. ලෝහ නොවන පරමාණුවලදී, බලයේ ඔක්සයිඩ වඩාත් වැදගත් වේ, එනම් ඉලෙක්ට්රෝන එකතු කිරීමේ හැකියාව. Qiu ගොඩනැගීම විද්යුත් සෘණතාවයේ අගය ගුනාංගීකරනය කරයි, එය ස්වභාවිකව කාල පරිච්ඡේද සහ උප කාණ්ඩ වල වෙනස් වන බැවින්. ෆ්ලෝරීන් යනු ශක්තිමත්ම ඔක්සිකාරක කාරකය වන අතර, රසායනික ප්රතික්රියා වල එහි පරමාණු ඉලෙක්ට්රෝන නිපදවන්නේ නැත, එනම්, ඔවුන් සැලකිය යුතු බලයක් පෙන්වයි. වෙනත් නොවන විසිකරන්නන්ට විශාල බලයක් පෙන්විය හැක, නමුත් ඔවුන් ලෝහ සමග තරාතිරම්වල සැලකිය යුතු ලෙස දුර්වල වේ; ඒවායේ කාල පරිච්ඡේද සහ උප කාණ්ඩ වලදී, ඔක්සිකරණ අනුපිළිවෙලෙහි ප්රතිලෝම අනුපිළිවෙලෙහි සැලකිය යුතු ගොඩනැගිල්ල වෙනස් වේ.
- මූලද්රව්ය-නො-විසි කරන ලද roztashovani ප්රධාන උප කණ්ඩායම් III-VIII කණ්ඩායම් PS D.I. මෙන්ඩලීව්, ඉහළ දකුණු කෙළවරේ වාඩිලාගෙන සිටී.
- පිටත ඉලෙක්ට්රෝන බෝලයේ ඉලෙක්ට්රෝන 3 සිට 8 දක්වා ඇත.
- මූලද්රව්යවල ලෝහ නොවන බල කාල පරිච්ඡේදවල වැඩි වන අතර මූලද්රව්යයේ සාමාන්ය සංඛ්යාව වැඩි වීමත් සමඟ උප සමූහවල දුර්වල වේ.
- ලෝහ නොවන වඩාත්ම ආම්ලික ආකාර ආම්ලික චරිතයක් (අම්ල ඔක්සයිඩ් සහ හයිඩ්රොක්සයිඩ්) ඇත.
- මූලද්රව්යවල පරමාණු - ගොඩනැගිල්ලේ ලෝහ නොවන, එනම් ඉලෙක්ට්රෝන පිළිගැනීම, ඔක්සයිඩ් ශ්රිත පෙන්වයි, එබැවින් ඒවා අත්යවශ්ය කාර්යයන් පෙන්වයි.
Budov සහ ලෝහ නොවන භෞතික බලය
සරල කථාවලදී, ලෝහ නොවන පරමාණු බැඳී ඇත සහසංයුජ ධ්රැවීය නොවන බන්ධනය. Zavdyaki tsomu ඉලෙක්ට්රොනික පද්ධතියේ විශාල ස්ථරයක්, අඩු පරිවරණය කළ පරමාණු සාදයි. මෙම අවස්ථාවේ දී, තනි (උදාහරණයක් ලෙස, ජල අණු H 2, හැලජන් F 2, Br 2, I 2), යැපෙන (උදාහරණයක් ලෙස, සල්ෆර් S 2 අණු වල), පාඩු (උදාහරණයක් ලෙස, නයිට්රජන් N අණු වල 2) සහසංයුජ බන්ධන.
- gnuchkist vіdsutnya
- දිලිසීමක් නැත
- තාප සන්නායකතාවය (මිනිරන් පමණි)
- වර්ණ පටිපාටිය වෙනස් ය: කහ, කහ-කොළ, රතු-දුඹුරු.
- විද්යුත් සන්නායකතාවය (මිනිරන් සහ කළු පොස්පර පමණි.)
සමස්ථ මෝල:
- නිජබිම - Br 2;
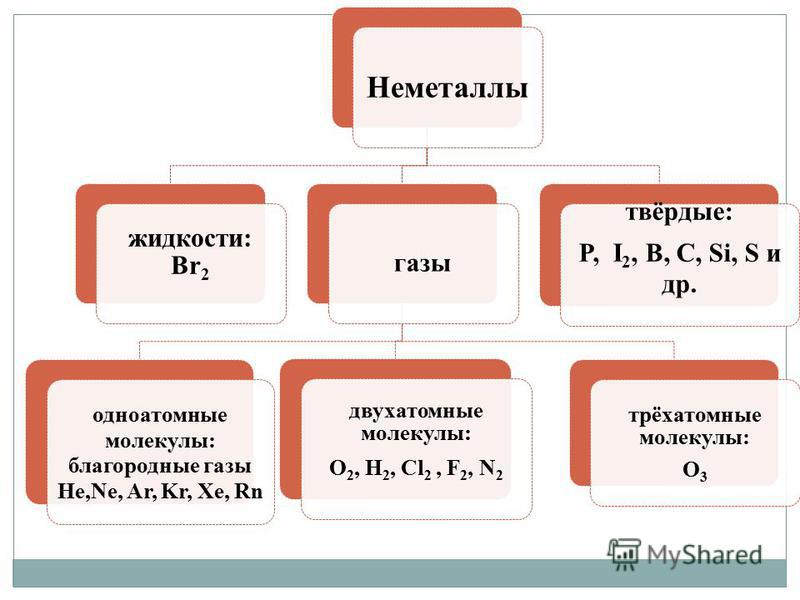
Vіdmіnu vіd metalіv නොවන වීසි මත - කතා කරන්න, බලධාරීන්ගේ විශාල විවිධත්වය මගින් සංලක්ෂිත වේ. Nemetali mayut විවිධ එකතු කිරීමේ කඳවුර ඉහළම මනසෙහි:
- වායු - H 2, O 2, O 3, N 2, F 2, Cl 2;
- නිජබිම - Br 2;
- දැඩි කථනය - සර්කා, පොස්පරස්, සිලිකන්, ගල් අඟුරු සහ ඇතුළත වෙනස් කිරීම්.
වර්ණ වර්ණාවලිය ලෝහ නොවන සඳහා පොහොසත් වේ: රතු - පොස්පරස් සඳහා, රතු-බුරියම් - බ්රෝමීන් සඳහා, කහ - sirka සඳහා, කහ-කොළ - ක්ලෝරීන් සඳහා, වයලට් - pari අයඩීන් සඳහා. මූලද්රව්ය - විශාල zdatnі නොවන ලෝහ, ලෝහ සමග යුගල වශයෙන්, විභේදන කිරීමට.
එක් රසායනික මූලද්රව්යයක පරමාණුවලට සරල කථන කිහිපයක් කිරීමට ඇති හැකියාව ඇලෝට්රොපි ලෙසත්, සරල කථන සංඛ්යාව ඇලෝට්රොපික් විශේෂ ලෙසත් හැඳින්වේ.
කථා වලට සමාව දෙන්න - මව්වරුන්ට විසි කළ නොහැක:
1. අණුක බුඩොව්.ශ්රේෂ්ඨ මනසක් ඇතිව, එවැනි කතාවලින් බහුතරයක් වායූන් (H 2, N 2, O 2, F 2, Cl 2, O 3) හෝ ඝන කථාව (I 2, P 4, S 8) සහ තනි බ්රෝමීන් එකකට වඩා වැඩිය. (Br 2) යනු නිජබිමයි. කථනයේ සියලුම වචන අණුක බුඩෝව්, ඒ වෙත පියාසර කරයි. ඝන තත්වයකදී, දුගඳ අන්තර් අණුක අන්තර්ක්රියා දුර්වල වීම නිසා විලයනය වන අතර, එමගින් ස්ඵටිකයේ ඇති අණු අඩු කරයි, සහ උත්ප්රේරණය දක්වා ගොඩනැගීම.
2. පරමාණුක ජීවය.කථනයේ වර්ණය සෑදී ඇත්තේ පරමාණුවල ලේන්සු දෙකකින් (C n, B n, Si n, Se n, Te n). සහසංයුජ බන්ධනවල මහා ඛනිජය හරහා, දුගඳ, රීතියක් ලෙස, ඉහළ දෘඪතාවක් ඇති කරයි, එය වෙනස් වුවද, වෙනස් වුවද, ඔවුන්ගේ ස්ඵටික (දියවීම, වාෂ්පීකරණය) තුළ සහසංයුජ බන්ධන බන්ධනය කරයි, විශාල vitratoy ශක්තිය ї. එවැනි කථන අධික ද්රවාංක සහ තාපාංක උෂ්ණත්වයන්ගෙන් පොහොසත් වන අතර, අස්ථාවරත්වය ඊටත් වඩා අඩුය.
බොහෝ මූලද්රව්ය-විසි නොකරන අය සරල කථා ඉසීමක් සාදයි - allotropic වෙනස් කිරීම්. පරමාණුවල බලය ඇලෝට්රොපි ලෙස හැඳින්වේ. ඇලෝට්රොපි වෙනත් අණු ගබඩාවක් (O 2, O 3) සමඟ සහ විවිධ අංකුර ස්ඵටික සමඟ සම්බන්ධ කළ හැක. කාබන් සහ ග්රැෆයිට්, දියමන්ති, කාබයින්, ෆුලරීන් වල ඇලෝට්රොපික් වෙනස් කිරීම්. සියලුම නොවන ලෝහවල ලක්ෂණයක් වන ආධිපත්යය පෙන්වීම සඳහා, මූලද්රව්යවල ආවර්තිතා පද්ධතියේ ඒවායේ ව්යාප්තිය කෙරෙහි අවධානය යොමු කිරීම සහ බාහිර ඉලෙක්ට්රෝන බෝලයේ වින්යාසය තීරණය කිරීම අවශ්ය වේ.
කාල සීමාව තුළ:
- න්යෂ්ටියේ ආරෝපණය වැඩි වේ;
- පරමාණුවේ අරය වෙනස් වේ;
- බාහිර ගෝලයේ ඉලෙක්ට්රෝන සංඛ්යාව වැඩි වෙමින් පවතී;
- ඊ-වාණිජ්යය වර්ධනය වෙමින් පවතී;
- අධිකාරියේ ඔක්සයිඩ ශක්තිමත් වේ;
- ලෝහ නොවන බලයන් ඉහළ යනු ඇත.
ප්රධාන උප සමූහයේ:
- න්යෂ්ටියේ ආරෝපණය වැඩි වේ;
- පරමාණුවේ අරය වැඩි වේ;
- පිටත බෝලයේ ඉලෙක්ට්රෝන ගණන වෙනස් නොවේ;
- විද්යුත් සෘණ වෙනස්කම්;
- බලයේ ඔක්සයිඩ දුර්වල වීම;
- ලෝහ නොවන බලයන් දුර්වල වෙමින් පවතී.
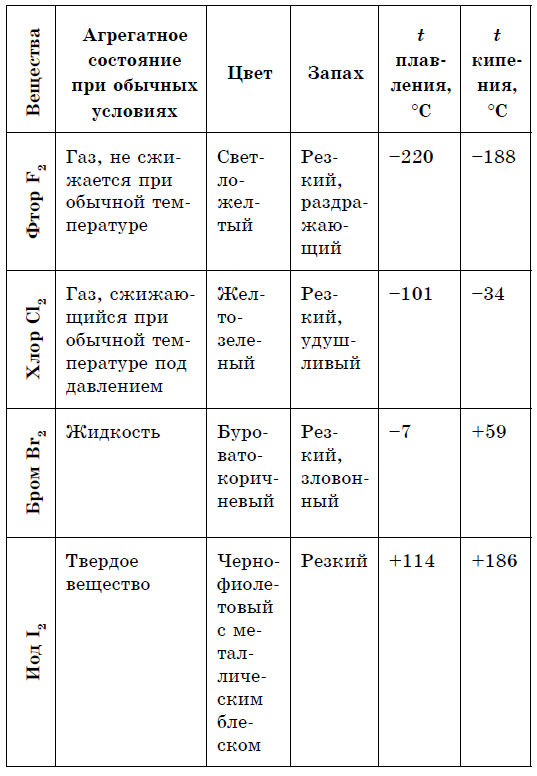
බොහෝ ලෝහ සඳහා, දුර්ලභ vinyatka (රන්, තඹ සහ deaks іnshі) සඳහා රිදී-සුදු zabarvlennia ලක්ෂණයකි. සහ සරල කථා වල අක්ෂය ලෝහ නොවන ගැමා වර්ණ, සැලකිය යුතු ලෙස වෙනස් වේ: P, Se - කහ; B - දුඹුරු; O 2 (g) - blakytnium; Si, As (හමු) - сірі; P 4 - සුදුමැලි කහ; I - ලෝහමය බැබළීමක් සහිත වයලට්-කළු; Br 2 (g) - borax දේශීය; C1 2 (d) - කහ-කොළ; F 2 (r) - සුදුමැලි කොළ; S 8 (TV) - Zhovta. ලෝහ නොවන ස්ඵටික ප්ලාස්ටික් නොවන අතර, විරූපණය සහසංයුජ බන්ධන බිඳවැටීමට හේතු වේ. ලෝහ නොවන බහුතරයක් ලෝහ දිලිසීමක් ඇති නොකරයි.

රසායනික මූලද්රව්ය 16 ක් ඇත - ලෝහ නොවන හොඳයි, එය පොහොසත් නොවේ, එය බොරු කීම වැනි, මූලද්රව්ය 114 දෘශ්යමාන වේ. විසි නොකළ මූලද්රව්ය දෙකක් පෘථිවියේ සරම්ප වලින් 76% දක්වා එකතු වේ. Tse kisen (49%) සහ සිලිකන් (27%). වායුගෝලයේ පෘථිවි පෘෂ්ඨයේ ඇඹුල් ස්කන්ධයෙන් 0.03% ක් පවතී. Nemetali රොස්ලින් ස්කන්ධයෙන් 98.5% ක්, මිනිස් සිරුරේ ස්කන්ධයෙන් 97.6% ක් බවට පත් වේ. ලෝහ නොවන C, H, O, N, S යනු ජීව සෛලවල වැදගත්ම කාබනික කථාව සෑදෙන ජෛවජනක මූලද්රව්ය වේ: ප්රෝටීන, මේද, කාබෝහයිඩ්රේට්, න්යෂ්ටික අම්ල. නැවත ගබඩාව තෙක්, mi dihaєmo ලෙස, එය ඇතුල් වීම පහසුය කඩා වැටෙන කතා, ලෝහ නොවන මූලද්රව්ය මගින් ද විසුරුවා හරිනු ලැබේ (ඔක්සිජන් O 2, නයිට්රජන් N 2, කාබන් ඩයොක්සයිඩ් CO 2, ජල වාෂ්ප H 2 O සහ in.)
සරල කථා වල බලයේ ඔක්සයිඩ - ලෝහ නොවන
ලෝහ නොවන පරමාණු සඳහා සහ පසුව, ඔවුන් විසින් සරල කථන ආලෝකමත් කිරීම සඳහා, එය ලක්ෂණයකි. ඔක්සිකරණය, ඉතින් අයි ආශ්වාදජනකබලය.
1. ලෝහ නොවන බල ඔක්සයිඩපළමු පේළියේ දිස්වේ ලෝහ සමඟ ඔවුන්ගේ අන්තර්ක්රියා සමඟ(Metali zavzhdi vodnovniki):

ක්ලෝරීන් Cl 2 හි ඔක්සිකරණ බලය ප්රබලයි, sirka හි අඩුයි, එම ලෝහයට Fe, +2 සහ +3 ඔක්සිකරණ අවධියේ එකම ගොයම් ගහක තිබිය හැකි අතර, එය ඉහළ ඔක්සිකරණ අවධියකට ඔක්සිකරණය වේ.
1. බොහෝ ලෝහ නොවන ඒවා පෙන්වයි බල ඔක්සයිඩ ජලය සමඟ අන්තර් ක්රියා කරන විට. එහි ප්රතිඵලයක් වශයෙන්, පියාඹන ජල පැළ පිහිටුවා ඇත.
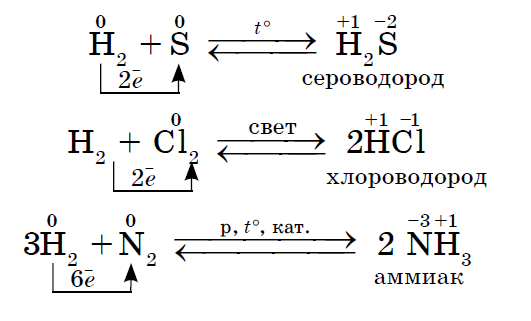
2. කිසියම් ලෝහයක් මෙම ලෝහ නොවන ද්රව්ය සමඟ ප්රතික්රියා වලදී ඔක්සිකාරක කාරකයක් ලෙස ක්රියා කරන්නේද, එයට විද්යුත් සෘණතාවේ වඩා අඩු අගයක් තිබිය හැක:
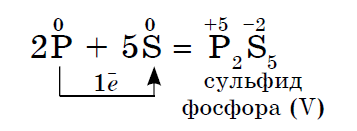
සර්කාහි විද්යුත් සෘණතාව වැඩි, පොස්පරස් අඩු බැවින් එය බලයේ ඔක්සයිඩ පෙන්වයි.
ෆ්ලෝරීන් වල විද්යුත් සෘණතාවය වැඩි, අනෙකුත් සියලුම රසායනික මූලද්රව්යවල අඩු, එම vin ඔක්සිකාරක කාරකයේ බලය පෙන්නුම් කරයි. ෆ්ලෝරීන් F 2 යනු ලෝහ නොවන අතර ප්රබලතම ඔක්සිකාරක කාරකය වන අතර ප්රතික්රියා වලදී ඔක්සිකාරක බලය පමණක් ප්රදර්ශනය කරයි.
3. ලෝහ නොවන බලයේ ඔක්සයිඩ සමහර නැමීමේ කථා සමඟ ප්රතික්රියා වලදී පෙන්වයි.
නැමීමේ කථා සමඟ ප්රතික්රියා වලදී ලෝහ නොවන ආම්ලිකතාවයේ බලය ඔක්සිකරණය කිරීමේ පළමු පේළියේ සැලකිය යුතු ලෙස:
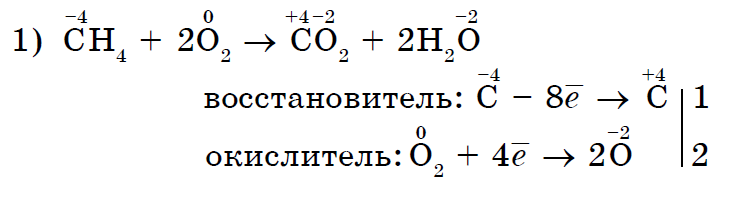
kisen පමණක් නොව, අනෙකුත් නොවන විසි කරන්නන් ද නැමිය හැකි කථනය සමඟ ප්රතික්රියා වලදී ඔක්සිකාරක කාරක විය හැක.- අකාබනික (1, 2) සහ කාබනික (3, 4):
ප්රබල ඔක්සිකාරක ක්ලෝරීන් Cl 2 සේලයින් ක්ලෝරයිඩ් (II) සේලයින් ක්ලෝරයිඩ් (III) දක්වා ඔක්සිකරණය කරයි;
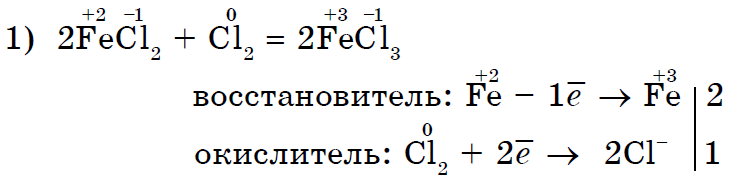
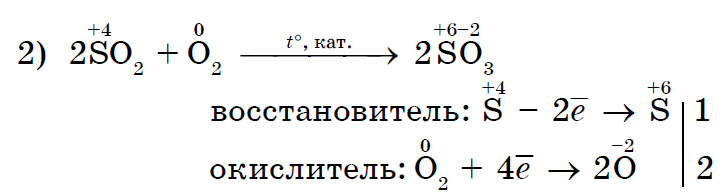
ක්ලෝරීන් Cl 2 ශක්තිමත් ඔක්සිකාරක කාරකයක් ලෙස අයඩීන් I 2 පොටෑසියම් අයඩයිඩ් වලට සමාන වේ;
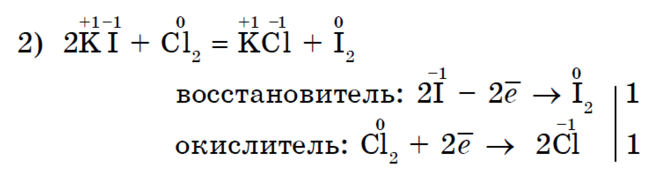
මීතේන් වලට හැලජනනය වීම ඇල්කේන සඳහා සාමාන්ය ප්රතික්රියාවකි;
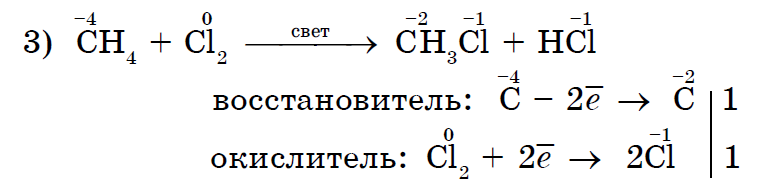
නොපවතින spoluchy කිරීමට Yakіsnoy ප්රතිචාරය є znebarvlennya ඔවුන් බ්රෝමීන් ජලය.
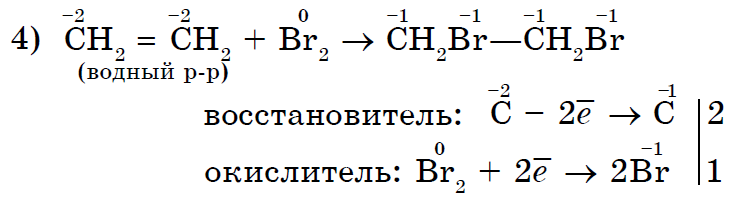
සරල කථා වල බලය පිළිබඳ අවබෝධය - ලෝහ නොවන
බලන විට ලෝහ නොවන ප්රතික්රියා එකින් එක, නමුත් ඒවායේ විද්යුත් සෘණතාවයේ අගයෙහි පහත වැටීම තුළ, ඔවුන්ගෙන් එක් අයෙකු ඔක්සිකාරක නියෝජිතයාගේ බලය පෙන්නුම් කරයි, සහ අනෙක් - නියෝජිතයාගේ බලය.
1. ෆ්ලෝරීන් හැඳින්වීමට අනුව, සෑම කෙනෙකුම විසි කළේ නැත (navit kisen) ඔවුන් අධිකාරී බලය පෙන්නුම් කරයි.
2. සාධාරණ ලෙස, ලෝහ නොවන, ක්රීම් සිට ෆ්ලෝරීන්, ඇඹුල් සමග අන්තර්ක්රියා අඩු කිරීමේ නියෝජිතයන් ලෙස සේවය කරයි.

ප්රතික්රියාවල ප්රතිඵලයක් ලෙස, ඒවා ස්ථාපිත කර ඇත ලෝහ නොවන ඔක්සයිඩ්: ලුණු නොවන සහ ලුණු සෑදීමේ අම්ල. මට ඇඹුලෙන් තොර හැලජන් අවශ්යයි, ඒවායේ ඔක්සයිඩවල: Cl 2 +1 O -2, Cl 2 +4 O 2 -2, Cl 2 +7 O 7 -2, Br 2 +1 O -2, Br +4 O 2 -2, I 2 +5 O 5 -2, i in., yakі වක්ර මාර්ගයක් ගන්න.
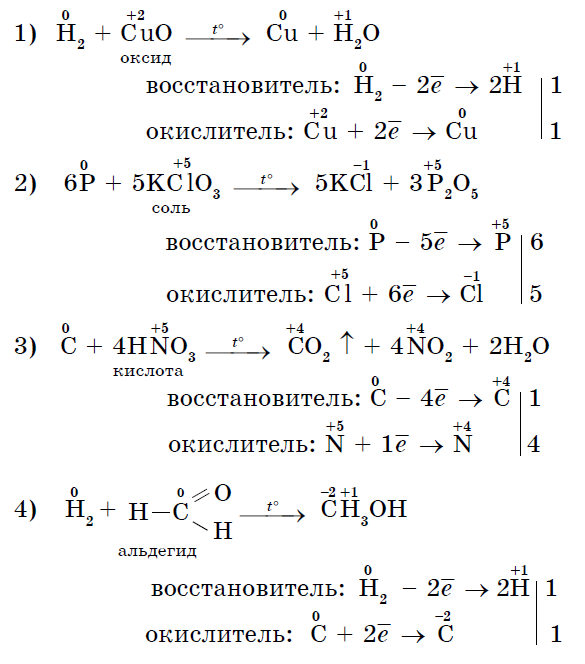
3. බගාටෝ විසි නොකරන අයට නැමිය හැකි කථනය සමඟ ප්රතික්රියා වලදී මාර්ගෝපදේශයක් ලෙස ක්රියා කළ හැකිය - ඔක්සිකාරක:
Іsnuyut සහ එවැනි ප්රතික්රියා, එක් හා එකම ලෝහ නොවන එකවර ඔක්සිකරණය වන අතර, vodnovnik. ස්වයං-ඔක්සිකරණ-ස්වයං-අලුත් කිරීමේ ප්රතික්රියා (අසමානතාවය):
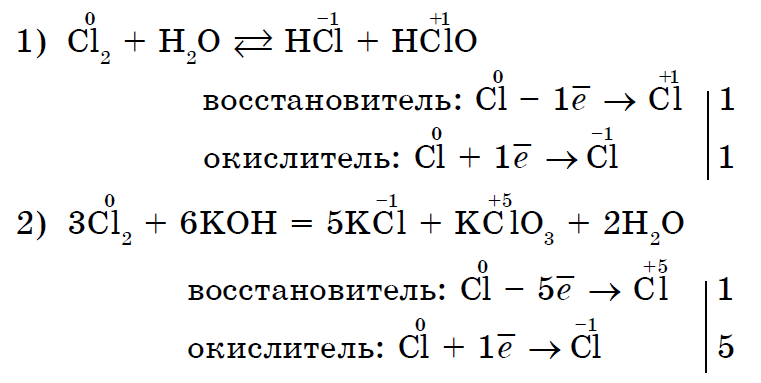
මේ ආකාරයෙන්, බොහෝ ලෝහ නොවන ඒවාට ක්රියා කළ හැකිය රසායනික ප්රතික්රියාඔක්සිකාරක කාරකයක භූමිකාව සහ නායකයෙකුගේ භූමිකාව යන දෙකම (බලපෑම බලය ෆ්ලෝරීන් F 2 සඳහා පමණක් සම්බන්ධ නොවේ).
ජලය මත පදනම් නොවන ලෝහ
vіdmіnu vіd metalіv nemetali utvoryuyut ගෑස් වැනි ජලය spoluki මත. ලෝහ නොවන ඔක්සිකරණ අවධියේ තැන්පත් කිරීමට Їx ගබඩාව.
RH 4 → RH 3 → H 2 R → HR
ලෝහ නොවන සියලුම පූජනීය බලය є ගිම්හාන ජල විභේදනය z'єdnan, බොහෝ අවස්ථාවලදී, ලෝහ නොවන ලෝහවල ඔක්සිකරණ මට්ටම අඩු විය හැක. කථන සූත්ර අතර, එය නිශ්ශබ්දතාවය, ආධිපත්යය, zastosuvannya සහ otrimannya vyvchali පොහොසත් වේ: CH 4, NH 3, H 2 O, H 2 S, HCl.
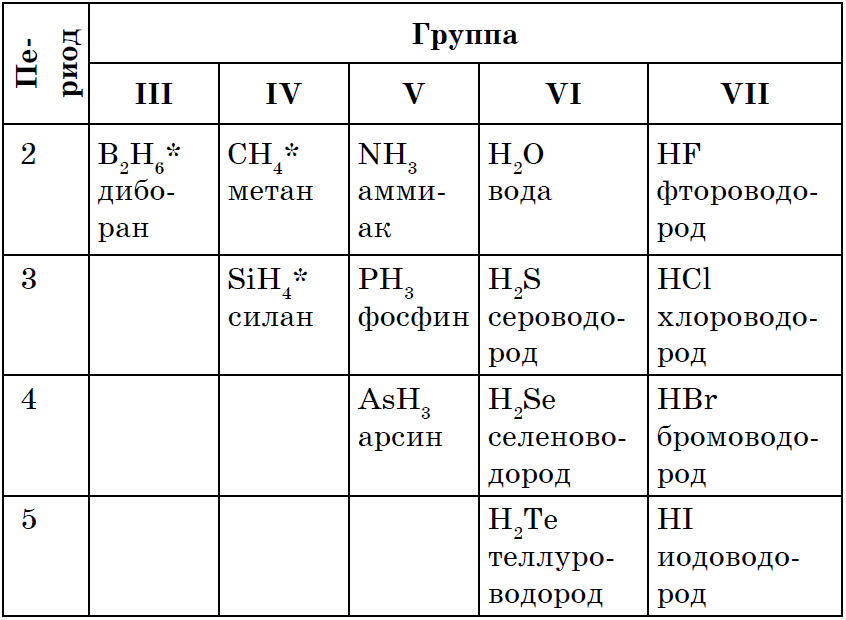
Vіdomo, scho වඩාත් සරලව qі spoluky මැද තොරව ගත හැක ජලය සමඟ ලෝහ නොවන අන්තර්ක්රියා, ටොබ්ටෝ සංශ්ලේෂණය:
![]()
ලෝහ නොවන සියලුම ජලය සහසංයුජ ධ්රැවීය බන්ධනවල අන්තර්ගත වේ; ජල z'ednan ලෝහ නොවන සඳහා, එය ජලයට සැකසීමේ වෙනසෙහි ලක්ෂණයකි. එහි ඇති මීතේන් සහ සිලේන් ප්රායෝගිකව වෙන්කර හඳුනාගත නොහැක. ඇමෝනියා ජලයේ දිය කළ විට, එය NH 3 H 2 O හි දුර්වල පදනමක් දිය කරයි. ජලයේ දිය කළ විට, හයිඩ්රජන් සෙලිනයිඩ්, හයිඩ්රජන් ටෙලුරයිඩ් සහ හයිඩ්රජන් හේලයිඩ, අම්ල එකම සූත්රය සමඟ දිය වේ, ඒවා ජලයම වේ: H 2 S, H 2 Se, H 2 Te, HF, HCl, HBr, HI.
ජලයේ අම්ල-පාදක බලය සමතුලිත කිරීම සඳහා, එක් කාල පරිච්ඡේදයක ලෝහ නොවන ලෝහ මගින් නිරවුල් කිරීම සඳහා, උදාහරණයක් ලෙස, තවත් (NH 3, H 2 O, HF) හෝ තෙවන (PH 3, H 2 S, HCl), එවිට ඔබට ශක්තිමත් ආම්ලික ආධිපත්යය පිළිබඳ නීතිය ගැන wisps කළ හැකිය i, vіdpovіdno, දුර්වල වූ මූලික ඒවා. මෙය පැහැදිලිවම ධ්රැවීයතාව වැඩි වීම නිසාය zv'azku E-N(De E යනු ලෝහ නොවන)
එක් උප කාණ්ඩයක ජලය මත පදනම් වූ ලෝහ නොවන අම්ල-පාදක බලය ද අභියෝගයට ලක් වේ. උදාහරණයක් ලෙස, හයිඩ්රජන් හේලයිඩ මාලාවේ HF, HCl, HBr, HI, බන්ධනය වැඩි වන නිසා E-H බන්ධනයේ තීව්රතාවය වෙනස් වේ. විවිධ මට්ටම්වලදී, HCl, HBr, HI ප්රායෝගිකව වැඩි වශයෙන් විඝටනය වේ - ශක්තිමත්ම අම්ල, සහ ඒවායේ ශක්තිය HF සිට HI දක්වා වැඩි වේ. තවත් එක් සාධකයක් සමඟ සම්බන්ධ වන දුර්වල අම්ල වලට HF එකතු කළ විට - අන්තර් අණුක අන්තර්ක්රියා, ජල බන්ධන පිහිටුවීම ... HF ... HF .... ජල පරමාණු ෆ්ලෝරීන් පරමාණු F සමඟ බැඳී ඇත එහි අණු පමණක් නොවේ. , නමුත් සහ අධිකරණමය.
Uzagalnyuyuchi සමාන ලක්ෂණයලෝහ නොවන ජලයේ අම්ල-පාදක බලතල, zrobimo vysnovkas මෙම කථා වල ආම්ලික සහ දුර්වල වූ මූලික බලයන් ශක්තිමත් කිරීම සහ වැඩි පරමාණුක ක්රමාංකවල ප්රධාන උප කාණ්ඩ ututvoryut їх මූලද්රව්ය.
රසායනික මූලද්රව්යවල PS හි කාලසීමාව තුළ, මූලද්රව්යයේ අනුක්රමික අංකය වැඩි වීම - ලෝහ නොවන, ජල බලාගාරයේ ආම්ලික ස්වභාවය වැඩි කරයි.
SiH 4 → PH 3 → H 2 S → HCl
Krіm බලධාරීන් දෙස බැලුවා, ඔක්සයිඩ්-ජල ප්රතික්රියා වල ලෝහ නොවන අඩකින් ජලය සෑම විටම නායකයින්ගේ බලය පෙන්නුම් කරයි, ඒවායේ ඇති ලෝහ නොවන ඒවාට අඩු ඔක්සිකරණයක් තිබිය හැකි වුවද.
ගංවතුර
ජල - හිස මූලද්රව්යයමුළු ලෝකයම. බොහෝ විශ්වීය වස්තූන් (ගෑස් අඳුරු, සූර්යයා ඇතුළු තරු) අඩකට වඩා ජලයට එකතු වේ. වායුගෝලය, ජලගෝලය සහ ලිතෝස්පියර් ඇතුළු පෘථිවියේ 0.88% ක් පමණි. බරින් ඇලස්, සහ ජලයේ පරමාණුක බර ඊටත් වඩා කුඩා වේ. එමනිසා, යෝග කුඩා ප්රමාණයක් පමණක් අත්හැර දමා ඇති අතර, පෘථිවියේ පරමාණු 100 ක සමෙන් 17 - ජල පරමාණුවකි.
නිදහස් කඳවුරක, H 2 අණු, පරමාණු අණුවකට බැඳී ඇති දර්ශනයේ ජලය දක්නට ලැබේ. සහසංයුජ ධ්රැවීය නොවන බන්ධනය.
Voden (H 2) යනු වියළි වායු වැනි ගංගා වලින් සැහැල්ලු වායුවයි. මට තාප සන්නායකතාවය ලබා ගැනීමට සහ තාපාංකය (හීලියම් පසු) අඩු කිරීමට ඉඩ දෙන්න. ජලයේ තරමක් දිය වේ. -252.8 ° C උෂ්ණත්වයකදී සහ වායුගෝලීය පීඩනයකදී ජලය දුර්ලභ තත්වයකට ගමන් කරයි.
1. ජල අණුවක් දැනටමත් mіtsna වේ, කොල්ලකෑමට її දේ අක්රිය:
H 2 \u003d 2H - 432 kJ
2. අධික උෂ්ණත්වවලදී, ජලය ක්රියාකාරී ලෝහ සමඟ ප්රතික්රියා කරයි:
Ca + H 2 \u003d CaH 2,
කැල්සියම් හයිඩ්රයිඩ් නිවාදැමීම, i z F 2, හයිඩ්රජන් ෆ්ලෝරයිඩ් නිවාදැමීම:
F 2 + H 2 \u003d 2HF
3. කවදාද ඉහළ උෂ්ණත්වයන් ඇමෝනියා ඉවත් කරන්න:
N 2 + 3H 2 \u003d 2NH 3
සහ ටයිටේනියම් හයිඩ්රයිඩ් (කුඩු වල ලෝහ):
Ti + H 2 \u003d TiH 2
4. විට podpalyuvanni ජලය ඇඹුල් සමඟ ප්රතික්රියා කරයි:
2H 2 + O 2 \u003d 2H 2 O + 484 kJ
5. Voden volodіy vіdnovlyuvalnoyu zdatnist:
CuO + H 2 \u003d Cu + H 2 O
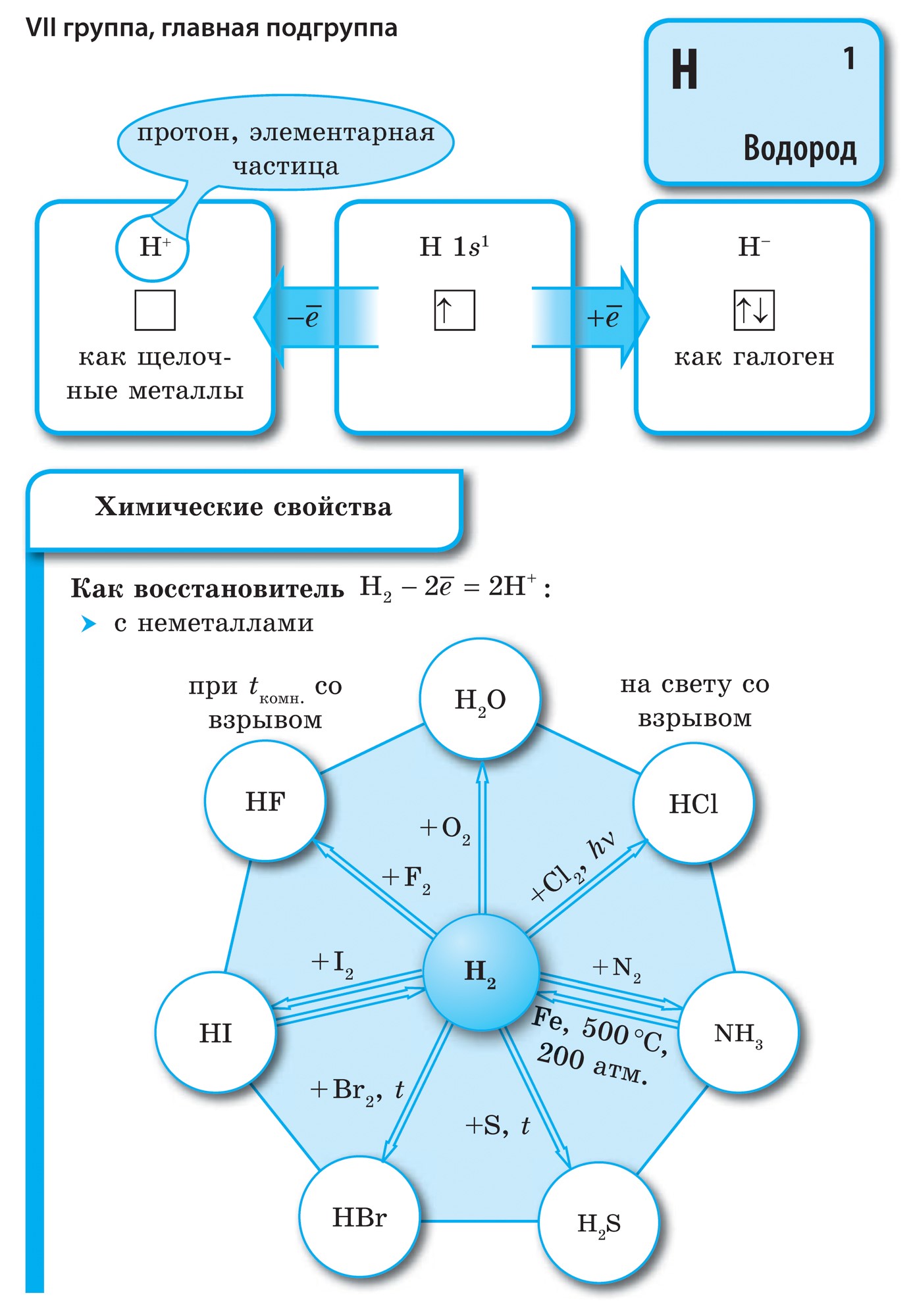

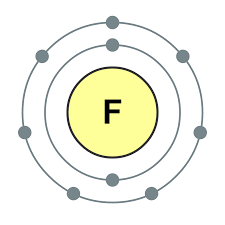
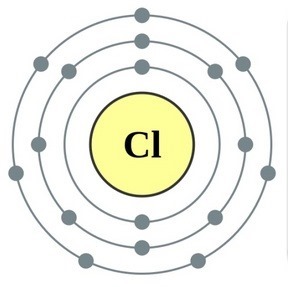
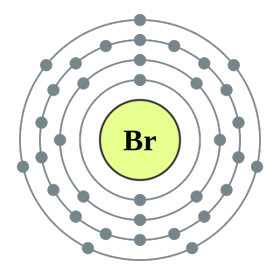
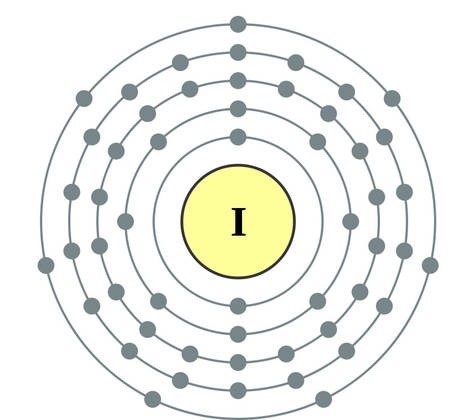
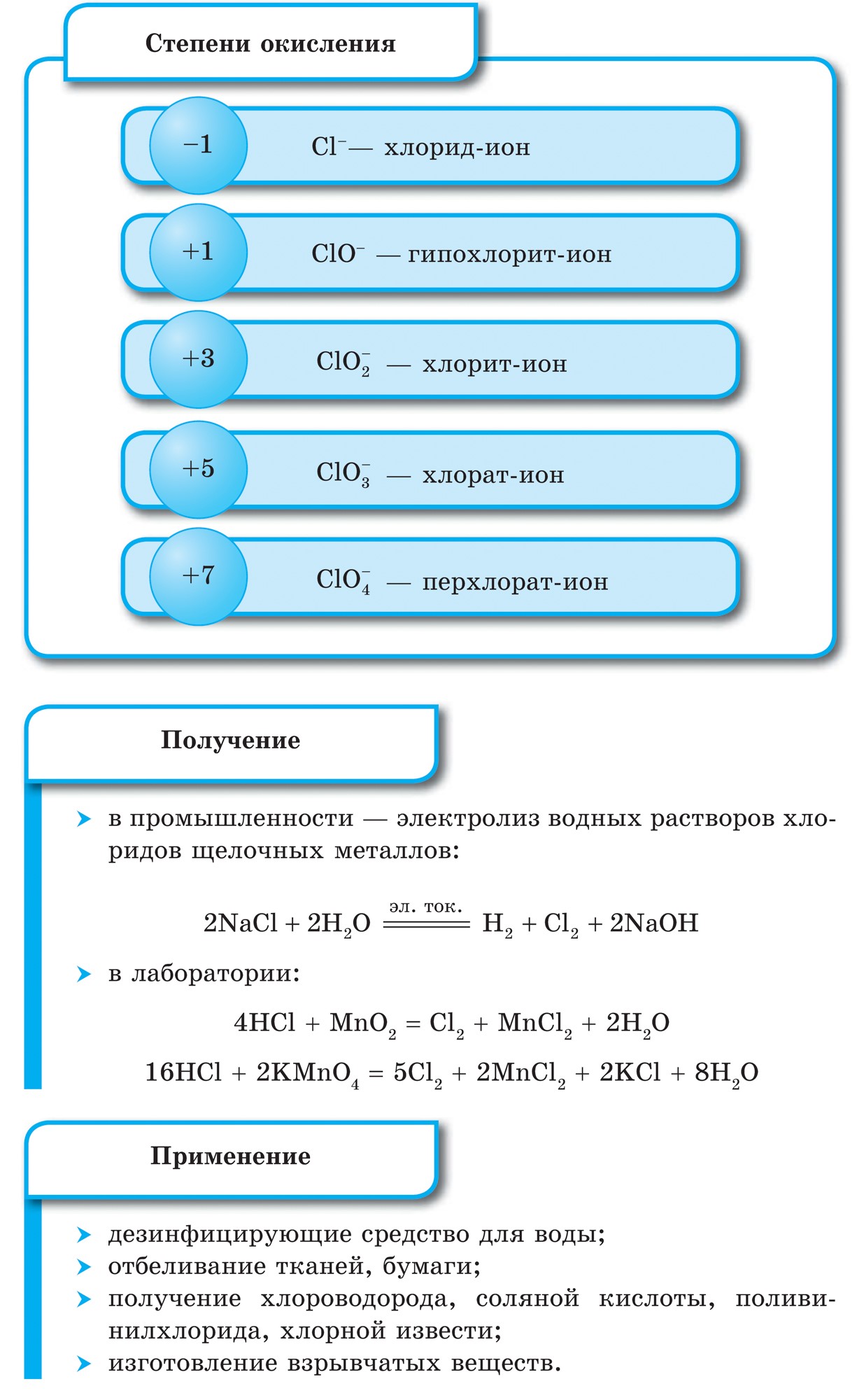
ආවර්තිතා පද්ධතියේ VII කාණ්ඩයේ ප්රධාන උප සමූහයේ මූලද්රව්ය, පොදු නාමය යටතේ ඒකාබද්ධ වේ හලෝ, ෆ්ලෝරීන් (F), ක්ලෝරීන් (Cl), බ්රෝමීන් (BG), අයඩීන් (I), astatine (At) (ස්වභාවධර්මයේ කලාතුරකින් දැකිය හැකි) - සාමාන්ය ලෝහ නොවන. Tse i zrozumilo, පළිගැනීමට їx පරමාණුව පවා සිම් ඉලෙක්ට්රොනික උපකරණවල බාහිර ශක්ති මට්ටම මත, මට යෝග සම්පූර්ණ කිරීමට එක් ඉලෙක්ට්රෝනයක් පමණක් මග හැරී ඇත. මෙම මූලද්රව්යවල පරමාණු, ලෝහ සමඟ අන්තර්ක්රියා කරන විට, ලෝහවල පරමාණු ලෙස ඉලෙක්ට්රෝනයක් ගනී. මෙම වයින් සමඟ අයනික සම්බන්ධකය සහ ලවණ නිරාකරණය වේ. Zvіdsi zagalna නම "halogeni", එනම් "Narodzhuyut ලුණු".
ඊටත් වඩා ශක්තිමත් ඔක්සිකාරක. රසායනික ප්රතික්රියා වලදී ෆ්ලෝරීන් ඔක්සිකරණ බලය පමණක් පෙන්වන අතර එය ඔක්සිකරණ අදියර -1 මගින් සංලක්ෂිත වේ. Reshta halogens වැඩි විද්යුත් සෘණ මූලද්රව්ය සමඟ අන්තර්ක්රියා කරන විට සැලකිය යුතු ආධිපත්යයක් පෙන්විය හැකිය - ෆ්ලෝරීන්, අම්ලය, නයිට්රජන්, ඒවායේ ඔක්සිකරණ අවධියේදීම +1, +3, +5, +7 අගය ලබා ගත හැක. හැලජන් වල බලයේ ආධිපත්යය ක්ලෝරීන් සිට අයඩින් දක්වා වැඩි වන අතර එය ඒවායේ පරමාණුවල අරය වැඩි වීම හා සම්බන්ධ වේ: ක්ලෝරීන් වල පරමාණු ආසන්න වශයෙන් දෙගුණයක් කුඩා වන අතර අයඩින් අඩුය.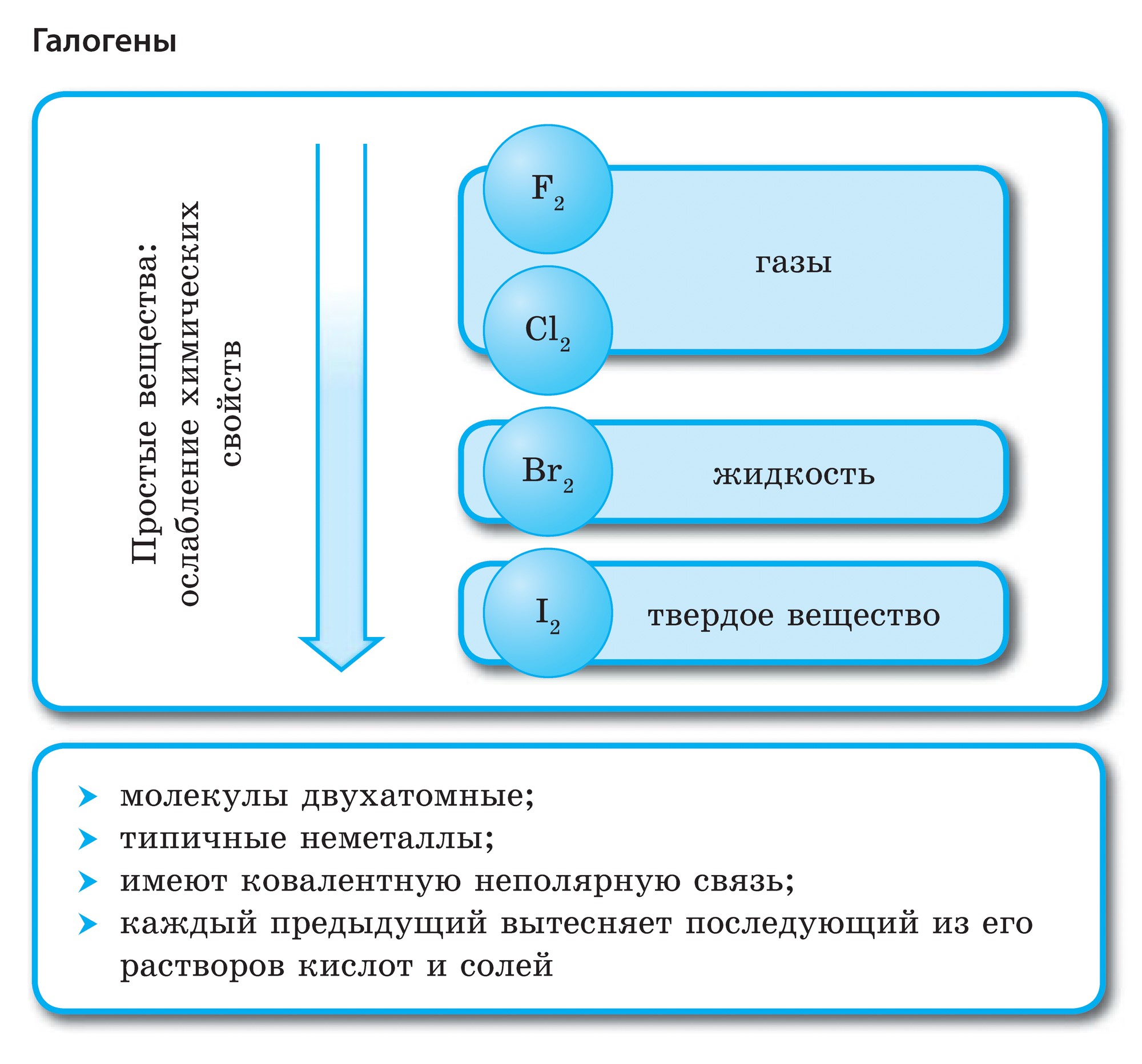
හැලජන් - කථා පමණි
සියලුම හැලජන් පරමාණු අතර සහසංයුජ ධ්රැවීය නොවන රසායනික බන්ධනයක් සහිත ද්වි පරමාණුක අණු ආකාරයෙන් නිදහස් තත්වයක දක්නට ලැබේ. ඝන වානේ F 2, Cl 2, Br 2, I 2 අණුක ස්ඵටික දැලිස්, එය їх මගින් තහවුරු වේ භෞතික බලයන්.
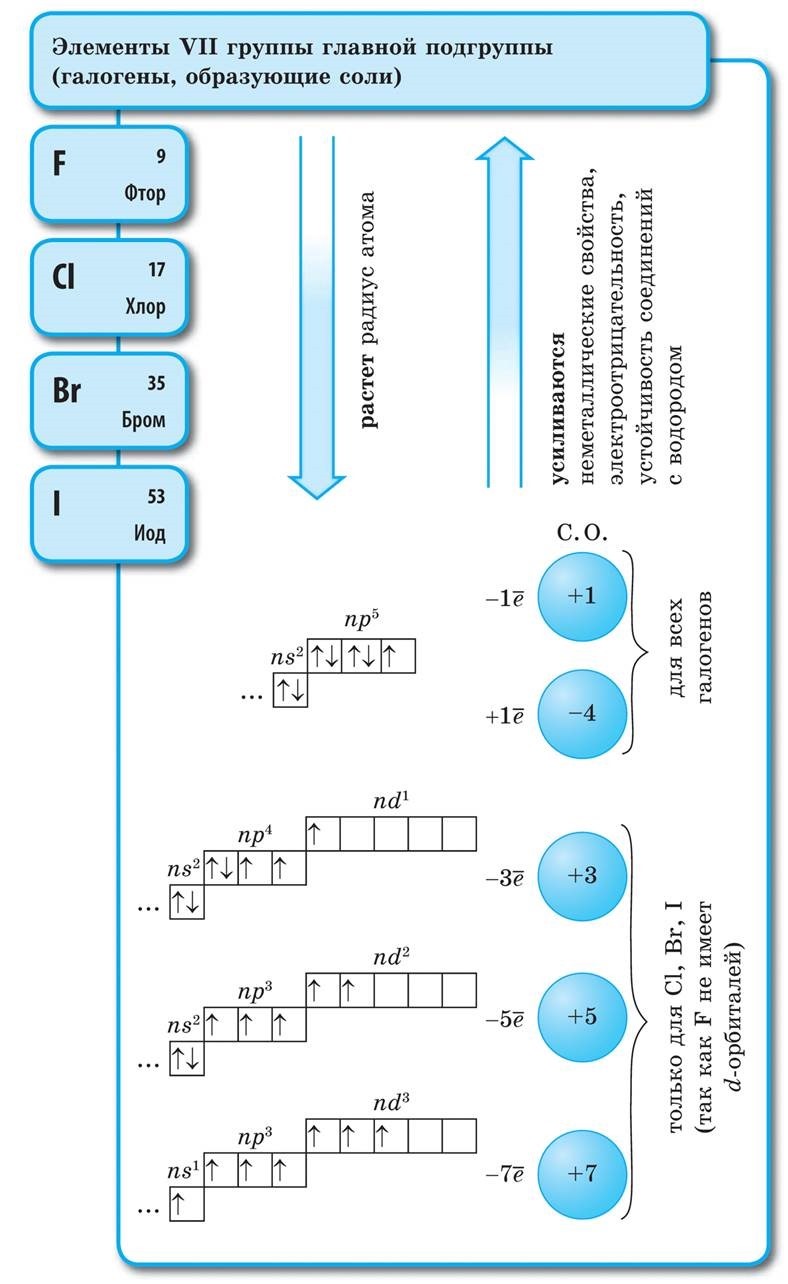
ද්රවාංක හා තාපාංක ස්ථානවල හැලජන වැඩි අණුක ස්කන්ධ සමඟ, ඔවුන් චලනය, ශක්තිය වැඩි: බ්රෝමීන් - rіdina, අයඩීන් - ඝන කථාව, ෆ්ලෝරීන් සහ ක්ලෝරීන් - වායු. මෙයට හේතුව හැලජන් වල පරමාණු සහ අණු ප්රසාරණය වීමත් සමඟ ඒවා අතර අන්තර් අණුක අන්තර්ක්රියා බලය වැඩි වීමයි. F 2 සිට I 2 දක්වා වූ අවස්ථාවක, හැලජන් දූෂණයේ තීව්රතාවය වැඩි වේ.
ෆ්ලෝරීන් සිට අයඩින් දක්වා ලෝහ නොවන හැලජන් වල රසායනික ක්රියාකාරිත්වය දුර්වලයි, අයඩින් ස්ඵටිකවල ලෝහමය දිලිසීමක් ඇත. සම් හැලජන් යනු එහි කාලපරිච්ඡේදයේ ශක්තිමත්ම ඔක්සිකාරකයයි. හැලජන් වල බලයේ ඔක්සයිඩ ලෝහ සමඟ අන්තර්ක්රියා කරන විට විවිධ ආකාරවලින් ප්රකාශ වේ. එහිදී ලවණ තැන්පත් වේ. ඉතින්, ෆ්ලෝරීන් දැනටමත් වැඩි ලෝහ සමඟ ප්රතික්රියා කරන අතර, රත් වූ විට, රත්රන්, රිදී, ප්ලැටිනම්, එහි රසායනික අක්රියතාව සමඟ ප්රතික්රියා කරයි. ෆ්ලෝරීන් වායුගෝලයේ ඇලුමිනියම් සහ සින්ක් විසිරී ඇත:
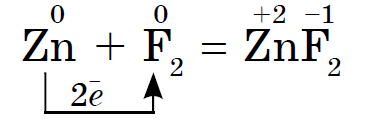
රත් වූ විට රෙෂ්ට හැලජන් ලෝහ සමඟ ප්රතික්රියා කරයි. ඉසින කුඩු රත් කර ක්ලෝරීන් සමඟ මිශ්ර වූ විට එය ද පත්තු වේ. ඩොස්විඩ් ඇන්ටිමනි සමඟ මෙන් සිදු කළ හැකිය, නමුත් තිර්සස් ඉදිරිපස පුරවා ඇත්නම් පමණක්, එය ආදාන හැන්දකින් එය උරා ගැනීම අවශ්ය වේ, එවිට අපට එය කුඩා කොටස් වලින් ක්ලෝරීන් සහිත නළයකට කාන්දු කළ හැකිය. ක්ලෝරීන් ප්රබල ඔක්සිකාරක කාරකයක් බැවින් ප්රතික්රියාවේ ප්රතිඵලයක් ලෙස ක්ලෝරයිඩ් (III) ද්රාවණය වේ.
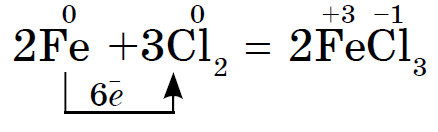
බ්රෝමීන් යුගල වශයෙන් පුළුස්සා පුලුස්සන ලද medniy drіt:
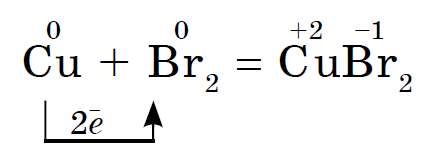
අයඩින් වැඩි ලෝහ ඔක්සිකරණය කරයි, ජලය ඉදිරියේ Ale, උත්ප්රේරකයක් ලෙස, ඇලුමිනියම් කුඩු සමඟ අයඩින් ප්රතික්රියාව පවා ඝෝෂාකාරී ලෙස ඉදිරියට යයි:
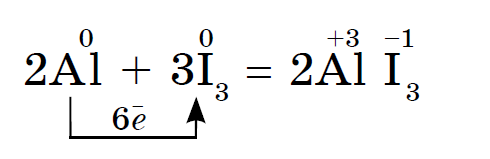
ප්රතික්රියාව අයඩින් වල වයලට් වාෂ්ප දැකීම සමඟ ඇත.
ඔක්සිකරණය වෙනස් කිරීම සහ ෆ්ලෝරීන් සිට අයඩින් දක්වා හැලජන් වල බලය වැඩි කිරීම ගැන ලවණවලින් එකක් ගැනීමට ඔවුන්ගේ ගොඩනැඟීමේ හැකියාවෙන් විනිශ්චය කළ හැකිය, තවද ඔවුන් ජලය සමඟ අන්තර් ක්රියා කරන විටද එය ප්රකාශ වේ. Rivnyanya tsієї ප්රතික්රියා මෙවැනි අවලාදයකින් ලිවිය හැකිය:
ෆ්ලෝරීන් ඕනෑම මනසක කම්පනයකින් ජලය සමඟ අන්තර්ක්රියා කරන්නා සේම, සෘජු නිදිබර ආලෝකයෙන් සන්සුන් වූ විට හෝ මඟ හැරුණු විට ජලය සමඟ ක්ලෝරීන් අඩුවෙන් ප්රතික්රියා කරයි, බ්රෝමීන් රත් වූ විට සහ කම්පනයකින් තොරව ජලය සමඟ අන්තර් ක්රියා කරයි. ප්රතික්රියා බාහිර තාප වේ. ජලය සමඟ අයඩින් ප්රතික්රියාව දුර්වල අන්තරාසර්ග වේ, එය රත් වූ විට සාමාන්යයෙන් ඉදිරියට යයි.
මෙම ප්රතික්රියා වල ප්රතිඵලයක් ලෙස හයිඩ්රජන් ෆ්ලෝරයිඩ් HF, ක්ලෝරීන් ජලය HCl, හයිඩ්රජන් බ්රෝමයිඩ් HBr සහ හයිඩ්රජන් අයඩයිඩ් HI ද්රාවණය වේ.
වගු වල ක්ලෝරීන් වල රසායනික ආධිපත්යය

හැලජන් ආනයනය කිරීම
ෆ්ලෝරීන් සහ ක්ලෝරීන් ඒවායේ ලවණ උණු කිරීම හෝ විසුරුවා හැරීමේ විද්යුත් විච්ඡේදනය මගින් ඉවත් කරනු ලැබේ. උදාහරණයක් ලෙස, සෝඩියම් ක්ලෝරයිඩ් දියවීම විද්යුත් විච්ඡේදනය කිරීමේ ක්රියාවලිය සැසඳිය හැක:
විද්යුත් විච්ඡේදනය මගින් ක්ලෝරීන් ඉවත් කරන විට, සෝඩියම් ක්ලෝරයිඩ් සහ ක්ලෝරීන් අතර වෙනස ද ජලයේ සහ සෝඩියම් හයිඩ්රොක්සයිඩ්වල දිය වේ:
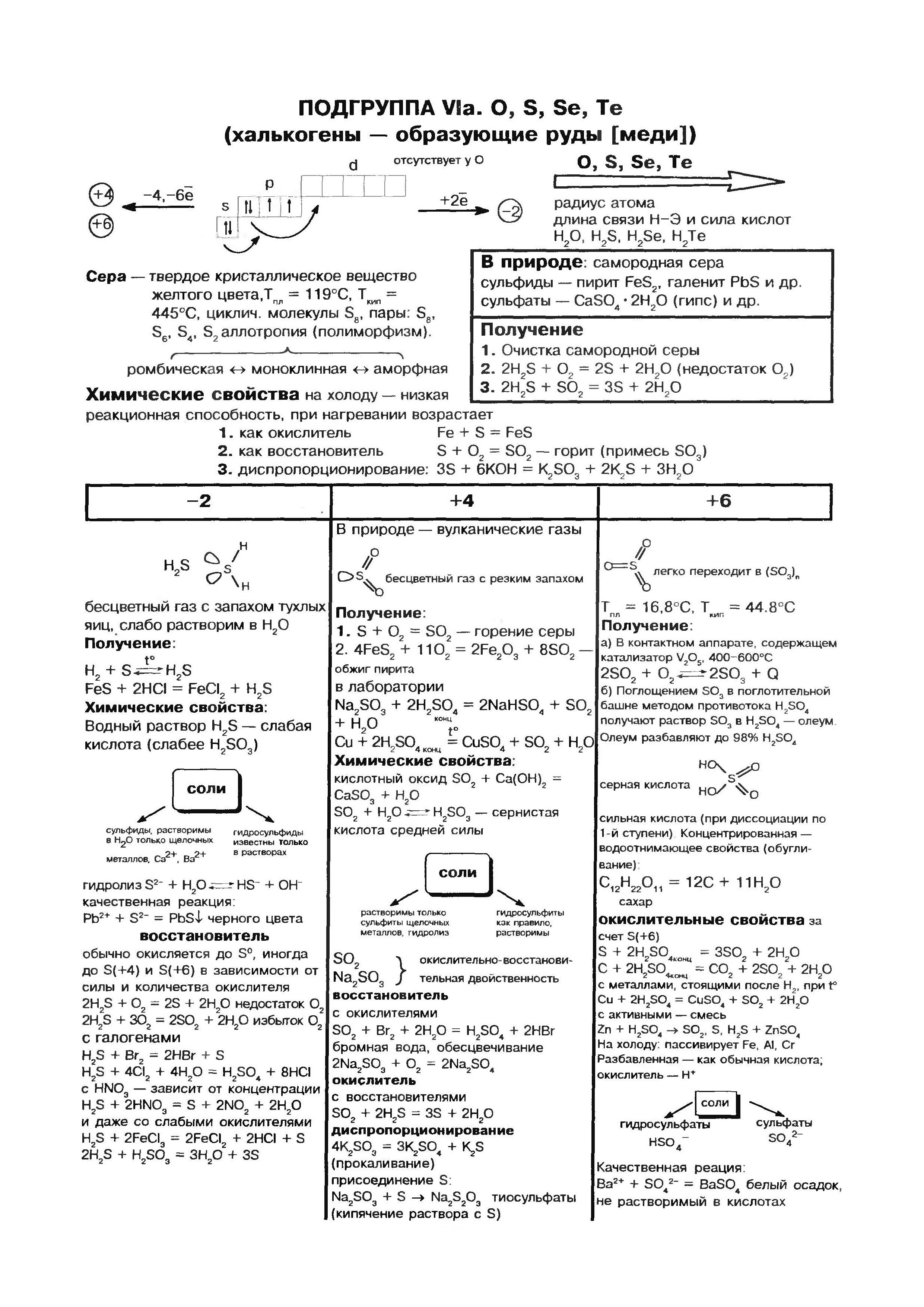
කිසන් (ඔහ්)- ආවර්තිතා මූලද්රව්ය පද්ධතියේ VI කාණ්ඩයේ ප්රධාන උප සමූහයේ මුතුන් මිත්තන්. මූලද්රව්ය tsієї pіdgrupi - kisen O, sіrka S, selenium Se, telurium Ti, polonіy Rho - පොදු නමක් තිබිය හැක "chalcogen", එනම් "ජනතාව රුඩි" යන්නයි.
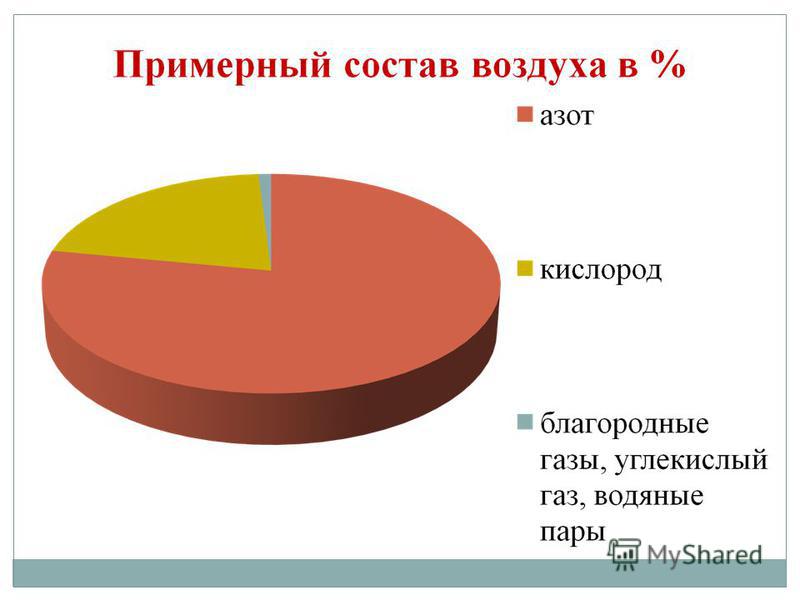
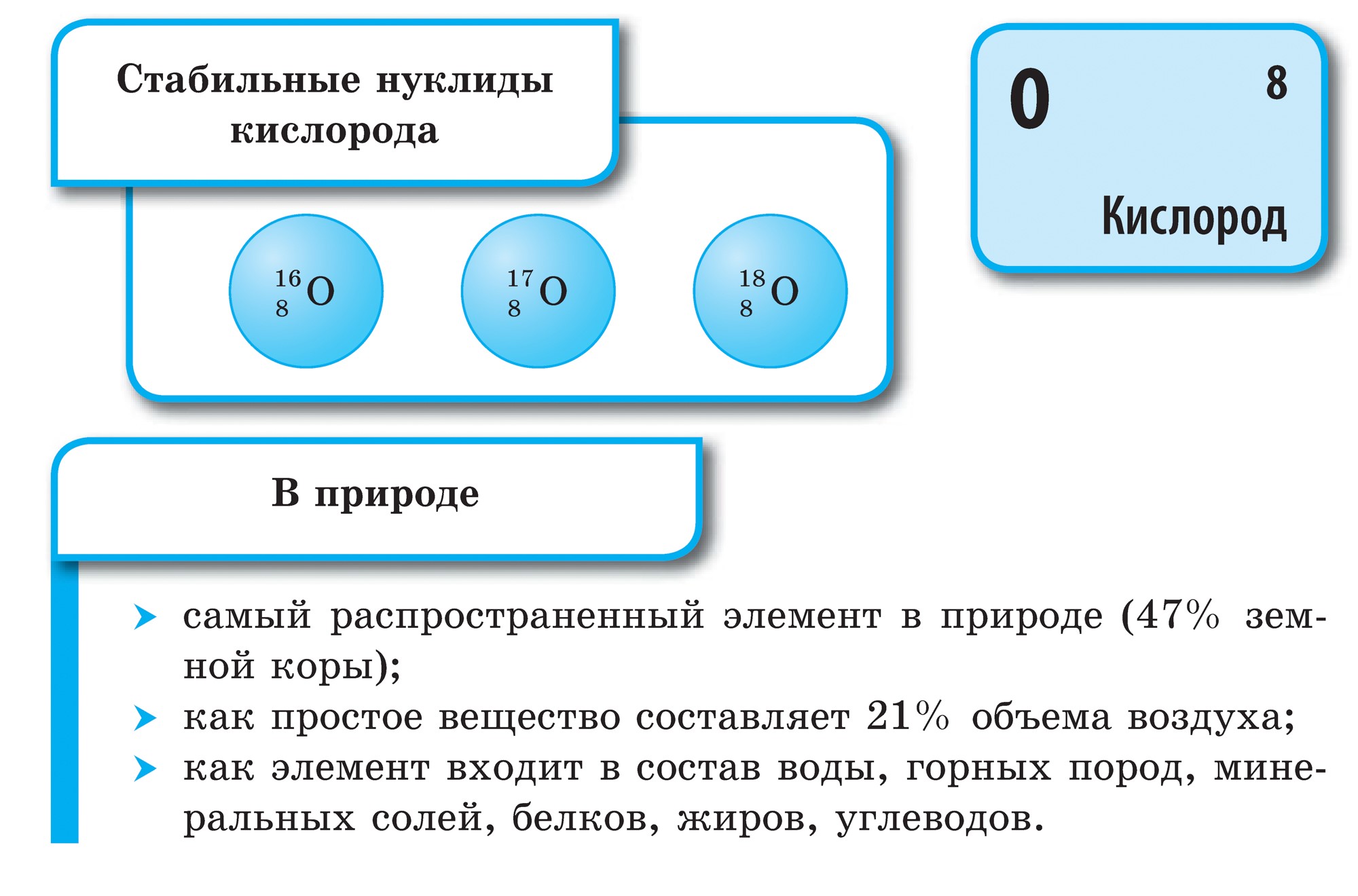
Kisen යනු අපගේ ග්රහලෝකයේ ඇති පුළුල්ම මූලද්රව්යය වේ. Vіn ජල ගබඩාවට ඇතුල් වේ (88.9%), නමුත් එය පෘථිවි හරයේ මතුපිටින් 2/3 ක් ආවරණය කරයි, එහි ජල කවචය - ජලගෝලය නිර්මාණය කරයි. Kisen - ජීවිතය සඳහා අර්ථයන් සඳහා kіlkіstyu සහ persha සඳහා මිතුරෙකි ගබඩා කොටසපෘථිවි කවචයේ මතුපිට වායුගෝලය වන අතර එය 21% (පරිමාව අනුව) සහ 23.15% (ස්කන්ධයෙන්) වේ. Kisen පෘථිවි සරම්ප වල දෘඩ කවචයේ සංඛ්යාත්මක ඛනිජ ලවණ ගබඩාවට ඇතුළු වේ - ලිතෝස්ෆියර්: පෘථිවි සරම්ප පරමාණු 100 ක් සමෙන්, පරමාණු 58 ක් අම්ලයේ කොටසක් මතට වැටේ.
ප්රාථමික කිසන් O2 ආකාරයෙන් පවතී. වර්ණය, සුවඳ සහ රසය නොමැතිව Tse වායුව. දුර්ලභ තත්වයක දී, ඝන - නිල් දී, ආලෝකය-blakitne zabarvlennya ඇත. ජලයේ, වායුව වැනි කිසන් බහුලව පවතින අතර නයිට්රජන් සහ ජලය අඩු වේ.
Kisen vzaєmodіє mayzhe z usima සරල කතා, හැලජන් ක්රීම්, උච්ච වායු, රන් සහ ප්ලැටිනම් ලෝහ. ඇඹුල් සහිත ලෝහ නොවන ප්රතික්රියා ඊටත් වඩා බොහෝ විට විශාල තාප ප්රමාණයක් දැකීමෙන් සිදුවන අතර පිළිස්සීම සමඟ ඇත - කන්දේ ප්රතික්රියා. උදාහරණයක් ලෙස, SO 2 ද්රාවණ සහිත ෆයර් සර්කා, පොස්පරස් - P 2 O 5 ද්රාවණ සමඟ හෝ vougillya - CO2 ද්රාවණ සමඟ. සියලුම ප්රතික්රියා බාහිර තාප විය හැක. Vignatok නයිට්රජන් සහ ඇඹුල් සමඟ සංයෝජනය වීමට: අන්තරාසර්ග ප්රතික්රියාව, එය 1200 ° C ට වැඩි උෂ්ණත්වයකදී හෝ විද්යුත් විසර්ජනයක් සමඟ ඉදිරියට යන විට:
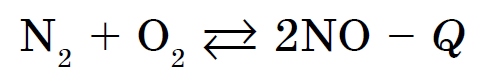
Kisen ජවසම්පන්න ලෙස ඔක්සිකරණය කරයි, සරල, අලේ සහ පොහොසත් ලෙස නැමුණු කථාව පමණක් නොව, මූලද්රව්යවල ඔක්සයිඩ විසුරුවා හරිනු ලැබේ, එවැනි දුර්ගන්ධයකින් ඒවා අවදි වේ:
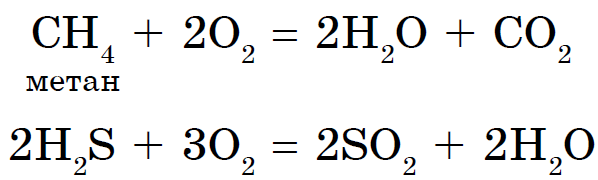
අම්ලයේ ඉහළ ඔක්සිකාරක ගොඩනැගිල්ල සියලු වර්ගවල ගිනි කන්දෙහි පදනම මත පිහිටා ඇත.
Kisen නියත උෂ්ණත්වයකදී විවිධ ගංගා සම්පූර්ණ ඔක්සිකරණය කිරීමේ ක්රියාවලීන් සඳහා සහභාගී වේ.මිනිසුන් සහ ජීවීන් හුස්ම ගැනීමේ ක්රියාවලියේදී ඇඹුල් වල කාර්යභාරය අතිශයින් වැදගත් ය. Roslini ද වායුගෝලීය kisen poglyayut. අඳුරේ වුවද, ඇඹුල් සමඟ පිනි මැටි කිරීමේ ක්රියාවලිය පමණක්, පසුව ආලෝකයේ දී, තවත් ක්රියාවලියක් සිදු වේ - ප්රභාසංශ්ලේෂණය, එහි ප්රතිඵලයක් ලෙස පිනි, කාබන් ඩයොක්සයිඩ් තෙත් වී ඇඹුල් දකියි.
කාර්මිකවාදයේ දී, දුම දුර්ලභ පුනරාවර්තනයකින් ලබා ගනී, සහ රසායනාගාරයේ - මැංගනීස් ඩයොක්සයිඩ් MnO සඳහා උත්ප්රේරකයක් ඉදිරිපිට ජල පෙරොක්සයිඩ් වෙත බෙදා හැරීමේ මාර්ගයෙන් 2 :
![]()
සහ ද පොටෑසියම් පර්මැන්ගනේට් KMnO බෙදා හැරීම 4 රත් වූ විට:
වගු වල ඇඹුල් වල රසායනික ආධිපත්යය

zastosuvannya ඇඹුල්
පැසවීම ක්රියාවලීන් වේගවත් කිරීම (තීව්ර කිරීම) සඳහා ලෝහ විද්යාත්මක හා රසායනික කර්මාන්තවලදී Kisen zastosovuyut. පිරිසිදු kisen zastosovuyt ද ඉහළ උෂ්ණත්වයන් සඳහා, උදාහරණයක් ලෙස, ගෑස් ගිනි හා ලෝහ කපා. වෛද්ය විද්යාවේදී, යම් ආකාරයක අසනීපයක් සමඟ බැඳී ඇති ටිම්චස්ගේ හුස්ම ගැනීමේ අපහසුතාවයේ රෝග ලක්ෂණ තුළ ඇඹුල් බව එකතැන පල් වේ. එසේම, kisen zastosovuyt ලෝහ විද්යාවේ රොකට් වෙඩි තැබීම සඳහා ඔක්සිකාරකයක් ලෙස, හුස්ම ගැනීම සඳහා ගුවන් ගමන් සඳහා, ලෝහ කැපීම සඳහා, ලෝහ පෙරීම සඳහා, කම්පන රොබෝවරුන් සමඟ. කිසන් 150 atm පීඩනයක් යටතේ කළු වර්ණයෙන් සාදන ලද වානේ සිලින්ඩර වලින් ගනු ලැබේ. රසායනාගාර මනසෙහි, කිසන් වීදුරු උපාංග වලින් ලබා ගනී - ගෑස්මීටරය.
පරමාණු සර්කි (එස්), ආම්ලිකතාවයේ පරමාණු සහ VI කාණ්ඩයේ ප්රධාන උප කාණ්ඩයේ අනෙකුත් සියලුම මූලද්රව්ය මෙන්, බාහිර ශක්ති මට්ටමෙන් පළිගැනීම 6 ඉලෙක්ට්රොනික උපකරණ, ඒ සඳහා යුගල නොකළ ඉලෙක්ට්රෝන දෙකක්. කෙසේ වෙතත්, ඔක්සිජන් පරමාණු සම්බන්ධයෙන් ගත් කල, සර්කා පරමාණු විශාල අරයක්, අඩු විද්යුත් සෘණ අගයක් තිබිය හැකි අතර, ඒවා ඔක්සිකරණ අවධිවල අනුපිළිවෙල තෘප්තිමත් කරමින් විශාල බලයක් පෙන්නුම් කරයි. +2, +4, +6. අඩු සෘණ මූලද්රව්ය (ජලය, ලෝහ) දක්වා වැඩි කිරීමෙන් සර්කා ඔක්සිකරණ බලය පෙන්වන අතර ඔක්සිකරණ මට්ටම වැඩි කරයි. -2 .
සර්කා - සරල කථාව
sirka සඳහා, kisnyu සඳහා මෙන්, allotropy ලක්ෂණයකි. විවිධ ගබඩාවල චක්රීය හෝ රේඛීය budovaya අණු සමඟ සර්කි Vіdomo පොහොසත් වෙනස් කිරීම.
S 8 අණු වලින් සමන්විත රොම්බික් කවයක් ලෙස හැඳින්වෙන වඩාත්ම ස්ථායී වෙනස් කිරීම. මෙම දුර්ගන්ධය ලෙමන්-කහ වර්ණයෙන් කුළු බඩු සහ මත් වන අතර, ද්රවාංකය 112.8 ° C. කාමර උෂ්ණත්වයේ දී මෙම වෙනස් කිරීම තුළ අනෙකුත් සියලුම වෙනස් කිරීම් පරිවර්තනය වේ. ස්ඵටිකීකරණයේදී, ද්රවාංකය (ස්ඵටිකයේ ප්රධාන කොටස, ද්රවාංකය 119.3 ° C) සිට මොනොක්ලිනික් සර්කා මතු වේ, පසුව අපි රොම්බික් එකක් බවට පත් කරමු. රත් වූ විට, සාම්පලවල ඇති shmatochkiv sirka දිය වී, කහ පැහැයේ නිජබිම බවට පරිවර්තනය වේ. 160 ° C ට ආසන්න උෂ්ණත්වයකදී, එය ඉක්මනින් අඳුරු වීමට පටන් ගනී, ඝන සහ දුස්ස්රාවී වේ, පරීක්ෂණ නළයෙන් පිටතට නොගැලපේ, තවදුරටත් රත් වූ විට, එය සැහැල්ලුවෙන් ගරා වැටෙන මව්බිමක් බවට පරිවර්තනය වේ, නමුත් විශාල තද දුඹුරු පැහැයක් ගනී. . Yakscho її vility in සීතල වතුර, වෝන් විනිවිද පෙනෙන රබර් ස්කන්ධයක් දුටුවේය. මුද්රාව ප්ලාස්ටික්. ඔබට නූල් පෙනුමෙන් එය ගත හැකිය. දින කිහිපයකට පසු, එය ද රොම්බික් කවයක් බවට පරිවර්තනය වනු ඇත.
Sirka ජලයෙන් වෙන් නොවේ. සර්කාවේ ස්ඵටික ජලය අසල ගිලී ඇති අතර කුඩු අක්ෂය ජල මතුපිට පාවෙයි, මන්ද සර්කාවේ වියළි ස්ඵටික ජලයෙන් මුත්රා නොකරන අතර නැවත බල්බ ගසමින් පාවෙන බැවිනි. පාවෙන ක්රියාවලිය. සර්කා එතිල් ඇල්කොහොල් සහ ඩයිතයිල් ඊතර් වල දුර්වල ලෙස ද්රාව්ය වේ, එය සල්ෆර් ගල් අඟුරු වල හොඳින් බෙදා හරිනු ලැබේ.
උතුම් සිත් ඇතිව sirka usima ටින් සහ luzhnoearth ලෝහ, මීඩි, රසදිය, රිදී සමඟ ප්රතික්රියා කරයි, උදාහරණ වශයෙන්:
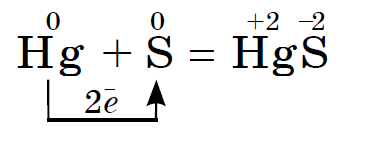
මෙම ප්රතික්රියාව ඉසින ලද රසදිය පෙනුමේ පදනම මත පිහිටා ඇත, නිදසුනක් ලෙස, කැඩුණු උෂ්ණත්වමානයකින්. දෘෂ්යමාන රසදිය බින්දු අර්කුෂ් කඩදාසි මත හෝ මධ්යම ප්ලාස්ටික් මත ලබා ගත හැක. ඒ කඩල බිව්ව ඒ රසදිය සර්කා කුඩු දාලා පොඟවන්න ඕන. මෙම ක්රියාවලිය demercurization ලෙස හැඳින්වේ.
රත් වූ විට, සර්කා වෙනත් ලෝහ (Zn, Al, Fe) සමඟ ප්රතික්රියා කරන අතර රත්රන් පමණක් කිසිදු හේතුවක් නිසා එය සමඟ අන්තර් ක්රියා නොකරයි. රත් වූ විට සමාන ප්රතික්රියාවක් සමඟ සර්කා බලයේ ඔක්සයිඩ ද ජලය සමඟ පෙන්වයි:
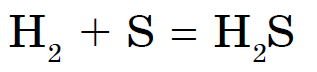
සල්ෆර් සහිත ලෝහ නොවන නයිට්රජන්, අයඩීන් සහ උච්ච වායු සමඟ පමණක් ප්රතික්රියා නොකරයි. Sirka නිල් පැහැති අර්ධ-ආලෝක පුළුස්සා, සල්ෆර් ඔක්සයිඩ් නිවාදැමීම (IV):
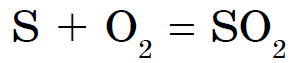
Tse z'ednannya syrchisty gas නමින් පුළුල් ලෙස ප්රසිද්ධයි.
වගු වල sirka හි රසායනික ආධිපත්යය
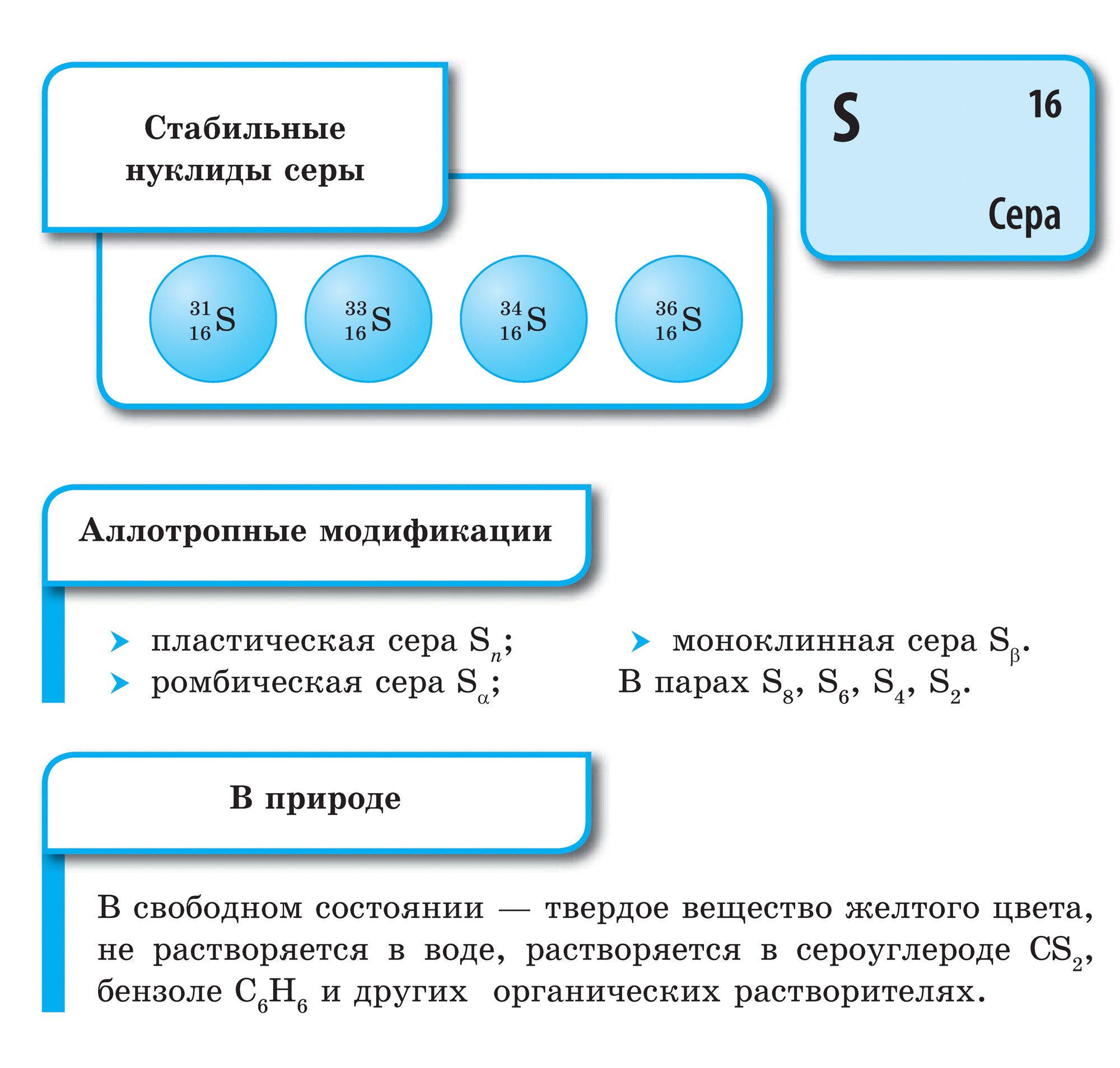

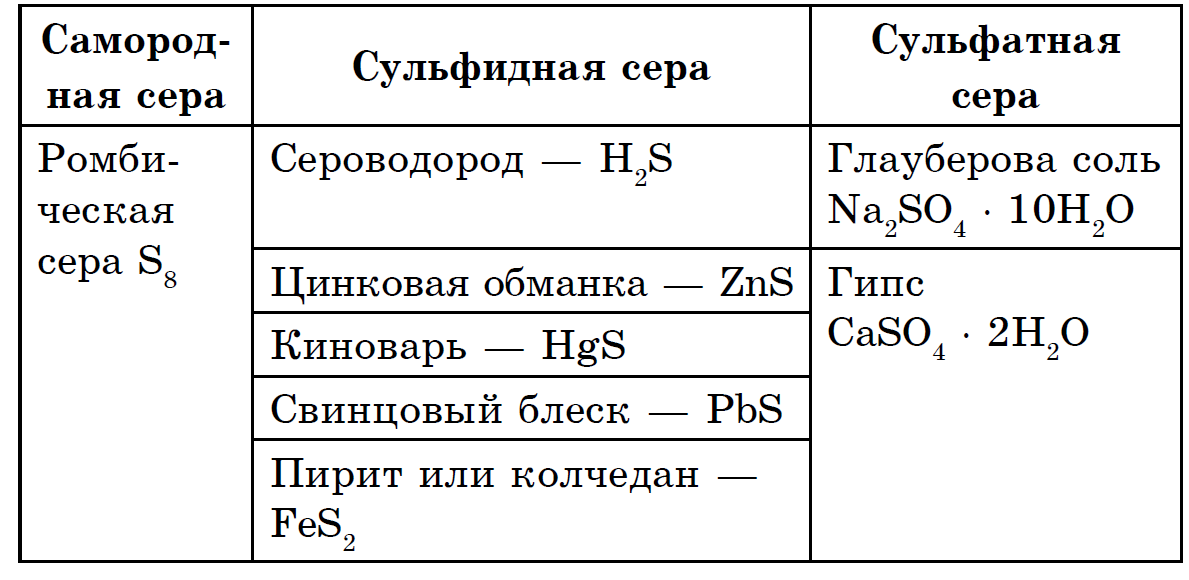
පරිධිය ඉතා පුළුල් මූලද්රව්ය දක්වා ගෙන එනු ලැබේ: පෘථිවි පෘෂ්ඨයේ ස්කන්ධය සඳහා පෘථිවියේ 4.7 10-2% පළිගනී (කුඩාම මූලද්රව්ය අතර 15 වන ස්ථානය), සහ සමස්තයක් ලෙස පෘථිවිය පොහොසත් වේ (0.7%). sirka හි හිස ස්කන්ධය පෘථිවියේ ගැඹුරේ, її මැන්ටල්-බෝල වල, පෘථිවි කබොල සහ පෘථිවි හරය අතර රැලි ගැසී ඇත. මෙහි, ආසන්න වශයෙන් 1200-3000 km ගැඹුරකදී, සල්ෆයිඩ් සහ ලෝහ ඔක්සයිඩ්වල තීව්ර බෝලයක් දක්නට ලැබේ. පෘථිවි පොත්තෙහි, නිදහස් කඳවුරක (ස්වදේශික) මෙන් සර්කා ඉරි ඇති බැවින්, ප්රධාන ශ්රේණියේ එය සල්ෆයිඩ් සහ සල්ෆේට් වලින් අඩක් මෙන් පෙනේ. පෘථිවි පෘෂ්ඨයේ ඇති සල්ෆයිඩ 3 ක් පළලම පයිරයිට් FeS2, chalcopirite FeCuS2, ඊයම් බ්ලිස්ක් (galena) PbS, සින්ක් මිශ්රණය (sphalerite) ZnS. sirka විශාල ප්රමාණයක් පෘථිවි පෘෂ්ඨයේ වැදගත් සල්ෆේට් අසල විසිරී ඇත - ජිප්සම් CaSO4 · 2H2O, barite BaSO4, මුහුදු ජලය, මැග්නීසියම් සල්ෆේට්, සෝඩියම් සහ පොටෑසියම්.
Tsikavo, පෘථිවියේ භූ විද්යාත්මක ඉතිහාසයේ පුරාණ කාලයේ (වසර මිලියන 800 කට පමණ පෙර) ස්වභාව ධර්මයේ සල්ෆේට් නොතිබුණි. වයිනයිල් වර්ධනයේ ජීවයේ ප්රතිඵලයක් ලෙස වායුගෝලය ඇඹුල් නම්, සල්ෆයිඩ් ඔක්සිකරණයේ නිෂ්පාදනයක් ලෙස දුර්ගන්ධය පදිංචි වී ඇත. ගිනිකඳු වායූන් වලදී, H2S සහ සල්ෆියුරික් ඇන්හයිඩ්රයිඩ් SO2 දිනය අනාවරණය වේ. මෙයට, ස්වදේශික සර්කා, වල් ගිනිකඳු (සිසිලි, ජපානය) ආසන්න ප්රදේශවලට හසු වන බැවින්, වායූන් දෙකක අන්තර්ක්රියා සමඟ පදිංචි විය හැකිය:
2H 2 S + SO 2 \u003d 3S + 2H 2 O.
දේශීය sirka හි අනෙකුත් ස්ථර ක්ෂුද්ර ජීවීන්ගේ ජීවිතයට සම්බන්ධ වේ.
ක්ෂුද්ර ජීවීන් ධනවතුන්ගේ ඉරණම ගනී රසායනික ක්රියාවලීන්, සමස්තයක් වශයෙන්, ඔවුන් ස්වභාව ධර්මයේ sirka සංසරණය සාදයි. їх spriyannya සල්ෆයිඩ් සඳහා සල්ෆේට ඔක්සිකරණය වේ, සල්ෆේට් ජීවී ජීවීන් විසින් මැටි කර ඇත, de sirka ප්රතිෂ්ඨාපනය කර ප්රෝටීන් සහ අනෙකුත් වැදගත් ජීව සම්පත් ගබඩාවට ඇතුල් වේ. ජීවීන්ගේ කුණු වූ අතිරික්තයන් සමඟ, ප්රෝටීන කඩා වැටෙන අතර, මධ්යහ්න දිනයක් ඇති අතර, එය මූලික සර්කා (සර්ක් නිරාකරණය වන්නේ මේ ආකාරයට) හෝ සල්ෆේට් වලට තවදුරටත් ඔක්සිකරණය වේ. Tsikavo, බව බැක්ටීරියා සහ ඇල්ගී, උදා වන තුරු වත්මන් දින ඔක්සිකරණය, ඔවුන්ගේ සෛල තුළ її ගන්න. එවැනි ක්ෂුද්ර ජීවීන්ගේ සෛල 95% පිරිසිදු සර්කා වලින් සමන්විත විය හැක.
සර්කා වල ස්වභාවය එහි ප්රතිසමය - සෙලේනියම් තුළ පැහැදිලිවම තහවුරු කළ හැකිය: ස්වදේශික sirka සෙලේනියම් වර්ධනය වන පරිදි, ගිනිකඳු sirka හි sirka, ජීවජනක නොමැති බැවින්, ක්ෂුද්ර ජීවීන් අද්විතීය බැවින්, ඇතුළත් වේ. ඔවුන්ගේ ජීවන චක්රයේ සෙලේනියම්, සමස්ථානික 32S, අඩු බර 34S වලින් වැඩි පළිගැනීම් ජෛවජනක වේ.
sirka හි ජීව විද්යාත්මක වැදගත්කම
ජීවය වැදගත් රසායනික මූලද්රව්යයකි. ප්රෝටීන ගබඩාවට ඇතුළු වීමට ජයග්රහණය කර ඇත - සියලුම ජීවීන්ගේ සෛලවල ප්රධාන රසායනික සංරචක වලින් එකකි. විශේෂයෙන් සුදු හිසකෙස්, අං, පිටත පොහොසත්. Krym tsgogo, sirka є ශරීරයට ජීව විද්යාත්මකව ක්රියාකාරී කථා වල ගබඩා කිරීමේ කොටස: විටමින් සහ හෝමෝන (උදාහරණයක් ලෙස, ඉන්සියුලින්). Sirka ශරීරයේ ඔක්සයිඩ්-ජල ක්රියාවලීන් සඳහා සහභාගී වේ. ශරීරයේ සර්කා හිඟයක් ඇති විට, ඇඬීම සහ බුරුසු වල බිඳෙනසුලු බව සහ හිසකෙස් වැටීම නිරීක්ෂණය කරනු ලැබේ.
Siroi පොහොසත් බෝංචි පැල (ඇට, අංකුර), වැල් ප්ලාස්ටික්, බිත්තර.
සර්කා
මෙම sirka vikoristovuєtsya විවිධ sirnikiv සහ කඩදාසි, ගම් සහ farb, vibukhovy speechovin සහ likіv, ප්ලාස්ටික් සහ රූපලාවන නිෂ්පාදන. ගම්බද ගම්බද ප්රදේශවල, රොස්ලින්ගේ පාසල් දරුවන්ට එරෙහිව සටන් කිරීමට ජයග්රාහකයින් යොදා ගනී. කෙසේ වෙතත්, සර්කාහි ප්රධාන ජීවිතාරක්ෂකයා වන්නේ රසායනික කර්මාන්තයයි. සල්ෆියුරික් අම්ලය නිෂ්පාදනය සඳහා සල්ෆියුරික් අම්ලය ලෝකයේ ලබා ගන්නා දේවලින් අඩකට ආසන්න ප්රමාණයක්.
නයිට්රජන්
![]()
නයිට්රජන් (N)- ආවර්තිතා පද්ධතියේ V කාණ්ඩයේ ප්රධාන උප සමූහයේ පළමු නියෝජිතයා. ඉලෙක්ට්රෝන පහක් ඇත, එයින් යුගල නොකළ ඉලෙක්ට්රෝන තුනක් සමාන ශක්ති මට්ටමෙන් පළිගැනීමට. මෙම මූලද්රව්යවල පරමාණු ඉලෙක්ට්රෝන තුනකින් සම්බන්ධ වී වත්මන් ශක්ති සමතුලිතතාවය සම්පූර්ණ කළ හැකි බව පෙනේ.
නයිට්රජන් පරමාණුවලට තමන්ගේම ඉලෙක්ට්රෝන වැඩි විද්යුත් සෘණ මූලද්රව්යවලට (ෆ්ලෝරීන්, අම්ලය) ලබා දිය හැකි අතර මෙම ඔක්සිකරණ අවධියේදී +3 සහ +5 ස්නානය කළ හැක. නයිට්රජන් පරමාණු ඔක්සිකරණ අවස්ථා වලදී වඩාත් වැදගත් බලය පෙන්වයි +1, +2, +4.
නිදහස් වානේවල, නයිට්රජන් ද්රව්යමය අණු N 2 ජලයේ පවතී. මෙම අණුවේ N හි පරමාණු දෙකක් පාහේ සමාන සහසංයුජ බන්ධනයකින් බන්ධනය වී ඇති අතර, බන්ධන පහත පරිදි හඳුනාගත හැක:

නයිට්රජන් යනු බාර් රහිත, ගන්ධ රහිත සහ රසකාරක වායුවකි.
උතුම් සිත් ඇතිව නයිට්රජන් vzaimodiє tіlki z lіtієm, utvoryuyuchi nitride Li 3 එන්:
අනෙකුත් ලෝහ සමග vіn vzaєmodіє ඉහළ උෂ්ණත්වවලදී පමණි.
එසේම ඉහළ උෂ්ණත්වවලදී සහ වයිස් උත්ප්රේරකයක් ඉදිරියේ නයිට්රජන් ජලය සමඟ ප්රතික්රියා කර ඇමෝනියා සාදයි.
විදුලි චාපයේ උෂ්ණත්වයේ දී, වයින් ඇඹුල් වීමට පටන් ගනී, නයිට්රික් ඔක්සයිඩ් (II) දිය කරයි:
වගු වල නයිට්රජන් වල රසායනික ආධිපත්යය

නයිට්රජන් පරිභෝජනය
දුර්ලභ අවස්ථාවක ආසවනයෙන් ලබාගත් නයිට්රජන්, ඇමෝනියා සංශ්ලේෂණය සහ සංස්ලේෂණය සඳහා කර්මාන්තයේ එකතැන පල් වේ. නයිටි්රක් අම්ලය. වෛද්ය විද්යාවේදී, පිරිසිදු නයිට්රජන් පෙනහළු ක්ෂය රෝගය සුව කිරීම සඳහා නිෂ්ක්රීය මාධ්යයක ගුණාත්මක භාවයෙන් එකතැන පල්වෙන අතර දුර්ලභ නයිට්රජන් - කඳු වැටි, හිම සහ අයිස් රෝග සුව කිරීමේදී.
පොස්පරස්
පොස්පරස් රසායනික මූලද්රව්යය ඇලෝට්රොපික් වෙනස් කිරීම් සිදු කරයි. ඒවායින් දෙකක් සරල කථා වේ: සුදු පොස්පරස් සහ රතු පොස්පරස්. සුදු පොස්පරස් වල P4 අණු වලින් සමන්විත අණුක ස්ඵටික දැලිසක් ඇත. ජලය අසල නොගැලපීම්, කාරුණිකව sirkovool දී විසුරුවා. මතුපිටින් එය පහසුවෙන් ඔක්සිකරණය වී ඇති අතර, කුඩු වැනි වානේ තුළ එය දැල්වෙයි. සුදු පොස්පරස් වඩාත් බිඳෙන සුළුය. විශේෂ බලයක් සහිතව, ගොඩනැගිල්ල ඔක්සිකරණයෙන් පසු අඳුරේ බබළයි. එය ජලය සමග ගන්න.රතු පොස්පරස් යනු තද තද රතු පාට කුඩු වර්ගයකි. චි ජලයෙන් හෝ කාබන් ඩයිසල්ෆයිඩ් වලින් වෙනස් නොවේ. මතුපිටින්, එය නිසි ලෙස ඔක්සිකරණය වන අතර ක්රියා නොකරයි. එය විෂ සහිත නොවන අතර අඳුරේ බැබළෙන්නේ නැත. රත් වූ විට, වයින් සාම්පලවල රතු පොස්පරස් සුදු පොස්පරස් බවට හැරේ (පරි සාන්ද්රණය).
රතු සහ සුදු පොස්පරස්වල රසායනික බලය සමීප නමුත් සුදු පොස්පරස් රසායනිකව ක්රියාකාරී වේ. එබැවින්, අමිහිරි දුගඳක් ලෝහ සමඟ අන්තර්ක්රියා කරයි, ෆොස්ෆයිඩ් තෘප්තිමත් කරයි:
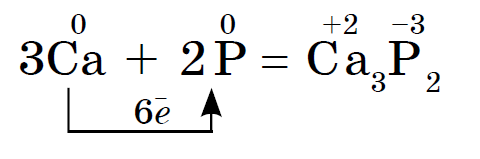
සුදු පොස්පරස් මතුපිටින් ස්වයංක්රීයව ක්රියා කරන අතර කෙළ ගසන විට රතු පොස්පරස් දැවී යයි. vipads දෙකෙහිම, පොස්පරස් (V) ඔක්සයිඩ් විසුරුවා හරිනු ලැබේ, එය ඝන සුදු දුමාරයක් මෙන් පෙනේ:
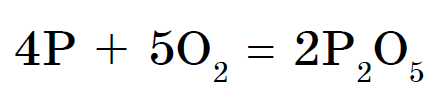
පොස්පරස් ජලය සමඟ මැදිහත් වීමකින් තොරව ප්රතික්රියා නොකරයි, ෆොස්ෆයින් PH 3 පැත්තකින් ගත හැකිය, උදාහරණයක් ලෙස, ෆොස්ෆයිඩ් වලින්:
ෆොස්ෆින් - ඩුජේ නිවුඩ්ඩ වායුව h පිළිගත නොහැකි සුවඳ. මතුපිටට ගිනි තැබීම පහසුය. පොස්පීන්හි බලය සහ වගුරු බිම්වල දැවෙන ගිනි වල පෙනුම පැහැදිලි කරයි.
වගු වල පොස්පරස් වල රසායනික ආධිපත්යය


පොස්පරස් පරිභෝජනය
පොස්පරස් යනු වඩාත් වැදගත් ජෛවජනක මූලද්රව්යය වන අතර ඒ සමඟම කර්මාන්තයේ වඩාත් පුළුල් ලෙස දැන ගැනීමට ඇත. virobnitsvі sіrnikov දී Chervoniy පොස්පරස් zastosovuyut. පෙට්ටියේ පිටත පෘෂ්ඨය මත සිහින් ව කැපූ ගුණයකින් සහ මැලියම් සමඟ එකම අවස්ථාවේදීම අයදුම් කරන්න. tertі s_rnikovoї හිස, පොටෑසියම් ක්ලෝරේට් සහ sirka ඇතුළත් ගබඩාව වෙත, ණය ගැනීම අවශ්ය වේ.
Mabut, පොස්පරස් වල පළමු බලය, පුද්ගලයෙකු සේවයේ යෙදී සිටින ආකාරයටම, දහනය කිරීමේ හැකියාවයි. පොස්පරස් දහනය කිරීමේ හැකියාව ඊටත් වඩා වැඩි වන අතර එය ඇලෝට්රොපික් වෙනස් කිරීම් වල තැන්පත් වේ.
වඩාත් ක්රියාකාරී රසායනික, විෂ සහිත සහ දහනය වන සුදු ("කහ") පොස්පරස්, බොහෝ විට zastosovuetsya වයින් (ප්රාථමික බෝම්බ, ආදිය).
Chervoniy පොස්පරස් - ප්රධාන වෙනස් කිරීම, viroblena සහ spozhivana කර්මාන්තය. Vіn zastosovuєtsya දී virobnitstvі sіrnikovіv, vybuhovyh chovina, ෆියුස් ගබඩා, විවිධ වර්ග paliva, මෙන්ම රත් කිරීමේ පහන් සඳහා ගෑස් දැවෙන ලාම්පු වැනි ප්රති-සිදු තෙල් ද්රව්ය.
පොස්පරස් (පොස්පේට් වැනි) ATP සංශ්ලේෂණයට සහභාගී වන වඩාත් වැදගත් ජෛවජනක මූලද්රව්ය තුනෙන් එකකි. විකෘති වූ විශාල කොටසක් පොස්පරික් අම්ලයපොස්පරික් ආකලන තෝරාගැනීමට යන්න - superphosphate, precipitate, ammophosphate සහ in.
ෆොස්ෆටි බහුලව භාවිතා වේ:
- සංකීර්ණ සෑදීමේ කාරකවල ධාරිතාව (ජල මෘදු කිරීම සඳහා බළලුන්),
- මතුපිට ලෝහයේ ගබඩා Pasivator (විඛාදනයට එරෙහිව ආරක්ෂාව, උදාහරණයක් ලෙස, t. zv. ගබඩාව "mazhef").
පොස්පේට් සහ ඇලුමිනොපොස්පේට් බන්ධන සකස් කිරීම සඳහා mіtsnu trivimіrny බහු අවයවික දැලක් vikorivuєtsya කිරීමට Zdatnistst fosfativ.
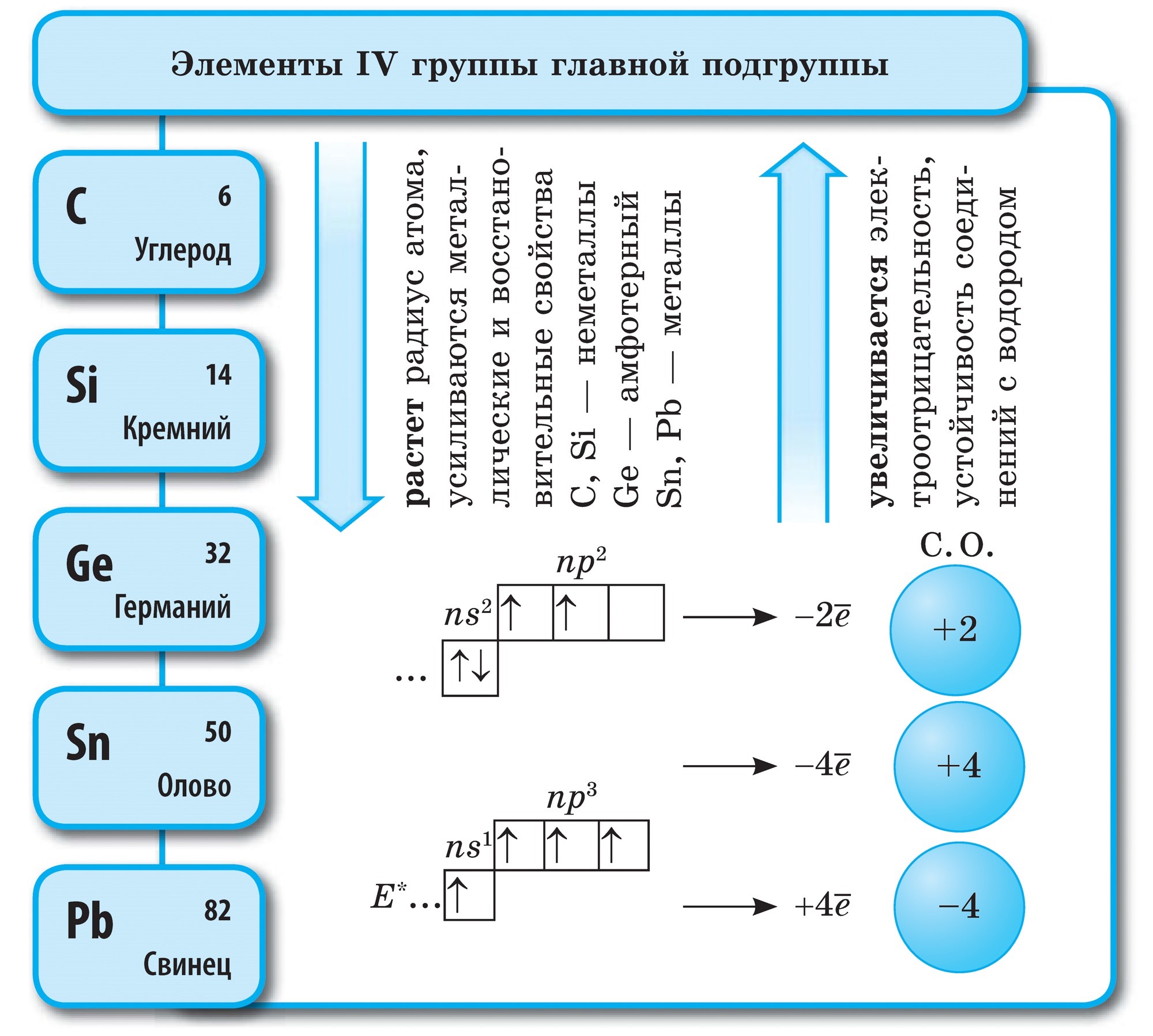
අඟුරු
Vuglets (C)- ආවර්තිතා පද්ධතියේ VI කාණ්ඩයේ ප්රධාන උප කාණ්ඩයේ පළමු මූලද්රව්යය. යෝගෝ පරමාණුව සහ ඉලෙක්ට්රෝන 4ක මට්ටමේ පළිගැනීම නිසා දුගඳට චෝටිරි ඉලෙක්ට්රෝනයක් ලබා ගත හැක, ඉදිමීම් ඔක්සිකරණ අවධියේදී -4 , I.E. බලයේ ඔක්සයිඩ පෙන්වන්න සහ ඒවායේ ඉලෙක්ට්රෝන වලට වැඩි විද්යුත් සෘණ මූලද්රව්ය ලබා දෙන්න, i.e. +4.
Vuglets - සරල කථාව
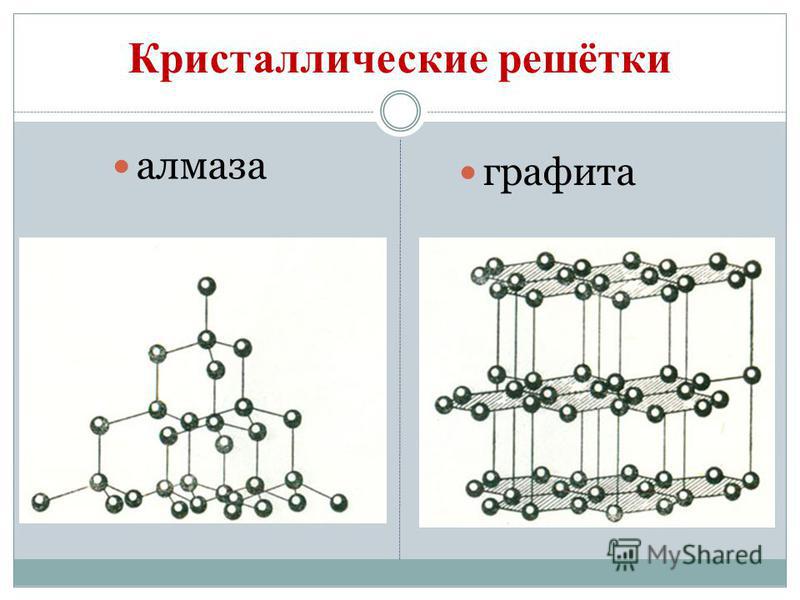
ගල් අඟුරු ඇලෝට්රොපික් වෙනස් කිරීම් තෘප්තිමත් කරයි දියමන්ති සහ මිනිරන්. දියමන්ති යනු පැහැදිලි ස්ඵටික කථාවකි, සියලු ස්වභාවික කථනයන් අතරින් අමාරුම කථාවකි. Vіn දෘඪතාවේ සම්මතයක් ලෙස සේවය කරයි, දස ලක්ෂ්ය පද්ධතිය සඳහා එය ඉහළම පන්දුව 10 මගින් ඇස්තමේන්තු කර ඇත. දියමන්තියේ එවැනි දෘඪතාව එහි පරමාණුක ස්ඵටික පෙරනයේ විශේෂ ව්යුහයකින් බැඳී ඇත. එය සමාන පරමාණු මගින් කාබන් කැපුම් සහිත සම පරමාණුවක් ඇති අතර, සාමාන්ය ටෙට්රාහෙඩ්රෝනයක සිරස් අතට කැරලි ගැසී ඇත.
දියමන්ති ස්ඵටික තීරුවකින් තොරව නාද වන නමුත් ඒවා නිල්, කළු, රතු සහ කළු වර්ණ වේ. අධික ආලෝකය පරාවර්තනය වන සහ ආලෝකය නැමෙන ගොඩනැගිල්ලක හිරු රශ්මියක දැඩි ආලෝකයක් පවා දුර්ගන්ධය විය හැකිය. සහ සුළං සුවිශේෂී ලෙස ඉහළ දෘඪතාව; ඇඹරුම් මෙවලම්, Rizanya ගබඩාව.
දියමන්ති විශාලතම පරම්පරාව පිව්ඩෙන්නි අප්රිකාවේ දක්නට ලැබෙන අතර රුසියාවේ ඒවා යකුටියා හි දක්නට ලැබේ.
ග්රැෆයිට් - තද අළු, ලෝහමය දීප්තිය සහිත ඩොටික් ස්ඵටික කථනය මත මේදය. දියමන්ති මුහුණත මත, මිනිරන් මෘදු (කඩදාසි මත හෝඩුවාවක් ඉතිරි) සහ පාරාන්ධ, එය තාපය හා විදුලිය සන්නයනය හොඳයි. මිනිරන් වල මෘදු බව ගෝලාකාර ව්යුහයකින් පෙලගැසී ඇත. ග්රැෆයිට්වල ස්ඵටික දැලිසේදී, එක් තලයක පිහිටා ඇති කාබන් පරමාණු, නිවැරදි හය-කැබලිවල ප්රවේශමෙන් බැඳී ඇත. බැලූන Malomitsnі අතර තරු. වින් ද පරාවර්තක වේ. ග්රැෆයිට් සෑදී ඇත්තේ ඉලෙක්ට්රෝඩ, ඝන තෙල්, න්යෂ්ටික ප්රතික්රියාකාරකවල නියුට්රෝන තනන්නන් සහ ඔලිව් සඳහා කතුරු වලින්. ඉහළ උෂ්ණත්වවලදී සහ ග්රැෆයිට් මත ග්රහණයෙන්, කෑලි දියමන්ති ලබා ගනී, ඒවා තාක්ෂණයේ බහුලව භාවිතා වේ.
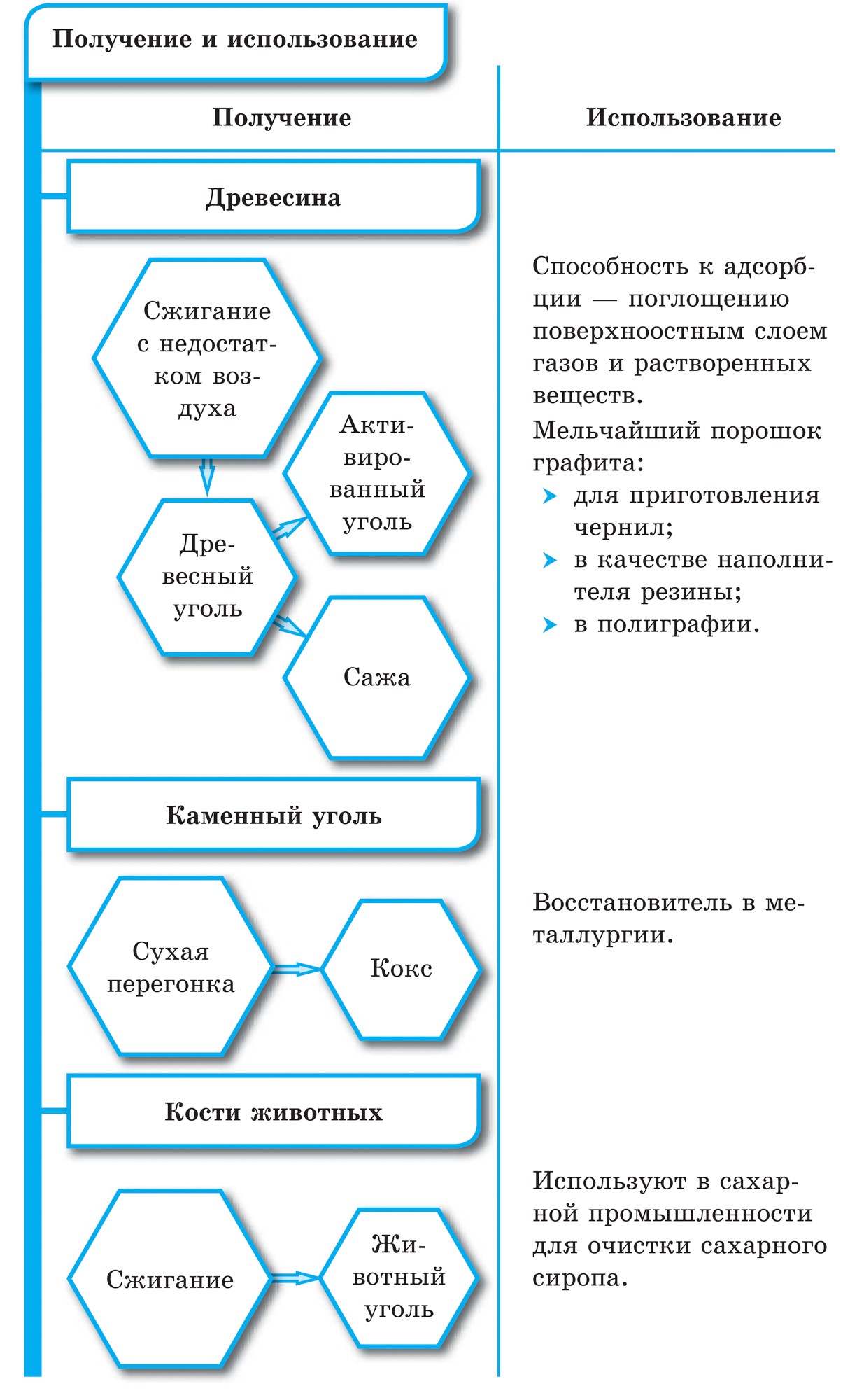
බුඩොව්ගේ මිනිරන් මෙන්, වුගිල්යා ගම්මානයේ සබන් දැමිය හැකිය. ගම වියළි ආසවනයේදී වුගිල්ය ගම රැගෙන යයි. Tse vugіllya zavdjaki එහි සිදුරු සහිත මතුපිට මැටි වායුව හා කථන ආශ්චර්යමත් ගොඩනැඟීම විය හැක. බලයේ අරමුණ adsorption ලෙස හැඳින්වේ. ලී vug එකක සිදුරු වැඩි වන තරමට adsorption වඩාත් ඵලදායී වේ. මැටි ගොඩනැඟිල්ල වැඩි කිරීම සඳහා වූගිල්ය ගම්මානය උණු වතුර වාෂ්ප බවට පත් කරයි. මෙලෙස යාවත්කාලීන කිරීම සක්රීය හෝ ක්රියාකාරී ලෙස හැඳින්වේ. ෆාමසිවල, යෝගෝ විකුණනු ලබන්නේ කළු පැහැති කාබොලීන් පෙති වැනි පෙනුමකිනි.
ගල් අඟුරු වල රසායනික බලය
දියමන්ති සහ මිනිරන් ඉහළ උෂ්ණත්වවලදී ඇඹුල් වේ. Soot සහ vugіllya vzaєmodіyut ඇඹුල් සමග වඩාත් පහසුවෙන්, රාත්රියේ දැවෙන. ඇලේ, සමාන මනෝභාවයකින්, එවැනි අන්තර්ක්රියාවක ප්රති result ලය සමාන වේ - කාබන් ඩයොක්සයිඩ් නිරවුල් වේ:
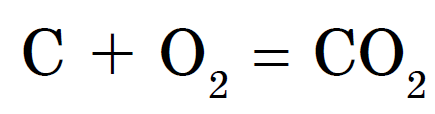
ලෝහ සමග, රත් වූ විට අඟුරු කාබයිඩ්:
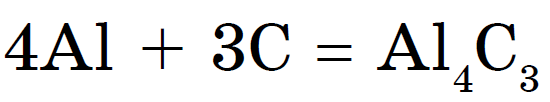
ඇලුමිනියම් කාබයිඩ්- ලා කහ පැහැති ස්ඵටික නිෂ්කාශන. Vіdomy karbіd kaltsіyu Sas 2 shmatkіv අළු පාට වගේ. යෝගෝ ඇසිටිලීන් ඉවත් කිරීම සඳහා ගෑස් පෑස්සුම්කරුවන් නතර කරන්න:
ඇසිටිලීන්ලෝහ කැපීම සහ පෙරීම, විශේෂ සෙරෙප්පු වල අතිරේක ඇඹුල් සඳහා යෝග පුළුස්සා දැමීම සඳහා ඇසිපිය ගසන්න.
ඔබ ඇලුමිනියම් කාබයිඩ් මත ජලය ඔසවන්නේ නම්, ඔබට වැඩි වායුවක් පෙනෙනු ඇත - මීතේන් CH 4:
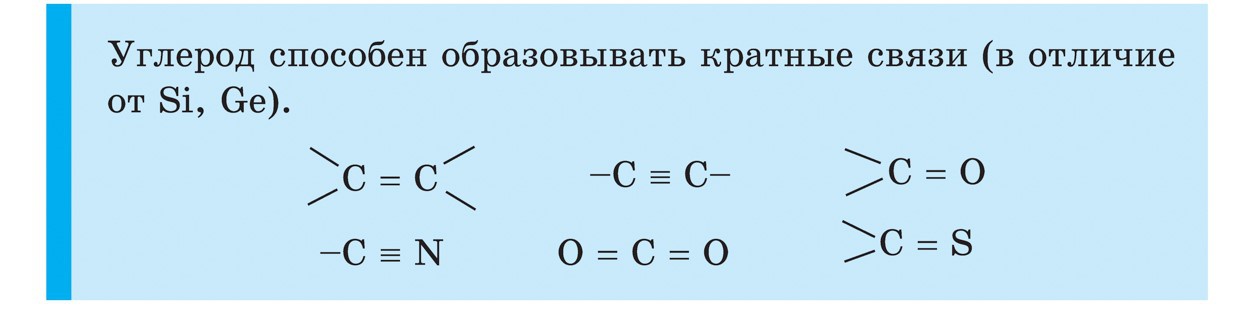
සිලිකන්
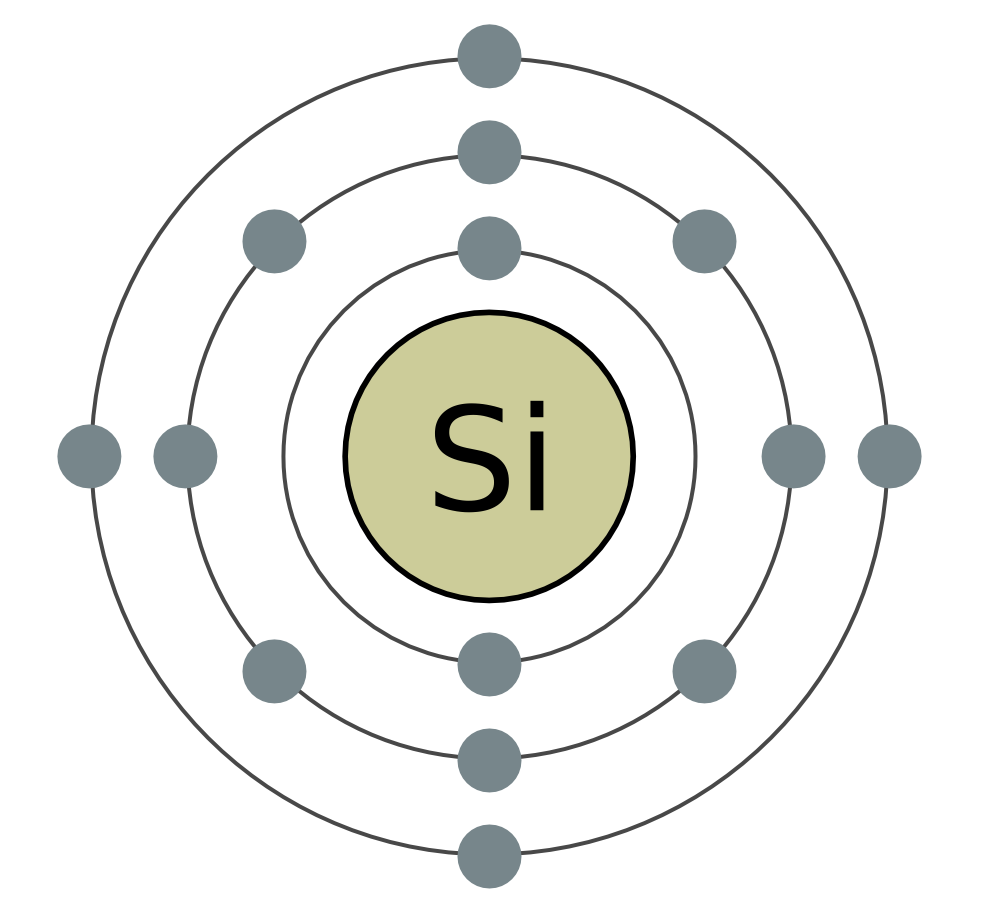
සිලිකන් (Si) යනු ආවර්තිතා පද්ධතියේ IV කාණ්ඩයේ ප්රධාන උප කාණ්ඩයේ තවත් අංගයකි. ස්වභාවයෙන්ම, සිලිකන් අම්ලයේ පළල සඳහා තවත් රසායනික මූලද්රව්යයකි. පෘථිවි පෘෂ්ඨයේ එක් කාර්තුවක සිට හතරෙන් එකකට වඩා නැවී ඇත. සිලිකන් වල විශාලතම ප්රසාරණය වන්නේ අයඩින් ඩයොක්සයිඩ් SiO 2 - සිලිකා ය. සොබාදහමේදී, වයින් සෑදී ඇත්තේ ඛනිජ ක්වාර්ට්ස් සහ පොහොසත් විවිධත්වයෙනි, එබැවින් ලිලැක් ආකෘතිය - ඇමතීස්ට්, මෙන්ම අගස්ති, ඔපල්, ජැස්පර්, චැල්සෙඩෝනි, කාර්නේලියන් ගර්ස්කි ස්ඵටිකයක් සහ යෝගෝ ලෙස ප්රසිද්ධය. සිලිකන් ඩයොක්සයිඩ් වඩාත් වැදගත් හා ක්වාර්ට්ස් වැලි වලට සමාන වේ. සිලිකන් සඳහා ස්වභාවික ද්රව්ය තවත් වර්ගයක් ce සිලිකේට් වේ. ඒවා අතර වඩාත් පුළුල් ඇලුමිනොසිලිකේට් වන්නේ කළුගල් ය. වෙනස් බලන්නමැටි, මයිකා. ඇලුමිනියම් පලි නොගන්නා සිලිකේට්, උදාහරණයක් ලෙස, ඇස්බැස්ටස්. රොස්ලින් සහ ජීවීන්ගේ ජීවිතය සඳහා සිලිකන් ඔක්සයිඩ් අවශ්ය වේ. Vіn dodaє mіtsnіst දඬු යට roslinі і zahishnih pokrittiv ජීවීන්. සිලිකන් මිනිසුන්ගේ අස්ථි වලට සිනිඳු බව සහ මෘදු බව එක් කරයි. පහළ ජීවීන්ගේ ගබඩාවට ඇතුළු වීමට සිලිකන් - ඩයැටම් සහ රේඩියෝලරියන්.
සිලිකන් වල රසායනික බලය
ඇඹුල් තුළ සිලිකන් පිළිස්සීම, සිලිකන් ඩයොක්සයිඩ් හෝ සිලිකන් (IV) ඔක්සයිඩ් නිවාදැමීම:
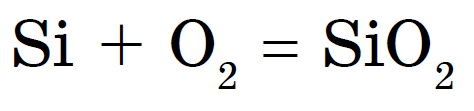
ලෝහ නොවන බැවින්, රත් වූ විට, වැල් ලෝහ හා මුද්රා සමග ඒකාබද්ධ වේ සිලිසයිඩ්:
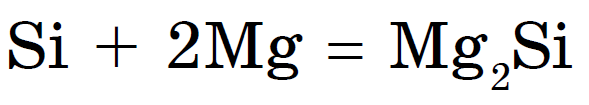
සිලිසයිඩ් ඉතා පහසුවෙන් ජලය හෝ අම්ල සමග ව්යාප්ත වන අතර, ඒ සමඟම සිලිකන් වායුවක් වැනි ජලය දැකිය හැක. සිලේන්:
4HCl + Mg 2 Si → SiH 4 + 2MgCl 2
vіdmіnu vіd vіd vuglevnіv silane මත poіtry ස්වයං රැකියා අනුමත සිලිකන් ඩයොක්සයිඩ් සහ ජලය සමග පිළිස්සීම:
මීතේන් CH4 සමඟ මිශ්රණයක සිලේන් ප්රතික්රියාව වැඩි වීම පැහැදිලි වන්නේ සිලිකන් පරමාණු ප්රමාණයෙන් විශාල වීම, අඩු කාබන්, රසායනික බන්ධන Si-H S-H වලට වඩා දුර්වලයි.
සාන්ද්රිත ජල රෝස තණබිම් සමඟ සිලිකන් අන්තර් ක්රියාකාරිත්වය, සන්සුන් සිලිකේට් සහ ජලය:
සිලිකන් දිනා ඇත, මැග්නීසියම් ඩයොක්සයිඩ් හෝ කාබන් සමඟ යෝග ඒකාබද්ධ කිරීම:
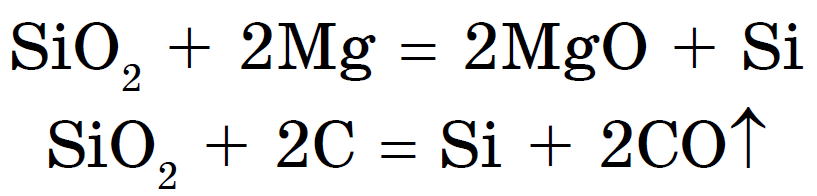
සිලිකන් ඔක්සයිඩ් (IV), හෝ සිලිකන් ඩයොක්සයිඩ්, හෝ සිලිකා SiO 2, yak і CO 2, є අම්ල ඔක්සයිඩ්. කෙසේ වෙතත්, vіdmіnu vіd CO 2 මත, එය අණුක විය නොහැක, නමුත් පරමාණු ස්ඵටික දැලිස්. එබැවින්, SiO 2 යනු දෘඩ හා වර්තන කථාවකි. Vіn ජලය සහ අම්ල, හයිඩ්රොෆ්ලෝරික් ක්රීම් සහ සිලිසිලික් අම්ලයේ ලවණ සහිත තණබිම් සහිත ඉහළ උෂ්ණත්වවලදී වෙනස් නොවේ - සිලිකේට්:
ලෝහ ඔක්සයිඩ් හෝ කාබනේට් සමඟ සිලිකන් ඩයොක්සයිඩ් මිශ්ර ලෝහයකින් සිලිකා ඉවත් කළ හැකිය:
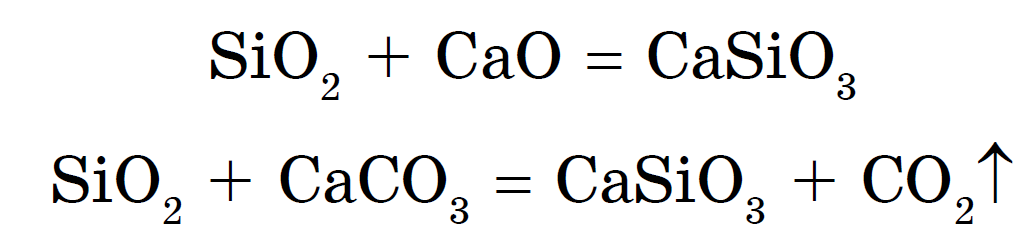
සෝඩියම් සහ පොටෑසියම් සිලිකේට් සිල්ලර කුණු ලෙස හැඳින්වේ. x ජලසම්පාදන- සිලිකේට් මැලියම් භාවිතා කිරීම හොඳයි. ඒවා මත වඩාත් ශක්තිමත් අම්ල ඇත - හයිඩ්රොක්ලෝරික්, සල්ෆියුරික්, ඔක්ටෝවොයික් සහ නේවිට් කාබොනික් - සිලිසිලික් අම්ලය එච් 2 SiO 3 :
otzhe, එච් 2 SiO 3 - ඉතා දුර්වල අම්ලය. වෝන් ජලයේ දිය නොවන අතර අගනා වැටලීමක් දුටු විට ප්රතිගාමී කැලඹිලිවලින් පිටතට වැටේ; එල්ලෙන විට tsієї masi utvoryutsya ඉතා porous කතාව - සිලිකා ජෙල්, adsorbent ගුණාත්මක පුළුල් ලෙස zastosovuvaniya - මැටි іnshih speechovina.



පරීක්ෂණය සමත් වීම සඳහා Dovіdkovy ද්රව්ය:
ආවර්තිතා වගුව
සිල්ලර වගුව