
Poskytnite spätnú väzbu o výžive: 1. Koľko atómov je v molekule kože inertného plynu? 2. Pozrite sa na etymológiu názvu „inertné plyny“. 3. Ako sa volá jej kamarátka? 4. Aký je najlepší spôsob prístupu k inertným plynom? od priateľa



Pohľad na neón Neón je najefektívnejší typ modernej reklamy. Neónové reklamné a svetelné boxy sú obľúbené vo všetkých častiach sveta. Sklenená trubica naplnená neónom alebo argónom je zabalená do svetelných škatúľ a vikorizovaná spolu s nápisom alebo písmenom, aby bola svetelná reklama nápadná, efektívna a efektívna.


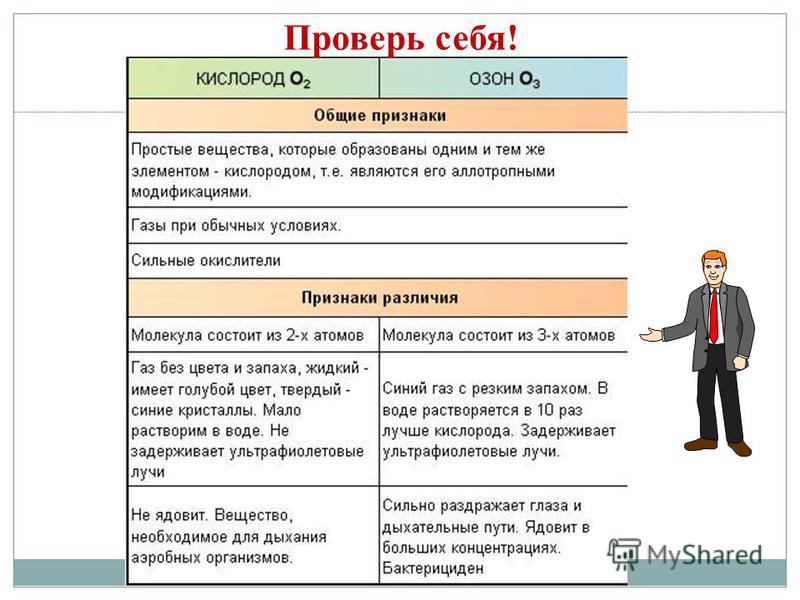
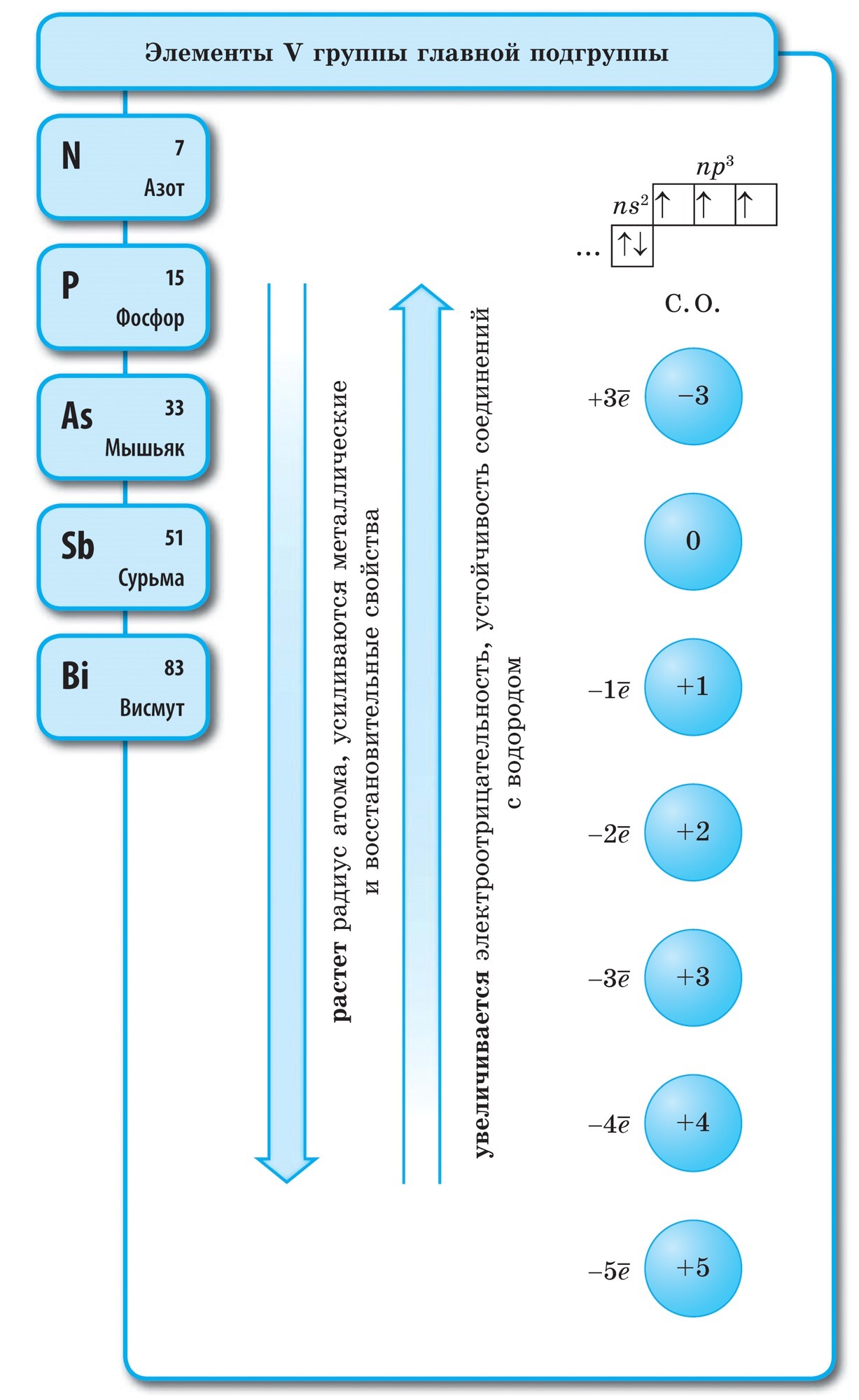
Alotropia je pôvodom akcií JE, ktoré vytvárajú množstvo jednoduchých prejavov, ktoré sú oddelené každodenným životom a autoritami. Z - diamant, grafit, fullerén. O - kisen, ozón. S - kosoštvorcový, monoklinický, plastický. P - biela, červená, čierna. Fenomén alotropie vzniká z dvoch dôvodov: 1) rozdielny počet atómov v molekule, napríklad kyslík O2 a ozón O3. 2) výtvory rôznych kryštalických foriem, ako je diamant a grafit.









Z predpísaného toku si vyberte výkonovú charakteristiku diamantu a grafitu: 1. číra kryštalická živica 2. vedie teplo a tečie 3. má veľmi silný lesk 4. tmavosivá, hustejšia kryštalická živica 5. najtvrdšia zo všetkých prirodzených rečí v 6 .nevedú teplo a tečú 7. rozpadajú sa na kúsky 8. vytvárajú kovové trblietky
 Kovy Nekovy 1. Tuhé látky (ortuť Hg) 1, Tuhé látky (síra S, červený fosfor a biely fosfor P 4, jód I 2, diamant a grafit C), látky podobné plynom (kyslík O2, ozón O3, dusík N 2 , voda H 2, chlór C1 2, fluór F 2, vzácne plyny) a radián (bróm Br 2) 2. umyte kovový blesk 2. kovový blesk neumývajte (jód I 2, grafit C) 3. el. vodivosť 3. Už neviesť elektrický prúd (medzi vodiče patrí napr. kremík, grafit) 4. kované, plastické, viskózne 4. V pevných látkach šľachovité Jednoduché slová:
Kovy Nekovy 1. Tuhé látky (ortuť Hg) 1, Tuhé látky (síra S, červený fosfor a biely fosfor P 4, jód I 2, diamant a grafit C), látky podobné plynom (kyslík O2, ozón O3, dusík N 2 , voda H 2, chlór C1 2, fluór F 2, vzácne plyny) a radián (bróm Br 2) 2. umyte kovový blesk 2. kovový blesk neumývajte (jód I 2, grafit C) 3. el. vodivosť 3. Už neviesť elektrický prúd (medzi vodiče patrí napr. kremík, grafit) 4. kované, plastické, viskózne 4. V pevných látkach šľachovité Jednoduché slová:
![]()
Poskytnite svoje výživové rady Čo je to alotropia? Uveďte význam alotropných modifikácií. Aký je fenomén alotropie? Čo je jedným z dôvodov rôznorodosti prejavov? Prečo je tento chemicky nepresne poetický výraz: „Vo vetre bola búrka“? Prečo ste sa delili na kovy a nekovy? Prečo ste sa delili na kovy a nekovy?


Chemické prvky - nekovy
Celkovo existuje 16 nekovových chemických prvkov a dva z nich, oxid a kremík, tvoria 76 % hmotnosti zemskej kôry. Nekovy tvoria 98,5 % hmotnosti rastlín a 97,6 % hmotnosti ľudí. S uhlíkom, vodou, kyslom, kyslom, fosforom a dusíkom vznikajú všetky najdôležitejšie organické látky, smrad a prvky života. Voda a hélium sú hlavnými prvkami Vesmíru, z ktorého sa formujú všetky kozmické objekty, vrátane nášho Slnka. Bez spojenia neziskoviek nie je možné pochopiť náš život, hlavne uhádnuť, čo je v živote najdôležitejšie chemické spojenie- voda - pozostáva z vodnej a kyslej.
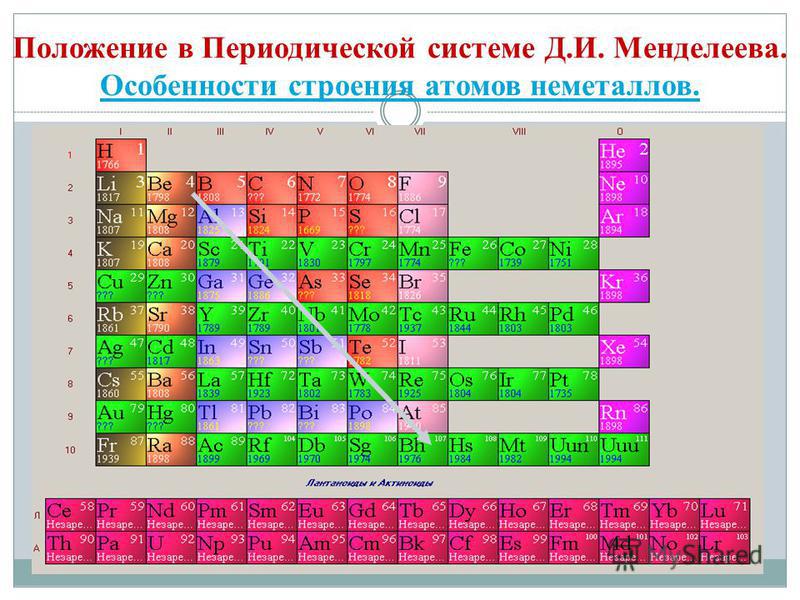
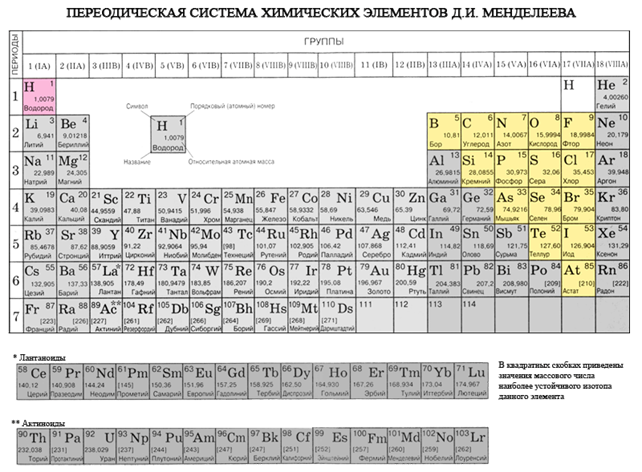
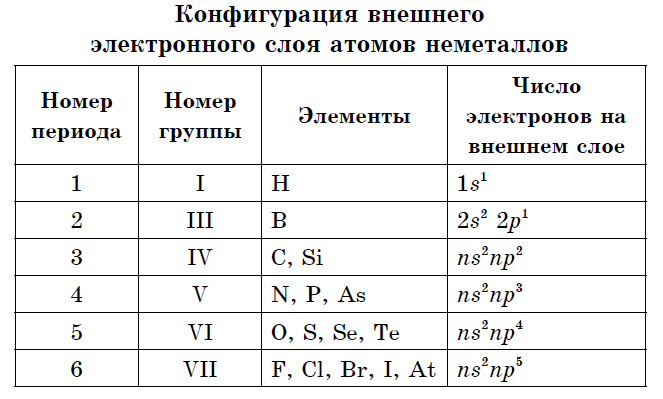
Ak v periodickom systéme nakreslíme uhlopriečku od berýlia po astat, potom vpravo do kopca pozdĺž uhlopriečky budú nekovové prvky a dole budú kovy a pred nimi budú prvky všetkých dcérskych spoločností. podskupiny, lantanoidy a aktinoidy. Prvky umiestnené v blízkosti uhlopriečky, napríklad berýlium, hliník, titán, germánium, antimón, majú dvojaký charakter a súvisia s Metaloidom. Nekovové prvky: S-prvok - Voden; skupina p-prvkov 13 - bór; 14 fanúšikov - uhlie a kremík; 15 fanúšikov - dusík, fosfor a popol, 16 skupina - kisen, sirka, selén a telur a všetky prvky skupiny 17 - fluór, chlór, bróm, jód a astatín. Skupina Elementi 18 - Inertné plyny Zaberajú špeciálnu pozíciu, číhajú okolo koncov vonkajšej elektronickej gule a zaujímajú medzipolohu medzi kovmi a nekovmi. Niekedy sú klasifikované ako nekovy alebo formálne za fyzickými znakmi.
Nekovy- tse chemické prvky, Atómy, ktoré berú elektróny na dokončenie vonkajšej energetickej hladiny, čo na nich vytvára negatívny náboj.
Vonkajšia elektrónová sféra nekovových atómov obsahuje tri až osem elektrónov.
Takmer všetky nekovy majú rovnomerne malé polomery a veľký počet elektrónov na aktuálnej energetickej úrovni od 4 do 7, vyznačujú sa vysokými hodnotami elektronegativity a oxidy sily. Preto sa vo vzťahu k atómom kovov nekovy vyznačujú:
· Menší atómový polomer;
· Viac ako elektrón v súčasnej energetickej hladine;
To je taká dôležitá sila nekovových atómov – trend je prijímať až 8 elektrónov denne, potom oxidy sily. Jasnou charakteristikou nekovových atómov je, že elektronický obchod môže slúžiť ako miera ich nekovovosti, pretože sila atómov chemických prvkov polarizuje chemickú väzbu, čo vedie k tomu, že si domov odnesiete nejaké bláznivé elektronické stávky;
Prvou vedeckou klasifikáciou chemických prvkov bolo ich rozdelenie na kovy a nekovy. Táto klasifikácia nestratila svoj význam ani v súčasnosti. Nekovy sú chemické prvky, pre ktoré sa atómy vyznačujú schopnosťou prijímať elektróny pred dokončením vonkajšej sféry, spravidla sa na vonkajšej elektrónovej sfére nachádza niekoľko alebo viac elektrónov a atómy s malým polomerom sa rovnajú kovu. atómov.
Táto hodnota zbavuje ostatné prvky skupiny VIII hlavnej podskupiny - inertné alebo vzácne plyny, atómy, ktoré môžu dopĺňať vonkajšiu elektrónovú guľu. Elektrónová konfigurácia atómov týchto prvkov je taká, že ich nemožno klasifikovať ani ako kovy, ani ako nekovy. Smrdí sú tie predmety, ktoré rozdeľujú prvky na kovy a nekovy a zaujímajú medzi nimi tesnú polohu. Inertné alebo vzácne plyny ("ušľachtilosť" je vyjadrená inertnosťou) sú klasifikované ako nekovy alebo ešte formálnejšie za fyzikálnymi znakmi. Tieto produkty zachovávajú plyn podobnú rastlinu aj pri veľmi nízkych teplotách. Hélium Chi teda neprechádza do zriedkavého stavu pri t ° \u003d -268,9 ° C.
Chemická inertnosť týchto prvkov je zrejmá. Pre xenón a kryptón sa kombinuje s fluórom a kyselinou: KrF 2, XeF 2, XeF 4 a iné. Nepochybne v týchto štúdiách pôsobili ako priekopníci inertné plyny. Existuje veľa nekovov a ich atómy sa vyznačujú vysokými hodnotami elektronegativity. Mení sa medzi 2 a 4. Nekovy sú prvky hlavných podskupín, najdôležitejšie sú p-prvky a potom s-prvok.
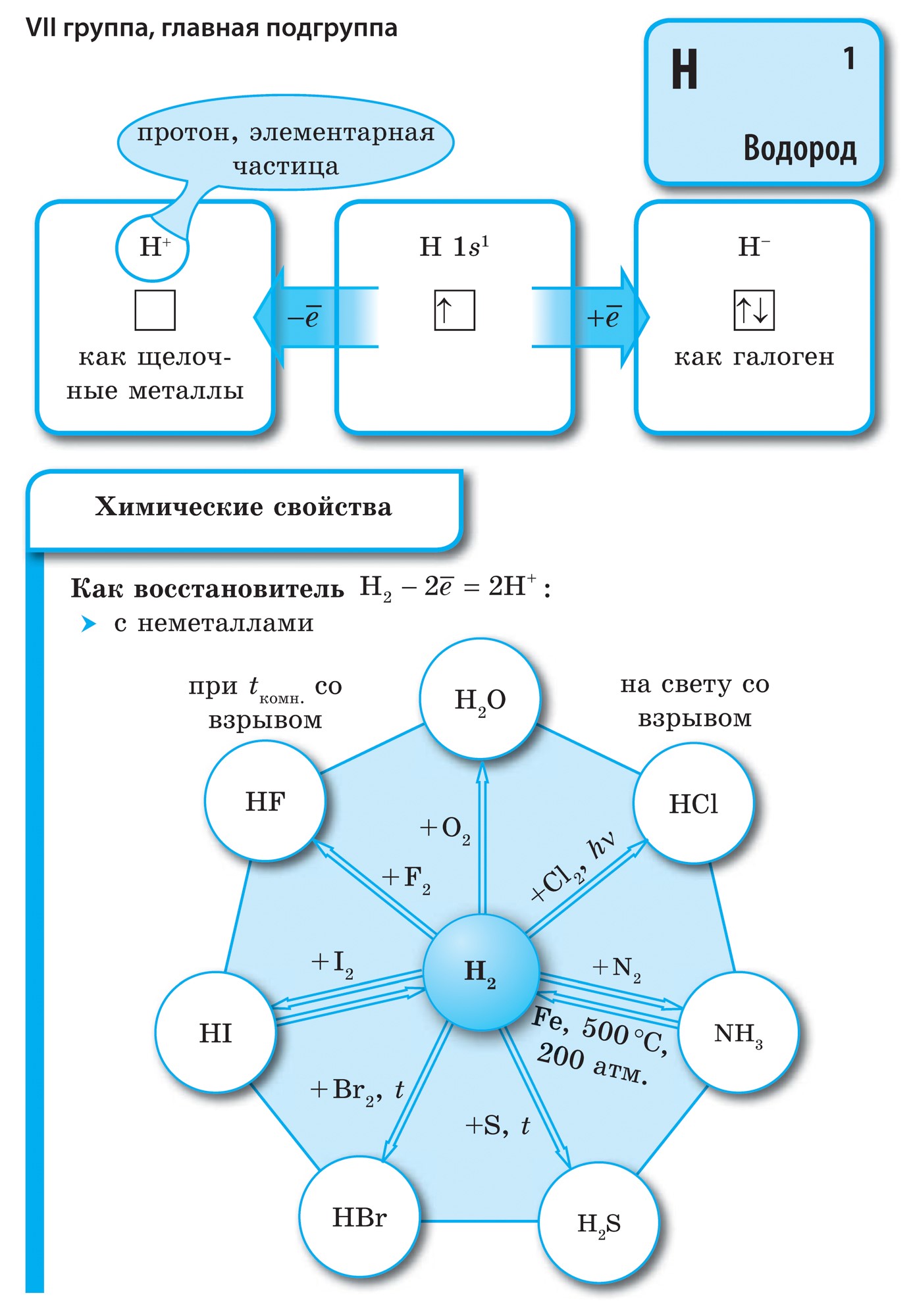
Všetky nekovové prvky (vrátane vody) sú zahrnuté v periodickej tabuľke chemických prvkov D. I. Mendelevov pravý horný roh, ktorý otvára tricullus, ktorého vrcholom je fluór F a základňou je uhlopriečka B - At. Osobitne by sme sa však mali zamerať na nejednoznačné postavenie vody v periodickom systéme: v hlavných podskupinách I a VII skupiny. nie je to vymyslené. Na jednej strane má atóm vody, podobne ako atómy nižších kovov, na vonkajšej (a pre novú) elektrónovej gule jeden elektrón (elektronická konfigurácia 1s 1), ktorý je daný v súčasnosti, prejavujúci sa moc vodcu.
Väčšina vody, podobne ako kovy, vykazuje oxidačný stupeň +1. Darovanie elektrónu atómom vode je dôležitejšie ako darovanie atómov základných kovov. Na druhej strane, atóm vody, podobne ako atómy halogénu, na dokončenie elektrónovej sféry stratí jeden elektrón, takže atóm vody môže prijať jeden elektrón, pričom vykazuje silu oxidačného činidla a oxidačný krok -1 charakteristický pre halogén v hydridoch. (spojené s kovmi, podobné zlučovanie kovov s halogénmi - halogenidy). Pri pridávaní jedného elektrónu k atómu je voda dôležitejšia ako halogény.
pri v najväčších mysliach voda N 2 - plyn. Táto molekula, podobne ako halogény, je dvojatómová. V nekovových atómoch sú dôležitejšie oxidy sily, t.j. prítomnosť elektrónov. Tento fakt charakterizuje hodnotu elektronegativity, ktorá sa prirodzene mení v obdobiach a podskupinách. Fluór je najsilnejšie oxidačné činidlo, ktorého atómy sa pri chemických reakciách nevzdávajú elektrónov, t.j. odhaľujú novú silu. Ostatné nekovy môžu vykazovať extrémnu silu, aj keď na oveľa slabšej úrovni v porovnaní s kovmi; v obdobiach a podskupinách ich pôvodnej produkcie sa mení v obrátenom poradí v súlade s oxidačným.
- Nekovové prvky sú zmiešané v hlavových podskupinách III-VIII skupín PS D.I. Mendelev, ktorý zaberá pravý horný roh.
- Vonkajšia elektrónová sféra atómov nekovových prvkov obsahuje 3 až 8 elektrónov.
- Nekovové mohutnosti prvkov v periódach silnejú a v podskupinách slabnú so zvyšovaním poradového čísla prvku.
- Väčšina kyslých častí nekovov má kyslý charakter (oxidy a hydroxidy kyselín).
- Atómy nekovových prvkov sú vytvorené tak, aby prijímali elektróny, ktoré vykazujú oxidické funkcie, a poskytovali im ďalšie funkcie.
Budova a fyzická sila nekovov
V jednoduchých rečiach sú atómy a nekovy spojené kovalentná nepolárna väzba. Výsledkom je vytvorenie stabilnejšieho elektronického systému ako u izolovaných atómov. V tomto prípade jednoduché (napríklad v molekulách vody H 2, halogény F 2, Br 2, I 2), dvojité (napríklad v molekulách alkoholu S 2), trojité (napríklad v molekulách dusíka N). 2) vznikajú kovalentné väzby.
- ráznosť dňa
- nie je tam žiadny lesk
- Tepelná vodivosť (iba grafit)
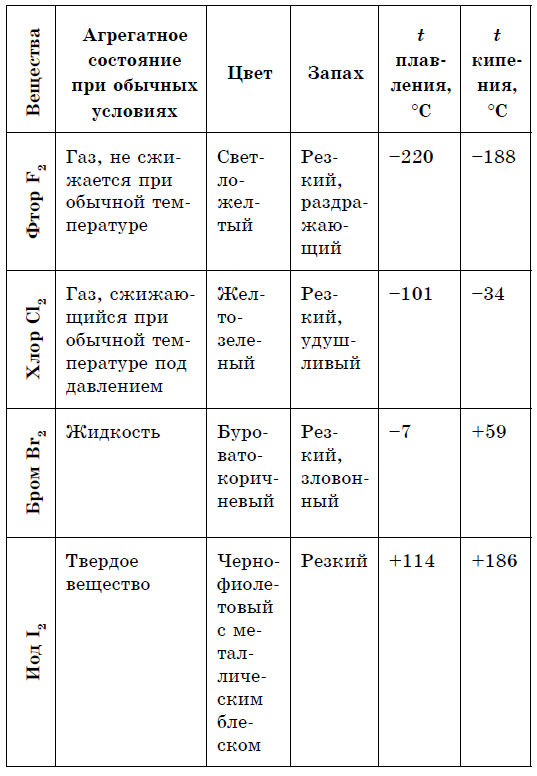
- Farby sú rozmanité: žltá, žltozelená, červenohnedá.
- Elektrická vodivosť (iba grafit a čierny fosfor)
Mlyn na agregáty:
- rídina - Br 2;
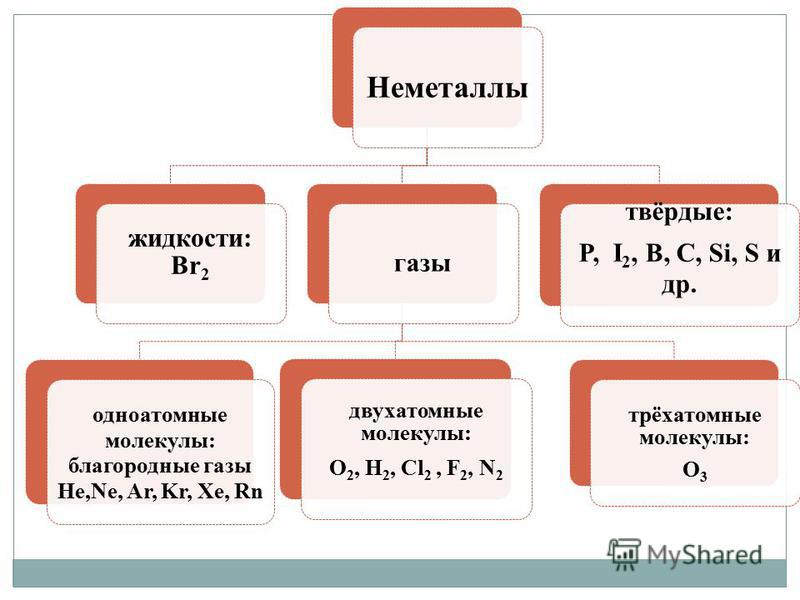
Okrem kovov aj nekovy - odpusť mi tie slová, Vyznačuje sa veľkou rozmanitosťou právomocí. Nekovy sú odtrhnuté od agregátov mlyna s maximálnou mysľou:
- plyn - H2, O2, O3, N2, F2, Cl2;
- rídina - Br 2;
- tuhé látky - modifikácie síry, fosforu, kremíka, uhlíka atď.
Nekovy majú bohatšie spektrum farieb: červená - pre fosfor, červeno-hnedá - pre bróm, žltá - pre sirka, žltozelená - pre chlór, fialová - pre jód. Prvky sú väčšinou nekovy, kombinované s kovmi, až do alotrópie.
Schopnosť atómov jedného chemického prvku vytvárať množstvo jednoduchých zlúčenín sa nazýva alotropia a tieto jednoduché zlúčeniny sa nazývajú alotropné druhy.
Odpustite slová - nekovy môžu matka:
1. Molecular Budova. Pri nízkych koncentráciách tvoria väčšinu týchto látok plyny (H 2, N 2, O 2, F 2, Cl 2, O 3) alebo pevné látky (I 2, P 4, S 8) a menej ako jeden bróm (Br 2) є rіdina. Všetky tieto slová sa zdajú molekulárnemu duchu, a preto letia. V pevnom stave má smrad nízku teplotu topenia v dôsledku slabých medzimolekulových interakcií, ktoré odstraňujú ich molekuly v kryštáli, čo vedie k sublimácii.
2. Atómovú budovu. Tieto slová sú vytvorené dlhými kopijami atómov (C n, B n, Si n, Se n, Ten). Kvôli veľkej hodnote kovalentných väzieb má zápach spravidla vysokú tvrdosť a akékoľvek zmeny spojené s deštrukciou kovalentných väzieb v ich kryštáloch (topenie, vyparovanie) vedú k veľkým stratám energie. V skutočnosti majú takéto zlúčeniny vysoké teploty topenia a varu a prchavosť je veľmi nízka.
Niekoľko jednoduchých prejavov je vytvorených množstvom nekovových prvkov - alotropné modifikácie. Sila atómov sa nazýva alotropia. Alotropia môže byť spojená s rôznym zložením molekúl (O 2, O 3) a s iným typom kryštálov. Alotropické modifikácie uhlíka zahŕňajú grafit, diamant, karabín, fullerén. Na odhalenie mohutností charakteristických pre všetky nekovy je potrebné venovať pozornosť ich rozloženiu v periodickej sústave prvkov a brať do úvahy konfiguráciu vonkajšej elektrónovej gule.
Obdobie:
- jadrový náboj sa zvyšuje;
- polomer atómu sa mení;
- počet elektrónov vo vonkajšej sfére sa zvyšuje;
- Elektronický obchod rastie;
- oxidy sily budú silyuyutsya;
- Nekovové orgány budú mať prednosť.
V hlavnej podskupine:
- jadrový náboj sa zvyšuje;
- polomer atómu sa zväčšuje;
- počet elektrónov na vonkajšej gule sa nemení;
- Zmeny elektronegativity;
- oxidy sily oslabujú;
- Nekovové sily slabnú.
Väčšina kovov, až na zriedkavé výnimky (zlato, meď a iné), sa vyznačuje striebristo-bielym sfarbením. A os jednoduchých rečí - nekovy, farby gama sú výrazne odlišné: P, Se - žltá; B - hnedá; O2(l) - blakitnium; Si, As (met) - sірі; P 4 - bledo-zhovty; I - fialovo-čierna s kovovými trblietkami; Br2(g) - bórax; C12 (g) - žltozelená; F 2 (r) - svetlozelená; S 8 (TV) - zhovta. Nekovové kryštály nie sú plastické a akákoľvek deformácia vedie k zničeniu kovalentných väzieb. Väčšina nekovov nevytvára kovové odlesky.

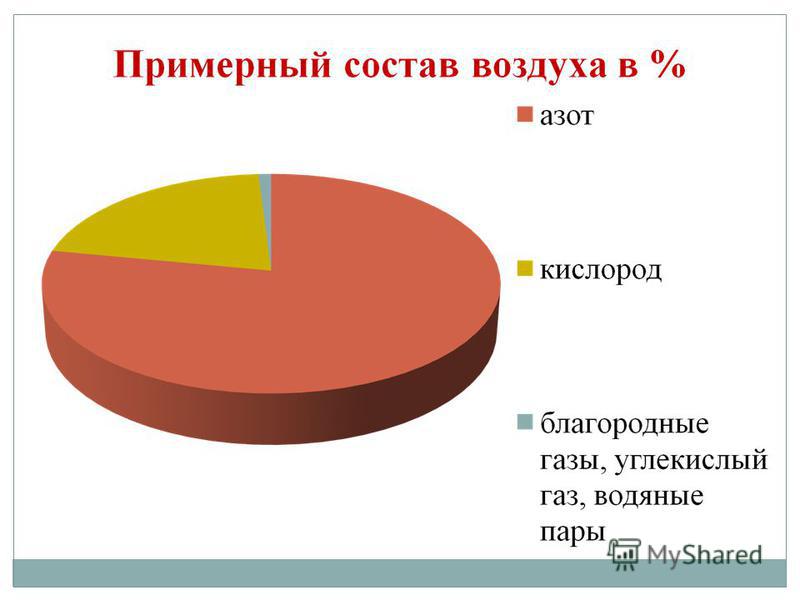
Spolu je to 16 chemických prvkov-nekovov! Nie je toho veľa, ak veríte, že existuje 114 prvkov. Dva nekovové prvky tvoria 76 % zemskej kôry. Ide o kisen (49 %) a kremík (27 %). Atmosféra obsahuje 0,03% kyslej hmoty v zemskej kôre. Nespravili kov, aby sa stali 98,5 % hmotnosti Roslyn, 97,6 % hmotnosti ľudského tela. Nekovy C, H, O, N, S sú biogénne prvky, ktoré vytvárajú najdôležitejšie organické zlúčeniny živej hmoty: bielkoviny, tuky, sacharidy, nukleové kyseliny. Vo vetre, ktorému sa vyhýbame, je ľahké vojsť do skladu skladacie prejavy, Vytvorené aj s nekovovými prvkami (kyslík O 2, dusík N 2, oxid uhličitý CO 2, vodná para H 2 O t.j.)
Oxidová sila jednoduchých látok - nekovov
Pre atómy nekovov, a teda pre nimi osvetlené jednoduché slová, je to charakteristické oxidácia, takže ja láska moc.
1. Oxidová sila nekovov objaviť na prvom mieste keď interagujú s kovmi(Metals of the Days of the Day):

Oxidy sily chlóru Cl 2 sú silnejšie, s nižším obsahom síry, takže kov Fe, ktorý je prítomný v kombinovaných stabilných oxidačných stupňoch +2 a +3, sa ním oxiduje do vyššieho oxidačného stupňa.
1. Väčšina neziskoviek ukazuje oxidy sily pri interakcii s vodou. V dôsledku toho vznikajú lietajúce častice vody.
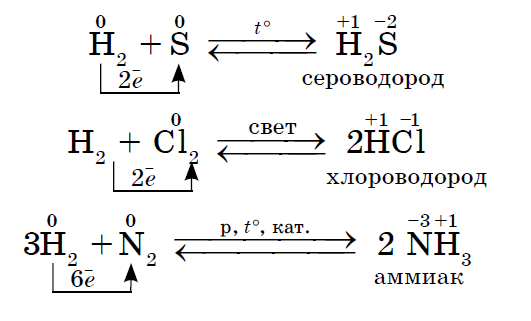
2. Akýkoľvek nekov pôsobí ako oxidačné činidlo pri reakciách s tými nekovmi, ktoré majú nižšie hodnoty elektronegativity:
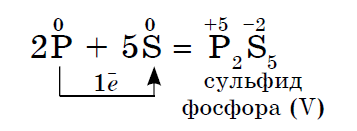
Elektronegativita síry je väčšia ako u fosforu, ktorý vykazuje oxidy sily.
Elektronegativita fluóru je väčšia ako u všetkých ostatných chemických prvkov, a preto vykazuje silu oxidačného činidla. Fluór F 2 je najsilnejším okysličovadlom nekovov a pri reakciách vykazuje iba oxidickú silu.
3. Oxidy sily nekovov sa odhaľujú v reakciách s rôznymi skladacími rečami.
V prvom rade je významná oxidická sila oxidácie nekovov pri reakciách so skladacími slovami:
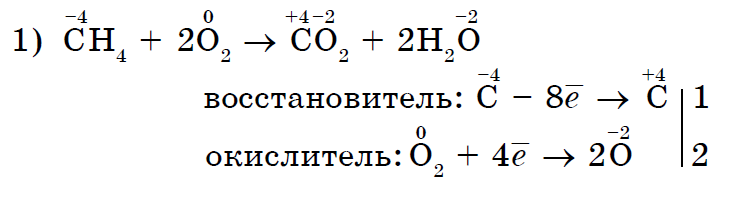
Oxidačnými činidlami pri reakciách so skladacími zlúčeninami môžu byť nielen kyslé, ale aj iné nekovy- anorganické (1, 2) a organické (3, 4):
Silne oxidujúci chlór Cl2 oxiduje chlorid (II) na chlorid (III);
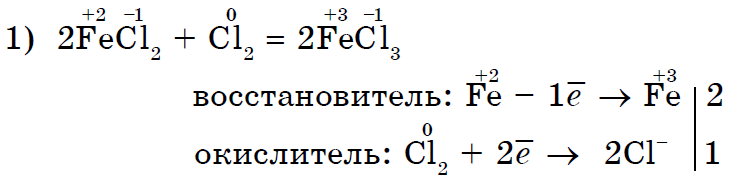
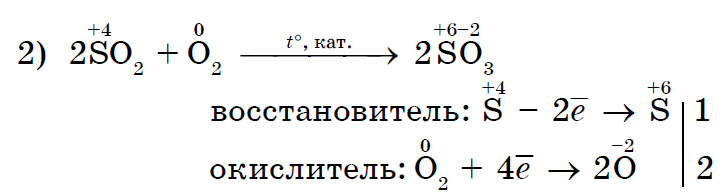
Chlór Cl 2, ktorý je silnejším oxidačným činidlom, spája jód I 2 s čírym vzhľadom jodidu draselného;
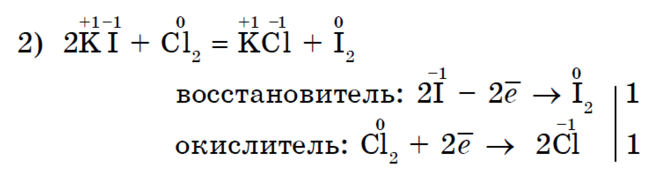
Halogenácia metánu je charakteristickou reakciou pre alkány;
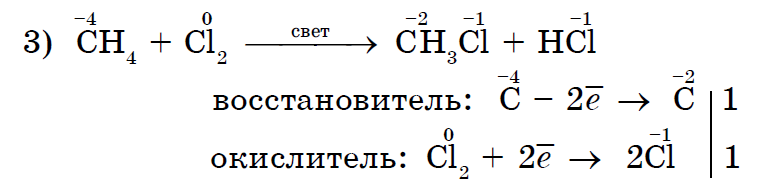
Jasnou reakciou na nedostatok nasýtenia je pridanie brómovej vody do nich.
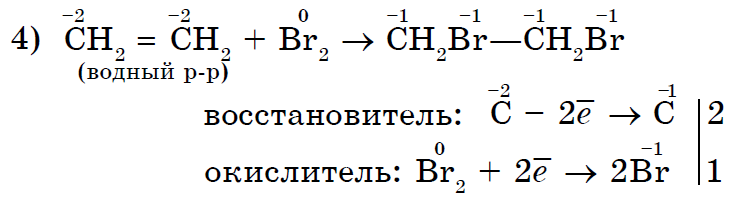
Nová sila jednoduchých rečí – neziskovky
pri pohľade na reakcie nekovov jeden po druhom V závislosti od významu ich elektronegativity však jeden z nich ukazuje silu oxidačného činidla a druhý - silu vodcu.
1. Vo vzťahu k fluóru všetky nekovy (ako kisen) vykazujú maximálnu silu.
2. Zdá sa, že nekovy, vrátane fluóru, slúžia ako redukčné činidlá pri interakcii s kyselinou.

V dôsledku reakcie, oxidy nekovov: Nesolnotvorné a soľotvorné kyseliny. A hoci halogény nezanevrú na kyseliny, sú to oxidy: Cl 2 +1 O -2, Cl 2 +4 O 2 -2, Cl 2 +7 O 7 -2, Br 2 +1 O -2, Br +402-2, I2+505-2 a in., ako je určené nepriamou cestou.
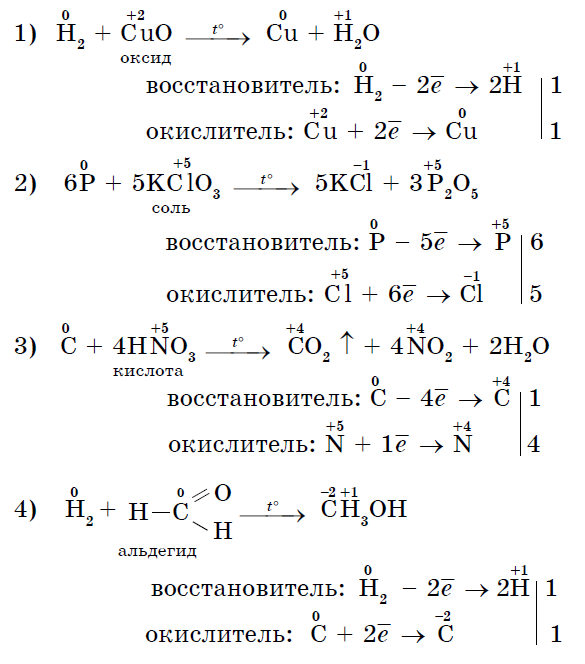
3. Mnohé nekovy môžu pôsobiť ako katalyzátor pri reakciách so skladacími zlúčeninami - oxidačnými činidlami:
Existujú tiež reakcie, pri ktorých ten istý nekov súčasne oxiduje aj degeneruje. Reakcia samooxidácie-samoobnova (disproporcionácia):
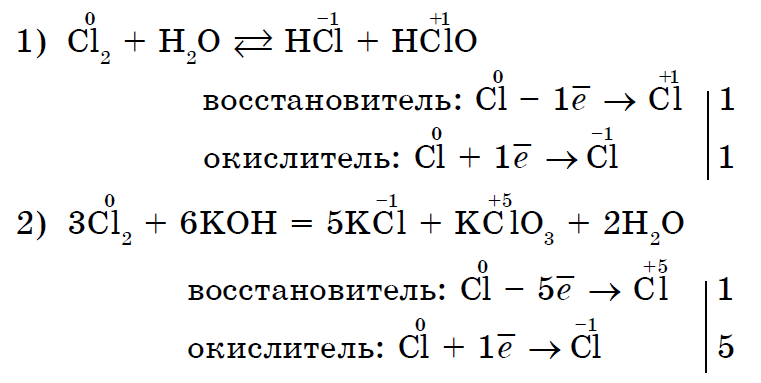
Do toho teda môže vstúpiť väčšina nekovov chemické reakcie ako v úlohe okysličovadla, tak aj v úlohe generátora (nový výkon sa nepridáva len fluóru F 2).
Zásobovanie vodou z nekovov
Namiesto kovov vznikajú nekovy plynnými zlúčeninami podobnými vode. Ich sklad je uložený v štádiu oxidácie nekovov.
RH4 -> RH3 -> H2R -> HR
Skrytá sila všetkých nekovov є zakladanie letných vodných združení, Vo väčšine nekovov je stupeň oxidácie nižší. Medzi indukciou vzorcov prejavov je veľa tichých, silných, stagnujúcich a otrimanných, ktoré ste predtým používali: CH 4, NH 3, H 2 O, H 2 S, HCl.
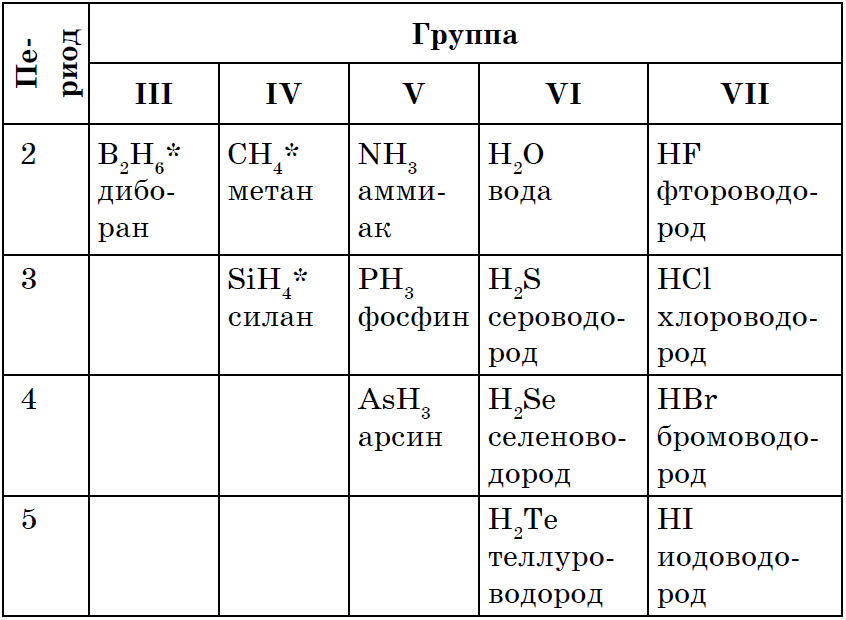
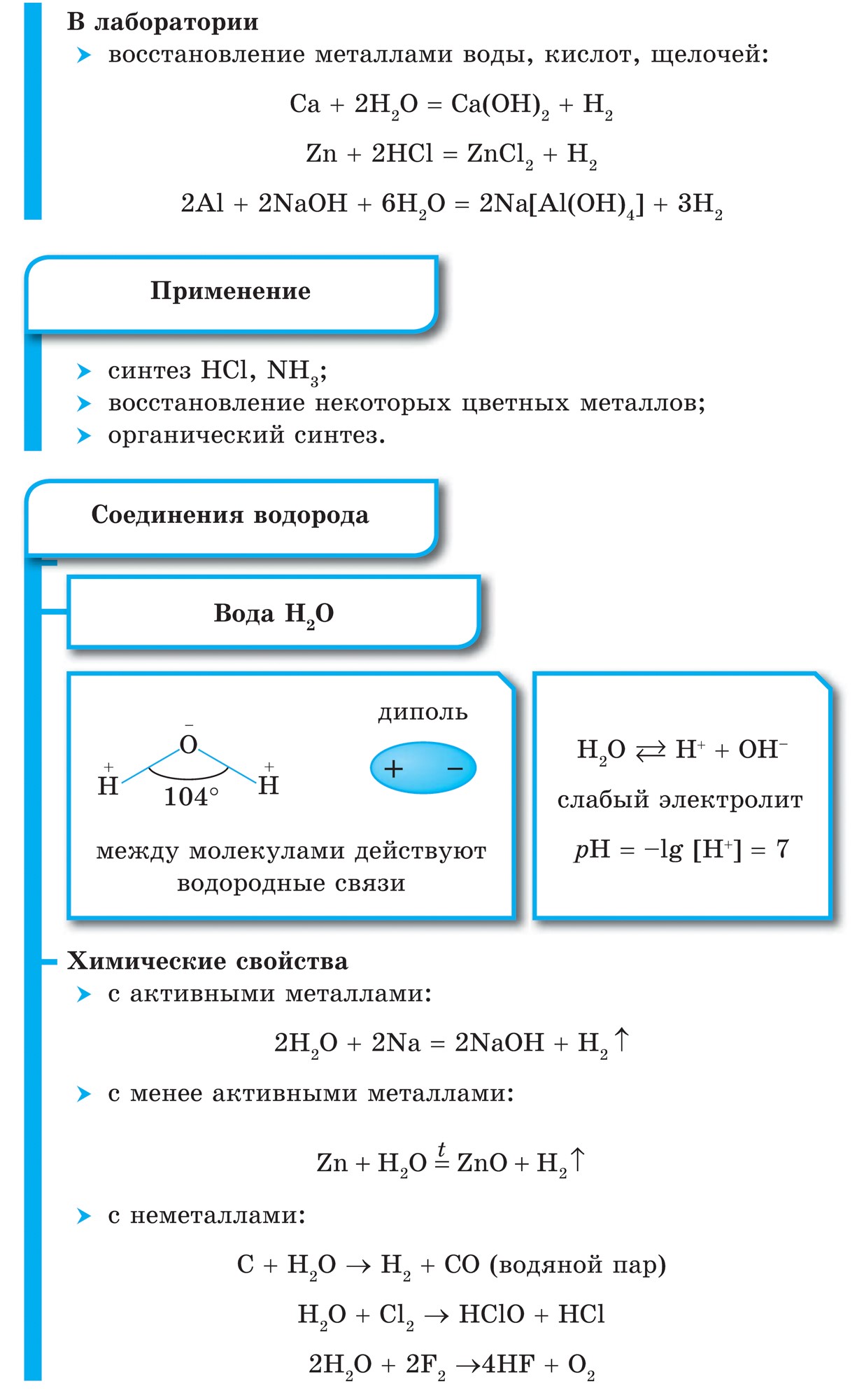
Zdá sa, že najjednoduchšia vec, ktorú môžete urobiť, je odstrániť ju zo stredu interakcia nekovu s vodou, Tobto syntéza:
![]()
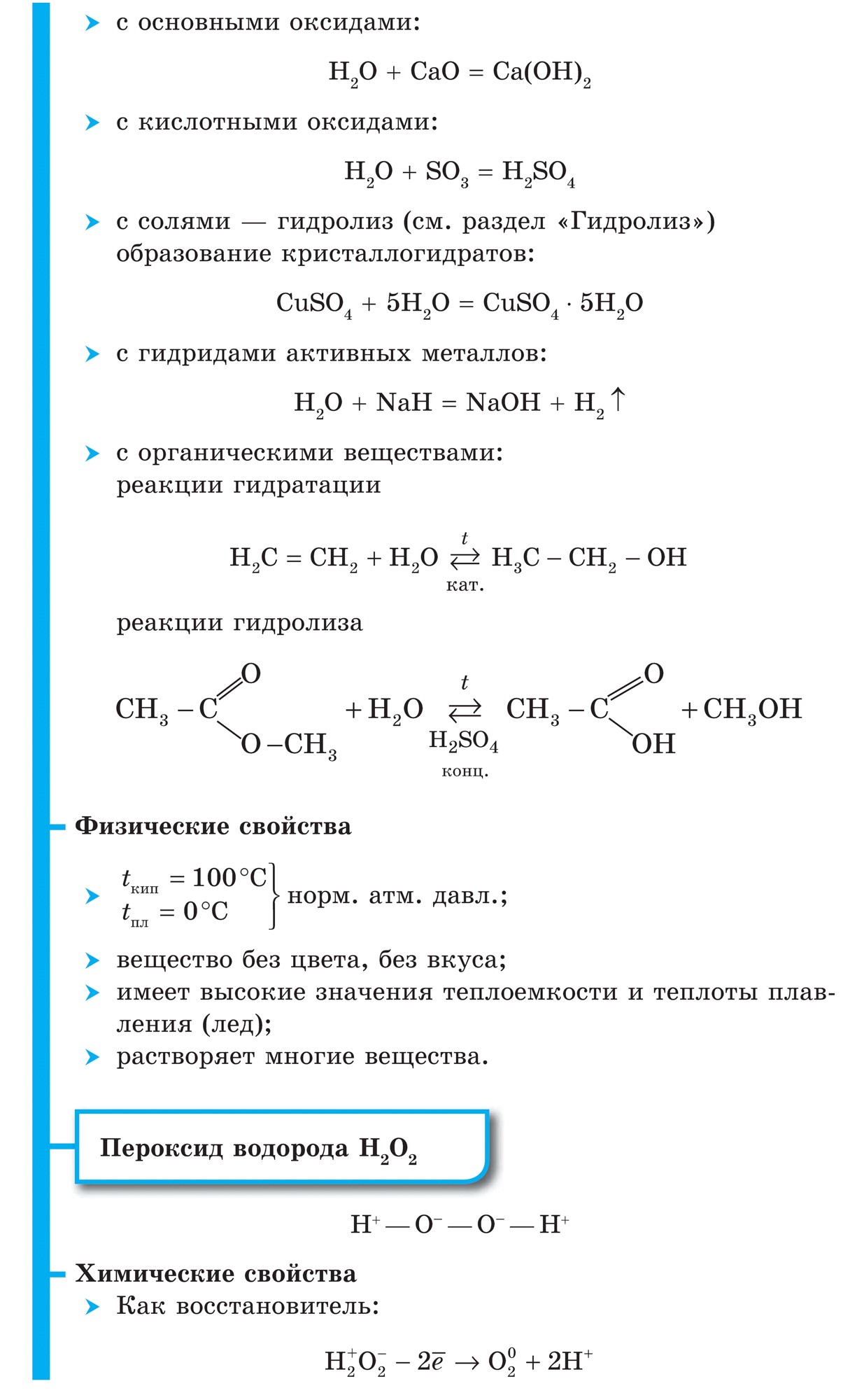
Všetky nekovové zlúčeniny na vodnej báze vznikajú kovalentnými polárnymi väzbami, tvoria molekulárnu látku a vo väčšine prípadov aj iné plyny ako voda. Pre vodné spoje nekovov je typické ich rozdielne umiestnenie pred vodou. Metán a silán v ňom sú prakticky nepostrádateľné. AMIAC Pod Rozchinni, voda je základom nH 3 h 2 o. S Roschinenni vo vode, selenovodoroda, tellurovodorod, a také halogenovodorodov sú stiahnuté vzorcom, I vodnevi spoluki: h 2 s, h 2 s, h2Te, HF, HCl, HBr, HI.
Ak vyrovnáte acidobázickú silu zlúčenín vody vytvorených nekovmi jedného obdobia, napríklad iného (NH 3, H 2 O, HF) alebo tretieho (PH 3, H 2 S, HCl), potom môže vyvodiť záver o prirodzenom posilňovaní ich kyslých síl a zrejme o oslabení zásaditých. Je to zrejme spôsobené tým, že sa polarita zvyšuje odkaz E-N(De E je nekov).
Acidobázická sila vodných zlúčenín nekovov jednej podskupiny je tiež rozdelená. Napríklad v rade halogenovodíkov HF, HCl, HBr, HI sa význam väzby E-H mení, pretože sa zvyšuje sila väzby. V rôznych druhoch HCl, HBr, HI disociujú takmer úplne od silných kyselín a ich sila sa zvyšuje z HF na HI. V tomto prípade sa HF redukuje na slabé kyseliny, čo je podmienené ďalším faktorom - medzimolekulovou interakciou, tvorbou vodných väzieb...HF...HF.... Atómy vody sú viazané na atómy fluóru F nielen jeho molekuly, ale aj a slúžka.
Uzagalnuyuchi rovnaké vlastnosti acidobázická sila vodných zlúčenín nekovov, učíme sa o zosilňovaní kyslosti a zoslabovaní zásaditej sily týchto látok v priebehu období a hlavné podskupiny so zvýšenými atómovými číslami vytvárajú ich prvky.
Počas obdobia v PS chemických prvkov v dôsledku zvýšenia poradového čísla prvku - nekovu sa zvyšuje kyslosť vodovodnej prípojky.
SiH4 -> PH3 -> H2S -> HCl
Vodné efekty nekovov pri oxido-bázových reakciách okrem vyššie uvedených mocností vždy ukazujú sily nových a aj v nich je nekov na nižšom stupni oxidácie.
Voden
voden - hlavový prvok Celý svet. Väčšina kozmických objektov (plynové oblaky, hviezdy vrátane Slnka) je z menej ako polovice tvorená vodou. Na Zemi vrátane atmosféry, hydrosféry a litosféry len 0,88 %. Aloe má veľkú hmotnosť, ale atómová hmotnosť vody je veľmi malá. Preto vzniká malé množstvo a z každých 100 atómov na Zemi je 17 atómov vody.
Vo voľnej prírode sa voda objavuje vo forme molekúl H 2, atómy sú spojené do molekuly kovalentná nepolárna väzba.
Voden (H 2) je najľahší plyn zo všetkých riek podobných plynu. Budem mať najvyššiu tepelnú vodivosť a najnižší bod varu (po héliu). Mierne rozpustný vo vode. Pri teplote -252,8 ° C a atmosférickom tlaku sa voda stáva vzácnou.
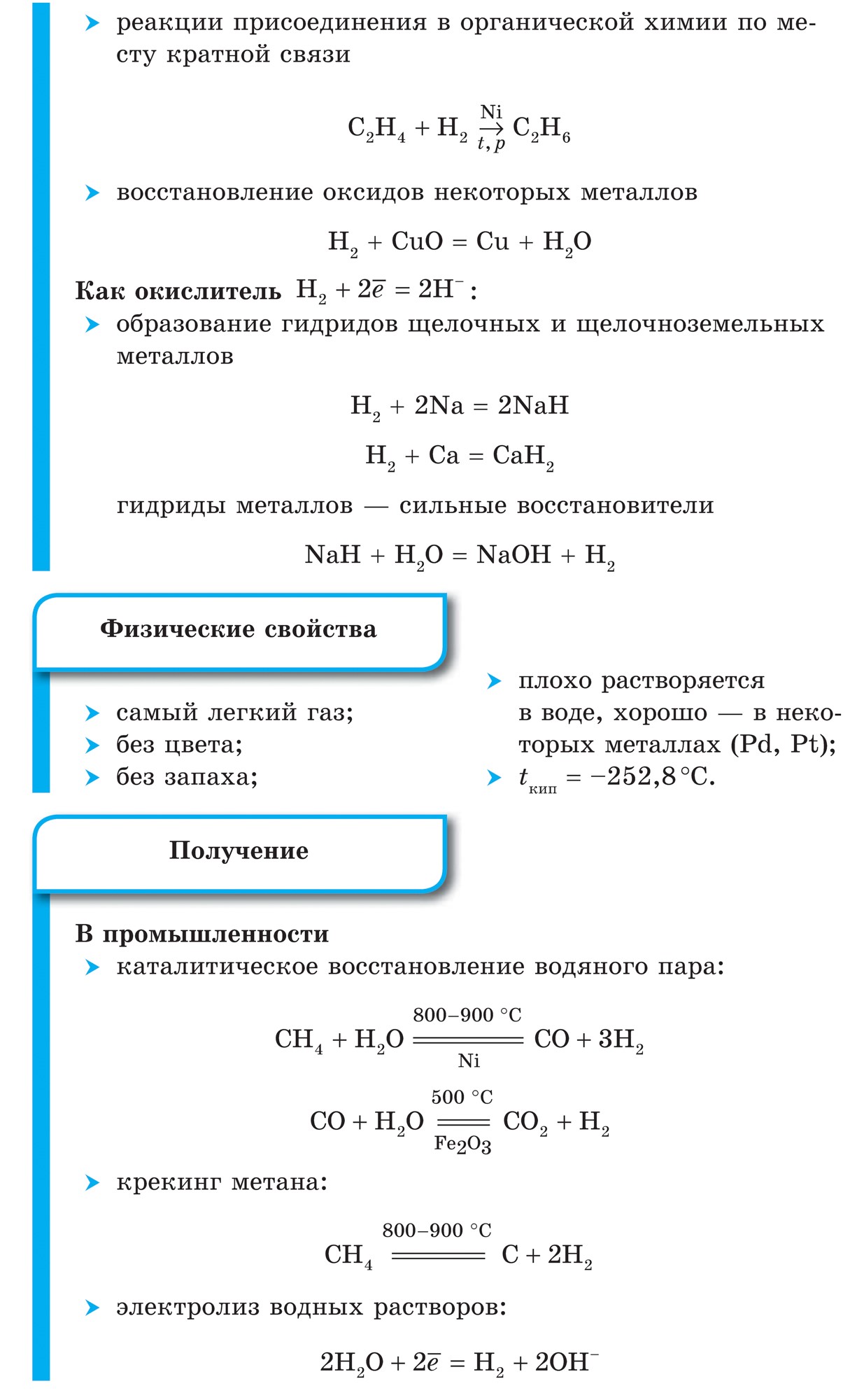
1. Molekula vody je oveľa silnejšia ako predtým, čo s tým neaktívne:
H 2\u003d 2H - 432 kJ
2. Pri extrémnych teplotách voda reaguje s aktívnymi kovmi:
Ca + H2 \u003d CaH2,
solubilizujúci hydrid vápenatý, is F 2, solubilizujúci fluorovodík:
F2 + H2 \u003d 2HF
3. Kedy vysoké teploty odstrániť amoniak:
N2 + 3H2 \u003d 2NH3
a hydrid titánu (kovový prášok):
Ti + H2 \u003d TiH 2
4. Pri použití vody reaguje kyslosťou:
2H 2 + O 2 \u003d 2 H 2 O + 484 kJ
5. Voden Voloďa je vysoko cenená budova:
CuO + H2 \u003d Cu + H20

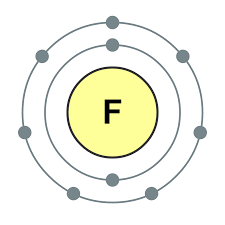
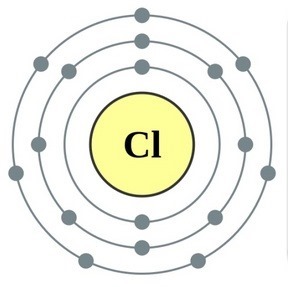
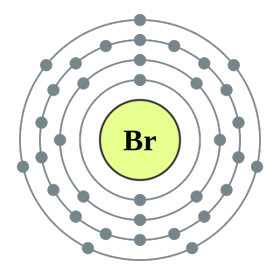
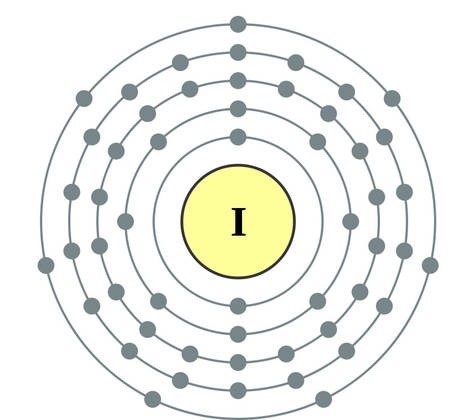
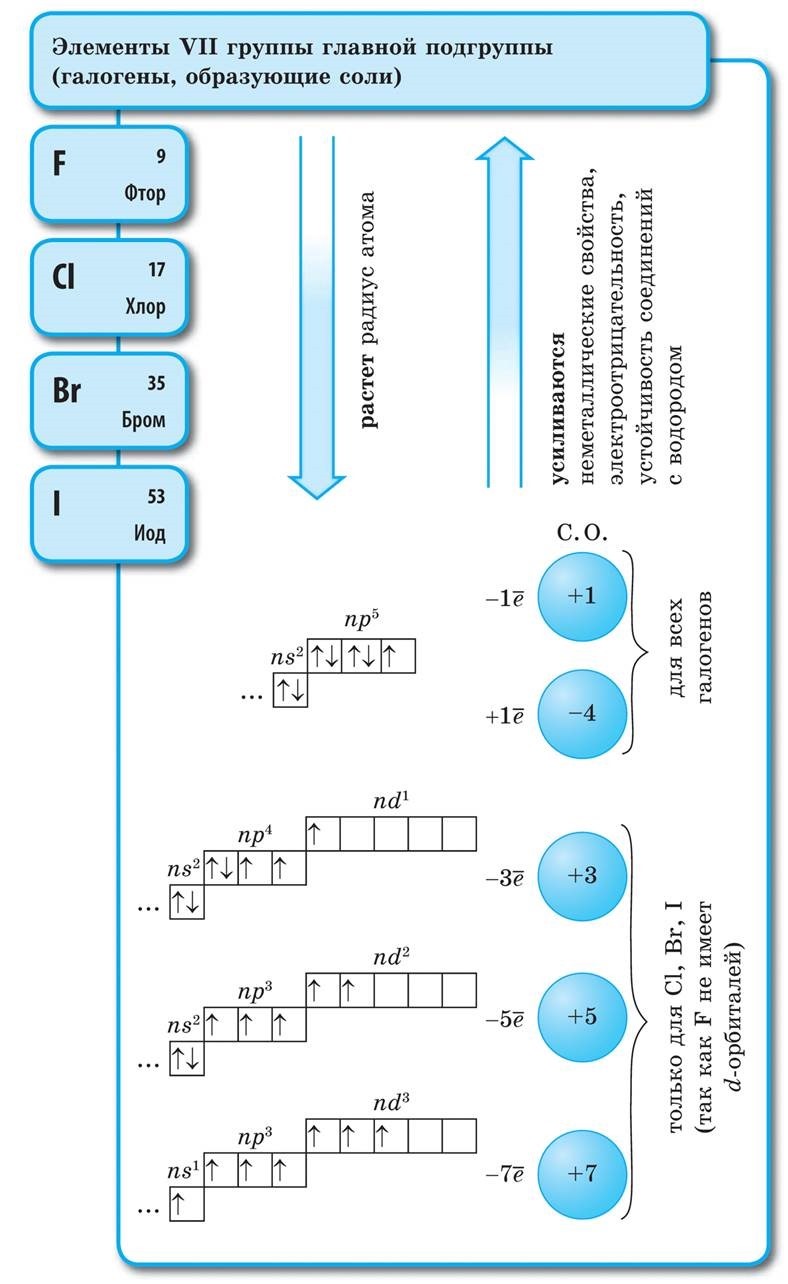
Prvky hlavnej podskupiny skupiny VII periodického systému, zjednotené pod spoločným názvom halogény, Fluór (F), chlór (Cl), bróm (BG), jód (I), astatín (At) (zriedka sa vyskytujúci v prírode) sú typické nekovy. Je to pochopiteľné a dokonca aj ich atómy sa pomstia na vonkajšej energetickej úrovni týchto elektrónov, A vyraďujem len jeden elektrón, aby som to dokončil. Atómy týchto prvkov pri interakcii s kovmi prijímajú elektrón z atómov kovu. V tomto prípade sa vytvorí iónová väzba a soli sa stabilizujú. Názov slova je „halogény“, t.j. „soli Narodzhuyut“.
veľmi silne oxiduje. Fluór v chemických reakciách vykazuje iba oxidy sily a jeho charakteristický oxidačný stupeň je -1. Tieto halogény môžu vykazovať značnú silu pri interakcii s viac elektronegatívnymi prvkami - fluórom, kyselinou, dusíkom, kde stupeň ich oxidácie môže narásť až na hodnotu +1, +3, +5, +7. Ohromujúca sila halogénov sa zvyšuje od chlóru k jódu, čo je spojené so zväčšením polomerov ich atómov: atómy chlóru sú približne dvakrát toľko ako atómy jódu.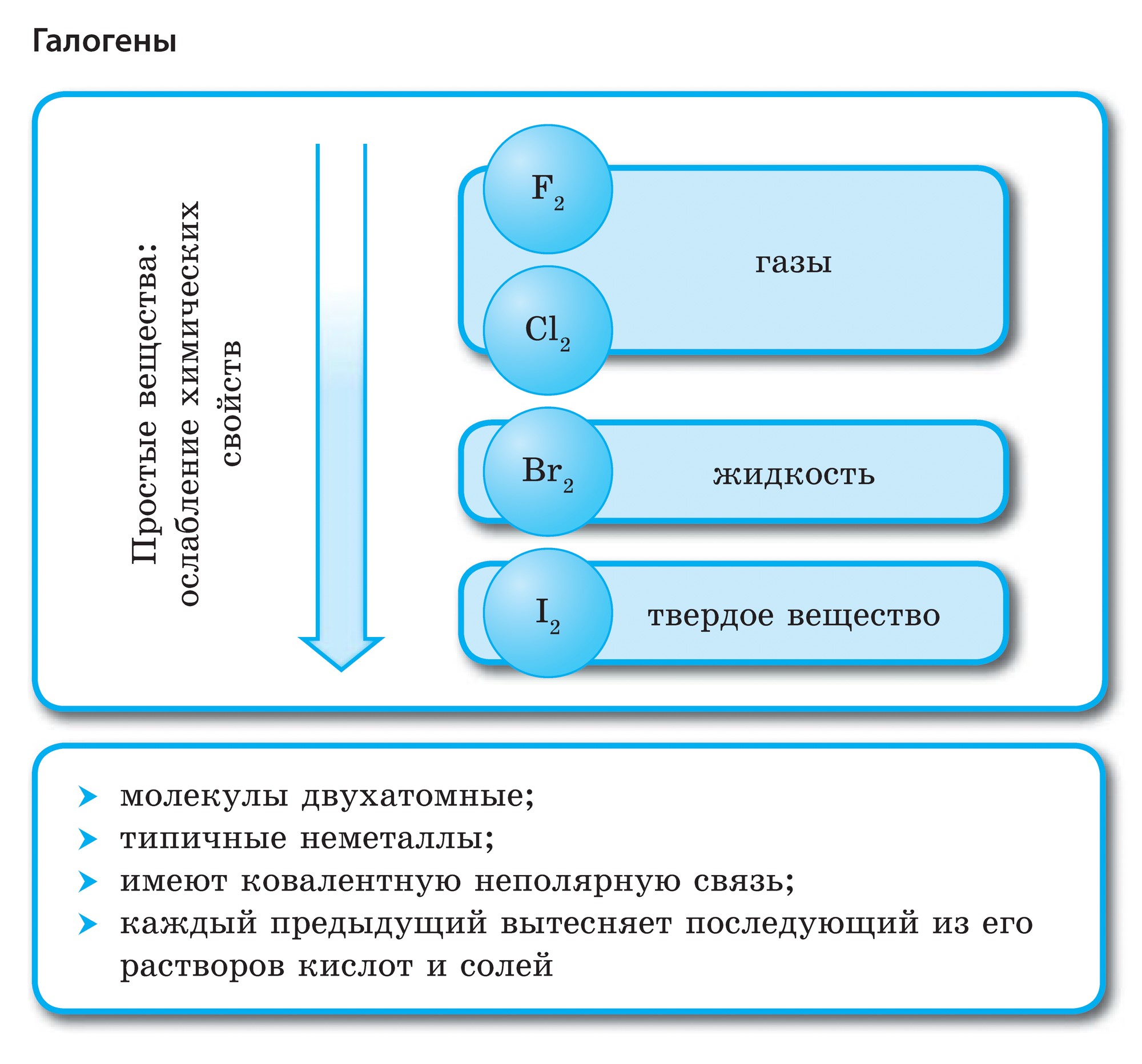
Galogény – jednoduché slová
Všetky halogény sa objavujú vo forme dvojatómových molekúl s kovalentnou nepolárnou chemickou väzbou medzi atómami. V pevnom stave F2, Cl2, Br2, I2 tkáčsky stav molekulárne kryštálové mriežky, čo je nimi potvrdené fyzické autority.
S nárastom molekulovej hmotnosti halogénov sa pohybujú teploty topenia a varu, zvyšujú sa sily: bróm - kyselina, jód - tuhý hydroxid, fluór a chlór - plyny. Je to spôsobené tým, že so zväčšenou veľkosťou atómov a molekúl halogénov sa medzi nimi zvyšujú sily medzimolekulovej interakcie. Od F 2 do I 2 sa intenzita úbytku halogénov zvyšuje.
Chemická aktivita halogénov ako nekovov od fluóru po jód je slabšia, Jódové kryštály majú kovový lesk. Halogén pokožky je najsilnejším oxidačným činidlom vo svojom období. Oxidy sily halogénov sa zreteľne prejavujú pri interakcii s kovmi. V tomto bode sa soli rozpustia. Tak fluór aj v extrémnych podmienkach reaguje s väčšinou kovov a pri zahrievaní so zlatom, striebrom, platinou prejavuje svoju chemickú pasivitu. Hliník a zinok spaľujú fluór v atmosfére:
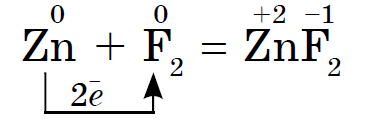
Halogény Reshta pri zahrievaní reagujú s kovmi. Zahrejte slaný prášok a ten sa tiež vznieti, keď reaguje s chlórom. Dôkaz je možné vykonať ako pri surme, ale iba štítnu žľazu je potrebné vopred zapáliť v liečivej lyžičke a potom ju po malých častiach rozšľahať do banky s chlórom. Keďže chlór je silné oxidačné činidlo, výsledkom reakcie je vytvorenie chloridu (III):
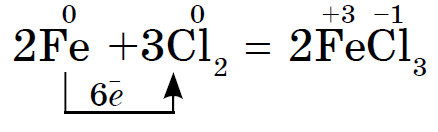
Pary obsahujú bróm spáli upečený med vysuší:
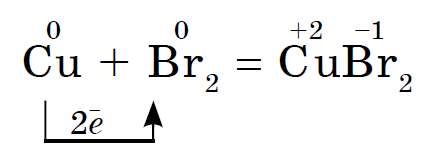
Jód viac oxiduje kovy Avšak v prítomnosti vody, ktorá je katalyzátorom, reakcia jódu s hliníkovým práškom prebieha veľmi energicky:
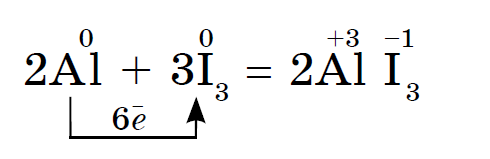
Reakcia je sprevádzaná uvoľňovaním fialových pár z jódu.
O zmenách oxidačných a zvýšených oxidačných silách halogénov z fluóru na jód možno posúdiť a podľa ich kvality určiť jeden zo stupňov ich solí, A tiež sa to prirodzene prejavuje, keď interagujú s vodou. Táto reakcia môže byť napísaná vo formálnej forme takto:
Yakshcho fluór je vzájomný vo Wighs s Vibahu, potom zhrnutý chlór reakcie reakcie pri Pidpalyanni-to-hand-to-hand-to-fee, Brom Delight, Brome with the Water s vyhrievaným I bez Vibuha. Tieto reakcie sú exotermické. Reakcia medzi jódom a vodou je slabo endotermická a po zahriatí prebieha úplne.
V dôsledku týchto reakcií vzniká fluorovodík HF, kyselina chlorovodíková HCl, bromovodík HBr a jodovodík HI.
Chemická sila chlóru v tabuľkách

odstránenie halogénov
Fluór a chlór sa odstraňujú elektrolýzou tavenín alebo ich rozpustených solí. Napríklad proces elektrolýzy s roztaveným chloridom sodným možno modifikovať takto:
Keď sa chlór odstraňuje elektrolýzou z chloridu sodného, chlór sa tiež rozpustí s vodou a hydroxidom sodným:
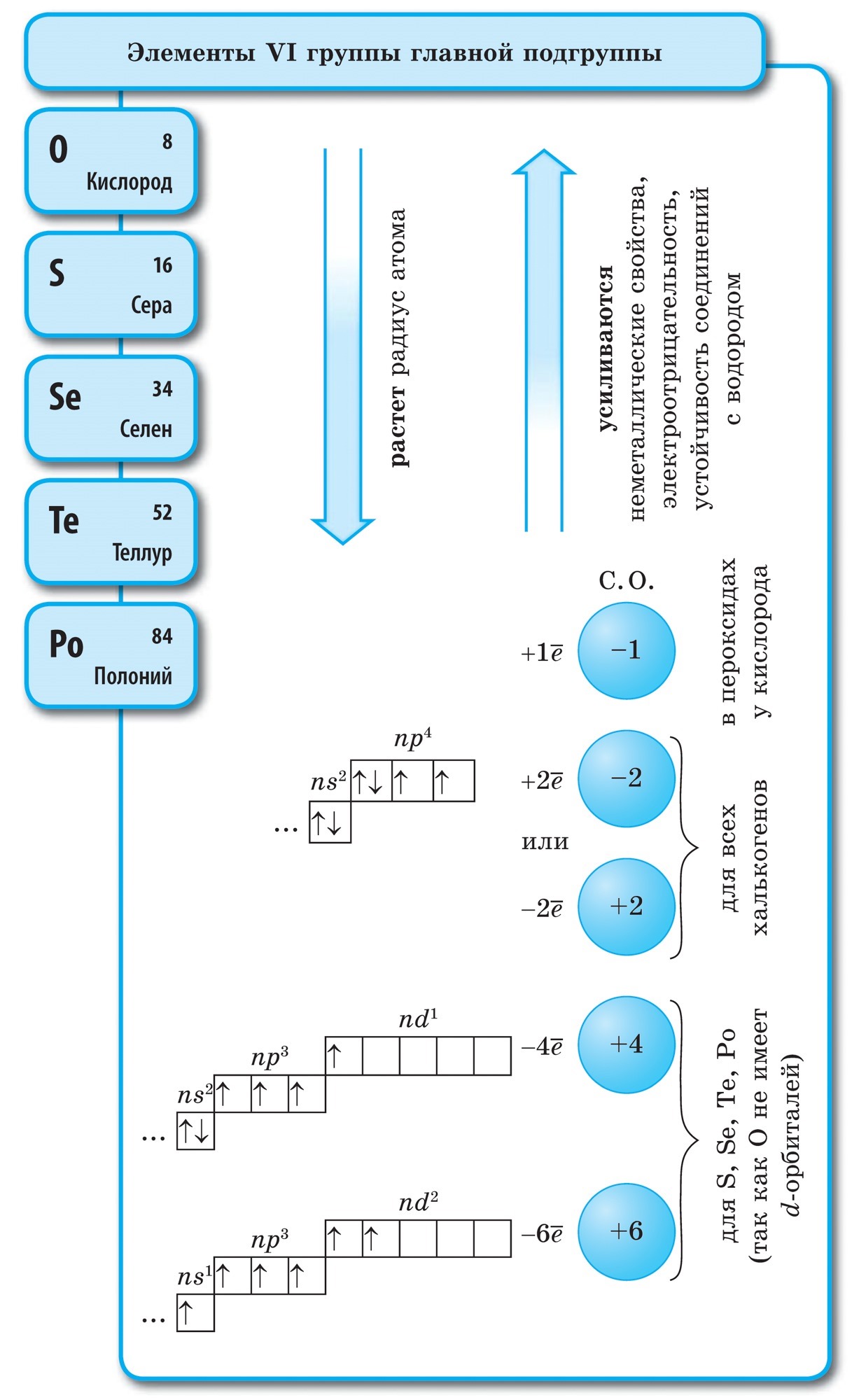
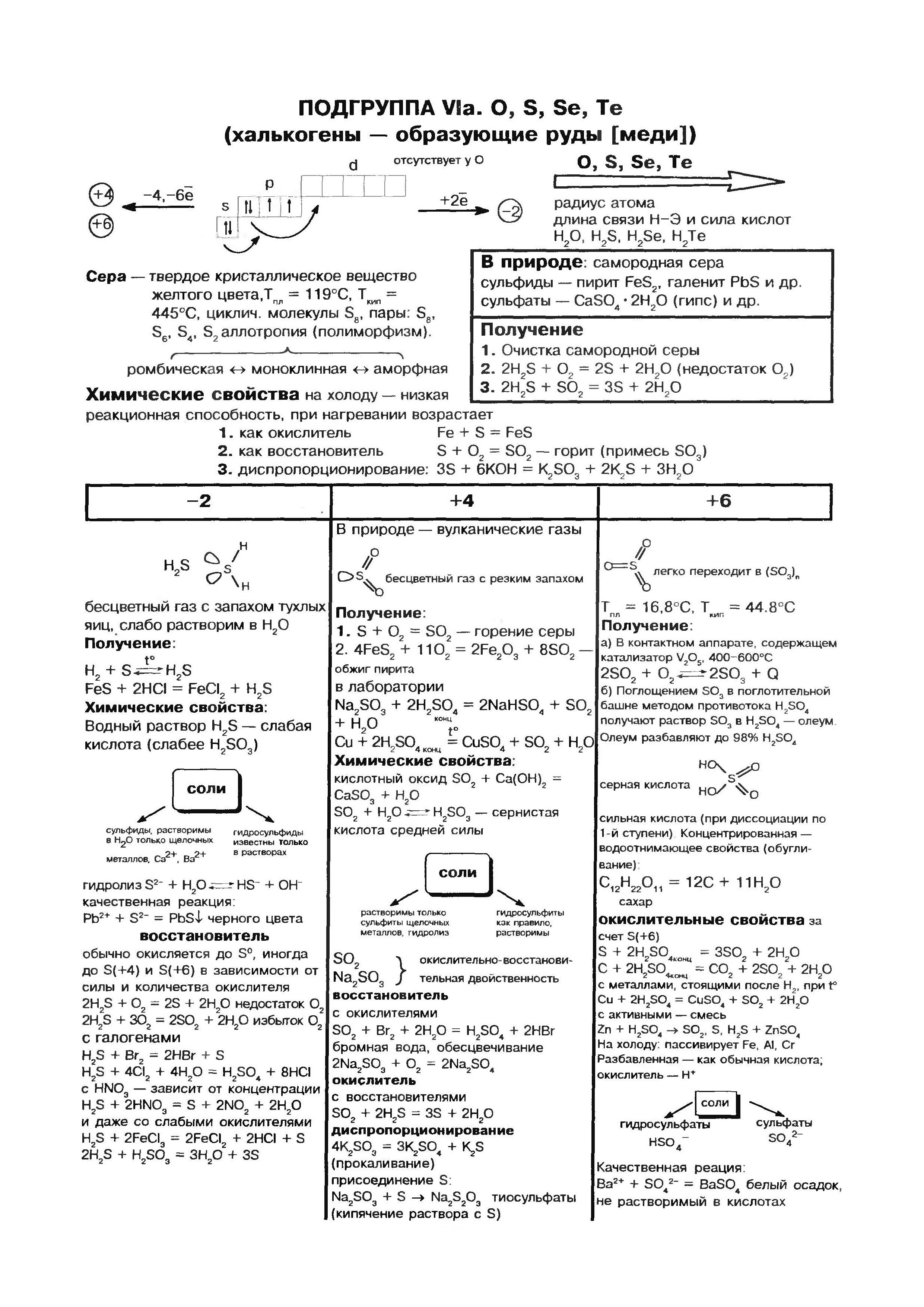
Kisen (O)- predchodca hlavnej podskupiny VI. skupiny periodickej sústavy prvkov. Prvky tejto podskupiny - kislen O, síra S, selén Se, telur Ti, polónium Po - možno nazvať "chalkogén", čo znamená "produkovať rudy".
Kisen je najširší prvok na našej planéte. Dosahuje zásobu vody (88,9 %) a pokrýva aj 2/3 povrchu zemského jadra, čím vytvára jeho vodný obal – hydrosféru. Kisen - priateľ pre množstvo a prvý pre významy pre život skladová časť Vzdušným obalom Zeme je atmosféra, kde táto časť tvorí 21 % (objemovo) a 23,15 % (hmotnostne). Kisen vstupuje do skladu číselných minerálov pevného obalu zemskej kôry – litosféry: z každých 100 atómov zemskej kôry pripadá 58 atómov na časť kisenu.
Pôvodný kisen je vo forme O2. Je to plyn bez farby, zápachu a chuti. V ojedinelých prípadoch je sfarbenie svetlomodré, v ťažkých prípadoch modré. Vo vode je kyslosť podobná plynu silnejšia, nižšia ako dusík a voda.
Kisen interaguje s väčšinou jednoduchých prejavov, vrátane halogénov, vzácnych plynov, zlata a platinových kovov. Reakcie nekovov s kyselinou často prebiehajú za prítomnosti veľkého tepla a sú sprevádzané spaľovacími – spaľovacími reakciami. Napríklad horský sirup obsahuje SO 2, fosfor - P 2 O 5, alebo vugilla - CO2. Možno všetky reakcie zahŕňajúce kyselinu sú exotermické. Výsledkom je interakcia dusíka s kyselinou: endotermická reakcia, ktorá sa vyskytuje pri teplotách nad 1200 ° C alebo počas elektrického výboja:
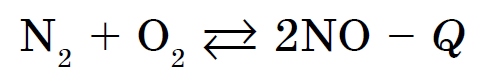
Oxidácia energeticky oxiduje nielen jednoduché látky, ale aj mnohé zložité zlúčeniny, čím vznikajú oxidy prvkov, ktoré spôsobujú zápach:
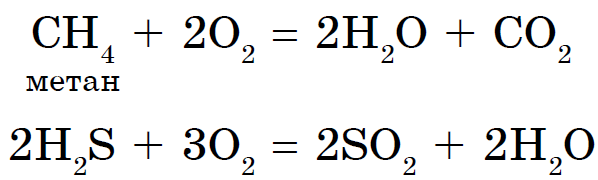
Vysoké oxidačné vlastnosti kyslosti sú základom spaľovania všetkých druhov horenia.
Kisen sa podieľa na procesoch úplnej oxidácie rôznych látok pri extrémnych teplotách. Dôležitá je aj úloha kyseliny v procese vymierania ľudí a tvorov. Roslini tiež íly atmosférické želé. Ak v tme dochádza len k procesu vypálenia kyslosti riasami, na svetle prebieha ďalší dlhotrvajúci proces - fotosyntéza, v dôsledku ktorej riasy absorbujú oxid uhličitý a vytvárajú kyslosť.
V priemysle sa želé chráni pred zriedkavým vetrom a v laboratóriu - Cesta je vyložená peroxidom vody v prítomnosti katalyzátora a oxidu manganičitého MnO 2 :
![]()
ako aj distribúcia manganistanu draselného KMnO 4 pri zahrievaní:
Chemická sila a kyslosť v tabuľkách
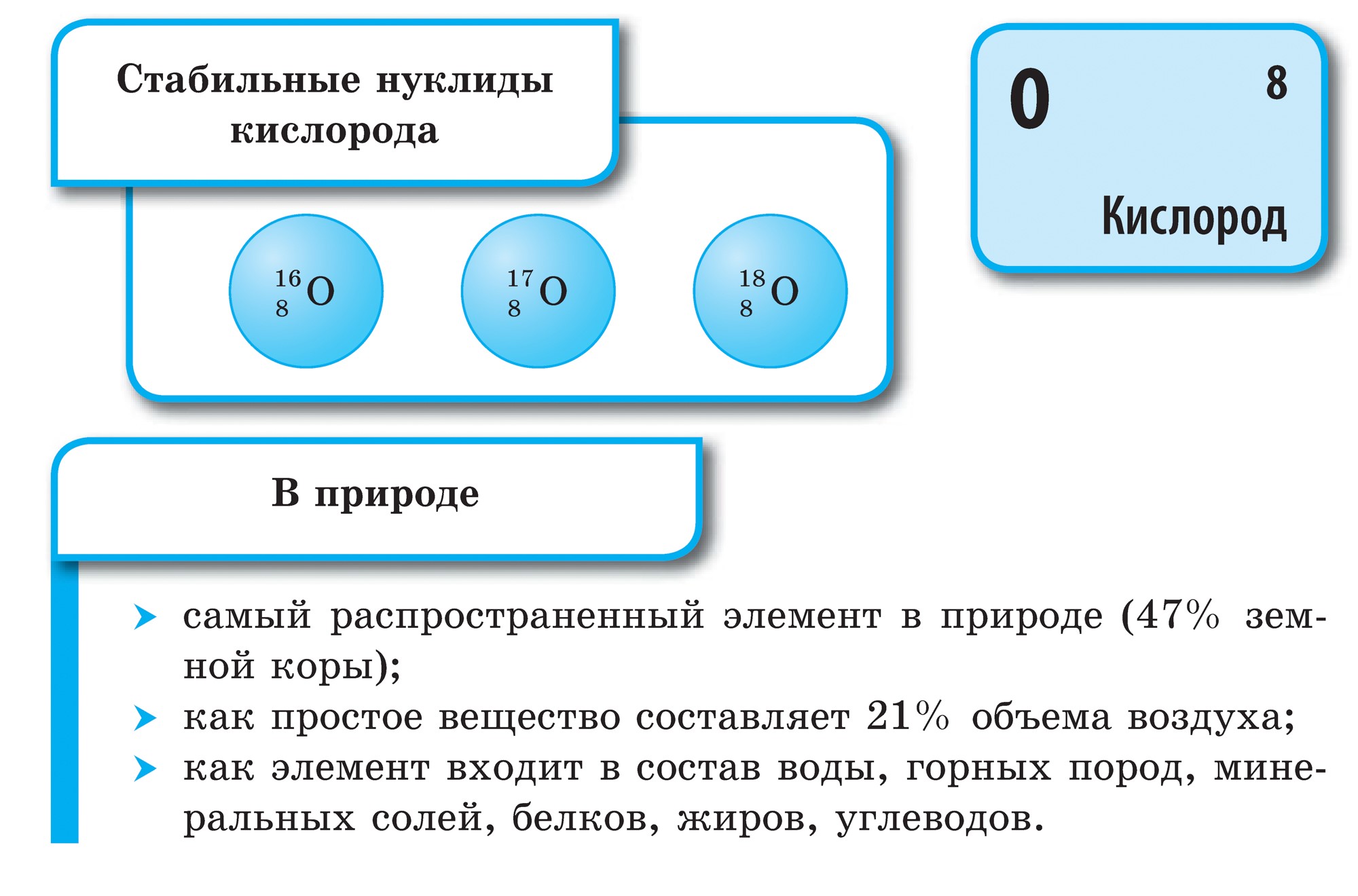

zastosuvannya kisnyu
Kisen sa používa v metalurgickom a chemickom priemysle na urýchlenie (intenzifikáciu) výrobných procesov. Čisté želé sa používa aj na odolávanie vysokým teplotám, napríklad pri zváraní plynom a rezaní kovov. V medicíne sa kašovitá stagnácia vyskytuje počas epizód dočasných ťažkostí s dýchaním spojených s určitými chorobami. Kisen sa používa aj v metalurgii ako okysličovadlo pre raketové palivo, v letectve na dýchanie, na rezanie kovov, na zváranie kovov a vo vibračných robotoch. Kisen je uložený v oceľových valcoch, potiahnutých čiernou farbou, pod tlakom 150 atm. V laboratórnych mysliach sa mus šetrí v prekliatych prístrojoch – plynomere.
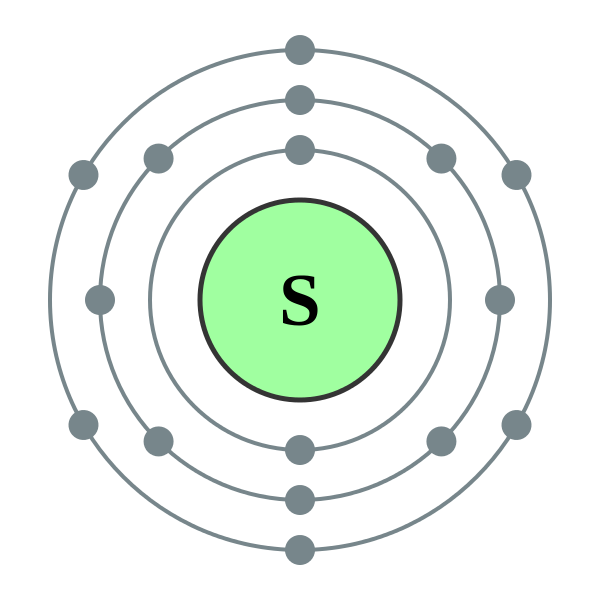
atómy sirki (S), Rovnako ako atómy kyslosti a všetky ostatné prvky hlavnej podskupiny skupiny VI, umiestnite na aktuálnu energetickú úroveň 6 elektrónov, s dva elektróny sú nepárové. Avšak kyslé atómy zarovnané s kyslými atómami majú väčší polomer, menšiu elektronegativitu, a preto vykazujú nové sily, ktoré vytvárajú spojenia s oxidačnými krokmi. +2, +4, +6. Vo vzťahu k menšiemu počtu negatívnych prvkov (voda, kovy) roztok vykazuje oxidy sily a zvyšuje oxidačný stupeň -2 .
Sirka je jednoduchá reč
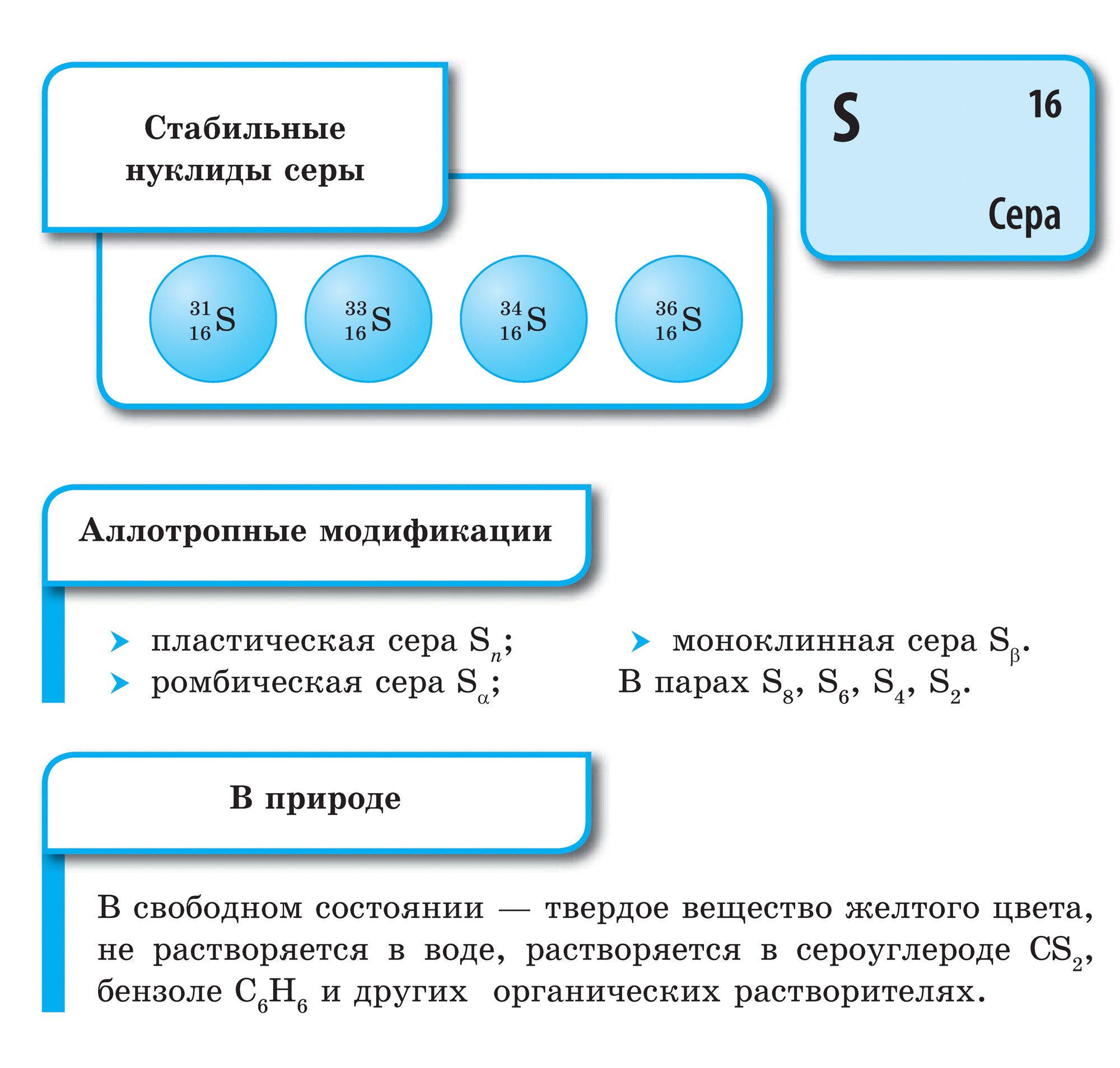
Alotropia je charakteristická pre sirka, rovnako ako kisnu. Existuje množstvo modifikácií sirupu s cyklickými alebo lineárnymi molekulami rôzneho zloženia.
Najstabilnejšia modifikácia je známa ako kosoštvorcový kryštál, ktorý je tvorený molekulami S 8. Tieto kryštály majú vzhľad osemstenov s brúsenými výbrusmi. Vône sú pripravené v citrónovo žltej farbe a aróme, bod topenia 112,8°C. Táto úprava premieňa všetky ostatné úpravy pri izbovej teplote. Pri kryštalizácii vystupuje z taveniny monoklinický kryštál (časti kryštálu, teplota topenia 119,3 °C), ktorý sa následne mení na kosoštvorcový. Keď sa látka zahreje, síra vo vzorke sa roztopí a zmení sa na žltú. Pri teplote asi 160 ° C síra začína tmavnúť, stáva sa hustá a viskózna, nevyteká zo skúmavky a pri zahrievaní sa ďalej mení na ľahko drobivú kvapalinu, ale zachováva si bohatú tmavohnedú farbu. Ako vstúpiť do studená voda, Vona padne pohľad na priehľadnú gumovú hmotu. Toto je plast. Dá sa odstrániť vo forme nití. Po niekoľkých dňoch sa tiež zmení na kruh v tvare diamantu.
Sirka sa nerozpadne pri vode. Kryštály síry klesajú vo vode a prášok pláva na hladine vody, pretože zrnité kryštály soľanky nie sú zmáčané vodou a vo vetre ich držia nad vodou zrnité cibuľky. Toto je flotačný proces. Sirup je mierne rozpustný v etylalkohole a dietyléteri, dobre sa rozpúšťa v sírovom uhlíku.
S najlepšími rozummi Síra silne reaguje s bázickými a nízkymi kovmi, medom, ortuťou, doskou, Napríklad:
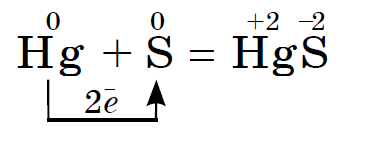
Táto reakcia je základom pre detekciu a emisiu rozliatej ortuti, napríklad z rozbitého teplomera. Viditeľné kvapky ortuti sa môžu zbierať na papieri alebo na strednom plaste. Tá ortuť, ktorá sa stratila v štrbinách, musí byť pokrytá práškom sirka. Tento proces sa nazýva demerkurizácia.
Pri zahrievaní síra reaguje s inými kovmi (Zn, Al, Fe) a iba zlato s ňou z akéhokoľvek dôvodu neinteraguje. Oxidy sily síry sa prejavujú s vodou, ktorá pri zahrievaní reaguje:
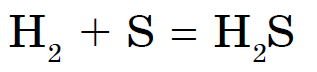
Len dusík, jód a vzácne plyny nereagujú s nekovmi. Síra horí na modrasté polovice a rozpúšťa oxid síry (IV):
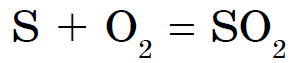
Táto zlúčenina je všeobecne známa ako čistý plyn.
Chemická sila v tabuľkách

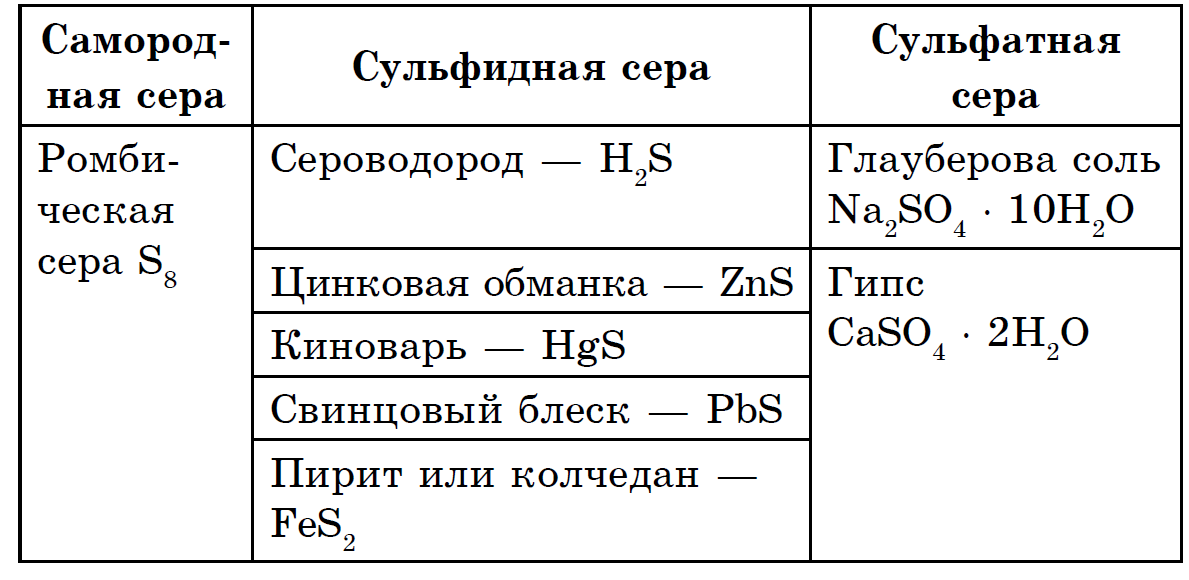
Sirka je rozdelená na veľké množstvo prvkov: zemská kôra obsahuje 4,7 · 10-2% soli na hmotnosť (15. miesto medzi ostatnými prvkami) a Zem ako celok obsahuje oveľa viac (0,7%). Hlavová hmota šťavela sa nachádza v hlbinách zeme, v jej plášťovej gule, rozprestierajúcej sa medzi zemskou kôrou a zemským jadrom. Tu, v hĺbke približne 1200-3000 km, leží hrubá guľa sulfidov a oxidov kovov. V zemskej kôre je kôra zaostrená ako vo voľnej forme (natívnej), tak predovšetkým vo forme sulfidov a síranov. Najrozšírenejšími sulfidmi v zemskej kôre sú pyrit FeS2, chalkopyrit FeCuS2, olovnatý blisk (galenit) PbS, zmes zinku (sfalerit) ZnS. Veľké množstvo síry sa nachádza v zemskej kôre vo forme dôležitých síranov - sadra CaSO4 2H2O, baryt BaSO4, v morskej vode je obohatená o sírany horčíka, sodíka a draslíka.
Je dôležité, že v dávnych dobách geologickej histórie Zeme (asi pred 800 miliónmi rokov) v prírode neboli žiadne sírany. Zápach sa objavil ako produkt oxidácie sulfidov, ak v dôsledku života vinylových rastlín bola kyslá atmosféra. Sopečné plyny obsahujú kyslý anhydrid H2S a kyslý anhydrid SO2. Je to spôsobené pôvodnou sírou, ktorá prúdi v oblastiach blízko aktívnych sopiek (Sicília, Japonsko) a mohla vzniknúť interakciou týchto dvoch plynov:
2H2S + S02 \u003d 3S + 2H20.
Iné druhy pôvodného zrna sú spojené so životom mikroorganizmov.
Mikroorganizmy berú svoj osud od bohatých chemické procesy, Ako ako celok tvoria cyklus sirka v prírode. Pri ich konjugácii dochádza k oxidácii sulfidov na sírany, sírany sú degradované živými organizmami a kvapalina sa obnovuje a vstupuje do zásobárne bielkovín a iných životne dôležitých látok. Keď mŕtve prebytočné organizmy hnijú, bielkoviny sa rozpadajú a vidíte síran, ktorý potom oxiduje buď na elementárnu síru (takto vznikajú sírne usadeniny), alebo na sírany. Je dôležité, aby sa v ich bunkách hromadili baktérie a riasy, ktoré okysličujú vodu. Bunky takýchto mikroorganizmov môžu byť z 95 % zložené z čistého sirupu.
Charakter síry je možné určiť zrejmou prítomnosťou jej analógu - selénu: zatiaľ čo prírodná síra obsahuje selén, vulkanický sir chýba - biogénny, pretože mikroorganizmy sú jedinečné v tom, že do nej obsahujú selén. Životný cyklus, aj biogénna síra, miesto viac izotopu 32S, nižšie ťažké 34S.
Biologický význam sirka
Životne dôležitý chemický prvok. Patrí sem ukladanie bielkovín – jednej z hlavných chemických zložiek buniek všetkých živých organizmov. Obzvlášť veľa šedej je v bielkach vlasov, rohov a vonku. Okrem toho je mlieko zásobárňou biologicky aktívnych látok v tele: vitamínov a hormónov (napríklad inzulínu). Sirka sa podieľa na procesoch na báze oxidov v tele. Ak je v tele nedostatok vosku, pozor na lámavosť a lámavosť štetcov a vypadávanie vlasov.
Šedé bohaté strukoviny (hrach, sochetica), ovsená tráva, vajcia.
zastosuvannya sirki
Syrka sa vyrába pri výrobe kyslých plodov a papiera, gumy a farbív, vodky a laku, plastov a kozmetických prípravkov. Vo vidieckej nadvláde sú to vikorysti, ktorí bojujú proti rozmaznávačom Roslinovcov. Hlavným zdrojom produkcie mlieka je však chemický priemysel. Približne polovica toho, čo sa vo svete vyrobí, ide na výrobu kyseliny sírovej.
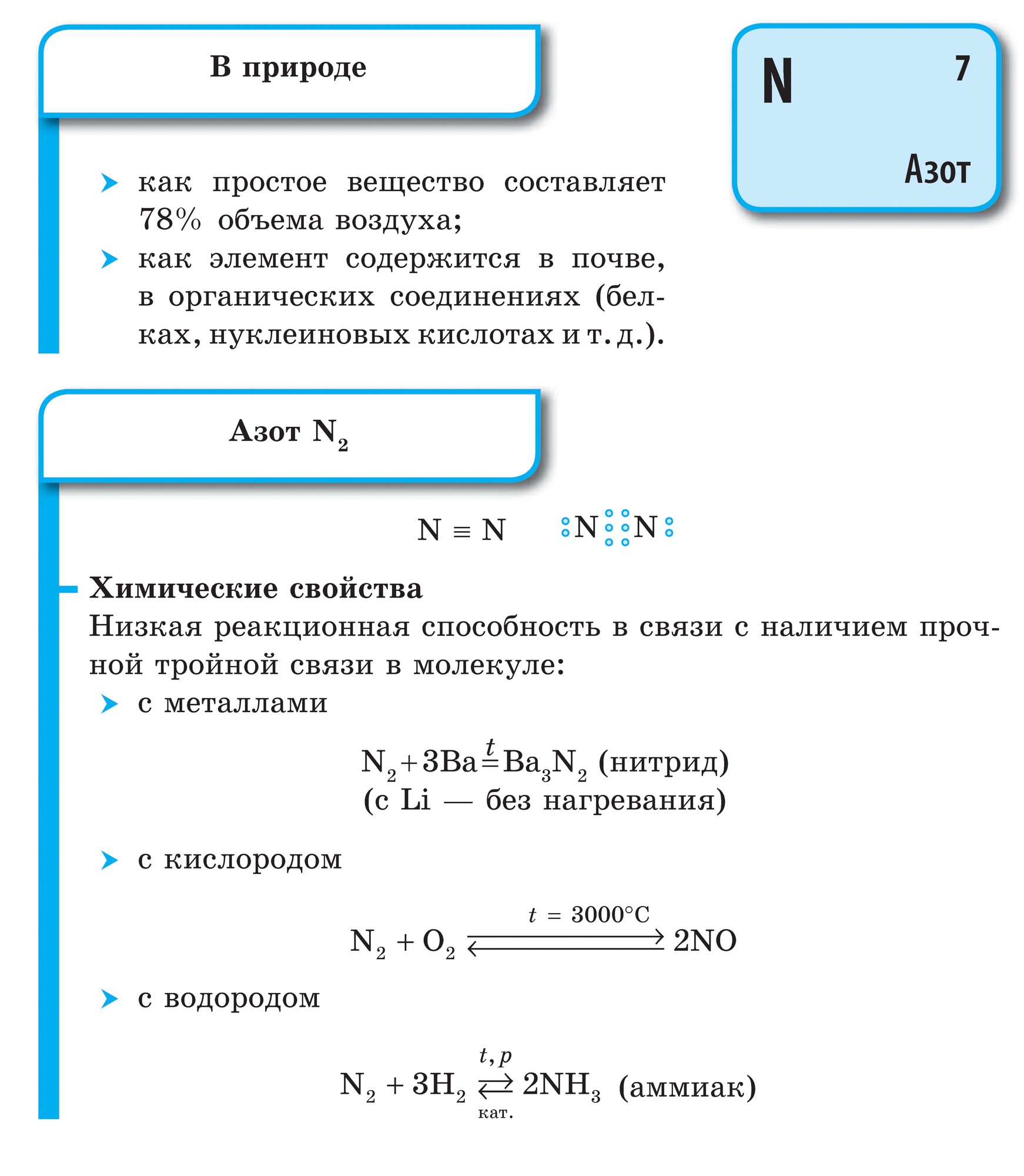
dusíka
![]()
dusík (N)- prvý zástupca hlavnej podskupiny V. skupiny periodickej tabuľky. Tento atóm má na vonkajšej energetickej úrovni päť elektrónov, z ktorých tri sú nepárové. Ukazuje sa, že atómy týchto prvkov môžu prijať tri elektróny, čím sa dokončí súčasný energetický tok.
Atómy dusíka môžu dať vlastné elektróny viac elektronegatívnym prvkom (fluór, kyslosť) a získať oxidačný stupeň +3 a +5. Atómy dusíka vykazujú nové sily v štádiách oxidácie +1, +2, +4.
Vo všeobecnosti sa dusík nachádza vo vode v dvojatómovej molekule N2. V tejto molekule sú dva atómy N spojené treťou kovalentnou väzbou a väzba môže byť označená nasledovne:

Dusík je jalový plyn bez zápachu a chuti.
S najlepšími rozummi Dusík interaguje iba s lítiom a solubilizuje nitrid Li 3 N:
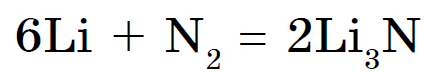
Ostatné kovy interagujú iba pri vysokých teplotách.
Aj pri vysokých teplotách a tlaku v prítomnosti katalyzátora dusík reaguje s vodou a rozpúšťa amoniak:
Pri teplote elektrického oblúka sa víno spája s kyselinou a vytvára oxid dusíka (II):
Chemická sila dusíka v tabuľkách

stagnácia dusíka
Dusík extrahovaný vzácnou destiláciou v priemysle stagnuje na syntézu amoniaku a hnojenie kyselina dusičná. V medicíne sa čistý dusík stagnuje v inertnom médiu na liečbu tuberkulózy pľúc a vzácny dusík sa používa na liečbu chorôb chrbtice, kĺbov atď.
fosfor
Chemický prvok fosfor sa premieňa množstvom alotropných modifikácií. Dve z nich sú jednoduché slová: biely fosfor a červený fosfor. Biely fosfor tvorí molekulárnu kryštálovú mriežku, ktorá sa skladá z molekúl P4. Nerozbitné pri vode, dobre sa rozkladajú v striebornom uhlí. Na vzduchu ľahko oxiduje a v práškovom stave sa vznieti. Biely fosfor je veľmi silný. Má zvláštnu silu svietiť v tme v dôsledku oxidácie. Udržujte ho pod vodou.Červený fosfor je tmavý karmínový prášok. Čchi sa nerozkladá ani vo vode, ani v sírouhlíku. Keď je vystavený vzduchu, úplne oxiduje a neoxiduje. Je nejedovatý a v tme nesvieti. Pri zahrievaní sa červený fosfor v skúmavke premení na biely fosfor (koncentrovaná para).
Chemické vlastnosti červeného a bieleho fosforu sú blízke a biely fosfor je chemicky aktívny. Takže zápach smradu interaguje s kovmi, ktoré upokojujú fosfidy:
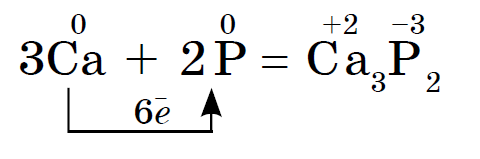
Biely fosfor sa vo vetre samovoľne zachytáva a červený fosfor pri zahriatí horí. V oboch formách vzniká oxid fosforečný (V), ktorý sa javí ako hustý biely dym:
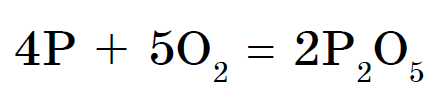
Fosfor nereaguje priamo s vodou, fosfín PH 3 možno izolovať oddelene, napríklad z fosfidov:
Fosfín - silnejší fúkať plyn h nepríjemný zápach. Vo vetre sa ľahko zapáli. Táto sila fosfínu vysvetľuje vzhľad bažinových výparov.
Chemická sila fosforu v tabuľkách


stagnácia fosforu
Fosfor je najdôležitejší biogénny prvok a zároveň má široké využitie v priemysle. Červený fosfor pri výrobe sirnikov stagnuje. Naneste ho spolu s jemne detailnou korálkou a lepidlom na prírodný povrch krabičky. Keď nastrúhate hlávku zázvoru, ktorá obsahuje chlorečnan draselný a síru, vstrebe sa.
Možno sa sila najprv zmení na fosfor, keď sa ľudia dávajú do služby - to je horľavosť. Horľavosť fosforu je veľmi vysoká a vyskytuje sa v dôsledku alotropných modifikácií.
Chemicky najaktívnejší je toxický a horľavý biely („žltý“) fosfor, ktorý sa často používa pri sterilizácii (v hasičských bombách a pod.).
Červený fosfor je hlavnou modifikáciou, viroblen a priemyselne vyrábaný. Bude stagnovať v blízkosti fermentačných burín, vibukhových riek, skladov zapaľovania, odlišné typy horiace, ako aj ropné materiály proti zadieraniu, ako sú odsávače plynu pri výrobe lámp na vyprážanie.
Fosfor (známy ako fosfáty) je jedným z troch najdôležitejších biogénnych prvkov, ktoré sa podieľajú na syntéze ATP. Veľká časť virblovaných kyselina fosforečná Idem odstrániť fosforové prísady - superfosfát, zrazenina, amofosfát atď.
Fosfáty sú široko vikorizované:
- v nádobe s komplexmi (komplexy na zmäkčovanie vody),
- v sklade Pasivátor na kovové povrchy (antikorózna ochrana napr. sklad Majef tzv.).
Schopnosť tvoriť fosfáty do trivimérovej polymérnej siete sa využíva na výrobu fosfátových a aluminofosfátových spojív.
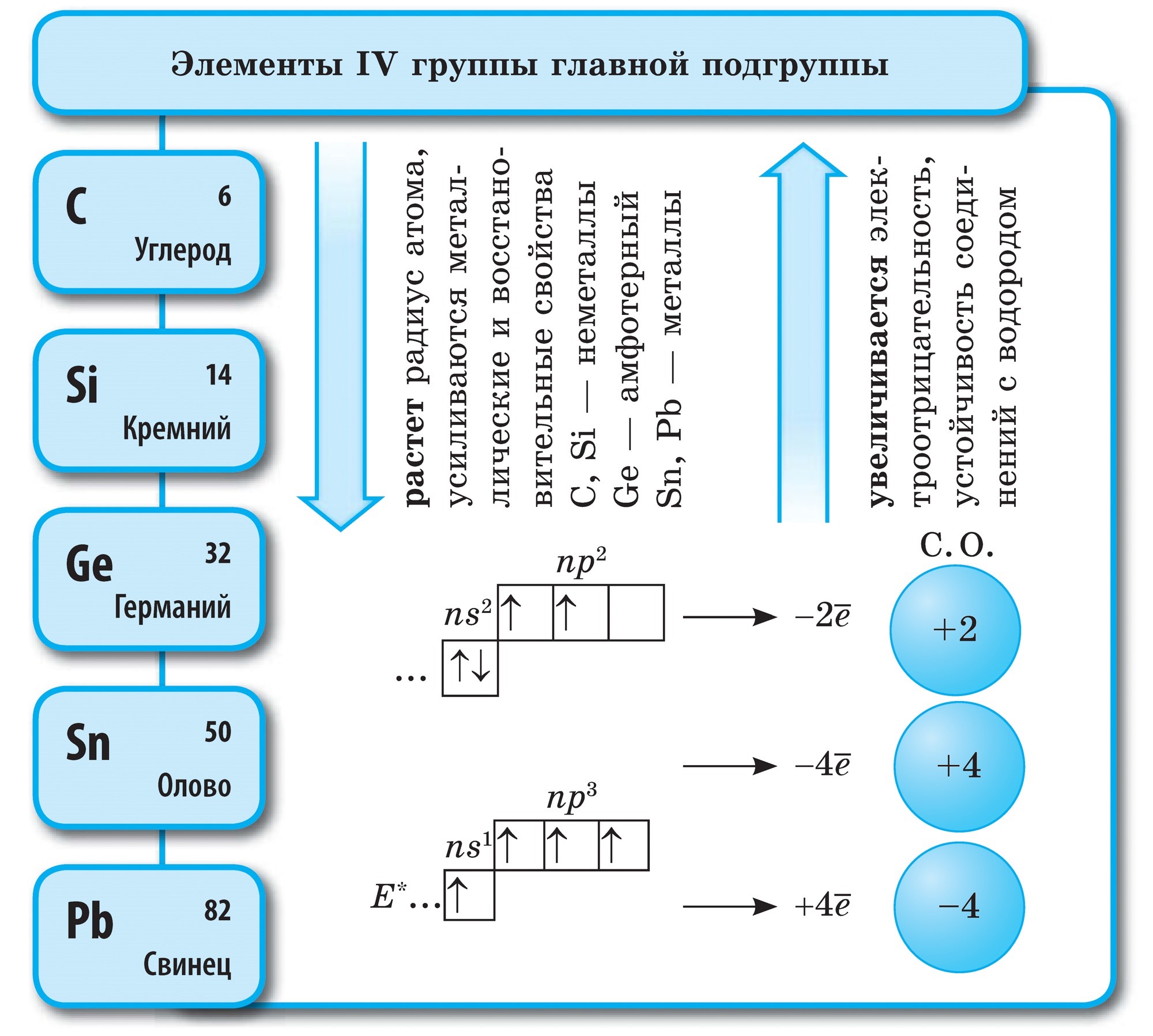
vuglets
Vuglets (C)- prvý prvok hlavnej podskupiny skupiny VI periodickej tabuľky. Váš atóm musí mať 4 elektróny na druhej úrovni, aby mohol prijať niekoľko elektrónov, pričom v tomto oxidačnom štádiu napučiava -4 , t.j. odhaliť oxidovú silu a vzdať svojich elektrónov viac elektronegatívnych prvkov, t.j. odhaliť novú silu, opuch v tomto štádiu oxidácie +4.
Vuglets je jednoduchá reč
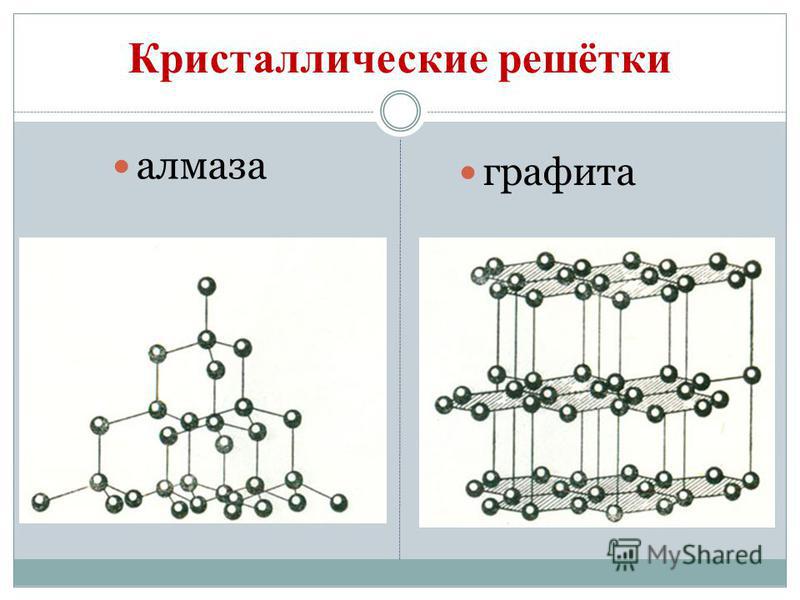
Vuglets vytvára alotropické modifikácie diamant a grafit. Diamant je čistý kryštalický potok, najtvrdší zo všetkých prírodných tokov. Slúži ako etalón tvrdosti, keďže v desaťbodovom systéme je hodnotený najvyšším skóre 10. Takáto tvrdosť diamantu je určená špeciálnou štruktúrou jeho atómového kryštalického sita. Má atóm kože naplnený rovnakými atómami, rozloženými vo vrcholoch pravidelného štvorstenu.
Diamantové kryštály sú bez bariel a sú dostupné v modrej, čiernej, červenej a čiernej farbe. Zápach vyžaruje ešte silnejšie oslnenie vďaka svojim vysokým refrakčným a svetlo vyžarujúcim vlastnostiam. A hlavne vysoká tvrdosť, smrad sa tvorí na prípravu vrtákov, vrtákov, brúsne nástroje, Rizannya skla.
Najväčšie rody diamantov sa nachádzajú v Novej Afrike a v Rusku sa nachádzajú v Jakutsku.
Grafit je tmavosivý, trochu hrubší kryštalický materiál s kovovým leskom. Namiesto diamantu je grafit mäkký (odstráni stopu na papieri) a nepriehľadný, lepšie vedie teplo a elektrinu. Mäkkosť grafitu je tvorená guľovou štruktúrou. V kryštálovej mriežke sú atómy grafitu a uhlíka, ktoré ležia v rovnakej rovine, pevne spojené do pravidelných šesťuholníkov. Prepojenia medzi plesami Malomitsna. Vin je dokonca žiaruvzdorný. Elektródy, pevné oleje, neutróny dodávajúce prostriedky v jadrových reaktoroch a nožnice pre ovce sú vyrobené z grafitu. Pri vysokých teplotách a zveráku z grafitu sa držia kusové diamanty, ktoré majú široké využitie v technike.
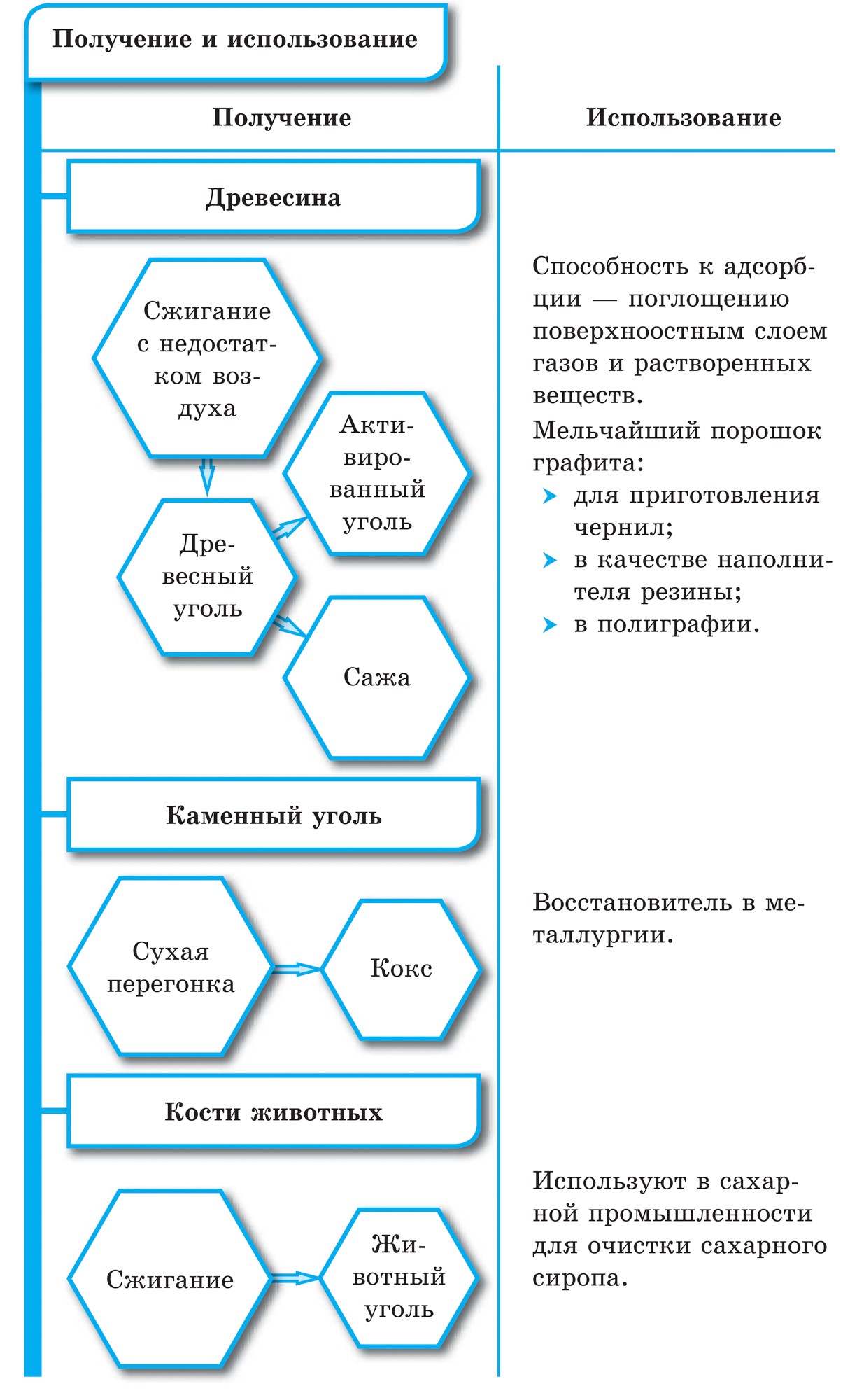
Sadze v dedine Vugilla sú podobné grafitu. Obec vugilla sa získava suchou destiláciou dreva. Táto vugilla má vďaka svojmu pórovitému povrchu zázračnú schopnosť absorbovať plyny a rozbíjať reč. Táto sila sa nazýva adsorpcia. Čím väčšia je pórovitosť dreveného uhlia, tým účinnejšia je adsorpcia. Na zvýšenie pohrebnej hodnoty je dedina Vugilla postriekaná horúcou vodnou parou. Formácia týmto spôsobom sa nazýva aktívna alebo aktívna. V lekárňach môžete predávať tablety karbolénu vo forme čiernych tabliet.
Chemická sila uhlia
Diamant a grafit sa spájajú s kyselinou pri veľmi vysokých teplotách. Sadze a vugilla interagujú s kyslým oveľa jednoduchšie, horľavé v novom. Ale v každom prípade je výsledok takejto interakcie rovnaký - vzniká oxid uhličitý:
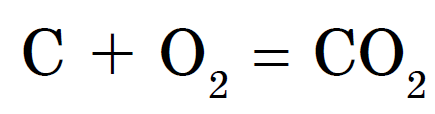
Pri zahrievaní uhlík reaguje s kovmi karbidy:
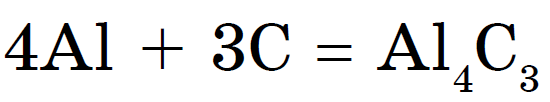
karbid hliníka- svetložlté kryštálové vízie. Pridajte karbid vápnika Sas 2 v sivej farbe. Na odstránenie acetylénu použite plynové zváračky:
acetylén použite vicor na rezanie a zváranie kovov, spaľovanie s prídavným dechtom v špeciálnych pylónoch.
Keď sa na karbid hliníka aplikuje voda, uvoľní sa ďalší plyn - metán CH 4:
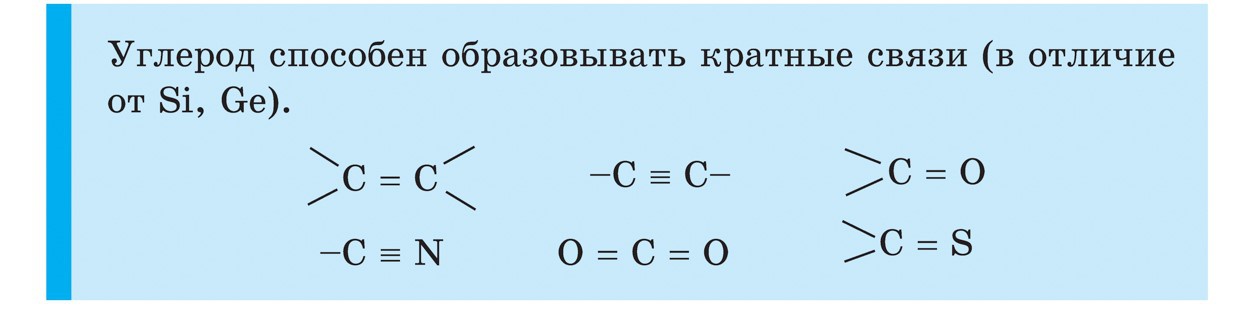
kremík
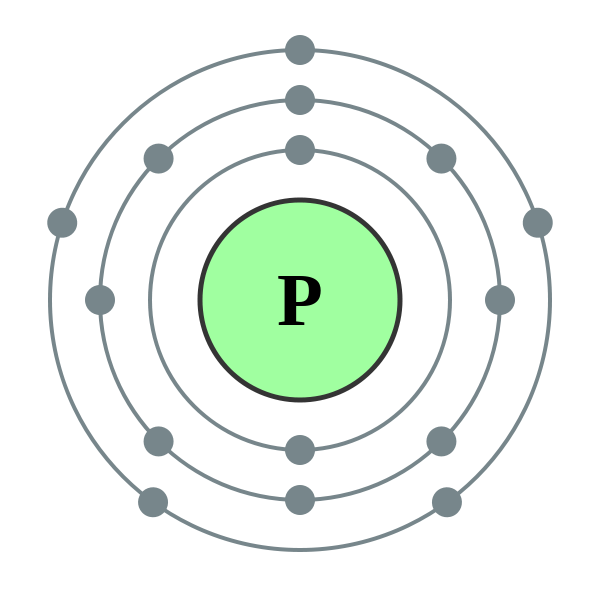
Kremík (Si) je ďalším prvkom hlavnej podskupiny IV. skupiny periodického systému. V prírode je kremík po kyslosti ďalším chemickým prvkom. Zemská kôra je viac ako zo štvrtiny preložená z jednej strany na druhú. Najpoužívanejším kremíkom je jeho oxid SiO 2 - oxid kremičitý. V prírode je minerál zložený z kremeňa a mnohých odrôd, ako je horský krištáľ a jeho slávna fialová forma - ametyst, ako aj achát, opál, jaspis, chalcedón, karneol. Oxid kremičitý je rovnaký ako kremenný piesok. Ďalším typom prírodných zlúčenín kremíka sú silikáty. Medzi nimi je najrozšírenejším hlinitokremičitanom žula, rôzne pohľady hlina, sľuda. Silikát, ktorý sa nemieša s hliníkom, alebo napríklad azbest. Oxid kremičitý je nevyhnutný pre život rastlín a živočíchov. Víno dodáva hodnotu stonkám rastlín a suchému povlaku zvierat. Kremík dodáva ľudským štetcom hladkosť a mäkkosť. Kremík sa dostáva do skladu nižších živých organizmov – rozsievok a rádiolariánov.
Chemická sila kremíka
Pazúrik horí kyslosťou, vytvrdzovanie oxidom kremičitým alebo oxidom kremičitým:
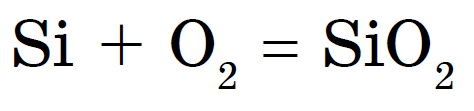
Keďže ide o nekov, pri zahrievaní sa spája s kovmi so zlúčeninami silicidy:
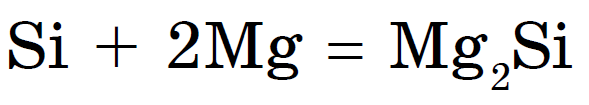
Silicidy sa ľahko rozložia vodou alebo kyselinami, výsledkom čoho je voda podobná plynu naviazaná na kremík - silan:
4HCl + Mg2Si -> SiH4 + 2MgCl2
Po nahradení sacharidmi je silán vo vzduchu samonasávací a horí oxidom kremičitým a vodou:
Zvýšená reakcia silánu v CH4 vyrovnaná s metánom sa vysvetľuje skutočnosťou, že kremík má väčšiu veľkosť atómov ako uhlík, takže chemické väzby Si-H je slabšia ako väzby C-N.
Kremík interaguje s koncentrovanými vodnými usadeninami na lúke, vytvrdzovanie kremičitanov a vody:
Vyhrá kremík, aktualizácie s oxidom horečnatým alebo uhlíkom:
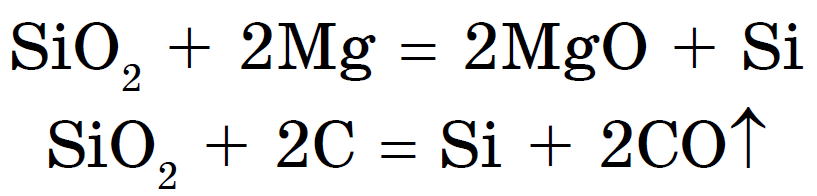
Oxid kremičitý (IV) alebo oxid kremičitý alebo oxid kremičitý, Si02 alebo C02 alebo kyslý oxid. Okrem CO 2 však nie je molekulárny, ale atómový kryštálová mriežka. Preto je Si02 tvrdá a žiaruvzdorná látka. Víno sa nerozpúšťa vo vode a kyselinách vrátane kyseliny fluorovodíkovej, ale pri vysokých teplotách reaguje s rozpustenými soľami kyseliny kremičitej - kremičitany:
Silikáty možno pripraviť aj ako zliatinu oxidu kremičitého s oxidmi kovov alebo uhličitanmi:
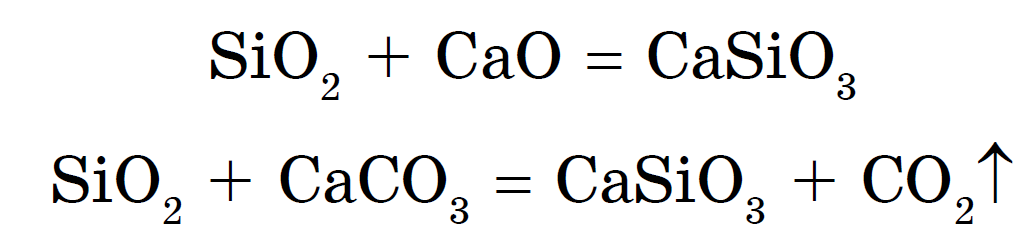
Kremičitany sodné a draselné sa nazývajú obyčajná hornina. їх vodné divízie- je to dobré silikátové lepidlo. Vďaka kremičitanom majú silnejšie kyseliny - chlorovodíkovú, kyslú, horkú a uhličitú - vystupuje kyselina kremičitá H 2 SiO 3 :
no dobre, H 2 SiO 3 - veľmi slabá kyselina. Je nerozpustný vo vode a vypadáva z reakčnej zmesi vo forme vyzrážanej zrazeniny, niekedy kompaktne dopĺňa celú zmes a premieňa ju na pevnú hmotu podobnú rôsolovitému mäsu. Keď zmes zaschne, vytvrdí sa vysoko porézna látka - silikagél, široko premiešaná v nádobe s adsorbentom - odstráni sa hlina ostatných látok.



Materiál pre lekára na testovanie:
periodická tabuľka
Tabuľka známok