strana 1
Kryštálová mriežka hliníka je plošne centrovaná kocka, ktorá je stabilná pri teplote 4 K do bodu topenia.
Kryštalická mriežka hliníka je vytvorená, podobne ako mnohé iné kovy, z plošne centrovanej kocky (div. Strana. Tepelná vodivosť hliníka je dvakrát vyššia ako tepelná vodivosť komory a okolia Ide o polovicu tepelnej vodivosti meď.
Vytvorenie kryštálovej mriežky s hliníkom v dôsledku presýtenia vedie k zvýšeniu hodnoty a tvrdosti zliatiny. Ak sa zliatina vytvrdzuje na vzduchu, dôjde k procesom, ktoré zmenia štruktúru. Atómy medi, ak sú viditeľné z kryštálovej mriežky hliníka, sú zoskupené v susedných častiach, rovnomerne rozmiestnených v celom objeme zliatiny. To zvyšuje tvorbu kryštálovej mriežky a zvyšuje tvrdosť a húževnatosť zliatiny. Na miestach, kde sa nakupujú atómy medi, vzniká kryštálová mriežka CuA12, v ktorej sú atómy A1 umiestnené medzi a bezprostredne vstupujú do štruktúry kryštálovej mriežky CuAls a kryštálovej mriežky hliníka. Vytvorenie takejto štruktúry sa uskutočňuje ďalšou reakciou kryštálovej mriežky s hliníkom a v dôsledku toho sa zliatina obohatí.
Krištáľová mriežka z hliníka, medi a dreva teda nadobúda tvar kocky so stredom tváre; sodík, draslík, bárium - objemovo centrovaná kocka a horčík, zinok a kadmium kryštalizujú v šesťhrannej mriežke. Všetky kovy kryštalizujú v dvoch alebo viacerých polymorfných formách.
Tieto prvky, vytvorené v kryštalickej mriežke hliníka, ju skutočne zvýrazňujú a mierne menia ťažnosť, čím zaisťujú dobrú deformovateľnosť zliatin.
Fragmenty medi majú vysoký atómový polomer (/GU 1 275 A), ktorý prispieva ku kryštalickej mriežke hliníka (rAi 1 43 A) a podporuje mechanickú pevnosť zliatiny. Vitrimka pri 150 - 180 C cvaká starý kus, čo je sprevádzané rozpadom tuhej hmoty z koncentrácií pozorovaných v miestach strednej 0-fázy, ktorá sa nerozpadá podľa chemický sklad Existuje stabilná fáza CuA12, ale existuje skrútená tetragonálna štruktúra.
Fragmenty medi majú vysoký atómový polomer (g = 1 275 A), čo prispieva ku kryštálovej mriežke hliníka /A1 1 43 A) a podporuje mechanickú pevnosť zliatiny. Vitrimka sa pri 150 - 180 C ukáže ako kus starého, čo je sprevádzané rozkladom tuhého odpadu vidno v miestach koncentrácie strednej b - fázy, ktorá sa za skladom chemikálií neprejavuje ako stajňa. silná fáza SiA12, ale existuje aj skrútený tetragonálny vzor.
Aktivita A1 je spôsobená nielen jeho účasťou na tvorbe väzieb d - orbitálov, ale v menšej miere aj na vyrovnávaní kryštálovej mriežky hliníka.
Aktivita hliníka je určená nielen jeho účasťou na tvorbe väzieb rf - orbitálov, ale aj vyrovnávaním koncentrácie kryštálovej mriežky hliníka.
Elektrónový lúč, ktorý dopadá na hliníkovú dosku, vytvára difrakčný obrazec a hranica (v strede obrazca) difrakčného maxima je rôzneho rádu v G Perióda hliníkovej kryštálovej mriežky yu (stoj medzi atómovými rovinami) d 0,405 nm.
Krištáľová mriežka hliníka, medi a striebra teda nadobúda tvar kocky so stredom tváre; sodík, draslík a bárium - objemovo centrovaná kocka a horčík, zinok a kadmium - šesťhranná mriežka. Všetky kovy kryštalizujú v dvoch alebo viacerých polymorfných formách.
Na vzduchu je hliníkový tvaroh potiahnutý tenkou vrstvou oxidu. Prvé guľôčky tejto taveniny tvoria kryštalickú hliníkovú mriežku, vytvárajúcu dokonca dokonalé spojenie. Mechanizmus rastu oxidovej taveniny sa za posledných 15 rokov využíval na vytváranie vysokoteplotných zliatin, ktoré sú nasýtené rozptýlenými časticami oxidu hlinitého. Tavenina sa pripravuje špeciálnou chemickou alebo elektrochemickou metódou a pridávaním rôznych prísad do nej môže dostať akúkoľvek farbu.
Čerstvo tvrdený dural má nízku pevnosť a vysokú ťažnosť, bez ohľadu na prítomnosť pevnej medi v hliníku. Je to spôsobené tým, že kryštálová mriežka je však vyrobená z hliníka a medi a parametre mriežky sa mierne líšia. Vysoká hodnota sily duralu vzniká až následkom ďalšieho starnutia. Staroveký názov je proces zmeny pevnosti a sily tvrdených zliatin, ku ktorému dochádza rýchlo pri izbovej teplote alebo pri zvýšených teplotách.
Silumina, výborná po tepelnom spracovaní, napr. po zahriatí na 520 - 530 a starnúcom kusovom tovare 10 - 30 rokov. Ich vysoká hodnota po starnutí sa vysvetľuje zakrivením kryštálovej mriežky hliníka a prítomnosťou Guinier-Prestonových zón.
„Kryštalické mriežky chémie“ - Kryštalické mriežky sa nazývajú molekulárne, v uzloch ktorých molekuly rastú. Hodnotenie sušenia vlhkosťou. Pevná reč. V prírode existujú tri kryštalické častice s atómovou kryštalickou mriežkou. Metalevi. Atómový Iónové kryštálové mriežky obsahujú soli, oxidy a hydroxidy kovov.
"Kryštalické a amorfné telá" - Druse Marion. laureáti Nobelovej ceny. Inštalácia na testovanie optických kryštálov. Amorfné telo. Polykryštálový kov. Kryštály priateľstva kryštálu Girsky. N.G. Basov. Prvá inštalácia na spracovanie kryštálov PROMIN. Polykryštál až ametyst (odroda kremeňa). Hrubozrnný kryštál sirka. Sila pevných telies.
„Sila hliníka“ - Hliník je ako jednoduchá reč: vynechaná. Hliník ako jednoduchá reč: chemická sila: Nespárovaná. Ar\u003d 27. Pozrite sa na diagram. Ak bojujete s ťažkými vecami, postavte znak výživy oproti zjavnej sile. Hlinitokremičitany tvoria prevažnú časť zemskej kôry. Získajte informácie o množstve hliníka v zemskej kôre v porovnaní s inými kovmi.
„Kryštalické mriežky“ - História: Určite typ chemického spojiva v týchto produktoch: Charakteristika hlavných typov kryštalických mriežok. Témou hodiny je krištáľová mriežka. Klasifikácia tuhých látok. HCl, Cl2, H20, NaBr, BaCl2, CaS, O2, NH3, CO2, C.
„Hliník 9. triedy“ - Orezaný hliník. Amfoterita hliníka. Hodil. Pozícia hliníka v periodickej tabuľke D.I. Mendelev. Hodina chémie v 9. ročníku na tému „Hliník“. 3. So základňami. AL. Fyzická sila hliník. Chemická sila hliník. 2. S kyselinami (sírovou a chlorovodíkovou (zriedenou). Elektrolýza je dnes hlavnou metódou odstraňovania hliníka.
"Kovový hliník" - Zastosuvannya. Môže to byť amfotér sily. Interakcia s vodou. Fyzická sila. Prvýkrát ho objavil dánsky fyzik Oersted v roku 1925. Na základe interakcie pri rôznych teplotách so sírou, dusíkom a uhlíkom. Najširší kov v prírode. Interakcie s kyselinami. Hlinitan bárnatý - na čistenie vody od síranov, karbonizácie a vápenatých iónov.





![]()








 Späť dopredu
Späť dopredu
Rešpekt! Pohľad spredu na snímky slúži len na informačné účely a nemusí vyjadrovať všetky možnosti prezentácie. Ak vás daný robot prepadol, láskavo ma nalákajte na novú verziu.
Typ lekcie Kombinácie.
Hlavná meta hodiny: Poskytnúť žiakom konkrétne informácie o amorfných a kryštalických rečiach, typoch kryštalických mriežok, nadviazať vzťahy medzi každodenným životom a silami reči.
Starostlivosť o lekciu.
Osvetlenie: formulovať koncepty o kryštalickom a amorfnom stave pevných látok, oboznámiť študentov s rôznymi typmi kryštalických mriežok, určiť umiestnenie fyzikálnych síl kryštálov, povahu chemickej väzby v kryštáloch a typ kryštálovej oceľovej mriežky, poskytnúť študuje hlavné javy o infúzii povahy chemického spojiva a typov kryštalických mriežok na sile reči, k dnešnému dňu učenie o zákone skladovania ocele.
Vikhovna: pokračujte vo formovaní vedeckého pohľadu, pozrite sa na vzájomný prílev zložiek celku - štruktúrnych častí prejavov, v dôsledku ktorých sa objavujú nové autority, organizujte svoju počiatočnú prácu, dodržiavajte pravidlá práce v tivi.
Rozvíjanie: rozvíjať kognitívny záujem školákov, skúmanie a problémové situácie; bližšie objasniť kauzalitu fyzikálnych mohutností rečí z chemickej väzby a typu kryštalickej mriežky, preniesť typ kryštalickej mriežky na základe fyzikálnych mohutností rečí.
Vlastníctvo: Periodický systém D. I. Mendelev, zbierka "Kovy", nekovy: drevené uhlie, grafit, červený fosfor, kisen; Prezentácia "Kryštalické mriežky", modely kryštalických mriežok rôznych typov (kuchynská soľ, diamant a grafit, oxid uhličitý a jód, kovy), častice plastov a ich deriváty, sklo, plastelína, živice, sk, žuvačky, čokoláda, počítač , multimediálna inštalácia, video "Sublimácia kyseliny benzoovej".
Pokrok v lekcii
1. Organizačný moment.
Učiteľ učí žiakov, zaznamenáva žiakov.
Potom uvedie tému do lekcie a meta lekcie. Naučte sa zapísať si tému lekcie do rámčeka. (Snímka 1, 2).
2. Kontrola domácich úloh
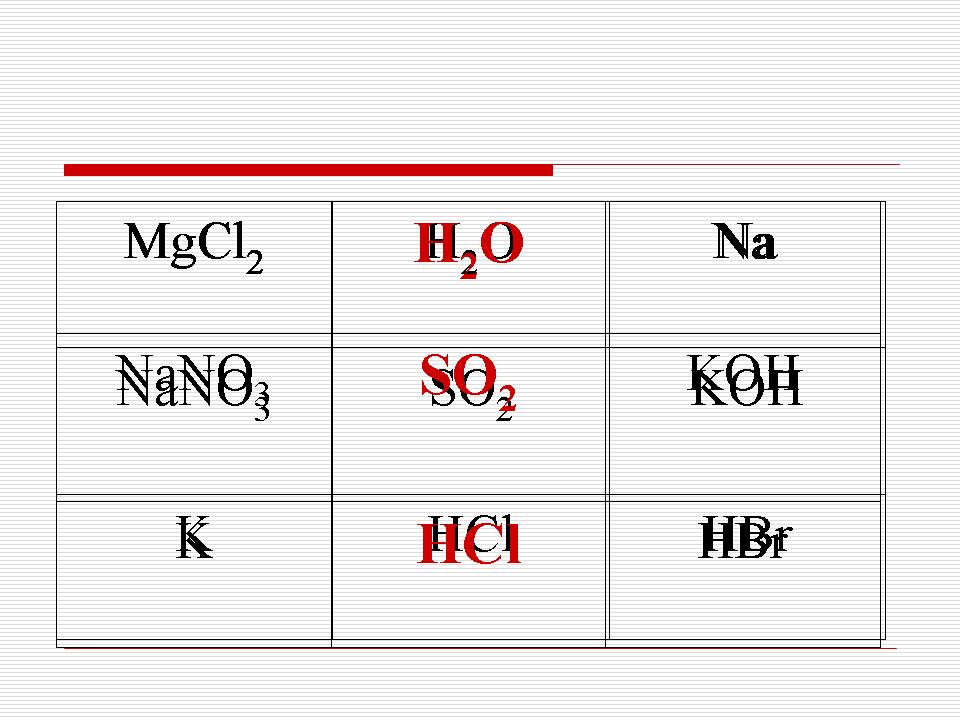
(2 školské hodiny: Určte typ chemického spojiva pre reč pomocou vzorcov:
1) NaCI, C02, I2; 2) Na, NaOH, H 2 S (odpoveď zapíšte do zoznamu a zaraďte do experimentu).
3. Analýza situácie.
Učiteľ: Čo robí chémia? Zhrnutie: Chémia je veda o rečiach, ich sile a premene reči.
Učiteľ: Čo je to za reč? Príslovie: Reč tvorí fyzické telo. (Snímka 3).
Učiteľ: Aké súhrnné stanice reči poznáte?
Zhrnutie: Existujú tri agregované štádiá: pevné, zriedkavé a plynné. (Snímka 4).
Učiteľ: Ukážte na zadky ventilov, ktoré možno použiť vo všetkých troch mlynoch na kamenivo pri rôznych teplotách.
Téma: Voda. pri v najväčších mysliach voda je v zriedkavom skupenstve, pri nízkej teplote pod 0 0 C prechádza voda do tuhého skupenstva - ľadu a pri zvýšenej teplote do 100 0 C sa vodná para odstraňuje (plynovité skupenstvo).
Učiteľ (doplnkový): Akákoľvek reč môže byť videná v pevnej, vzácnej alebo plynovej forme. Vodná smotana je kov, ktorý za normálnych podmienok zostáva v pevnom stave, pri zahriatí začína mäknúť a pri nízkej teplote (t pl) prechádza do mäkkého stavu - topí sa. Pri ďalšom zahrievaní až k bodu varu sa kovy začnú vyparovať a prechádzajú do stavu podobného plynu. Ak sa dá plyn premeniť na vzácnu a pevnú formu, znížením teploty: napríklad želé, ktoré sa pri teplote (-194 0 C) premení na bielu farbu a pri teplote (-218,8 0 C) stvrdne do hmoty podobnej snehu, ktorá sa skladá s modrými kryštálmi. Dnes sa v triede pozrieme na pevnú formu reči.
Učiteľ: Pomenujte, aké pevné slová sa nachádzajú na vašich stoloch.
Príklad: Kovy, plastelína, kuchynská soľ: NaCl, grafit.
Učiteľ: Čo si myslíte? Yake z tsikh rechovin zaive?
Pomôcka: Plastelína.
Učiteľ: Prečo?
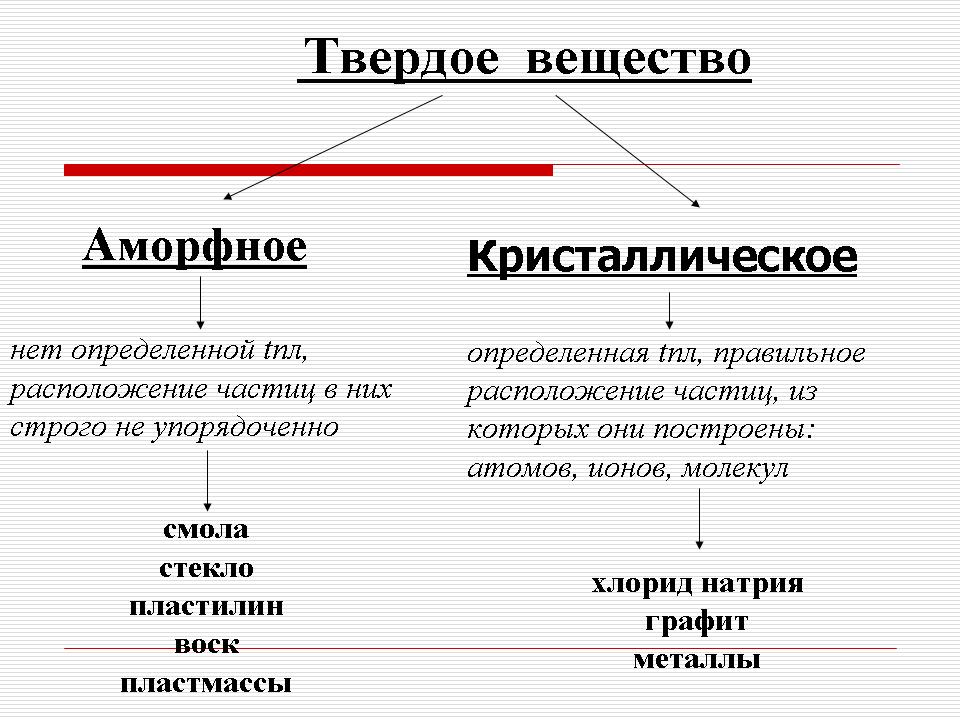
Lúpež je hanba. Ak to vedci nedokážu, potom s pomocou učiteľa prídu na pomoc, aby plastelína po odstránení z kovov a chloridu sodného nemala vysokú teplotu topenia - víno (plastelína) postupne mäkne a mení sa na tekutina. Taká napríklad čokoláda, ktorá je opálená v ústach, alebo žuvačka, ale aj tvrdá, umelá hmota, živica, vosk (pri vysvetlení učiteľ predvedie triede výrazy týchto slov). Takéto reči sa nazývajú amorfné. (Snímka 5) a kovy a chlorid sodný sú kryštalické. (Snímka 6).
Týmto spôsobom sú oddelené dva typy pevnej reči : amorfné a kryštalický. (Snímka 7).
1) V amorfnej živici nie je žiadny bod topenia a distribúcia častíc v nich nie je striktne usporiadaná.
Kryštalické látky majú presne definovanú teplotu topenia, a preto sa vyznačujú správnou distribúciou častíc, z ktorých sa vytvára vôňa: atómov, molekúl a iónov. Tieto časti sú umiestnené na presne určených bodoch v priestore a keďže sú uzly spojené priamymi čiarami, vytvorí sa priestranný rám - kryštálová mriežka.
pýta sa učiteľ problémové potraviny
Ako vysvetliť základ pevných prejavov rôznych autorít?
2) Prečo sa kryštalické prejavy pri dopade rozpadajú v speváckych rovinách, ale neforemné reči takejto sily sa nenafukujú?
Vypočujte si prejavy študentov a priveďte ich visnovku:
Sila reči v pevnom stave spočíva v type kryštalickej mriežky (predovšetkým v tom, aké časti sa nachádzajú v jej uzloch), ktorá je zase určená typom chemického spojiva v tejto reči.
Kontrola domácej úlohy:
1) NaCl - iónová väzba,
CO 2 - kovalentná polárna väzba
I 2 - kovalentná nepolárna väzba
2) Na - kovový článok
NaOH - iónová väzba medzi Na + iónom - (O a H kovalentné)
H 2 S - kovalentná polárna
Predná príprava.
- Ktorá väzba sa nazýva iónová?
- Ktorá väzba sa nazýva kovalentná?
- Ktorá väzba sa nazýva polárna kovalentná? nepolárne?
- Čo sa nazýva elektronegatívne?
Abstrakt: V prírode existuje logická postupnosť prepojení javov: Budova atóm-\u003e EO\u003e Typ chemickej väzby-\u003e Typ kryštálovej mriežky-\u003e Sila slova . (Snímka 10).
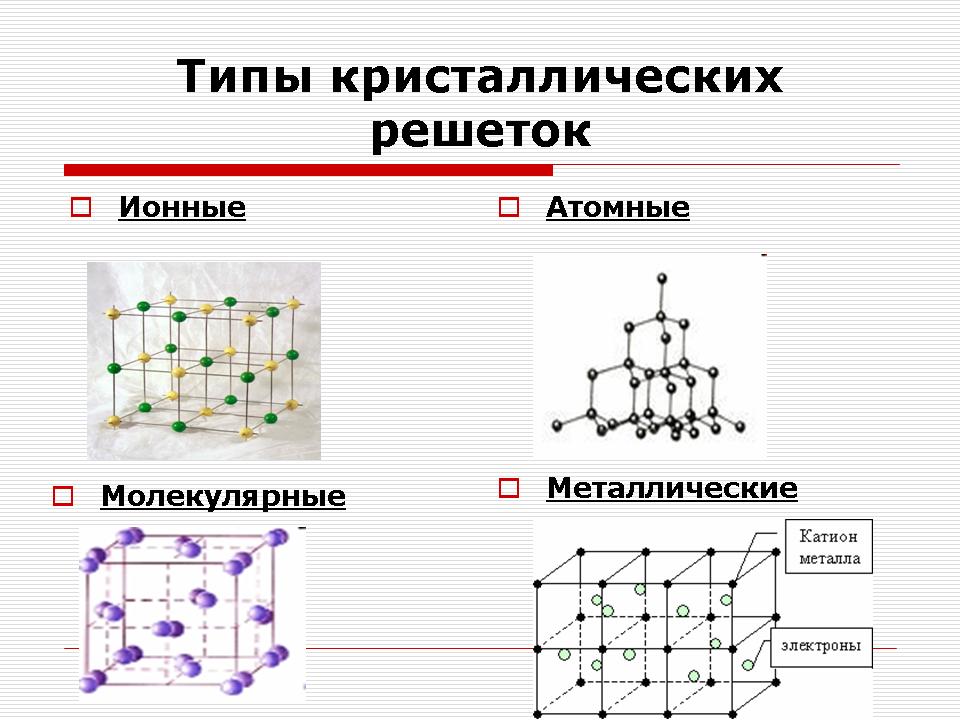
Učiteľ: Je dôležité oddeliť spojenie medzi nimi v závislosti od typu častíc a povahy spojenia niekoľko typov kryštálových mriežok: Iónové, molekulárne, atómové a kovy. (Snímka 11).
Výsledky sú formalizované v tabuľke so vzorkou v študentovi na večierku. (Div. Dodatok 1). (Snímka 12).
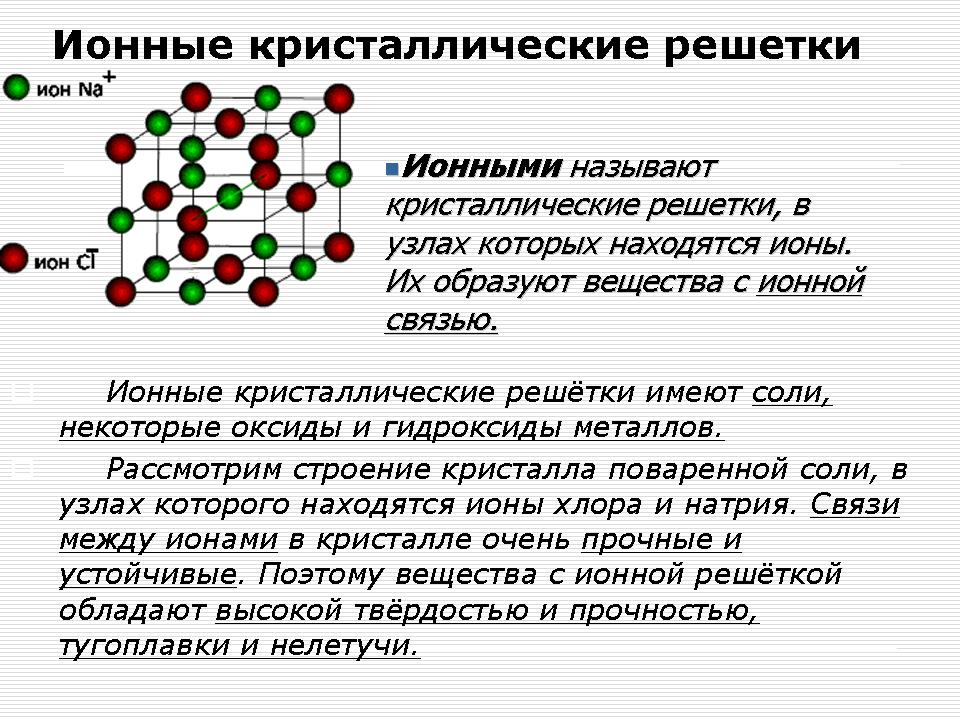
Iónové kryštálové mriežky
Učiteľ: Čo si myslíte? Pre rieky s akým typom chemickej väzby bude tento typ mriežky charakteristický?
Zhrnutie: Reči s iónovými chemickými väzbami budú charakterizované iónovou mriežkou.
Učiteľ: Aké častice sa budú nachádzať v uzloch mriežky?
Verzia: Ioni.
Učiteľ: Aké častice sa nazývajú ióny?
Tip: Sú to častice, ktoré nesú kladný alebo záporný náboj.
Učiteľ: Kto sú za skladom?
Verzia: Jednoduché a zložité.
Ukážka - model kryštálovej mriežky chloridu sodného (NaCl).
Vysvetlenie čitateľa: V uzloch kryštálovej mriežky obsahuje chlorid sodný sodík a chlór.

V kryštáloch NaCl chlorid sodný neobsahuje veľké molekuly. Celý kryštál možno vidieť ako obrovskú makromolekulu, ktorá sa skladá z rovnakého počtu iónov Na + a Cl -, Na n Cl n, kde n je veľké číslo.
Väzby medzi iónmi v takomto kryštáli sú ešte intenzívnejšie. Preto sú slová s iónmi rovnako tvrdé. Zápach je žiaruvzdorný, uletený, šľachovitý. Roztavte ich elektrickým prúdom (Prečo?), Ľahko sa demontujú pri vode.
Iónové zlúčeniny - sú to binárne zlúčeniny kovov (I A a II A), soli, lúky.
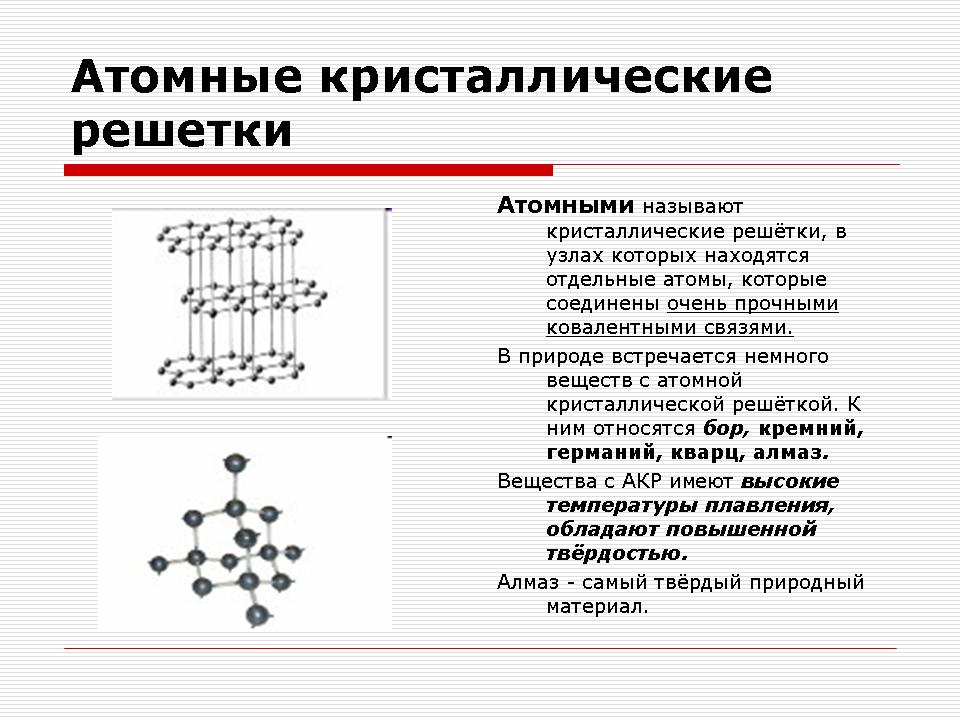
Atómové kryštálové mriežky
Ukážka kryštálových mriežok pre diamant a grafit.
Na stole sú škvrny od grafitu.
Učiteľ: Aké častice sa budú nachádzať v uzloch atómovej kryštálovej mriežky?
Zhrnutie: V uzloch atómovej kryštálovej mriežky je niekoľko atómov.
Učiteľ: Aká je chemická väzba medzi atómami?
Zhrnutie: Kovalentná chemická väzba.
Vysvetlenie čitateľa.
V uzloch atómových kryštalických mriežok je skutočne niekoľko atómov spojených kovalentnými väzbami. Keďže sa atómy, podobne ako ióny, môžu v priestore rozprestierať rôznymi spôsobmi, vznikajú kryštály rôznych tvarov.
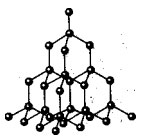
Atómová kryštálová mriežka diamantu
V týchto mriežkach sú molekuly denne. Celá kryštálová stopa vyzerá ako obrovská molekula. Pažba trstiny s týmto typom kryštalických mriežok môže byť alotropnými modifikáciami uhlíka: diamant, grafit; ako aj bór, kremík, červený fosfor, germánium. Odborník na výživu: Aké slová sa skrývajú za skladom? Verdikt: Ospravedlňujeme sa za sklad.
Atómové kryštálové mriežky sú nielen jednoduché, ale aj zložité. Napríklad oxid hlinitý, oxid kremičitý. Všetky tieto slová sa objavujú ešte dlhšie vysoké teploty tavenie (u diamantu je to cez 3500 0 C), mits a hards, non-úlety, vo voľnej prírode prakticky neoddeliteľné.
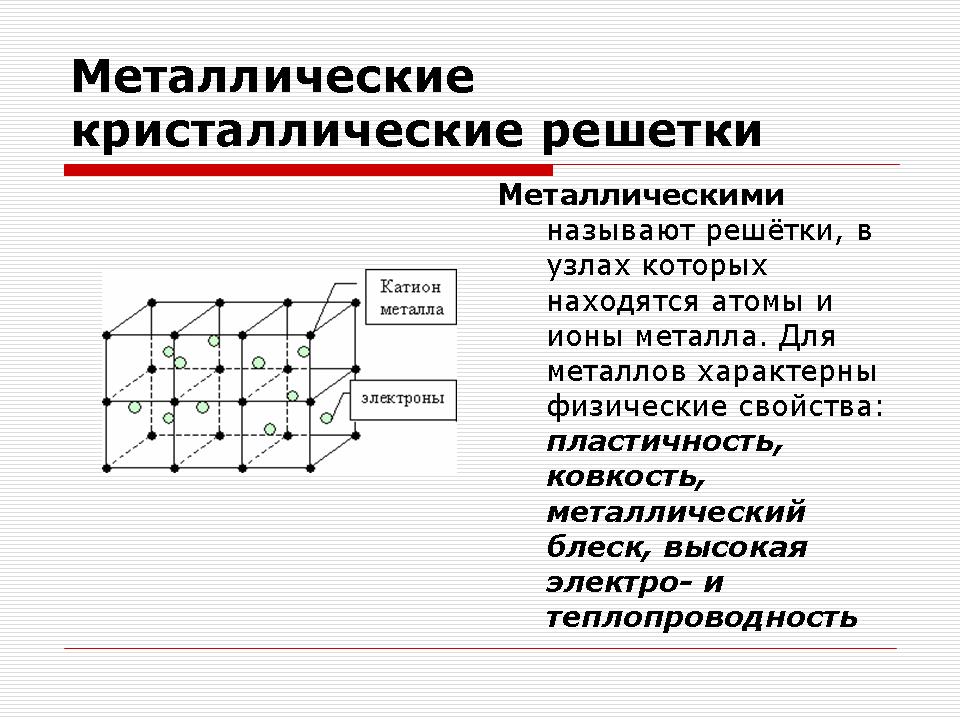
Kovové kryštálové mriežky
Učiteľ: Chlapci, na stoloch máte zbierku kovov, poďme sa na ne pozrieť.
Výživa: Aká chemická väzba je charakteristická pre kovy?
Podanie: Metaleva. Väzba v kovoch medzi kladnými iónmi pomocou socializovaných elektrónov.
Výživa: Aké skryté fyzické schopnosti sú charakteristické pre kovy?
Kľúčové slová: Blaženosť, elektrická vodivosť, tepelná vodivosť, ťažnosť.
Výživa: Vysvetlite, čo je dôvodom, prečo toľko rôznych prejavov má napriek tomu fyzickú silu?
Epilóg: Kovy sú roztrhané.
Ukážka modelov kryštalických mriežok kovov.
Vysvetlenie čitateľa.
Kovové kryštálové mriežky oscilujú s kovovou väzbou
Uzly takýchto strúhadiel obsahujú atómy a kladné ióny kovov a valenčné elektróny sa voľne pohybujú v objeme kryštálu. Elektróny elektrostaticky priťahujú kladné ióny kovov. To vysvetľuje stabilitu mriežky.
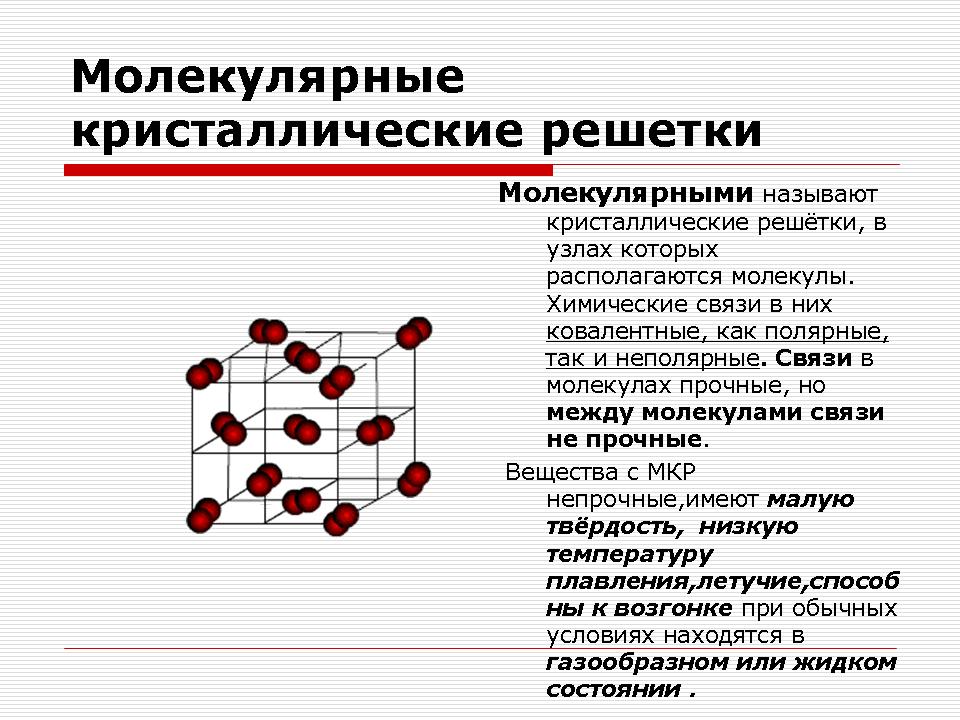
Molekulové kryštálové mriežky
Učiteľ predvádza a pomenúva prejavy: jód, sirka.
Výživa: Čo patrí do tejto reči?
Synopsa: Tieto slová sú nekovové. Ospravedlňujeme sa za sklad.
Výživa: Aká chemická väzba je v strede molekúl?
dôkaz: Chemické spojenie v strede molekúl je kovalentná nepolárna.
Výživa: Aký druh fyzickej sily ich charakterizuje?
Zhrnutie: Prchavý, taviteľný, s nízkym vplyvom vo vode.
Učiteľ: Vyrovnajme silu kovov a nekovov. Vedci naznačujú, že úrady sú zásadne nesúhlasné.
Výživa: Prečo sa sily nekovov výrazne líšia od schopností kovov?
Zhrnutie: Kovy majú kovové väzby a nekovy majú kovalentné, nepolárne väzby.
Učiteľ: No, typ mriežky je iný. Molekulárna.
Výživa: Aké častice sa nachádzajú v mriežkových uzloch?
Predmet: Molekuly.
Ukážka kryštálových mriežok oxidu uhličitého a jódu.
Vysvetlenie čitateľa.
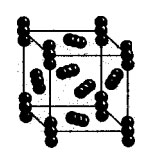
Molekulárna kryštálová mriežka
Molekulárna kryštalická mriežka môže byť v skutočnosti tvorená nielen pevnými látkami Prepáč reč: vzácne plyny, H 2, O 2, N 2, I 2, O 3, biely fosfor P 4, ale i skladanie: Tuhá voda, pevný chlorovodík a zelená voda. Väčšina pevných organických zlúčenín tvorí molekulové kryštalické mriežky (naftalén, glukóza, zukor).
V mriežkových uzloch sú nepolárne a polárne molekuly. Bez ohľadu na to, že atómy v strede molekúl sú spojené silnými kovalentnými väzbami, medzi molekulami samotnými existujú slabé sily medzimolekulovej interakcie.
visnovok: Sú nemecké, majú nízku tvrdosť, nízky bod topenia, sú prchavé a môžu sublimovať.
jedlo : Ktorý proces sa nazýva sublimácia alebo sublimácia?
Potvrdenie : Prechod látky z pevnej agregovanej fázy do plynnej, ale zriedkavej fázy sa nazýva sublimácia alebo sublimácia.
Kompletná demonštrácia: sublimácia kyseliny benzoovej (video).
Pracujte od zaplneného stola.
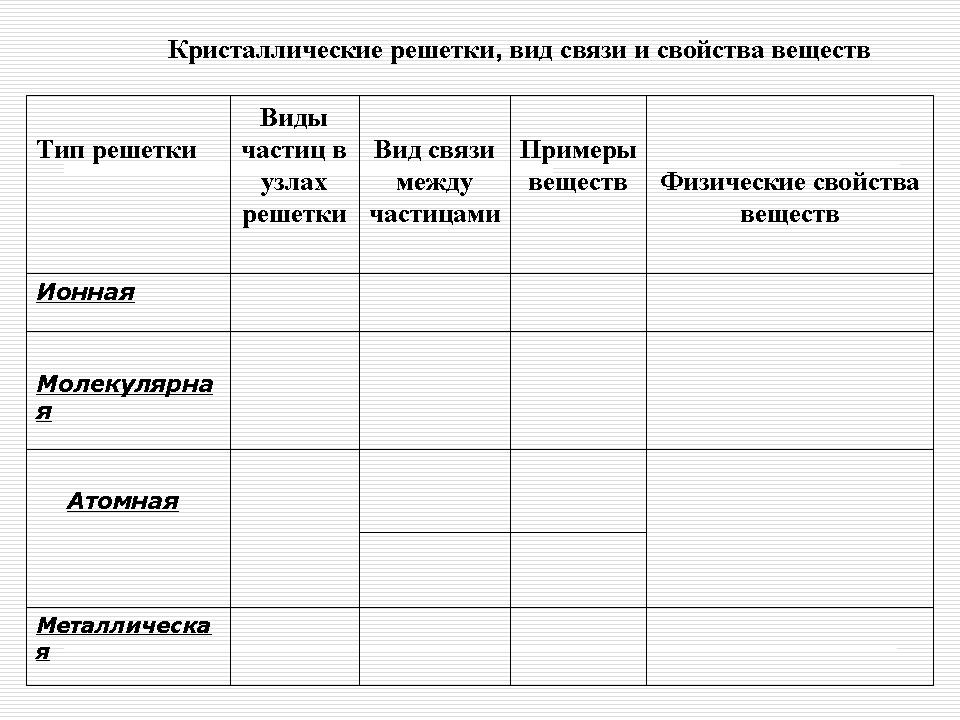
Dodatok 1. (Snímka 17)
Kryštálové mriežky, typ spojenia a sila prejavov
| Typ roštu | Pozrite sa na častice v uzloch mriežky |
Typ spojenia medzi časticami | aplikovať reč | Fyzická sila prejavov |
| Ionna | Ioni | Ionna - odkaz mіtsna | Soli, dusičnany (IA, IIA), oxidy a hydroxidy typických kovov | Pevné látky, mäso, mláďatá, šľachy, žiaruvzdorné látky, mnoho rôznych vecí v blízkosti vody, sa topia a vedú elektrický prúd |
| atómový | atómy | 1. Kovalentná nepolárna – väzba je ešte silnejšia 2. Kovalentná polárna – väzba je ešte pevnejšia |
prepáč rechovin A: Diamant (C), grafit (C), bór (B), kremík (Si).
Skladacie prejavy: oxid hlinitý (Al 2 O 3), oxid kremičitý (IY) -SiO 2 |
Veľmi tvrdé, veľmi žiaruvzdorné, mitsni, mláďatá, nerozbitné pri vode |
| molekulárne | molekuly | Medzi molekulami sú slabé sily medzimolekulového napätia a os v strede molekúl je silná kovalentná väzba | Pevná reč so špeciálnymi mysľami, ako napr obyčajný - gazi alebo iný (02, H2, Cl2, N2, Br2, H20, C02, HCl); Sirka, biely fosfor, jód; organické prejavy |
Nemecký, prchavý, taviteľný, sublimovaný, s nízkou tvrdosťou |
| metaleva | Atómové ióny | Kov rôznych druhov | Kovy a zliatiny | Kujné, kujné, tvárne, tepelne a elektricky vodivé |
Výživa: Ktorý typ kryštalickej mriežky, ako je vidieť vyššie, sa neobjavuje v jednoduchých rečiach?
Synopsa: Yonnyho kryštálové mriežky.
Výživa: Aké kryštalické mriežky sú charakteristické pre jednoduché reči?
Príklad: Pre jednoduché kovy-kovy-kovová kryštálová mriežka; pre nekovy - atómové alebo molekulárne.
Práca s periodickým systémom D.I. Mendelev.
Výživa: Kde sú kovové prvky prítomné v periodickej tabuľke a prečo? Nekovové prvky a prečo?
Tip: Ak nakreslíte uhlopriečku od bóru k astatínu, potom v ľavom dolnom rohu tejto uhlopriečky budú kovové prvky, takže na zostávajúcej úrovni energie bude jeden až tri elektroniv. Prvky I A, II A, III A (bór), ako aj cín a olovo, surma a všetky prvky sekundárnych podskupín.
Nekovové prvky sa nachádzajú v pravom hornom rohu tejto uhlopriečky, takže na zostávajúcej energetickej úrovni sú štyri až osem elektrónov. Prvky IY A, Y A, YI A, YII A, YIII A a bór.
Učiteľ: Poznáme prvky nekovov, ktoré odpusť mi tie slová hodiť atómovú kryštálovú mriežku (Verzia: C, B, Si) a molekulárne ( Verzia: N, S, O , halogény a vzácne plyny ).
Učiteľ: Sformulujte schému, ako môžete určiť typ kryštálovej mriežky jednoduchého slova vo vzťahu k polohe prvkov v periodickej sústave D. I. Mendelev.
Príklad: Pre kovové prvky nachádzajúce sa v I A, II A, IIIA (vrátane bóru), ako aj cín a olovo a všetky prvky sekundárnych podskupín v jednoduchom type kovovej mriežky.
Pre nekovové prvky IY A a bór je jednoducho kryštalická mriežka atómová; a v prvkoch Y A, YIA, YII A, YIII A je kryštalická mriežka molekulová v jednoduchých jednotkách.
Môžeme pokračovať v práci od dokončenej tabuľky.
Učiteľ: Pozerajte sa na stôl s úctou. Ako vzniká vzor?
Je dôležité počúvať prejavy študentov, po ktorých pracujeme spoločne s triedou:
Existuje jasný vzorec: ak je známe, že prejavy sú, potom sa ich sila môže preniesť, ale znova: ak je známe, že prejavy sú silné, ich sila sa môže preniesť. (Snímka 18).
Učiteľ: Pozerajte sa na stôl s úctou. Ako inak môžete klasifikovať prejavy?
Keďže vedci nemôžu, čitateľ to vysvetľuje Reči možno rozdeliť na molekulárnu a nemolekulárnu reč. (Snímka 19).
Molekulárna reč sa skladá z molekúl.
Slová nemolekulárnych látok sú zložené z atómov a iónov.
Zákon o stave zásob
Učiteľ: Dnes sa učíme o jednom zo základných zákonov chémie. Ide o zákon skladovania, ktorý objavil francúzsky chemik J. L. Proust. Zákon je spravodlivý len pre reči o molekulárnom živote. V súčasnosti zákon znie takto: "Molekulárne chemické zlúčeniny, bez ohľadu na spôsob ich extrakcie, ovplyvňujú stabilitu a silu." Ale na reči s nemolekulárnou Budova, zákon nezačína byť fér.
Teoretický a praktický význam zákona spočíva v tom, že na jeho základe možno zloženie slov vyjadriť pomocou ďalších chemických vzorcov (pre mnohé nemolekulárne látky chemický vzorec ukazuje skladisko nie skutočného života, ale mentálnych molekúl).
visnovok: Chemický vzorec reči má obsahovať veľké informácie.(Snímka 21)
Napríklad SO 3:
1. Konkrétne kyslý plyn - kyslý plyn, alebo kyslý oxid (YI).
2. Typy reči - viac skladacie; trieda - oxid.
3. yakisny sklad- pozostáva z dvoch prvkov: kyslého a kyslého.
4. Sklad oxidov - molekula je tvorená 1 atómom kyslého a 3 atómami kyslého.
5.Vo vzťahu k molekulovej hmotnosti - M r (SO 3) \u003d 32 + 3 * 16 \u003d 80.
6. Molová hmotnosť - M (SO 3) \u003d 80 g / mol.
7. Množstvo ďalších informácií.
Upevnenie a stagnácia stiahnutých vedomostí
(Snímka 22, 23).
Krížiky a nuly: krížia sa zvisle, vodorovne, uhlopriečne, tak aby tvorili kryštalickú mriežku.
Reflexia.
Učiteľ sa pýta učiteľa: "Chlapci, čo nové ste sa naučili v triede?"
Odovzdávanie aktivít
Učiteľ: Chlapci, zhrňme si hlavné body našej lekcie – dajte tip na výživu.
1. Aké klasifikácie prejavov ste sa naučili?
2. Ako rozumiete pojmu kryštalická mriežka?
3. Aké typy kryštalických mriežok teraz poznáte?
4. O akých vzorcoch života a sily v prejavoch ste sa naučili?
5. V ktorej agregátovej stanici sa vznášajú kryštalické mriežky?
6. Aké základné zákony chémie ste sa naučili na hodine?
Domáca úloha: §22, zhrnutie.
1. Spočítajte vzorce vzorcov: chlorid vápenatý, oxid kremičitý (IY), dusík, kremičitan.
Zvážte typ kryštálovej mriežky a pokúste sa predpovedať, aké budú teploty topenia týchto látok.
2. Urobte jedlo kreatívnejším – zredukujte jedlo na odsek.
Učiteľ robí vtip na hodinu. Poskytuje študentom známky.
