
पोषणाबद्दल अभिप्राय द्या: 1. अक्रिय वायूच्या त्वचेच्या रेणूमध्ये किती अणू असतात? 2. “अक्रिय वायू” या नावाची व्युत्पत्ती पहा. 3. तिच्या मैत्रिणीचे नाव काय आहे? 4. निष्क्रिय वायूंकडे जाण्याचा सर्वोत्तम मार्ग कोणता आहे? मित्राकडून



निऑनवर एक नजर निऑन हा आधुनिक जाहिरातींचा सर्वात प्रभावी प्रकार आहे. निऑन जाहिराती आणि लाइट बॉक्स जगाच्या सर्व भागांमध्ये लोकप्रिय आहेत. काचेची नळी, निऑन किंवा आर्गॉनने भरलेली, लाईट बॉक्समध्ये पॅक केली जाते आणि प्रकाशाची जाहिरात लक्षात येण्याजोगी, परिणामकारक आणि कार्यक्षम बनवण्यासाठी चिन्ह किंवा अक्षरासह विकोराइज केली जाते.


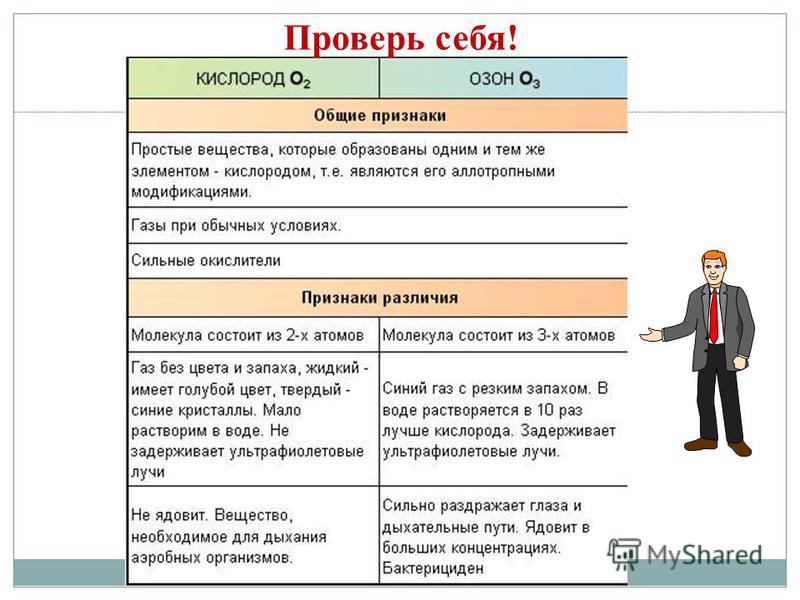
दैनंदिन जीवन आणि अधिकारी यांच्याद्वारे विभक्त केलेली अनेक साधी भाषणे तयार करण्यासाठी HE च्या कृतींचे मूळ आहे अॅलोट्रॉपी. Z - हिरा, ग्रेफाइट, फुलरीन. ओ - किसेन, ओझोन. एस - समभुज, मोनोक्लिनिक, प्लास्टिक. पी - पांढरा, लाल, काळा. अॅलोट्रॉपीची घटना दोन कारणांमुळे उद्भवते: 1) रेणूमधील अणूंची भिन्न संख्या, उदाहरणार्थ, ऑक्सिजन O2 आणि ओझोन O3. 2) हिरा आणि ग्रेफाइट सारख्या विविध स्फटिकरूपांची निर्मिती.









विहित प्रवाहातून, डायमंड आणि ग्रेफाइटचे सामर्थ्य वैशिष्ट्य निवडा: 1. स्पष्ट स्फटिकासारखे राळ 2. उष्णता आणि प्रवाह 3. खूप मजबूत चमक आहे 4. गडद राखाडी, स्फटिकासारखे राळ 5. सर्व नैसर्गिक भाषणांपैकी सर्वात कठीण भाषण 6 उष्णता आणि प्रवाह चालवू नका 7. तुकड्यांमध्ये विघटन करा 8. धातूची चमक निर्माण करा
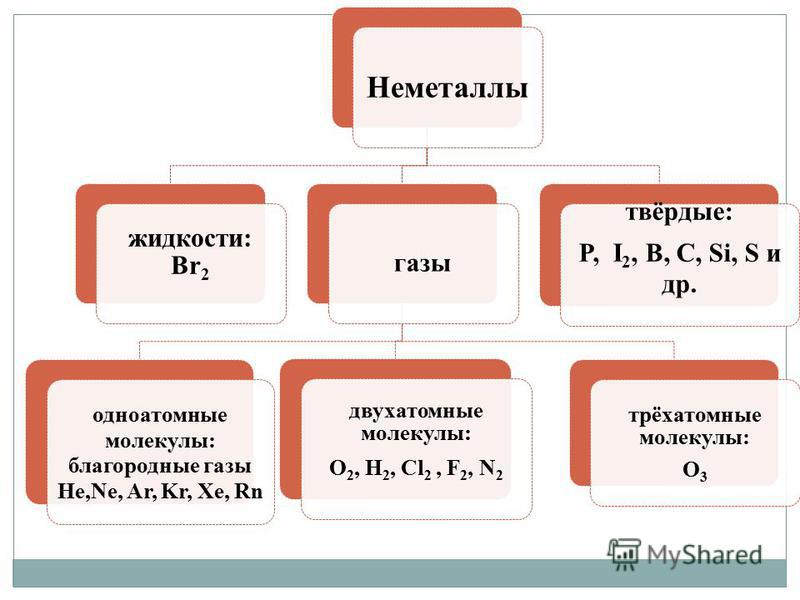
 धातू नसलेले धातू 1. घन पदार्थ (पारा Hg) 1, घन पदार्थ (गंधक S, लाल फॉस्फरस आणि पांढरा फॉस्फरस P 4, आयोडीन I 2, डायमंड आणि ग्रेफाइट C), वायूसारखे पदार्थ (ऑक्सिजन O2, ओझोन O3, नायट्रोजन N 2 , पाणी H 2, क्लोरीन C1 2, फ्लोरिन F 2, नोबल वायू) आणि रेडिन (ब्रोमाइन Br 2) 2. धातूचा फ्लॅश धुवा 2. धातूचा फ्लॅश धुवू नका (आयोडीन I 2, ग्रेफाइट C) 3. इलेक्ट्रिकल आणि थर्मल चालकता 3. यापुढे विद्युत प्रवाह चालवू नका (वाहकांमध्ये, उदाहरणार्थ, सिलिकॉन, ग्रेफाइटचा समावेश होतो) 4. बनावट, प्लास्टिक, चिकट 4. घन, टेंडिनस साध्या शब्दात:
धातू नसलेले धातू 1. घन पदार्थ (पारा Hg) 1, घन पदार्थ (गंधक S, लाल फॉस्फरस आणि पांढरा फॉस्फरस P 4, आयोडीन I 2, डायमंड आणि ग्रेफाइट C), वायूसारखे पदार्थ (ऑक्सिजन O2, ओझोन O3, नायट्रोजन N 2 , पाणी H 2, क्लोरीन C1 2, फ्लोरिन F 2, नोबल वायू) आणि रेडिन (ब्रोमाइन Br 2) 2. धातूचा फ्लॅश धुवा 2. धातूचा फ्लॅश धुवू नका (आयोडीन I 2, ग्रेफाइट C) 3. इलेक्ट्रिकल आणि थर्मल चालकता 3. यापुढे विद्युत प्रवाह चालवू नका (वाहकांमध्ये, उदाहरणार्थ, सिलिकॉन, ग्रेफाइटचा समावेश होतो) 4. बनावट, प्लास्टिक, चिकट 4. घन, टेंडिनस साध्या शब्दात:
![]()
तुमचा पोषण सल्ला द्या अॅलोट्रॉपी म्हणजे काय? ऍलोट्रॉपिक सुधारणांचा अर्थ सांगा. ऍलोट्रॉपीची घटना काय आहे? भाषणांच्या विविधतेचे एक कारण काय आहे? ही रासायनिकदृष्ट्या चुकीची काव्यात्मक अभिव्यक्ती का आहे: “वाऱ्यात वादळ होता”? तुम्ही धातू आणि नॉन-मेटल्समध्ये का विभागले? तुम्ही धातू आणि नॉन-मेटल्समध्ये का विभागले?


रासायनिक घटक - धातू नसलेले
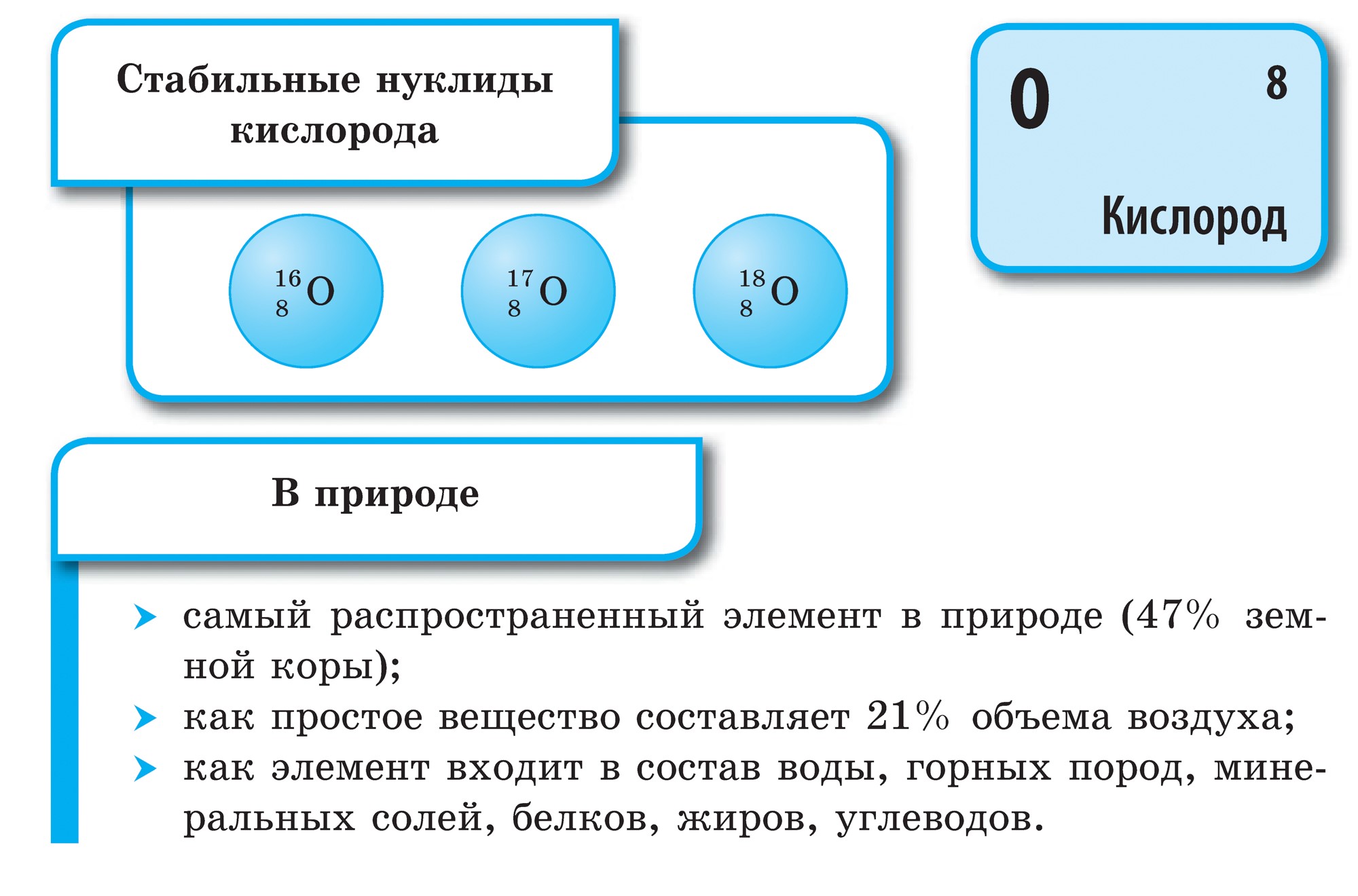
एकूण 16 नॉन-मेटल रासायनिक घटक आहेत आणि त्यापैकी दोन, ऑक्साईड आणि सिलिकॉन, पृथ्वीच्या कवचाच्या वस्तुमानाच्या 76% भाग बनवतात. नॉन-मेटल्समध्ये वनस्पतींच्या वस्तुमानाच्या 98.5% आणि मानवांच्या वस्तुमानाच्या 97.6% भाग असतात. कार्बन, पाणी, आंबट, आंबट, फॉस्फरस आणि नायट्रोजनसह सर्व महत्त्वपूर्ण सेंद्रिय पदार्थ तयार होतात, दुर्गंधी आणि जीवनाचे घटक असतात. पाणी आणि हेलियम हे विश्वाचे मुख्य घटक आहेत, ज्यापासून आपल्या सूर्यासह सर्व वैश्विक वस्तू तयार होतात. नॉन-मेटल्सच्या कनेक्शनशिवाय, आपले जीवन समजून घेणे अशक्य आहे, विशेषत: जीवनात सर्वात महत्वाचे काय आहे याचा अंदाज लावणे. रासायनिक कनेक्शन- पाणी - जलीय आणि आंबट असते.
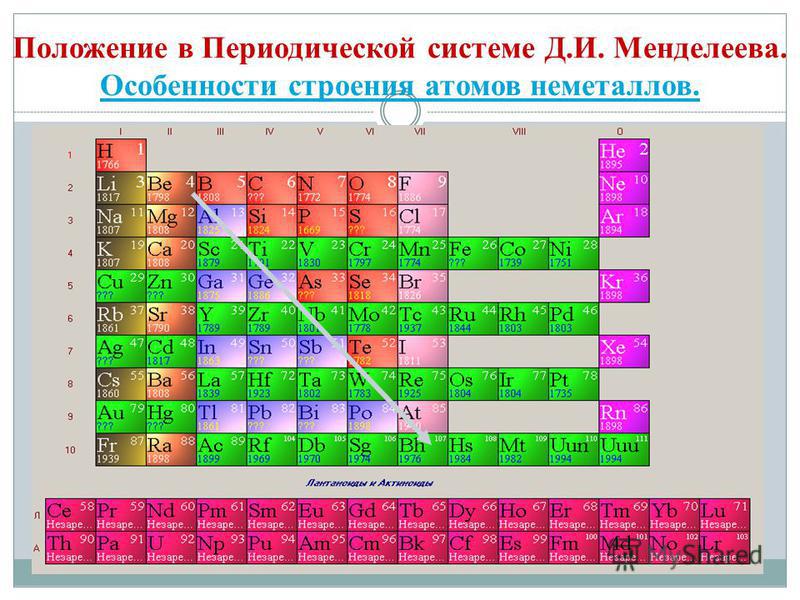
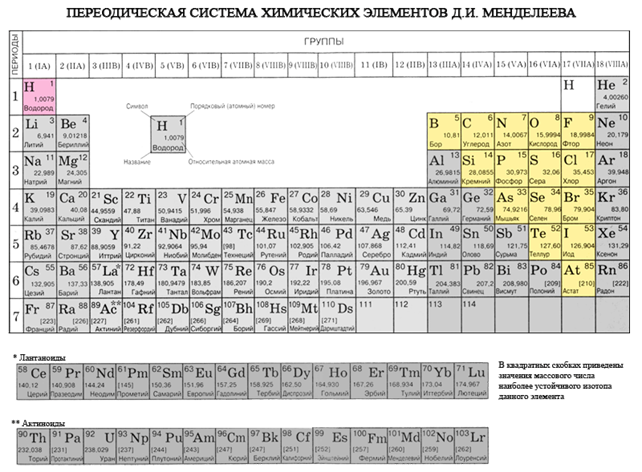
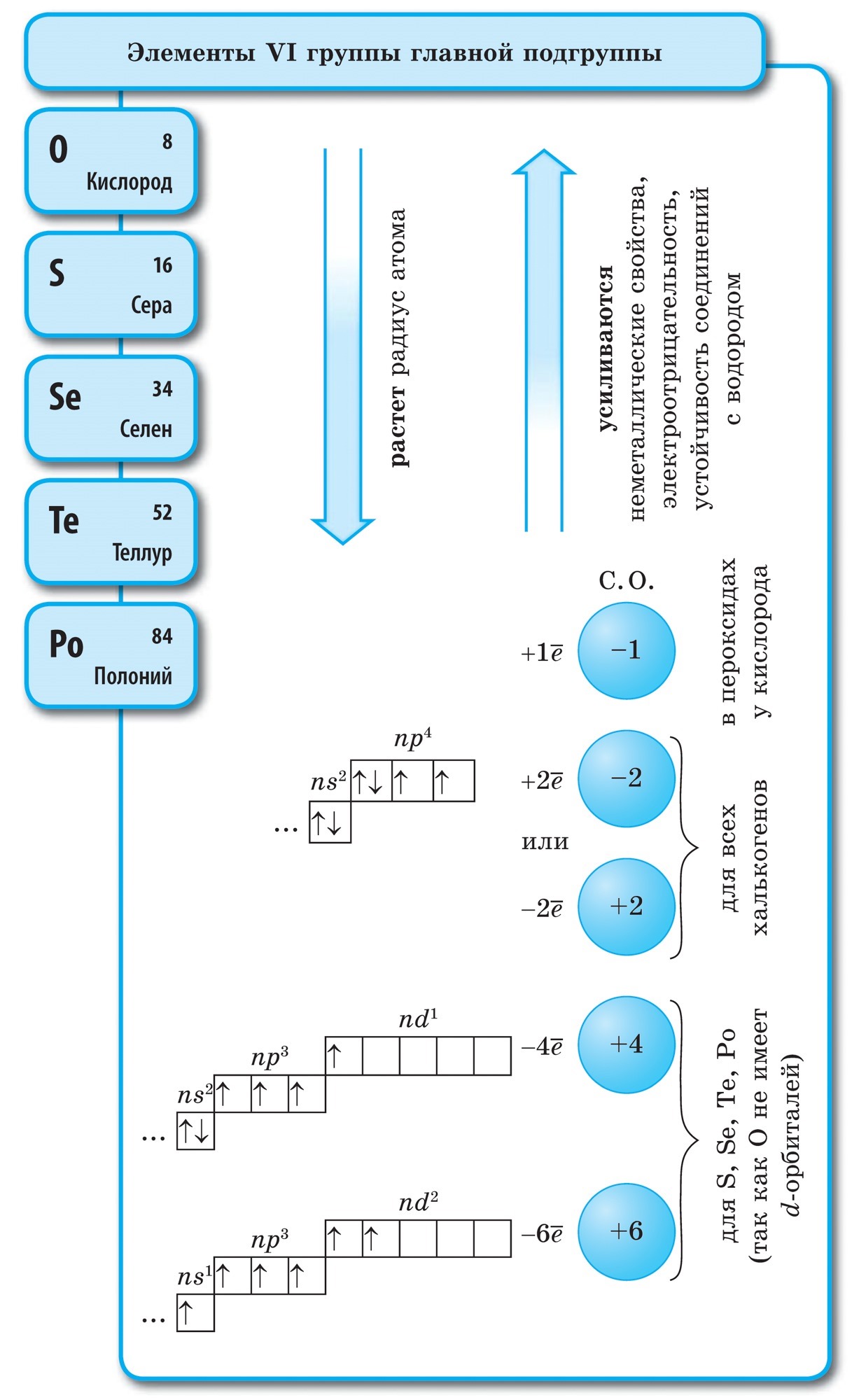
जर नियतकालिक प्रणालीमध्ये आपण बेरीलियमपासून अॅस्टाटिनपर्यंत कर्ण रेखाटले तर कर्णाच्या बाजूने उजव्या चढावर नॉन-मेटल घटक असतील आणि तळाशी - धातू असतील आणि त्यांच्यापर्यंत सर्व दुय्यम उपसमूहांचे घटक असतील, lanthanides आणि actinoides. कर्णाच्या जवळ ठेवलेले घटक, उदाहरणार्थ, बेरीलियम, अॅल्युमिनियम, टायटॅनियम, जर्मेनियम, अँटीमोनी, दुहेरी वर्ण आहेत आणि ते Metaloid शी संबंधित आहेत. धातू नसलेले घटक: s-घटक - वोडेन; p-घटक 13 गट - बोरॉन; 14 गट - कोळसा आणि सिलिकॉन; 15 गट - नायट्रोजन, फॉस्फरस आणि राख, 16 गट - किसेन, सिरका, सेलेनियम आणि तेलूरआणि गट 17 चे सर्व घटक - फ्लोरिन, क्लोरीन, ब्रोमिन, आयोडीन आणि अॅस्टाटिन. एलिमेंटी 18 गट - अक्रिय वायूते एक विशेष स्थान व्यापतात, ते बाह्य इलेक्ट्रॉनिक बॉलच्या टोकांभोवती लपून राहतात आणि धातू आणि नॉन-मेटल दरम्यान मध्यवर्ती स्थान व्यापतात. ते काहीवेळा नॉन-मेटल्स म्हणून वर्गीकृत केले जातात, किंवा औपचारिकपणे, भौतिक चिन्हांमागे.
धातू नसलेले- tse रासायनिक घटक, अणू जे बाह्य ऊर्जा पातळी पूर्ण करण्यासाठी इलेक्ट्रॉन घेतात, ज्यामुळे त्यांच्यावर नकारात्मक शुल्क निर्माण होते.
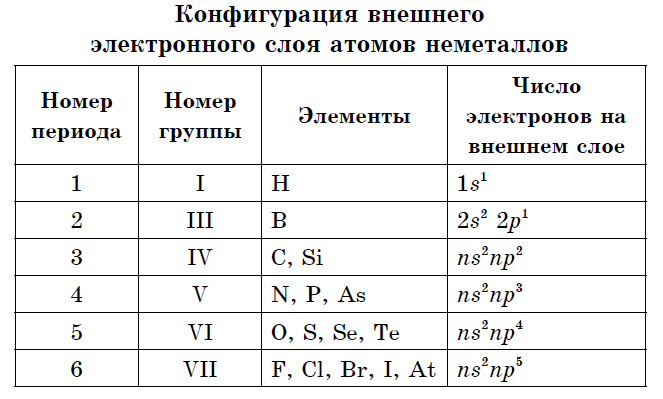
नॉनमेटल अणूंच्या बाह्य इलेक्ट्रॉन गोलामध्ये तीन ते आठ इलेक्ट्रॉन असतात.
जवळजवळ सर्व नॉन-मेटलमध्ये समान रीतीने लहान त्रिज्या आणि 4 ते 7 पर्यंतच्या वर्तमान ऊर्जा स्तरावर मोठ्या संख्येने इलेक्ट्रॉन असतात, ते इलेक्ट्रोनेगेटिव्हिटीच्या उच्च मूल्यांद्वारे वैशिष्ट्यीकृत आहेत आणि शक्तीचे ऑक्साइड. म्हणून, धातूच्या अणूंच्या संबंधात, नॉनमेटल्सचे वैशिष्ट्य आहे:
· लहान अणु त्रिज्या;
· वर्तमान ऊर्जा पातळीमध्ये इलेक्ट्रॉनपेक्षा जास्त;
नॉन-मेटल अणूंची ही एक महत्त्वाची शक्ती आहे - प्रवृत्ती दररोज 8 इलेक्ट्रॉनपर्यंत प्राप्त होते, नंतर पॉवरचे ऑक्साइड. नॉन-मेटल अणूंचे स्पष्ट वैशिष्ट्य म्हणजे इलेक्ट्रॉनिक कॉमर्स त्यांच्या गैर-धातुत्वाचे मोजमाप म्हणून काम करू शकतात, कारण रासायनिक घटकांच्या अणूंची शक्ती रासायनिक बंधनाचे ध्रुवीकरण करण्यासाठी, वेड्या इलेक्ट्रॉनिक बेटांना स्वतःकडे आकर्षित करण्यासाठी;
रासायनिक घटकांचे प्रथम वैज्ञानिक वर्गीकरण त्यांना धातू आणि नॉन-मेटल्समध्ये विभागणे होते. या वर्गीकरणाने या काळातही त्याचे महत्त्व गमावले नाही. नॉन-मेटल्स हे रासायनिक घटक आहेत ज्यासाठी अणूंना बाह्य गोलाकार पूर्ण होण्यापूर्वी इलेक्ट्रॉन स्वीकारण्याची क्षमता दर्शविली जाते, नियम म्हणून, बाह्य इलेक्ट्रॉनिक गोलावर चार किंवा अधिक इलेक्ट्रॉन असतात आणि थोड्या प्रमाणात अणू आणि धातूचे अणू.
हे मूल्य मुख्य उपसमूहाच्या आठव्या गटातील इतर घटकांपासून वंचित ठेवते - निष्क्रिय किंवा उदात्त वायू, अणू जे बाह्य इलेक्ट्रॉन बॉल पूर्ण करू शकतात. या घटकांच्या अणूंचे इलेक्ट्रॉनिक कॉन्फिगरेशन असे आहे की ते धातू किंवा गैर-धातू म्हणून वर्गीकृत केले जाऊ शकत नाहीत. दुर्गंधी ही त्या वस्तू आहेत ज्या घटकांना धातू आणि नॉन-मेटलमध्ये विभाजित करतात, त्यांच्यामध्ये जवळचे स्थान व्यापतात. जड किंवा उदात्त वायू ("कुलीनता" जडत्वात व्यक्त केली जाते) भौतिक चिन्हांमागे नॉन-मेटल्स म्हणून वर्गीकृत केली जाते किंवा त्याहूनही अधिक औपचारिकरित्या. ही उत्पादने अगदी कमी तापमानातही वायूसारखी वनस्पती टिकवून ठेवतात. अशा प्रकारे, हेलियम ची t ° \u003d -268.9 ° C वर दुर्मिळ अवस्थेत जात नाही.
या घटकांची रासायनिक जडत्व स्पष्ट आहे. झेनॉन आणि क्रिप्टनसाठी ते फ्लोरिन आणि ऍसिडसह एकत्र केले जाते: KrF 2, XeF 2, XeF 4 आणि इतर. निःसंशयपणे, या अभ्यासांमध्ये, अक्रिय वायूंनी पायनियर म्हणून काम केले. तेथे बरेच नॉन-मेटल्स आहेत आणि त्यांचे अणू इलेक्ट्रोनेगेटिव्हिटीच्या उच्च मूल्यांद्वारे वैशिष्ट्यीकृत आहेत. ते 2 आणि 4 दरम्यान बदलते. नॉन-मेटल्स हे मुख्य उपसमूहांचे घटक आहेत, सर्वात महत्त्वाचे म्हणजे p-घटक आणि नंतर s-घटक.
सर्व नॉन-मेटल घटक (पाण्यासह) रासायनिक घटक D. I च्या आवर्त सारणीमध्ये समाविष्ट आहेत. मेंडेलेव्हचा वरचा उजवा कोपरा, जो ट्रायकुलस उघडतो, ज्याचा शिखर फ्लोरिन एफ आहे आणि पाया आहे कर्ण B - At. तथापि, आपण विशेषत: नियतकालिक प्रणालीमध्ये पाण्याच्या अस्पष्ट स्थितीवर लक्ष केंद्रित केले पाहिजे: मुख्य उपसमूह I आणि VII गटांमध्ये. ते फॅन्सी नाही. एकीकडे, पाण्याच्या अणूमध्ये, खालच्या धातूंच्या अणूंप्रमाणे, बाह्य (आणि नवीनसाठी समान) इलेक्ट्रॉन बॉलवर एक इलेक्ट्रॉन (इलेक्ट्रॉनिक कॉन्फिगरेशन 1s 1) असतो, जो सध्याच्या काळात प्रकट होतो. नेत्याची शक्ती.
बहुतेक पाणी, धातूंप्रमाणे, ऑक्सिडेशन स्टेज +1 प्रदर्शित करते. पायाभूत धातूंच्या अणूंपेक्षा पाण्याला अणूचे इलेक्ट्रॉनचे दान अधिक महत्त्वाचे असते. दुसरीकडे, पाण्याचा अणू, हॅलोजन अणूंप्रमाणे, इलेक्ट्रॉन गोल पूर्ण करण्यासाठी एक इलेक्ट्रॉन गमावतो, म्हणून पाण्याचा अणू एक इलेक्ट्रॉन स्वीकारू शकतो, ऑक्सिडेशनची शक्ती आणि हायड्राइड्समधील हॅलोजनचे ऑक्सिडेशन चरण -1 वैशिष्ट्य प्रदर्शित करतो. धातू, हॅलोजनसह समान जोडणारे धातू - हॅलाइड्स). अणूमध्ये एक इलेक्ट्रॉन जोडताना, हॅलोजनपेक्षा पाणी अधिक महत्त्वाचे असते.
येथे सर्वात मोठ्या मनातपाणी N 2 - वायू. हे रेणू, हॅलोजनसारखे, डायटॉमिक आहे. नॉन-मेटल अणूंमध्ये, पॉवरचे ऑक्साइड अधिक महत्त्वाचे असतात, म्हणजे इलेक्ट्रॉनची उपस्थिती. ही वस्तुस्थिती इलेक्ट्रोनेगेटिव्हिटीचे मूल्य दर्शवते, जी नैसर्गिकरित्या पूर्णविराम आणि उपसमूहांमध्ये बदलते. फ्लोरिन हा सर्वात मजबूत ऑक्सिडायझिंग एजंट आहे, ज्याचे रासायनिक अभिक्रियांमधील अणू इलेक्ट्रॉन सोडत नाहीत, म्हणजेच नवीन शक्ती प्रकट करतात. इतर नॉन-मेटल्स अत्यंत शक्तीचे प्रदर्शन करू शकतात, जरी धातूंच्या संबंधात खूपच कमकुवत पातळीवर; ऑक्सिडेटिव्हच्या अनुषंगाने त्यांच्या मूळ उत्पादनाच्या कालावधी आणि उपसमूहांमध्ये उलट क्रमाने बदल होतात.
- नॉन-मेटल घटक हेड उपसमूह III-VIII गटांमध्ये मिसळले जातात PS D.I. मेंडेलेव्ह, वरच्या उजव्या कोपऱ्यावर कब्जा करत आहे.
- धातू नसलेल्या घटकांच्या अणूंच्या बाह्य इलेक्ट्रॉन गोलामध्ये 3 ते 8 इलेक्ट्रॉन असतात.
- घटकांच्या अधातूच्या शक्ती कालांतराने मजबूत होतात आणि घटकांच्या क्रमिक संख्येत वाढ झाल्यामुळे उपसमूहांमध्ये कमकुवत होतात.
- धातू नसलेले बहुतेक आंबट भाग आम्लयुक्त असतात (अॅसिड ऑक्साईड्स आणि हायड्रॉक्साइड्स).
- ऑक्साईड कार्ये प्रदर्शित करणारे इलेक्ट्रॉन स्वीकारण्यासाठी आणि त्यांना अतिरिक्त कार्ये प्रदान करण्यासाठी नॉन-मेटल घटकांचे अणू तयार केले जातात.
बुडोवा आणि नॉन-मेटल्सची भौतिक शक्ती
साध्या भाषणात, अणू आणि नॉनमेटल्स जोडलेले असतात सहसंयोजक नॉन-ध्रुवीय बंध. परिणामी, वेगळ्या अणूंपेक्षा अधिक स्थिर इलेक्ट्रॉनिक प्रणाली तयार होते. या प्रकरणात, एकल (उदाहरणार्थ, पाण्याच्या रेणूंमध्ये H 2, हॅलोजन F 2, Br 2, I 2), दुप्पट (उदाहरणार्थ, अल्कोहोल S 2 च्या रेणूंमध्ये), तिप्पट (उदाहरणार्थ, नायट्रोजन N च्या रेणूंमध्ये 2) सहसंयोजक बंध तयार होतात.
- दिवसाचा जोम
- कोणतीही चमक नाही
- थर्मल चालकता (केवळ ग्रेफाइट)
- रंग भिन्न आहेत: पिवळा, पिवळसर-हिरवा, लाल-तपकिरी.
- विद्युत चालकता (फक्त ग्रेफाइट आणि ब्लॅक फॉस्फरस)
एकूण मिल:
- rіdina - Br 2;
धातू व्यतिरिक्त, नॉन-मेटल्स - मला शब्द माफ कर, शक्तींच्या मोठ्या विविधतेद्वारे वैशिष्ट्यीकृत. नॉन-मेटल्स अत्यंत मनाने गिरणीच्या समुच्चयातून फाटल्या जातात:
- वायू - H 2, O 2, O 3, N 2, F 2, Cl 2;
- rіdina - Br 2;
- घन पदार्थ - सल्फर, फॉस्फरस, सिलिकॉन, कार्बन इ.
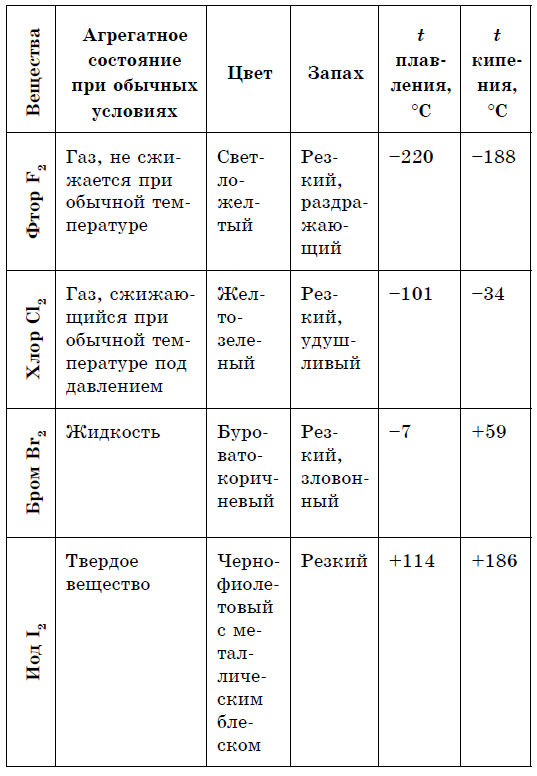
नॉन-मेटल्समध्ये रंगांचा अधिक समृद्ध स्पेक्ट्रम असतो: लाल - फॉस्फरससाठी, लाल-तपकिरी - ब्रोमिनसाठी, पिवळा - सिरकासाठी, पिवळा-हिरवा - क्लोरीनसाठी, व्हायलेट - आयोडीनसाठी. घटक बहुतेक धातू नसलेले असतात, धातूंसह एकत्रितपणे, अॅलोट्रॉपीच्या बिंदूपर्यंत.
एका रासायनिक घटकाच्या अणूंच्या अनेक साध्या संयुगे तयार करण्याच्या क्षमतेला अॅलोट्रॉपी म्हणतात आणि त्या साध्या संयुगांना अॅलोट्रॉपिक प्रजाती म्हणतात.
शब्द माफ करा - नॉन-मेटल्स आई करू शकतात:
1. आण्विक बुडोवा.कमी सांद्रतेमध्ये, यातील बहुतेक पदार्थ हे वायू (H 2, N 2, O 2, F 2, Cl 2, O 3) किंवा घन पदार्थ (I 2, P 4, S 8) आणि एकापेक्षा कमी ब्रोमिन (Br) असतात. 2 ) є rіdina. हे सर्व शब्द आण्विक आत्म्याला वाटतात आणि म्हणूनच उडत आहेत. घन अवस्थेत, दुर्गंधीमध्ये कमकुवत आंतरआण्विक परस्परसंवादामुळे कमी वितळण्याचा बिंदू असतो, ज्यामुळे त्यांचे रेणू क्रिस्टलमध्ये काढून टाकतात, ज्यामुळे उदात्तीकरण होते.
2. आत्मनु बुडोवु ।हे शब्द अणूंच्या लांब लॅन्सने तयार केले आहेत (C n, B n, Si n, Se n, Ten). सहसंयोजक बंधांच्या महान मूल्यामुळे, दुर्गंधी, एक नियम म्हणून, उच्च कडकपणा आहे आणि त्यांच्या क्रिस्टल्समधील सहसंयोजक बंधांच्या नाशाशी संबंधित कोणतेही बदल (वितळणे, बाष्पीभवन) महान विट्राटो यू उर्जेमुळे प्रभावित होतात. खरं तर, अशा संयुगे उच्च वितळणे आणि उकळत्या बिंदू आहेत, आणि अस्थिरता खूप कमी आहे.
मूठभर साधी भाषणे अनेक नॉन-मेटल घटकांद्वारे तयार केली जातात - ऍलोट्रॉपिक बदल. अणूंच्या शक्तीला अॅलोट्रॉपी म्हणतात. अॅलोट्रॉपी रेणूंच्या वेगळ्या रचनेशी (O 2, O 3) आणि वेगळ्या प्रकारच्या क्रिस्टल्सशी संबंधित असू शकते. कार्बनच्या अॅलोट्रॉपिक बदलांमध्ये ग्रेफाइट, डायमंड, कार्बाइन, फुलरीन यांचा समावेश होतो. सर्व नॉन-मेटल्सची वैशिष्ट्ये प्रकट करण्यासाठी, घटकांच्या नियतकालिक प्रणालीमध्ये त्यांच्या वितरणाकडे लक्ष देणे आणि बाह्य इलेक्ट्रॉन बॉलचे कॉन्फिगरेशन विचारात घेणे आवश्यक आहे.
कालावधी:
- परमाणु शुल्क वाढते;
- अणूची त्रिज्या बदलते;
- बाह्य क्षेत्रामध्ये इलेक्ट्रॉनची संख्या वाढते;
- इलेक्ट्रॉनिक कॉमर्स वाढत आहे;
- शक्ती ऑक्साइड silyuyutsya होईल;
- अधातू अधिकारी प्रबळ होतील.
मुख्य उपसमूहात:
- परमाणु शुल्क वाढते;
- अणूची त्रिज्या वाढते;
- बाहेरील चेंडूवरील इलेक्ट्रॉनची संख्या बदलत नाही;
- इलेक्ट्रोनेगेटिव्हिटी बदल;
- शक्तीचे ऑक्साईड कमकुवत होतात;
- धातू नसलेल्या शक्ती क्षीण होत आहेत.
बहुतेक धातू, दुर्मिळ अपवादांसह (सोने, तांबे आणि इतर), चांदी-पांढर्या रंगाच्या विकृतीद्वारे दर्शविले जातात. आणि साध्या भाषणांची अक्ष - धातू नसलेली, गामा रंग लक्षणीय भिन्न आहेत: पी, से - पिवळा; बी - तपकिरी; ओ 2 (एल) - ब्लॅकिटनिअम; Si, As (भेटले) - sірі; पी 4 - फिकट गुलाबी-zhovty; मी - धातूच्या चकाकीसह वायलेट-काळा; Br 2 (g) - बोरॅक्स; C1 2 (g) - पिवळा-हिरवा; एफ 2 (आर) - फिकट हिरवा; S 8 (TV) - zhovta. नॉन-मेटल क्रिस्टल्स प्लास्टिक नसतात आणि कोणत्याही विकृतीमुळे सहसंयोजक बंधांचा नाश होतो. बहुतेक नॉन-मेटल्स धातूची चमक निर्माण करत नाहीत.

एकूण 16 रासायनिक घटक-गैर-धातू आहेत! 114 घटक आहेत असा तुमचा विश्वास असेल तर तिथे फार काही नाही. दोन नॉन-मेटल घटक पृथ्वीच्या 76% कवच बनवतात. हे किसेन (49%) आणि सिलिकॉन (27%) आहे. पृथ्वीच्या कवचामध्ये वातावरणात ०.०३% आम्ल असते. रोझलिनच्या वस्तुमानाच्या 98.5%, मानवी शरीराच्या वस्तुमानाच्या 97.6% होण्यासाठी ते धातू बनले नाहीत. सी, एच, ओ, एन, एस नॉन-मेटल्स हे बायोजेनिक घटक आहेत जे जिवंत ऊतींचे सर्वात महत्वाचे सेंद्रिय पदार्थ तयार करतात: प्रथिने, चरबी, कार्बोहायड्रेट, न्यूक्लिक अॅसिड. वाऱ्यावर गोदामात प्रवेश करणे सोपे आहे, जे आपण टाळतो संकुचित भाषण, तसेच नॉन-मेटल घटक (ऑक्सिजन O 2, नायट्रोजन N 2, कार्बन डायऑक्साइड CO 2, पाण्याची वाफ H 2 O i.e.) सह तयार केलेले.
साध्या पदार्थांची ऑक्साईड शक्ती - नॉन-मेटल्स
धातू नसलेल्या अणूंसाठी आणि म्हणूनच त्यांच्याद्वारे प्रकाशित केलेल्या साध्या शब्दांसाठी ते वैशिष्ट्यपूर्ण आहे ऑक्सिडेशन, म्हणून मी प्रेमशक्ती
1. नॉन-मेटल्सची ऑक्साईड पॉवरप्रथम स्थानावर दिसतात जेव्हा ते धातूंशी संवाद साधतात(दिवसाच्या दिवसांचे धातू):

क्लोरीन Cl 2 च्या पॉवरचे ऑक्साईड अधिक मजबूत असतात, सल्फरमध्ये कमी असते, त्यामुळे +2 आणि +3 च्या एकत्रित स्थिर ऑक्सिडेशन टप्प्यांमध्ये उपस्थित असलेल्या Fe धातूचा ऑक्सिडेशन उच्च पातळीवर केला जातो.
1. बहुतेक नॉन-मेटल्स दाखवतात शक्तीचे ऑक्साइड पाण्याशी संवाद साधताना. परिणामी, उडणारे पाण्याचे कण तयार होतात.
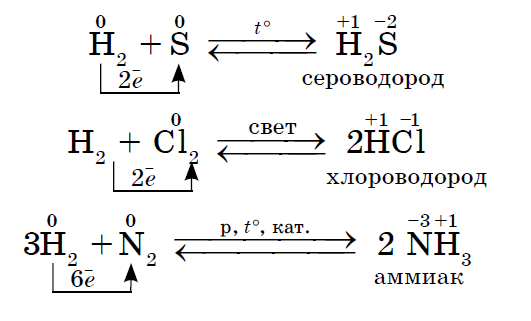
2. कोणतीही नॉन-मेटल त्या गैर-धातूंच्या प्रतिक्रियांमध्ये ऑक्सिडायझिंग एजंट म्हणून कार्य करते ज्यांचे मूल्य इलेक्ट्रोनेगेटिव्हिटी कमी असते:
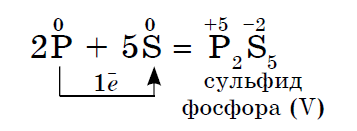
सल्फरची विद्युत ऋणात्मकता फॉस्फरसपेक्षा जास्त असते, जी शक्तीचे ऑक्साइड दर्शवते.
फ्लोरिनची इलेक्ट्रोनेगेटिव्हिटी इतर सर्व रासायनिक घटकांपेक्षा जास्त आहे, म्हणूनच ते ऑक्सिडायझिंग एजंटची शक्ती प्रदर्शित करते. फ्लोरिन F 2 हे धातू नसलेले सर्वात मजबूत ऑक्सिडायझर आहे आणि प्रतिक्रियांमध्ये फक्त ऑक्साईड शक्ती प्रदर्शित करते.
3. विविध फोल्डिंग स्पीचसह प्रतिक्रियांमध्ये नॉन-मेटलच्या शक्तीचे ऑक्साइड प्रकट होतात.
फोल्डिंग शब्दांसह प्रतिक्रियांमध्ये नॉन-मेटल ऑक्सिडेशनची ऑक्साईड शक्ती प्रथम स्थानावर लक्षणीय आहे:
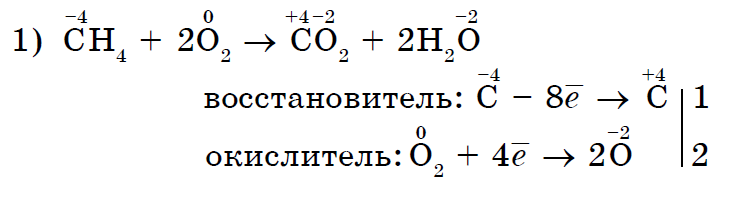
केवळ आंबटच नाही तर इतर नॉन-मेटल्स देखील फोल्डिंग कंपाऊंड्सच्या प्रतिक्रियांमध्ये ऑक्सिडायझिंग घटक असू शकतात.- अजैविक (1, 2) आणि सेंद्रिय (3, 4):
मजबूत ऑक्सिडायझिंग क्लोरीन Cl 2 क्लोराईड (II) चे क्लोराईड (III) मध्ये ऑक्सिडाइझ करते;
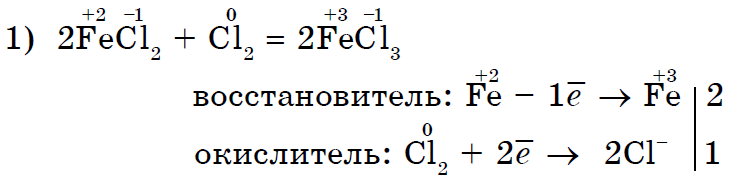
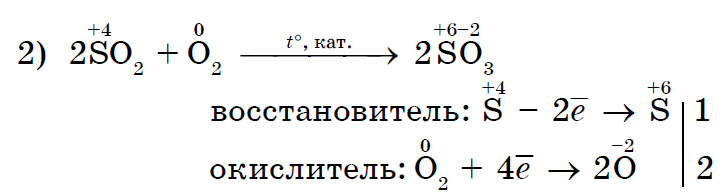
क्लोरीन Cl 2, जो एक मजबूत ऑक्सिडायझिंग एजंट आहे, पोटॅशियम आयोडाइडच्या स्पष्ट स्वरूपासह आयोडीन I 2 एकत्र करतो;
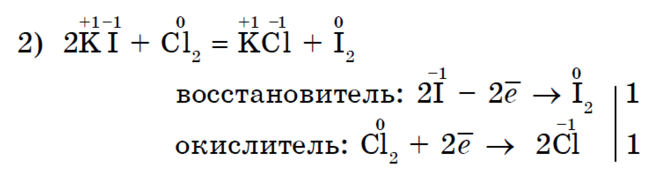
मिथेनचे हॅलोजनेशन ही अल्केनसाठी वैशिष्ट्यपूर्ण प्रतिक्रिया आहे;
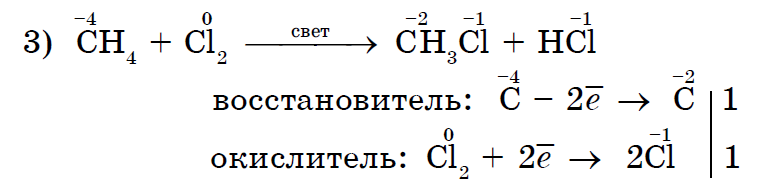
संपृक्ततेच्या कमतरतेची स्पष्ट प्रतिक्रिया म्हणजे त्यांच्यामध्ये ब्रोमाइन पाणी जोडणे.
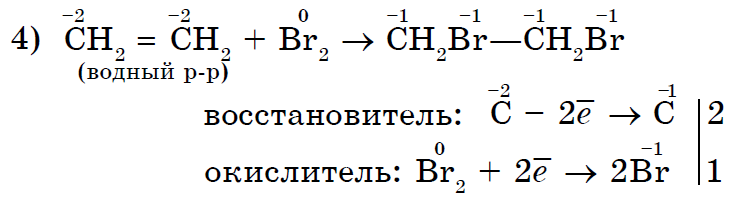
साध्या भाषणांची नवीन शक्ती - नॉन-मेटल
पाहताना एक एक करून नॉन-मेटल्सची प्रतिक्रियातथापि, त्यांच्या इलेक्ट्रोनेगेटिव्हिटीच्या महत्त्वानुसार, त्यापैकी एक ऑक्सिडायझरची शक्ती दर्शवितो, आणि दुसरा - नेत्याची शक्ती.
1. फ्लोरिनच्या संबंधात, सर्व गैर-धातू (किसेन सारख्या) अंतिम शक्ती प्रदर्शित करतात.
2. वरवर पाहता, फ्लोरिनसह गैर-धातू, ऍसिडशी संवाद साधताना कमी करणारे एजंट म्हणून काम करतात.

प्रतिक्रियेचा परिणाम म्हणून, नॉन-मेटल ऑक्साईड्स: मीठ न बनवणारी आणि मीठ तयार करणारी आम्ल. आणि जरी हॅलोजन ऍसिडवर रागवत नसले तरी ते ऑक्साइड आहेत: Cl 2 +1 O -2, Cl 2 +4 O 2 -2, Cl 2 +7 O 7 -2, Br 2 +1 O -2, Br +4 O 2 -2, I 2 +5 O 5 -2, आणि in., अप्रत्यक्ष मार्गाने निर्धारित केल्याप्रमाणे.
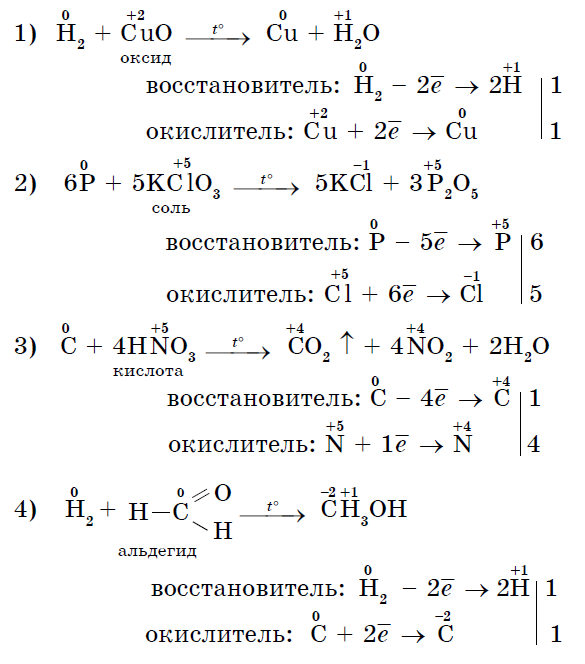
3. अनेक नॉन-मेटल्स फोल्डिंग कंपाऊंड्स - ऑक्सिडायझर्ससह प्रतिक्रियांमध्ये उत्प्रेरक म्हणून कार्य करू शकतात:
अशा प्रतिक्रिया देखील आहेत ज्यामध्ये समान नॉन-मेटल एकाच वेळी ऑक्सिडायझिंग आणि डिजनरेटिंग दोन्ही आहे. स्व-ऑक्सिडेशन-स्व-नूतनीकरणाची प्रतिक्रिया (विषमता):
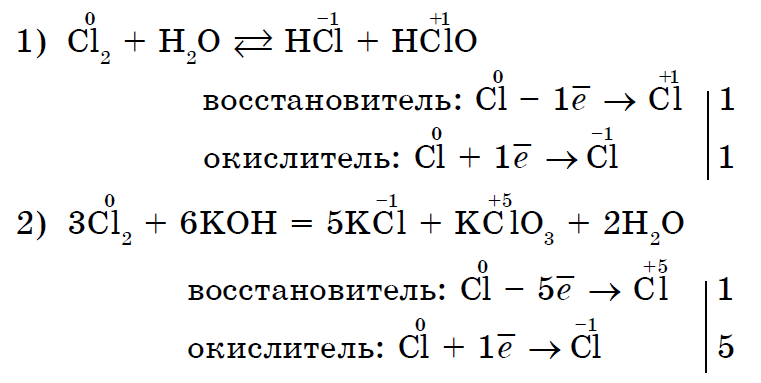
अशा प्रकारे, बहुतेक नॉन-मेटल्समध्ये प्रवेश करू शकतात रासायनिक प्रतिक्रियाऑक्सिडायझरच्या भूमिकेत आणि जनरेटरच्या भूमिकेत (नवीन शक्ती केवळ फ्लोरिन एफ 2 मध्ये जोडली जात नाही).
नॉन-मेटल्सचा पाणीपुरवठा
धातूंऐवजी, नॉन-मेटल्स वायूयुक्त पाण्यासारख्या संयुगे तयार होतात. त्यांचे कोठार नॉन-मेटलच्या ऑक्सिडेशनच्या टप्प्यावर साठवले जाते.
RH 4 → RH 3 → H 2 R → HR
सर्व नॉन-मेटल्सची लपलेली शक्ती उन्हाळी पाणी संघटनांची स्थापना, बहुतेक नॉन-मेटल्समध्ये, ऑक्सिडेशन स्टेज कमी आहे. भाषणाच्या सूत्रांच्या समावेशामध्ये तुम्ही आधी वापरलेले बरेच शांत, शक्तिशाली, स्थिर आणि ओट्रीमन्या आहेत: CH 4, NH 3, H 2 O, H 2 S, HCl.
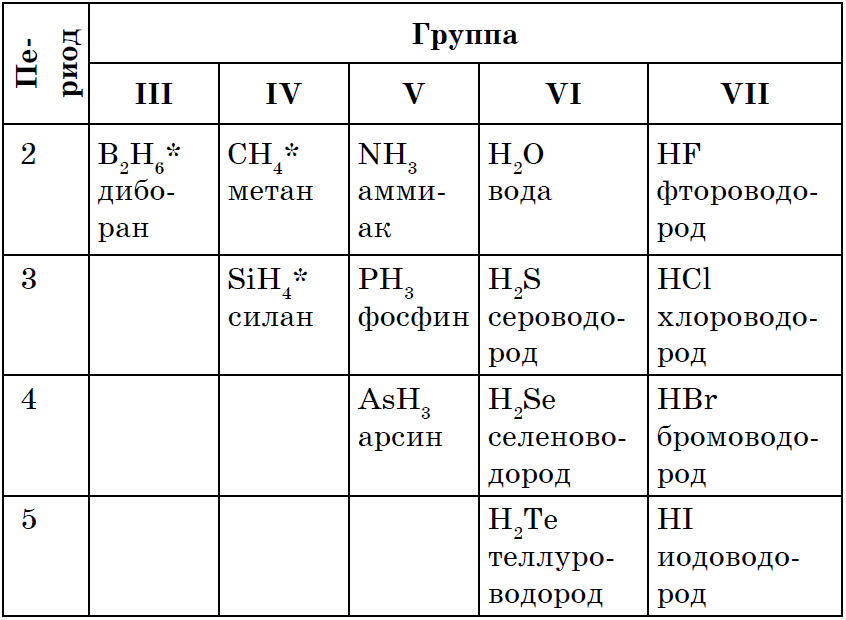
असे दिसते की आपण करू शकता ही सर्वात सोपी गोष्ट मधूनच काढून टाकणे आहे पाण्याशी नॉनमेटलचा परस्परसंवाद, टोबटो संश्लेषण:
![]()
सर्व जल-आधारित, नॉन-मेटलिक संयुगे सहसंयोजक ध्रुवीय बंधांद्वारे तयार केले जातात, एक आण्विक पदार्थ बनवतात आणि बहुतेक प्रकरणांमध्ये, पाण्याशिवाय इतर वायू बनतात. नॉन-मेटलच्या जल-आधारित कनेक्शनसाठी, त्यांना पाण्यापूर्वी वेगळ्या पद्धतीने ठेवणे वैशिष्ट्यपूर्ण आहे. त्यात मिथेन आणि सिलेन व्यावहारिकदृष्ट्या अपरिहार्य आहेत. अमोनिया, पाण्यात विरघळल्यावर, कमकुवत आधार NH 3 H 2 O विरघळते. पाण्यात विरघळल्यावर, हायड्रोजन सेलेनाइड, हायड्रोजन टेल्युराइड आणि हायड्रोजन हॅलाइड्स पाण्याच्या संयुगांच्या समान सूत्रासह ऍसिड विरघळतात: H 2 S, H 2 Se , H 2 Te, HF, HCl, HBr, HI.
जर तुम्ही एका कालखंडातील नॉन-मेटल्सद्वारे तयार केलेल्या पाण्याच्या संयुगांच्या आम्ल-बेस पॉवरची समानता केली, उदाहरणार्थ, दुसरे (NH 3, H 2 O, HF) किंवा तिसरे (PH 3, H 2 S, HCl), तर तुम्ही अम्लीय शक्तींच्या नैसर्गिक बळकटीकरणाबद्दल आणि वरवर पाहता, मूलभूत कमकुवत करण्याबद्दल निष्कर्ष काढू शकतो. हे स्पष्टपणे ध्रुवीयता वाढते या वस्तुस्थितीमुळे आहे लिंक E-N(डी ई नॉन-मेटल आहे).
एका उपसमूहाच्या नॉन-मेटल्सच्या जलीय संयुगांची आम्ल-आधार शक्ती देखील उपविभाजित केली जाते. उदाहरणार्थ, हायड्रोजन हॅलाइड्स HF, HCl, HBr, HI च्या मालिकेत, E-H बाँडचे महत्त्व बदलते, कारण बाँडची ताकद वाढते. वेगवेगळ्या प्रजातींमध्ये, HCl, HBr, HI जवळजवळ पूर्णपणे मजबूत ऍसिडपासून वेगळे होतात आणि त्यांची शक्ती HF ते HI पर्यंत वाढते. या प्रकरणात, HF कमकुवत ऍसिडमध्ये कमी केला जातो, जो दुसर्या घटकाद्वारे निर्धारित केला जातो - आंतरआण्विक परस्परसंवाद, पाण्याचे बंध तयार करणे ... HF ... HF .... पाण्याचे अणू फ्लोरिन अणू F ला बांधलेले असतात. त्याचे रेणू, पण आणि दासी.
Uzagalnuyuchi समान वैशिष्ट्येनॉन-मेटल्सच्या पाण्याच्या संयुगांची आम्ल-बेस पॉवर, आम्ही आम्लाच्या बळकटीकरणाबद्दल आणि या पदार्थांची मूलभूत शक्ती ठराविक कालावधीत कमकुवत होण्याबद्दल शिकत आहोत आणि वाढलेल्या अणुसंख्येसह मुख्य उपसमूह त्यांचे घटक तयार करतात.
रासायनिक घटकांच्या PS च्या कालावधीत घटकांच्या अनुक्रमांकात वाढ झाल्यामुळे - नॉन-मेटल, पाण्याच्या जोडणीचे अम्लीय स्वरूप वाढते.
SiH 4 → PH 3 → H 2 S → HCl
वर नमूद केलेल्या शक्तींव्यतिरिक्त, ऑक्साईड-बेस अभिक्रियांमध्ये नॉन-मेटल्सचे पाण्याचे परिणाम नेहमी नवीन शक्ती दर्शवतात आणि त्यातही नॉन-मेटलमध्ये ऑक्सिडेशनची निम्न अवस्था असते.
वोडेन
वोडेन - प्रमुख घटकसर्व जग. बहुतेक वैश्विक वस्तू (वायू ढग, तारे, सूर्यासह) कमी-अधिक अर्ध्या पाण्याने बनलेल्या असतात. पृथ्वीवर, वातावरण, हायड्रोस्फियर आणि लिथोस्फियरसह, फक्त 0.88%. कोरफड वजनाने मोठे आहे, परंतु पाण्याचे अणू वजन खूपच लहान आहे. म्हणून, एक लहान रक्कम तयार केली जाते आणि पृथ्वीवरील प्रत्येक 100 अणूंमधून 17 पाण्याचे अणू असतात.
जंगलात, पाणी H 2 रेणूंच्या रूपात दिसते, अणू एका रेणूमध्ये जोडलेले असतात. सहसंयोजक नॉन-ध्रुवीय बंध.
वोडेन (H 2) हा सर्व वायूसदृश नद्यांमधील सर्वात हलका वायू आहे. माझ्याकडे सर्वात जास्त थर्मल चालकता असेल आणि सर्वात कमी उकळत्या बिंदू (हिलियम नंतर) असेल. पाण्यात किंचित विरघळणारे. -252.8 ° से तापमानात आणि वातावरणाचा दाब, पाणी दुर्मिळ होते.
1. पाण्याचा रेणू पूर्वीपेक्षा खूप मजबूत आहे, त्याचे काय करावे निष्क्रिय:
H 2\u003d 2H - 432 kJ
2. अत्यंत तापमानात, पाणी सक्रिय धातूसह प्रतिक्रिया देते:
Ca + H 2 \u003d CaH 2,
कॅल्शियम हायड्राइड विरघळवणे, i s F 2, हायड्रोजन फ्लोराइड विरघळवणे:
F 2 + H 2 \u003d 2HF
3. केव्हा उच्च तापमान अमोनिया काढून टाका:
N 2 + 3H 2 \u003d 2NH 3
आणि टायटॅनियम हायड्राइड (मेटल पावडर):
Ti + H 2 \u003d TiH 2
4. पाणी वापरताना आंबटपणासह प्रतिक्रिया देते:
2H 2 + O 2 \u003d 2H 2 O + 484 kJ
5. वोडेन वोलोद्या ही एक अत्यंत मौल्यवान इमारत आहे:
CuO + H 2 \u003d Cu + H 2 O
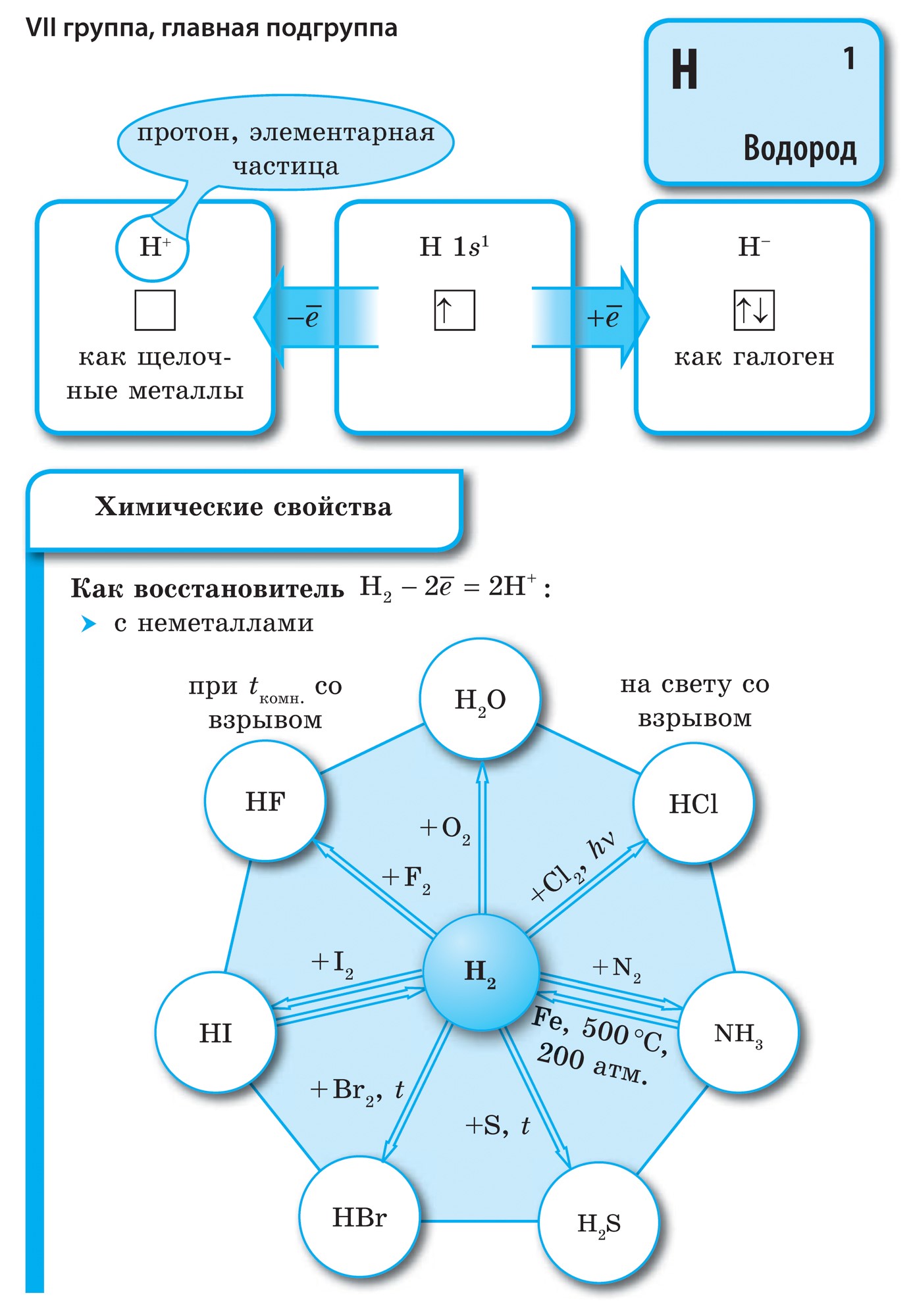
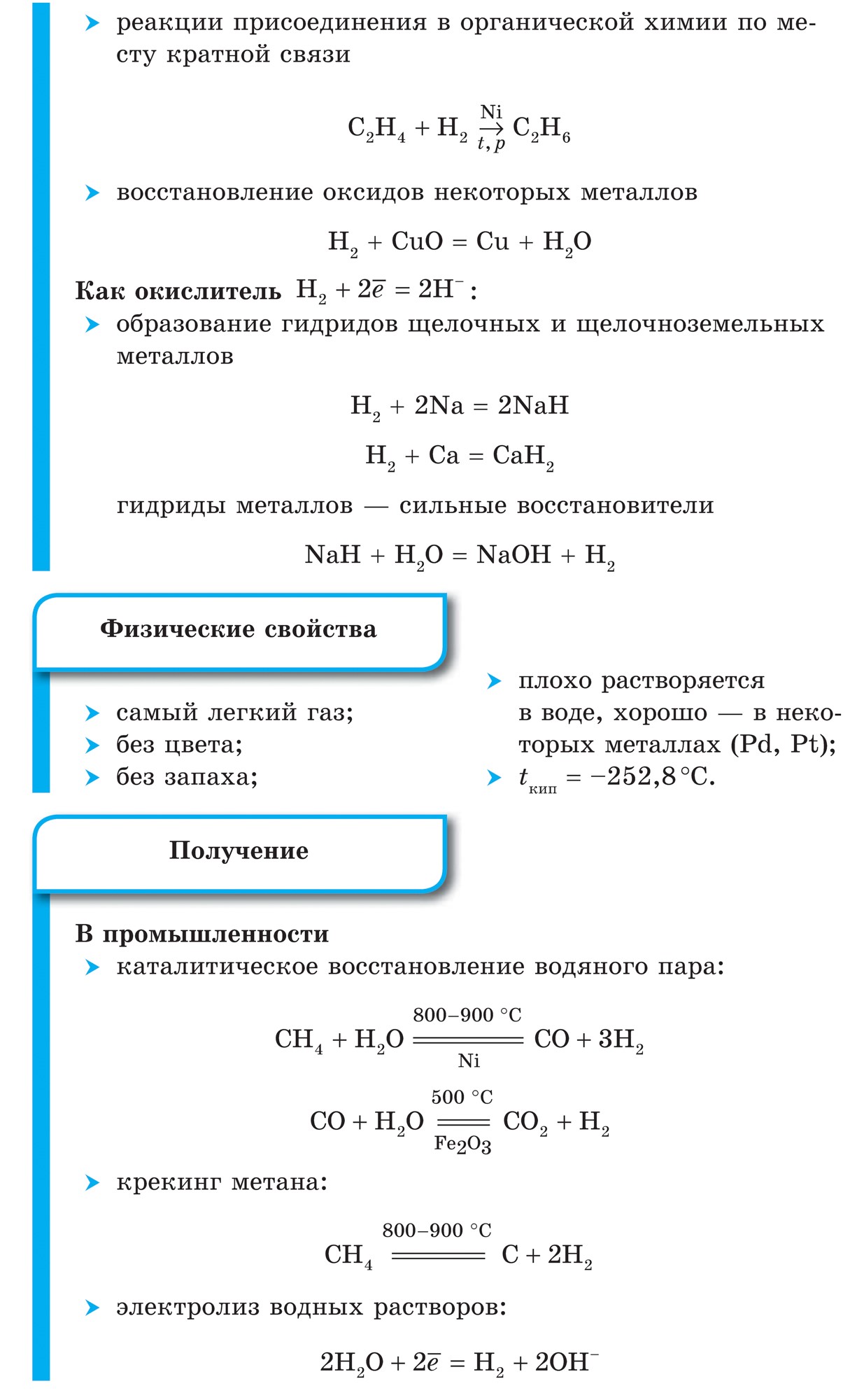
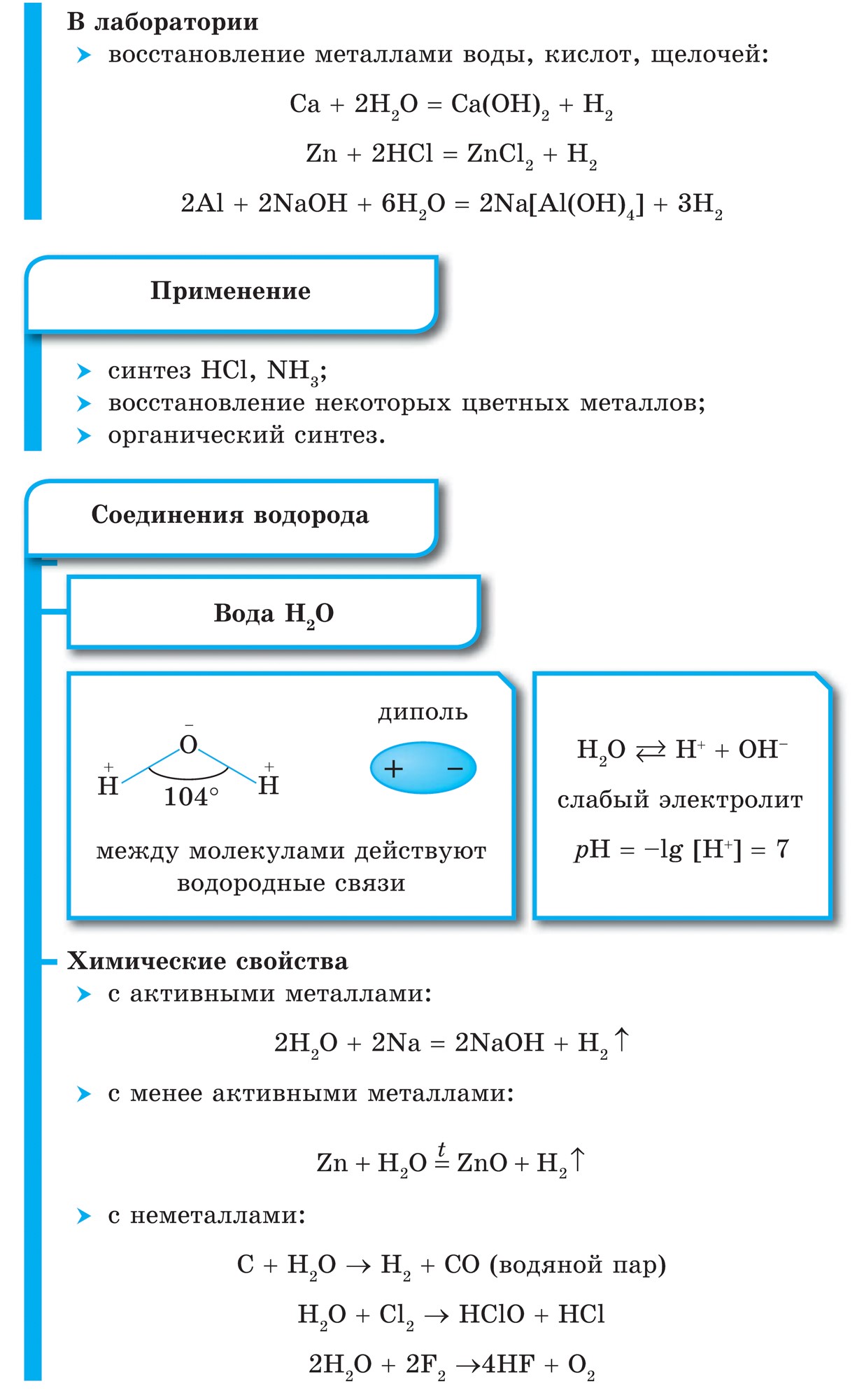
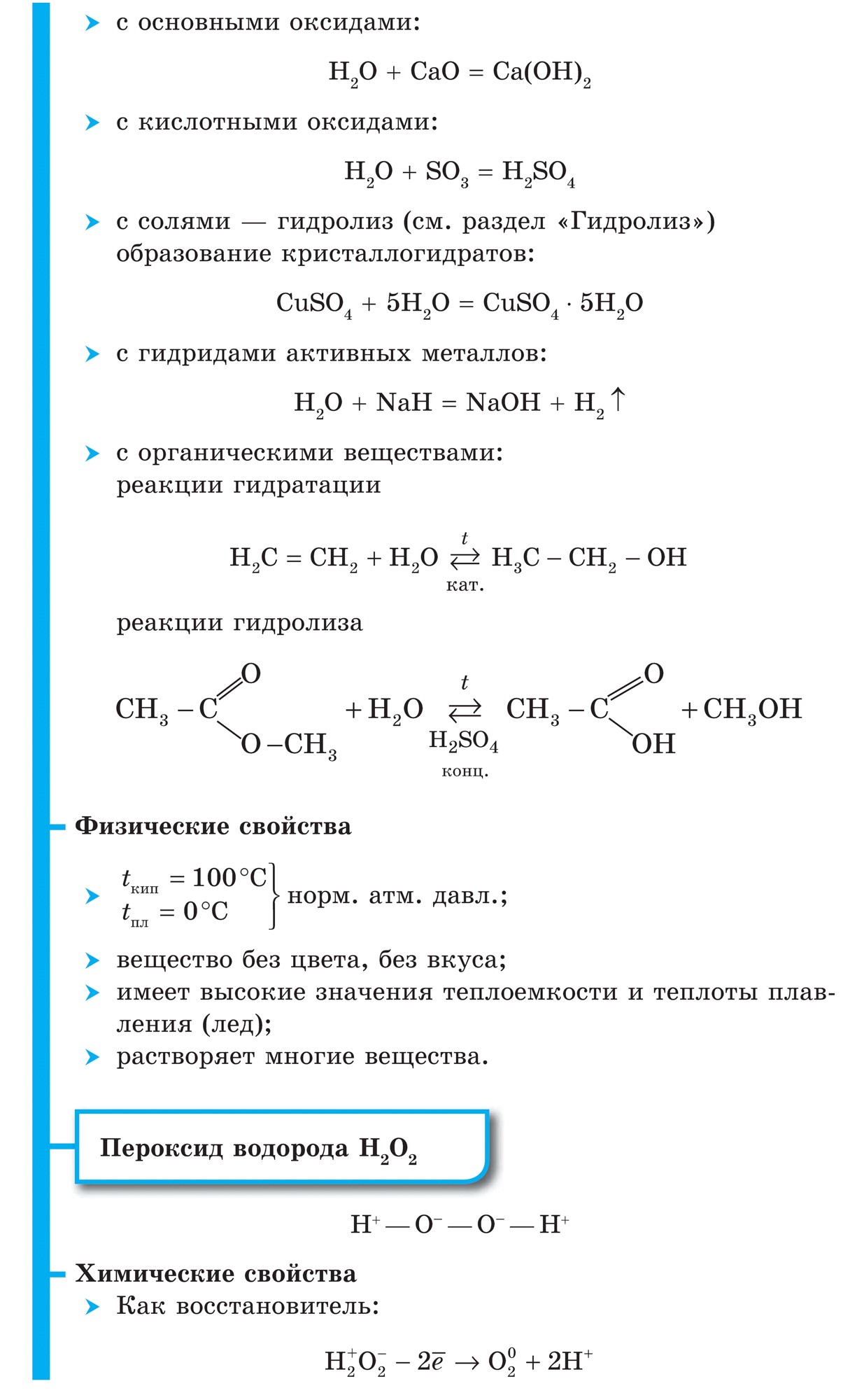

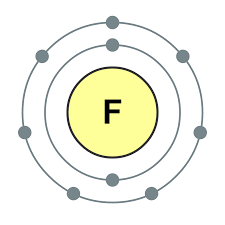
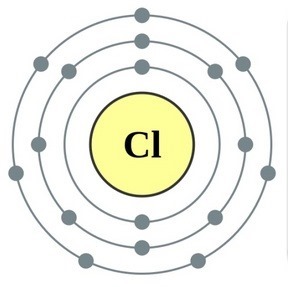
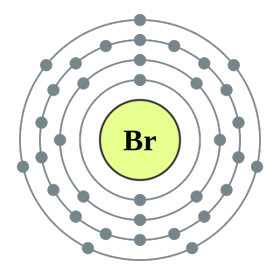
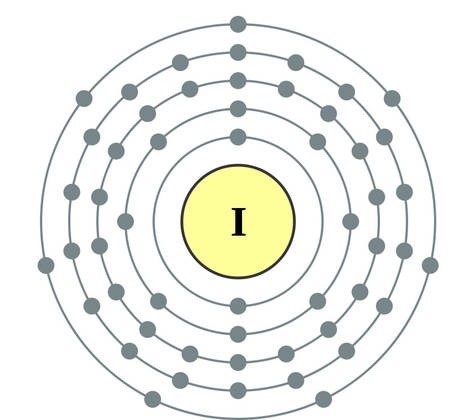
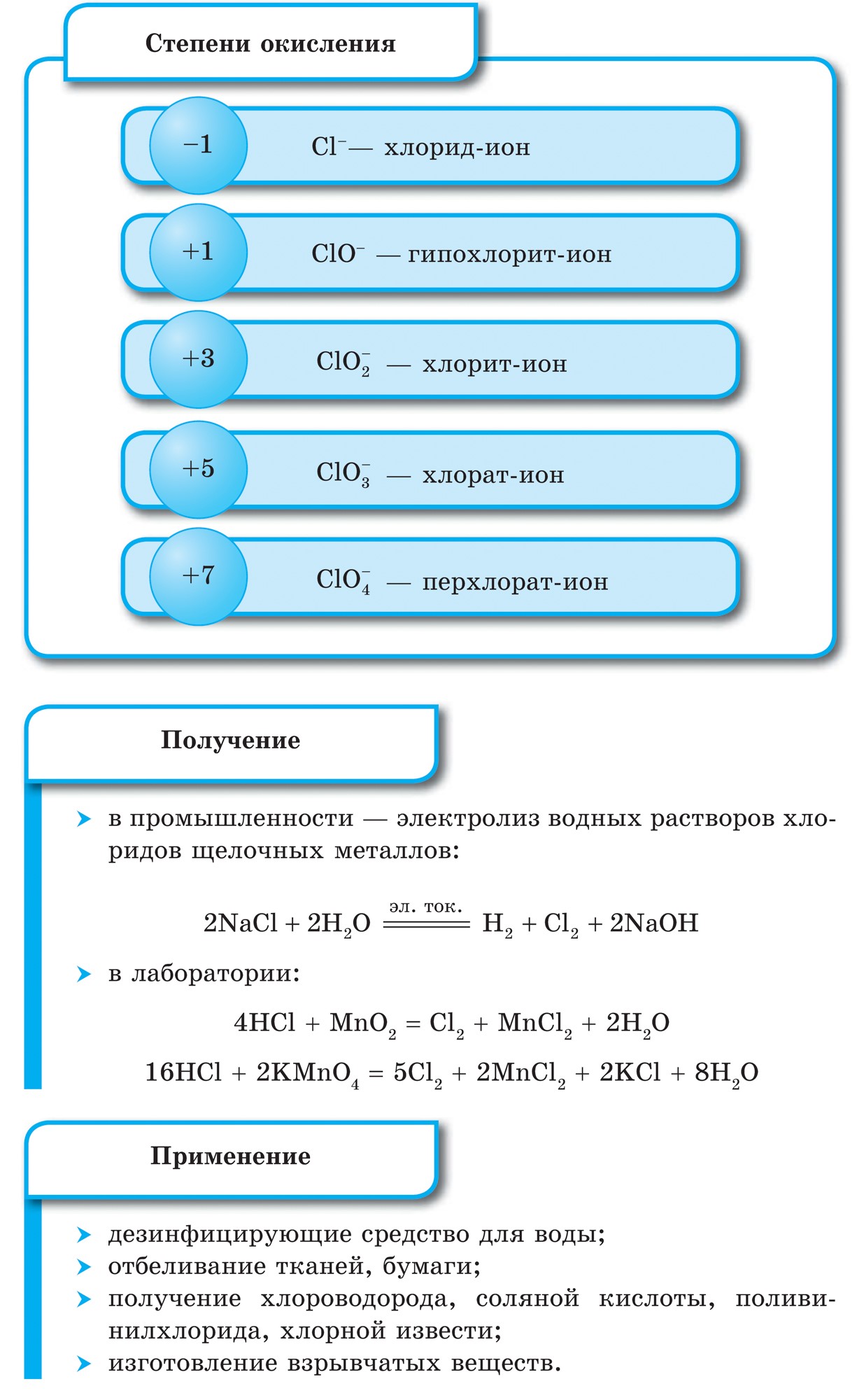
नियतकालिक प्रणालीच्या गट VII च्या मुख्य उपसमूहाचे घटक, सामान्य नावाखाली एकत्रित हॅलोजन, फ्लोरिन (F), क्लोरीन (Cl), ब्रोमाइन (BG), आयोडीन (I), अस्टाटिन (At) (क्वचितच निसर्गात आढळणारे) हे वैशिष्ट्यपूर्ण नॉन-मेटल्स आहेत. हे समजण्यासारखे आहे आणि त्यांचे अणू देखील बदला घेतात या इलेक्ट्रॉनच्या बाह्य ऊर्जा स्तरावर, आणि मी ते पूर्ण करण्यासाठी फक्त एक इलेक्ट्रॉन स्क्रॅप करत आहे. या घटकांचे अणू, धातूंशी संवाद साधताना, धातूच्या अणूंमधून इलेक्ट्रॉन स्वीकारतात. या प्रकरणात, आयन बंध तयार होतात आणि क्षार स्थिर होतात. या शब्दाचे नाव आहे “हॅलोजन”, म्हणजे “नरोदझयुत लवण”.
खूप जोरदार ऑक्सिडायझिंग. रासायनिक अभिक्रियांमध्ये फ्लोरिन केवळ शक्तीचे ऑक्साइड प्रदर्शित करते आणि त्याची वैशिष्ट्यपूर्ण ऑक्सिडेशन अवस्था -1 आहे. रेश्टा हॅलोजन अधिक इलेक्ट्रोनगेटिव्ह घटकांशी संवाद साधताना लक्षणीय शक्ती प्रदर्शित करू शकतात - फ्लोरिन, आम्ल, नायट्रोजन, ज्यामध्ये त्यांच्या ऑक्सिडेशनची अवस्था +1, +3, +5, +7 च्या मूल्यापर्यंत वाढू शकते. हॅलोजनची जबरदस्त शक्ती क्लोरीनपासून आयोडीनपर्यंत वाढते, जी त्यांच्या अणूंच्या त्रिज्या वाढण्याशी संबंधित आहे: क्लोरीनचे अणू आयोडीनच्या तुलनेत जवळजवळ दुप्पट आहेत.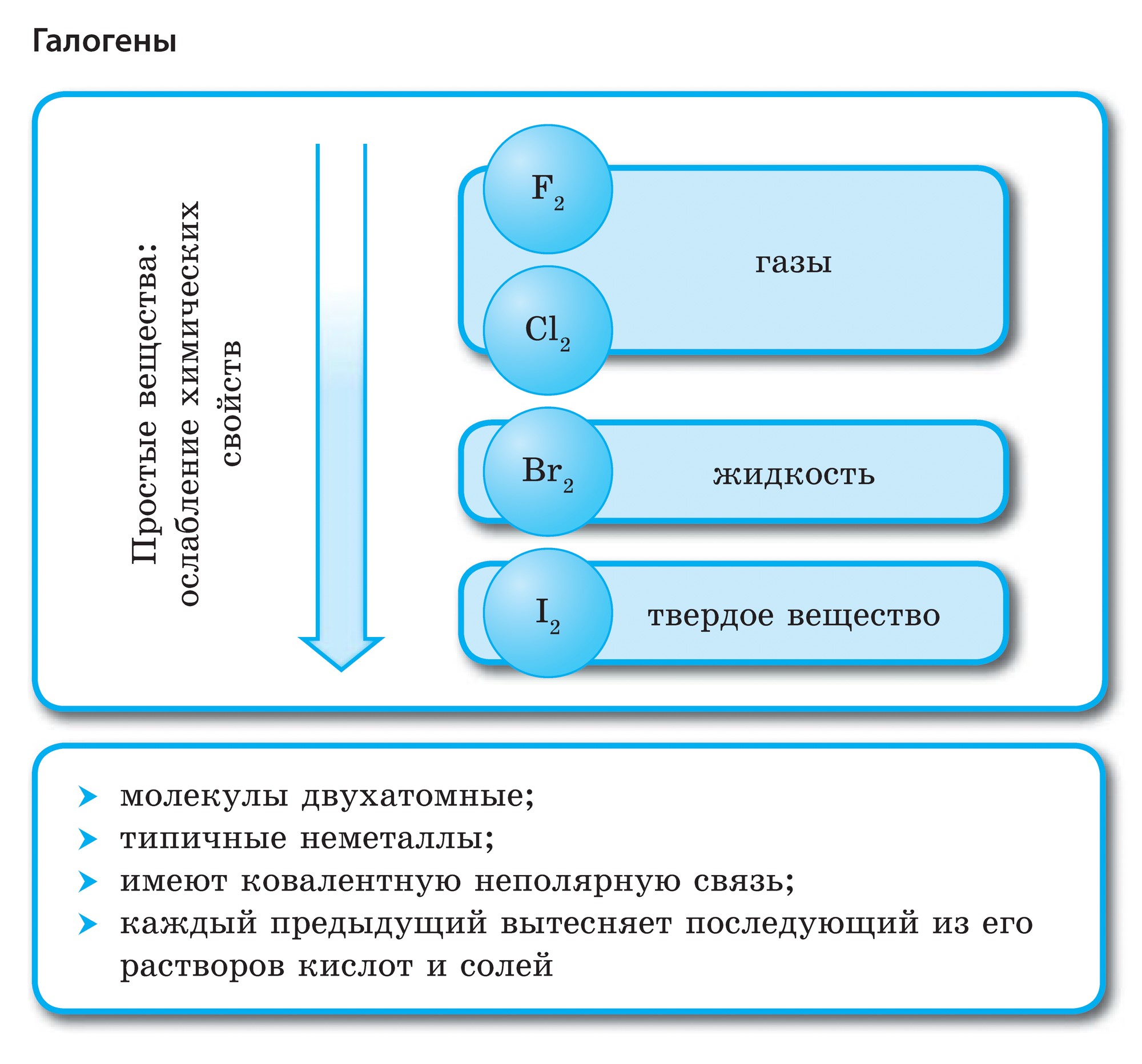
गॅलोजेन्स - साधे शब्द
सर्व हॅलोजन डायटॉमिक रेणूंच्या स्वरूपात अणूंमधील सहसंयोजक नॉनपोलर रासायनिक बंधनासह दिसतात. घन स्थितीत F 2, Cl 2, Br 2, I 2 लूम आण्विक क्रिस्टल जाळी, ज्याची त्यांच्याद्वारे पुष्टी केली जाते भौतिक अधिकारी.
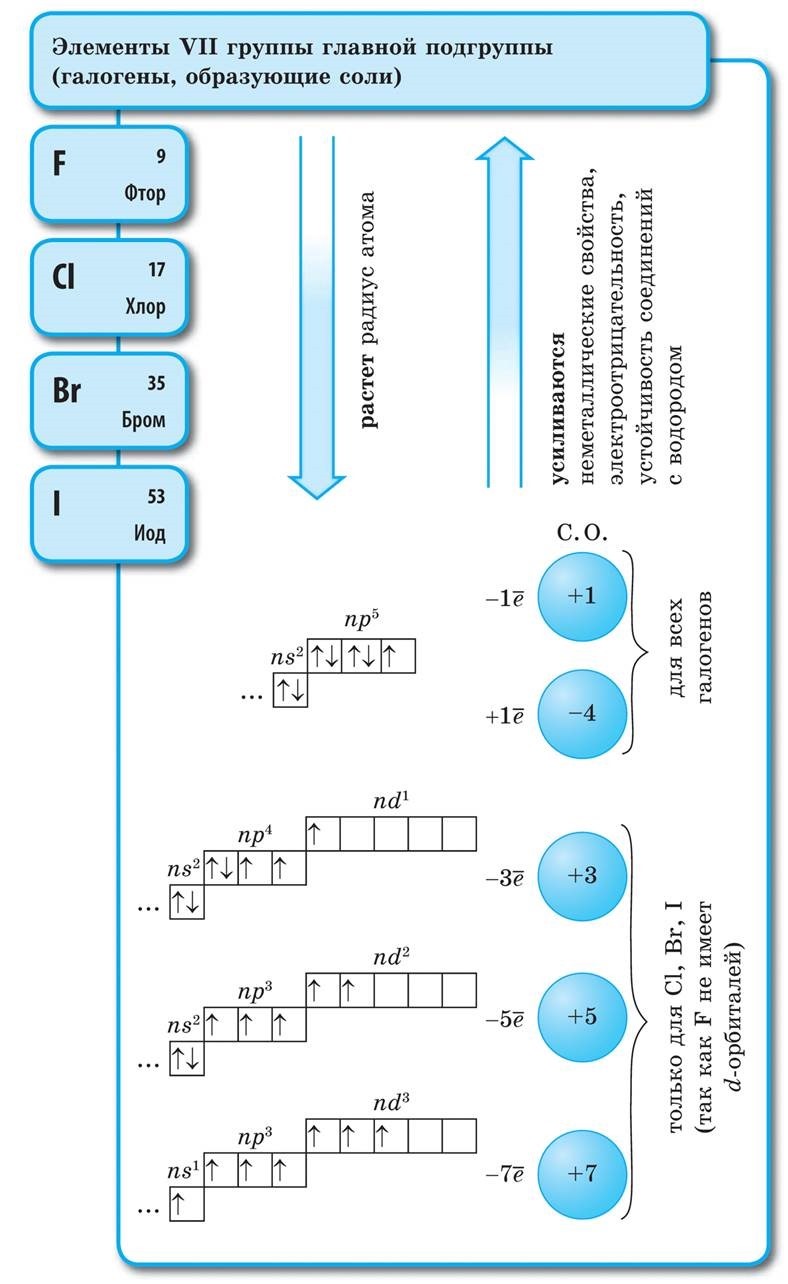
हॅलोजनच्या आण्विक वजनात वाढ झाल्यामुळे, वितळणे आणि उकळणारे बिंदू हलतात, सामर्थ्य वाढते: ब्रोमिन - ऍसिड, आयोडीन - सॉलिड हायड्रॉक्साइड, फ्लोरिन आणि क्लोरीन - वायू. हे या वस्तुस्थितीमुळे आहे की अणू आणि हॅलोजनच्या रेणूंच्या वाढीव आकारासह, त्यांच्यातील आंतरआण्विक परस्परसंवादाची शक्ती वाढते. F 2 ते I 2 पर्यंत हॅलोजन कमी होण्याची तीव्रता वाढते.
फ्लोरिनपासून आयोडीनपर्यंत नॉन-मेटल्स म्हणून हॅलोजनची रासायनिक क्रिया कमकुवत असते, आयोडीन क्रिस्टल्स एक धातूचा चकाकी प्रदर्शित करतात. त्वचा हॅलोजन त्याच्या कालावधीत सर्वात मजबूत ऑक्सिडायझर आहे. हॅलोजनच्या शक्तीचे ऑक्साइड जेव्हा ते धातूंशी संवाद साधतात तेव्हा स्पष्टपणे प्रकट होतात. ज्या ठिकाणी क्षार विरघळतात. अशा प्रकारे, फ्लोरिन, अगदी अत्यंत परिस्थितीतही, बहुतेक धातूंवर प्रतिक्रिया देते आणि जेव्हा सोने, चांदी, प्लॅटिनमसह गरम केले जाते तेव्हा ते त्याची रासायनिक निष्क्रियता प्रदर्शित करते. अॅल्युमिनियम आणि झिंक वातावरणातील फ्लोरीन जाळून टाकतात:
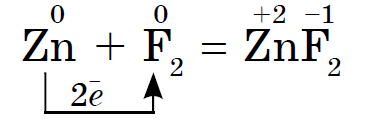
रेश्टा हॅलोजन गरम केल्यावर धातूंवर प्रतिक्रिया देतात. खारटपणाची पावडर गरम करा आणि जेव्हा ती क्लोरीनवर प्रतिक्रिया देईल तेव्हा ते देखील पेटेल. सुरमाप्रमाणेच पुरावा काढता येतो, परंतु केवळ थायरसला आधी औषधी चमच्याने प्रज्वलित करावे लागेल आणि नंतर क्लोरीनच्या फ्लास्कमध्ये लहान भागांमध्ये फेटावे लागेल. क्लोरीन एक मजबूत ऑक्सिडायझर असल्याने, प्रतिक्रियेमुळे क्लोराईड (III) तयार होते:
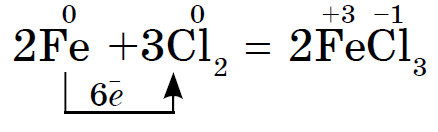
बाष्पांमध्ये ब्रोमिन असते भाजलेले मध सुकते:
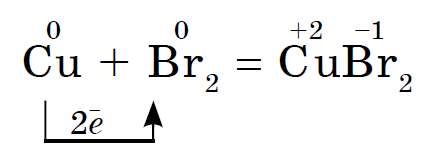
आयोडीन धातूंचे अधिक ऑक्सिडायझेशन करतेतथापि, पाण्याच्या उपस्थितीत, जे उत्प्रेरक आहे, अॅल्युमिनियम पावडरसह आयोडीनची प्रतिक्रिया अतिशय जोमाने पुढे जाते:
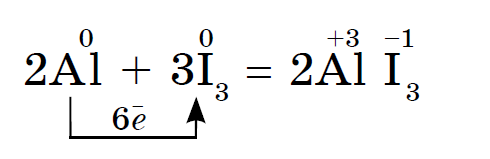
प्रतिक्रिया आयोडीन पासून वायलेट वाफ च्या प्रकाशन दाखल्याची पूर्तता आहे.
फ्लोरिनपासून आयोडीनमध्ये हॅलोजनच्या ऑक्सिडेटिव्ह आणि वाढलेल्या ऑक्सिडेटिव्ह पॉवरमधील बदलांबद्दल त्यांचा न्याय केला जाऊ शकतो आणि त्यांच्या गुणवत्तेवरून त्यांच्या क्षारांचा एक दर्जा ठरवता येतो, आणि जेव्हा ते पाण्याशी संवाद साधतात तेव्हा ते नैसर्गिकरित्या देखील प्रकट होते. ही प्रतिक्रिया याप्रमाणे औपचारिक स्वरूपात लिहिली जाऊ शकते:
फ्लोरिन कोणत्याही द्रावणातील पाण्याशी कंपनाने संवाद साधत असल्याने, क्लोरीन आणि पाण्याचे मिश्रण जेव्हा गरम केले जाते किंवा थेट सोडियम लाइटने दाबले जाते तेव्हाच प्रतिक्रिया देते, ब्रोमिन गरम झाल्यावर आणि कंपन न करता पाण्याशी संवाद साधते. या प्रतिक्रिया एक्झोथर्मिक आहेत. आयोडीन आणि पाणी यांच्यातील प्रतिक्रिया कमकुवतपणे एंडोथर्मिक असते आणि गरम झाल्यावर पूर्णपणे पुढे जाते.
या प्रतिक्रियांच्या परिणामी, हायड्रोजन फ्लोराइड HF, हायड्रोक्लोरिक ऍसिड HCl, हायड्रोजन ब्रोमाइड HBr आणि हायड्रोजन आयोडाइड HI तयार होतात.
टेबलमधील क्लोरीनची रासायनिक शक्ती

हॅलोजन काढणे
फ्लोरिन आणि क्लोरीन वितळलेल्या किंवा त्यांच्या विरघळलेल्या क्षारांच्या इलेक्ट्रोलिसिसद्वारे काढले जातात. उदाहरणार्थ, वितळलेल्या सोडियम क्लोराईडसह इलेक्ट्रोलिसिसची प्रक्रिया खालीलप्रमाणे सुधारली जाऊ शकते:
जेव्हा सोडियम क्लोराईडपासून इलेक्ट्रोलिसिसद्वारे क्लोरीन काढून टाकले जाते, तेव्हा क्लोरीन देखील पाण्यात आणि सोडियम हायड्रॉक्साईडमध्ये विरघळते:
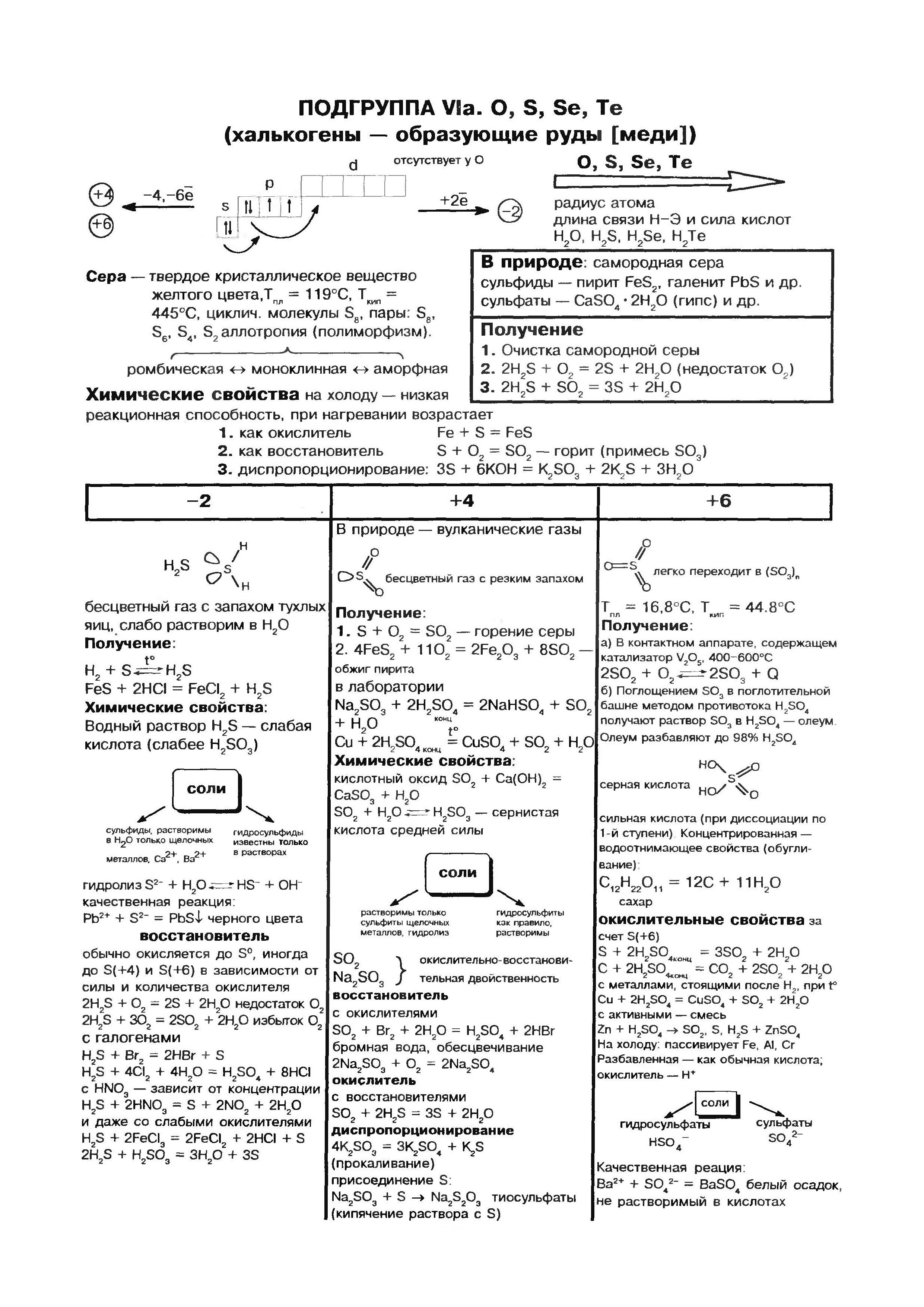
किसेन (ओ)- घटकांच्या आवर्त सारणीच्या गट VI च्या मुख्य उपसमूहाचा पूर्वज. या उपसमूहातील घटक - किसलेन ओ, सल्फर एस, सेलेनियम से, तेलूर टी, पोलोनियम पो - यांना "चॅल्कोजेन" म्हटले जाऊ शकते, ज्याचा अर्थ "अयस्क तयार करणे" आहे.
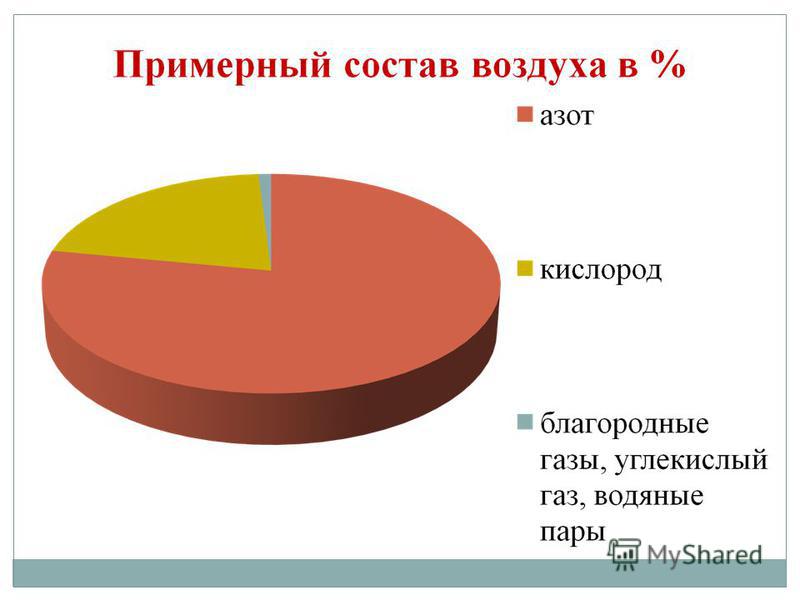
किसेन हा आपल्या ग्रहावरील सर्वात विस्तृत घटक आहे. ते पाण्याच्या साठ्यापर्यंत पोहोचते (88.9%), आणि ते पृथ्वीच्या गाभ्याच्या पृष्ठभागाचा 2/3 भाग देखील व्यापते, ज्यामुळे त्याचे पाण्याचे कवच - हायड्रोस्फियर तयार होते. किसेन - प्रमाणासाठी मित्र आणि जीवनाच्या अर्थासाठी प्रथम गोदामाचा भागपृथ्वीचे हवेशीर कवच हे वातावरण आहे, जिथे हा भाग 21% (व्हॉल्यूमनुसार) आणि 23.15% (वजनानुसार) आहे. किसेन पृथ्वीच्या कवच - लिथोस्फियरच्या घन कवचातील संख्यात्मक खनिजांच्या गोदामात प्रवेश करतो: पृथ्वीच्या कवचातील प्रत्येक 100 अणूंमधून, किसेनच्या प्रत्येक भागामध्ये 58 अणू पडतात.
मूळ किसेन O2 स्वरूपात आहे. हा रंग, गंध किंवा चव नसलेला वायू आहे. दुर्मिळ प्रकरणांमध्ये रंग हलका-निळा असतो, कठोर प्रकरणांमध्ये तो निळा असतो. पाण्यात, वायूसारखा आंबटपणा अधिक मजबूत असतो, नायट्रोजन आणि पाण्यापेक्षा कमी असतो.
किसेन सर्वात सोप्या भाषणात संवाद साधतात, हॅलोजन, उदात्त वायू, सोने आणि प्लॅटिनम धातूंचा समावेश आहे. आम्लासह नॉन-मेटल्सच्या प्रतिक्रिया बर्याचदा मोठ्या उष्णतेच्या उपस्थितीत होतात आणि ज्वलन - ज्वलन प्रतिक्रियांसह असतात. उदाहरणार्थ, माउंटन सिरपमध्ये SO 2, फॉस्फरस - P 2 O 5, किंवा vugilla - CO2 असते. कदाचित ऍसिडचा समावेश असलेल्या सर्व प्रतिक्रिया एक्झोथर्मिक आहेत. परिणाम म्हणजे ऍसिडसह नायट्रोजनचा परस्परसंवाद: एक एंडोथर्मिक प्रतिक्रिया जी 1200 डिग्री सेल्सियसपेक्षा जास्त तापमानात किंवा इलेक्ट्रिक डिस्चार्ज दरम्यान उद्भवते:
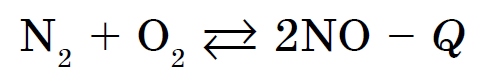
ऑक्सिडिटी केवळ साध्या पदार्थांचेच नव्हे तर अनेक जटिल संयुगे देखील ऊर्जावानपणे ऑक्सिडायझ करते, ज्यामुळे दुर्गंधी निर्माण करणाऱ्या घटकांचे ऑक्साइड तयार होतात:
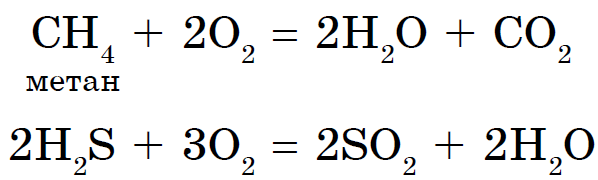
आंबटपणाचे उच्च ऑक्सिडेटिव्ह गुणधर्म सर्व प्रकारच्या जळजळीच्या ज्वलनास अधोरेखित करतात.
किसेन अत्यंत तापमानात विविध पदार्थांच्या संपूर्ण ऑक्सिडेशनच्या प्रक्रियेत भाग घेते.लोक आणि प्राणी नष्ट होण्याच्या प्रक्रियेत ऍसिडची भूमिका देखील महत्त्वपूर्ण आहे. रोझलीनी वातावरणातील जेली देखील चिकणमाती करते. जर अंधारात फक्त एकपेशीय वनस्पती आंबटपणा जाळण्याची प्रक्रिया घडते, तर प्रकाशात आणखी एक दीर्घकाळ चालणारी प्रक्रिया घडते - प्रकाशसंश्लेषण, परिणामी एकपेशीय वनस्पती कार्बन डायऑक्साइड शोषून घेते आणि आंबटपणा निर्माण करते.
उद्योगात, जेली दुर्मिळ वाऱ्यापासून ठेवली जाते आणि प्रयोगशाळेत - उत्प्रेरक आणि मॅंगनीज डायऑक्साइड MnO च्या उपस्थितीत वॉटर पेरोक्साइडसह मार्ग तयार केला जातो. 2 :
![]()
तसेच पोटॅशियम परमॅंगनेट KMnO चे वितरण 4 गरम झाल्यावर:
टेबल्समध्ये रासायनिक शक्ती आणि आंबटपणा

zastosuvannya kisnyu
किसेनचा वापर मेटलर्जिकल आणि रासायनिक उद्योगांमध्ये उत्पादन प्रक्रियांना गती देण्यासाठी (तीव्र) करण्यासाठी केला जातो. उच्च तापमानाचा सामना करण्यासाठी शुद्ध जेली देखील वापरली जाते, उदाहरणार्थ, गॅस वेल्डिंग आणि धातू कापताना. वैद्यकशास्त्रात, विशिष्ट आजारांशी संबंधित श्वास घेण्यात तात्पुरती अडचण येण्याच्या एपिसोडमध्ये चिखलमय स्तब्धता येते. रॉकेट इंधनासाठी ऑक्सिडायझर म्हणून, श्वासोच्छवासासाठी, धातू कापण्यासाठी, धातू कापण्यासाठी, धातू वेल्डिंगसाठी आणि कंपन रोबोटमध्ये ऑक्सिडायझर म्हणून किसेनचा वापर धातुशास्त्रात केला जातो. किसेन स्टीलच्या सिलिंडरमध्ये साठवले जाते, काळ्या रंगात लेपित केले जाते, 150 एटीएमच्या दाबाखाली. प्रयोगशाळेच्या मनात, मस शापित उपकरणांमध्ये जतन केले जाते - एक गॅसोमीटर.
अणू सिर्की (एस), आंबटपणाचे अणू आणि गट VI च्या मुख्य उपसमूहातील इतर सर्व घटकांप्रमाणे, सध्याच्या ऊर्जा स्तरावर ठेवा 6 इलेक्ट्रॉन, एस दोन इलेक्ट्रॉन जोडलेले नाहीत. तथापि, अम्लीय अणूंशी संरेखित केलेल्या अम्लीय अणूंची त्रिज्या मोठी असते, कमी इलेक्ट्रोनेगेटिव्हिटी असते आणि त्यामुळे ऑक्सिडेशन पायऱ्यांसह कनेक्शन निर्माण करणाऱ्या नवीन शक्ती प्रदर्शित करतात. +2, +4, +6. कमी नकारात्मक घटकांच्या (पाणी, धातू) संबंधात, द्रावण शक्तीचे ऑक्साइड प्रदर्शित करते आणि ऑक्सिडेशन स्टेज वाढवते. -2 .
सिरका हे साधे भाषण आहे
ऍलोट्रॉपी हे सिरका, तसेच किस्नूचे वैशिष्ट्य आहे. वेगवेगळ्या रचनांच्या चक्रीय किंवा रेखीय रेणूंसह सिरपमध्ये बरेच बदल आहेत.
सर्वात स्थिर फेरफार एक समभुज क्रिस्टल म्हणून ओळखले जाते, जे S 8 रेणूंनी बनलेले आहे. या क्रिस्टल्समध्ये कट कटसह अष्टहेड्रॉनचे स्वरूप आहे. वास लिंबू-पिवळ्या रंगात आणि सुगंधात तयार केला जातो, वितळण्याचा बिंदू 112.8 ° से. हा बदल खोलीच्या तपमानावर इतर सर्व बदलांचे रूपांतर करतो. क्रिस्टलायझेशन दरम्यान, एक मोनोक्लिनिक क्रिस्टल (क्रिस्टल भाग, वितळण्याचा बिंदू 119.3 डिग्री सेल्सिअस) वितळण्यापासून बाहेर पडतो, जो नंतर समभुज आकारात बदलतो. कापड गरम केल्यावर, नमुन्यातील गंधक वितळेल, पिवळ्या रंगात बदलेल. जवळच्या 160 ° C च्या तापमानात RIKOKA SIRITH, Stanoye, I कमर, एक नमुना नाही, एक इंधन गरम पाण्याची सोय RIDINA, Ale Kolishniy Dark Corrichevy Kolir सह. मध्ये प्रवेश कसा करायचा थंड पाणी, वोना पारदर्शक रबरी वस्तुमान पाहतो. हे प्लास्टिक आहे. हे थ्रेड्सच्या स्वरूपात काढले जाऊ शकते. काही दिवसांनंतर, ते हिऱ्याच्या आकाराच्या वर्तुळात देखील बदलते.
पाण्याजवळ सरका फुटत नाही. गंधकाचे स्फटिक पाण्यात बुडतात आणि पावडर पाण्याच्या पृष्ठभागावर तरंगते, कारण ब्राइनचे दाणेदार स्फटिक पाण्याने ओले होत नाहीत आणि वाऱ्यात दाणेदार बल्बद्वारे तरंगत राहतात. ही एक फ्लोटेशन प्रक्रिया आहे. सिरप इथाइल अल्कोहोल आणि डायथिल इथरमध्ये किंचित विरघळते; ते सल्फ्यूरिक कार्बनमध्ये चांगले विरघळते.
उत्तम मनाने सल्फर बेस आणि लो-अर्थ धातू, मध, पारा, स्लॅब यांच्यावर तीव्र प्रतिक्रिया देते, उदाहरणार्थ:
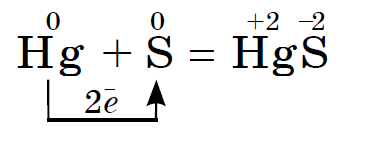
ही प्रतिक्रिया सांडलेल्या पाराच्या शोध आणि उत्सर्जनाचा आधार आहे, उदाहरणार्थ, तुटलेल्या थर्मामीटरमधून. पाराचे दृश्यमान थेंब कागदावर किंवा मधल्या प्लास्टिकवर गोळा केले जाऊ शकतात. तो पारा जो दरीत हरवला आहे त्याला सिरका पावडरने झाकणे आवश्यक आहे. या प्रक्रियेला डिमरक्युरायझेशन म्हणतात.
गरम झाल्यावर, सल्फर इतर धातूंशी (Zn, Al, Fe) प्रतिक्रिया देते आणि कोणत्याही कारणास्तव फक्त सोने त्याच्याशी संवाद साधत नाही. सल्फरच्या शक्तीचे ऑक्साईड पाण्याबरोबर दिसतात, जे गरम झाल्यावर प्रतिक्रिया देतात:
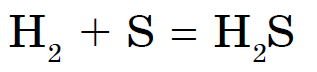
केवळ नायट्रोजन, आयोडीन आणि उदात्त वायू नॉन-मेटल्सवर प्रतिक्रिया देत नाहीत.सल्फर निळसर अर्ध्या भागात जळतो, सल्फरचा ऑक्साईड विरघळतो (IV):
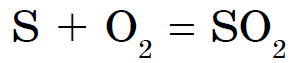
हे कंपाऊंड मोठ्या प्रमाणावर शुद्ध वायू म्हणून ओळखले जाते.
टेबल मध्ये रासायनिक शक्ती

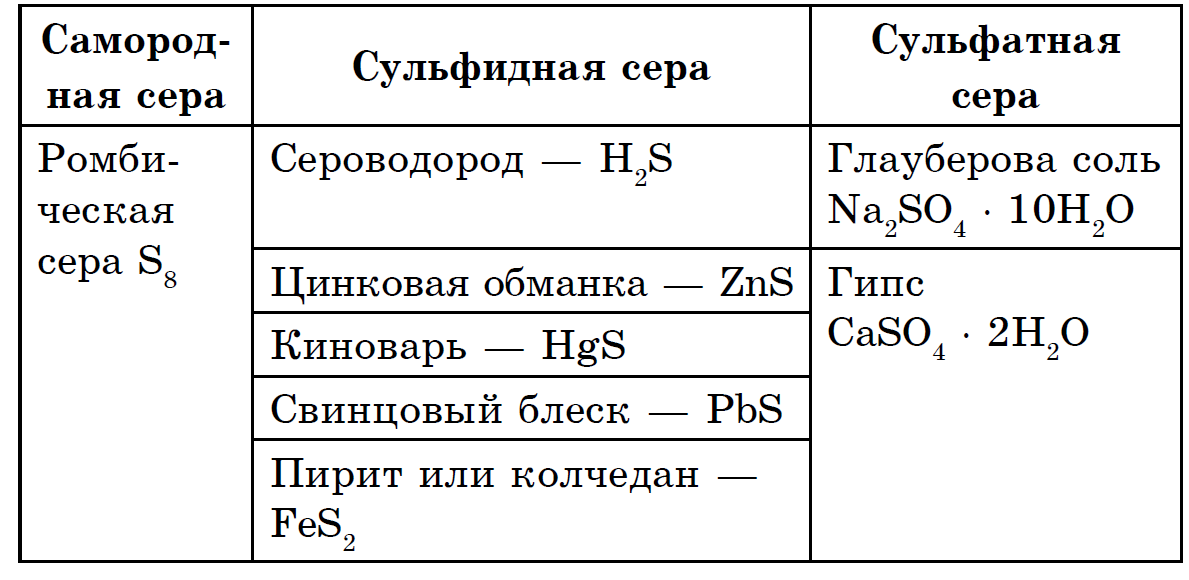
सिरका मोठ्या प्रमाणात घटकांमध्ये वितरीत केले जाते: पृथ्वीच्या कवचात प्रति वस्तुमान 4.7 · 10-2% मीठ असते (इतर घटकांमध्ये 15 वे स्थान), आणि संपूर्ण पृथ्वीमध्ये बरेच काही (0.7%) असते. सॉरेलचे डोके पृथ्वीच्या खोलवर, त्याच्या आवरण-बॉलमध्ये, पृथ्वीच्या कवच आणि पृथ्वीच्या गाभ्यामध्ये पसरलेले आढळते. येथे, अंदाजे 1200-3000 किमी खोलीवर, सल्फाइड आणि मेटल ऑक्साईडचा जाड बॉल आहे. पृथ्वीच्या कवचामध्ये, कवच मुक्त स्वरूपात (नेटिव्ह) आणि प्रामुख्याने सल्फाइड आणि सल्फेटच्या स्वरूपात तीक्ष्ण केले जाते. पृथ्वीच्या कवचामध्ये सर्वाधिक मुबलक असलेले सल्फाइड म्हणजे पायराइट FeS2, chalcopyrite FeCuS2, लीड ब्लिस्क (गॅलेना) PbS, झिंक ब्लेंडे (स्फेलेराइट) ZnS. पृथ्वीच्या कवचामध्ये महत्त्वपूर्ण सल्फेट - जिप्सम CaSO4 2H2O, बॅराइट BaSO4, समुद्राच्या पाण्यात ते मॅग्नेशियम, सोडियम आणि पोटॅशियमच्या सल्फेटसह समृद्ध असलेल्या मोठ्या प्रमाणात सल्फर आढळतात.
हे महत्वाचे आहे की पृथ्वीच्या भूगर्भशास्त्रीय इतिहासाच्या प्राचीन काळात (सुमारे 800 दशलक्ष वर्षांपूर्वी) निसर्गात सल्फेट नव्हते. विनाइल वनस्पतींच्या जीवनाचा परिणाम म्हणून, आंबट वातावरण असल्यास, सल्फाइडच्या ऑक्सिडेशनचे उत्पादन म्हणून दुर्गंधी उद्भवली. ज्वालामुखीय वायूंमध्ये अम्लीय एनहाइड्राइड H2S आणि अम्लीय एनहाइड्राइड SO2 असतात. हे सक्रिय ज्वालामुखी (सिसिली, जपान) जवळच्या भागात वाहणाऱ्या मूळ सल्फरमुळे आहे आणि या दोन वायूंच्या परस्परसंवादाने तयार केले जाऊ शकते:
2H 2 S + SO 2 \u003d 3S + 2H 2 O.
इतर प्रकारचे मूळ धान्य सूक्ष्मजीवांच्या जीवनाशी संबंधित आहेत.
सूक्ष्मजीव त्यांचे भाग्य श्रीमंतांकडून घेतात रासायनिक प्रक्रिया, संपूर्णपणे, निसर्गात सिरका चक्र कसे बनवायचे. त्यांच्या संयुग्मन दरम्यान, सल्फाइडचे सल्फेटमध्ये ऑक्सिडाइझ केले जाते, सल्फेट सजीवांद्वारे खराब केले जातात आणि द्रव नूतनीकरण केले जाते आणि प्रथिने आणि इतर महत्त्वपूर्ण पदार्थांच्या साठवणीत प्रवेश करते. जेव्हा मृत अतिरिक्त जीव कुजतात, तेव्हा प्रथिने चुरा होतात आणि तुम्हाला सल्फेट दिसेल, जे नंतर एकतर मूलभूत सल्फरमध्ये (अशा प्रकारे सल्फरचे साठे तयार होतात) किंवा सल्फेटमध्ये ऑक्सिडाइझ होते. हे महत्वाचे आहे की बॅक्टेरिया आणि शैवाल, जे पाण्याचे ऑक्सिडायझेशन करतात, त्यांच्या पेशींमध्ये जमा होतात. अशा सूक्ष्मजीवांच्या पेशी 95% शुद्ध सिरपच्या बनलेल्या असू शकतात.
सल्फरचे स्वरूप त्याच्या अॅनालॉग - सेलेनियमच्या स्पष्ट उपस्थितीद्वारे स्थापित करणे शक्य आहे: मूळ सल्फरमध्ये सेलेनियम असताना, ज्वालामुखीय सल्फर अनुपस्थित आहे - बायोजेनिक, कारण सूक्ष्मजीव त्याच्या या जीवन चक्रात सेलेनियम समाविष्ट करण्यास सक्षम आहेत, तसेच बायोजेनिक कचरा. , अधिक समस्थानिक 32S, कमी जड 34S ठेवते.
सिरकाचे जैविक महत्त्व
एक अत्यंत महत्वाचा रासायनिक घटक. यामध्ये प्रथिनांचे संचयन समाविष्ट आहे - सर्व सजीवांच्या पेशींच्या मुख्य रासायनिक घटकांपैकी एक. केसांच्या पांढर्या, शिंगे आणि बाहेरील भागांमध्ये विशेषतः राखाडी रंगाचा बराचसा भाग असतो. याव्यतिरिक्त, दूध शरीरातील जैविक दृष्ट्या सक्रिय पदार्थांचे भांडार आहे: जीवनसत्त्वे आणि हार्मोन्स (उदाहरणार्थ, इन्सुलिन). सिरका शरीरातील ऑक्साईड-आधारित प्रक्रियांमध्ये भाग घेते. जर शरीरात मेणाची कमतरता असेल तर ब्रशचे ठिसूळपणा आणि ठिसूळपणा आणि केस गळतीपासून सावध रहा.
राखाडी समृद्ध शेंगा (मटार, सोचेटिका), ओट गवत, अंडी.
zastosuvannya sirki
आंबट बेरी आणि कागद, डिंक आणि फर्ब, वोडका आणि वार्निश, प्लास्टिक आणि कॉस्मेटिक तयारीच्या उत्पादनात सिरका तयार केली जाते. ग्रामीण वर्चस्वात, ते रोझलिन्सच्या बिघडवणाऱ्यांविरुद्ध लढण्यासाठी विकोरीस्ट आहेत. तथापि, दूध उत्पादनाचा मुख्य स्त्रोत रासायनिक उद्योग आहे. जगात जे काही तयार होते त्यापैकी निम्मे सल्फ्यूरिक ऍसिडच्या निर्मितीमध्ये जाते.
नायट्रोजन
![]()
नायट्रोजन (N)- आवर्त सारणीच्या गट V च्या मुख्य उपसमूहाचा पहिला प्रतिनिधी. या अणूमध्ये बाह्य ऊर्जा स्तरावर पाच इलेक्ट्रॉन आहेत, ज्यापैकी तीन जोडलेले नाहीत. असे दिसून आले की या घटकांचे अणू वर्तमान ऊर्जा प्रवाह पूर्ण करून तीन इलेक्ट्रॉन प्राप्त करू शकतात.
नायट्रोजन अणू त्यांचे स्वतःचे इलेक्ट्रॉन अधिक इलेक्ट्रोनगेटिव्ह घटकांना (फ्लोरिन, आम्लता) देऊ शकतात आणि ऑक्सिडेशन स्टेज +3 आणि +5 प्राप्त करू शकतात. नायट्रोजन अणू ऑक्सिडेशनच्या टप्प्यात नवीन शक्ती प्रदर्शित करतात +1, +2, +4.
सर्वसाधारणपणे, नायट्रोजन हे डायटॉमिक रेणू N2 मध्ये पाण्यात आढळते. या रेणूमध्ये, दोन N अणू तिसऱ्या सहसंयोजक बंधाने जोडलेले असतात, आणि बंध खालीलप्रमाणे नियुक्त केले जाऊ शकतात:

नायट्रोजन हा गंध किंवा चव नसलेला वांझ नसलेला वायू आहे.
उत्तम मनाने नायट्रोजन केवळ लिथियमशी संवाद साधते, ली नायट्राइड विरघळते 3 एन:
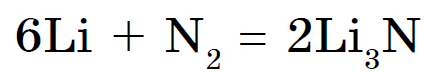
इतर धातू केवळ उच्च तापमानात संवाद साधतात.
तसेच उच्च तापमान आणि दबाव उत्प्रेरकाच्या उपस्थितीत, नायट्रोजन पाण्यावर प्रतिक्रिया देते, अमोनियाचे विद्रव्य करते:
इलेक्ट्रिक आर्कच्या तपमानावर, वाइन ऍसिडसह एकत्रित होते, ज्यामुळे नायट्रोजन ऑक्साईड (II):
तक्त्यांमध्ये नायट्रोजनची रासायनिक शक्ती

नायट्रोजन स्थिरता
दुर्मिळ डिस्टिलेशनद्वारे काढलेले नायट्रोजन, अमोनिया आणि फलनाच्या संश्लेषणासाठी उद्योगात स्थिर होते. नायट्रिक आम्ल. वैद्यकशास्त्रात, फुफ्फुसांच्या क्षयरोगाच्या उपचारासाठी शुद्ध नायट्रोजन अक्रिय माध्यमात स्थिर केले जाते आणि दुर्मिळ नायट्रोजन मणक्याचे, सांधे इत्यादींच्या रोगांवर उपचार करण्यासाठी वापरले जाते.
फॉस्फरस
रासायनिक घटक फॉस्फरस अनेक ऍलोट्रॉपिक बदलांद्वारे रूपांतरित केले जातात. त्यापैकी दोन साधे शब्द आहेत: पांढरा फॉस्फरस आणि लाल फॉस्फरस. पांढरा फॉस्फरस एक आण्विक क्रिस्टल जाळी बनवतो जो P4 रेणूंनी बनलेला असतो. पाण्याजवळ अतूट, ते चांदीच्या कोळशात चांगले फुटतात. ते हवेत सहजपणे ऑक्सिडाइझ होते आणि पावडर सारख्या स्थितीत ते आग पकडते. पांढरा फॉस्फरस खूप मजबूत आहे. ऑक्सिडेशनच्या परिणामी अंधारात चमकण्याची विशेष शक्ती आहे. ते पाण्याखाली ठेवा. लाल फॉस्फरस एक गडद किरमिजी रंगाची पावडर आहे. ची पाण्यात किंवा कार्बन डायसल्फाइडमध्ये मोडत नाही. जेव्हा हवेच्या संपर्कात येते तेव्हा ते पूर्णपणे ऑक्सिडाइझ होते आणि ऑक्सिडाइझ होत नाही. हे विषारी नसून अंधारात चमकत नाही. गरम केल्यावर, चाचणी नळीतील लाल फॉस्फरस पांढर्या फॉस्फरसमध्ये (केंद्रित वाफ) रूपांतरित होतो.
लाल आणि पांढऱ्या फॉस्फरसचे रासायनिक गुणधर्म जवळ आहेत आणि पांढरा फॉस्फरस रासायनिकदृष्ट्या सक्रिय आहे. तर, दुर्गंधीचा वास फॉस्फाईड्सला शांत करणाऱ्या धातूंशी संवाद साधतो:
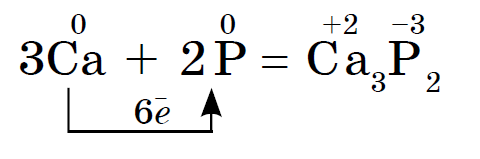
पांढरा फॉस्फरस वाऱ्यात स्वतःला पकडतो आणि गरम झाल्यावर लाल फॉस्फरस जळतो. दोन्ही स्वरूपात, फॉस्फरस (V) ऑक्साईड तयार होतो, जो जाड पांढरा धूर दिसतो:
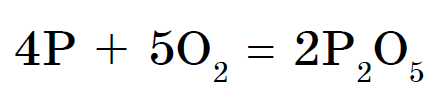
फॉस्फरस पाण्यावर थेट प्रतिक्रिया देत नाही; फॉस्फिन PH 3 वेगळे केले जाऊ शकते, उदाहरणार्थ, फॉस्फाइड्सपासून:
फॉस्फिन - मजबूत गॅस फुंकणे h अप्रिय वास. वाऱ्यात आग पकडणे सोपे आहे. फॉस्फिनची ही शक्ती दलदलीच्या धुराचे स्वरूप स्पष्ट करते.
तक्त्यांमध्ये फॉस्फरसची रासायनिक शक्ती


फॉस्फरसची स्थिरता
फॉस्फरस हा सर्वात महत्वाचा बायोजेनिक घटक आहे आणि त्याच वेळी उद्योगात मोठ्या प्रमाणात वापरला जातो. लाल फॉस्फरस सिरनिकच्या उत्पादनात थांबतो. बॉक्सच्या नैसर्गिक पृष्ठभागावर बारीक तपशीलवार मणी आणि गोंद सह एकत्र लागू करा. पोटॅशियम क्लोरेट आणि सल्फर असलेले आल्याचे डोके तुम्ही किसून घ्याल तेव्हा ते शोषले जाईल.
कदाचित, शक्ती प्रथम फॉस्फरसकडे वळते, कारण लोक स्वत: ला सेवेत ठेवतात - ही ज्वलनशीलता आहे. फॉस्फरसची ज्वलनशीलता खूप जास्त आहे आणि अॅलोट्रॉपिक बदलांमुळे उद्भवते.
सर्वात सक्रिय रासायनिक विषारी आणि ज्वलनशील पांढरा ("पिवळा") फॉस्फरस आहे, जो बर्याचदा निर्जंतुकीकरणात (फायर बॉम्ब इ.) वापरला जातो.
रेड फॉस्फरस हे मुख्य फेरफार, व्हायरोब्लेन आणि औद्योगिक उत्पादन आहे. हे किण्वन तण, विबुखोवी नद्या, प्रज्वलन गोदामांजवळ स्थिर होईल, वेगळे प्रकारबर्निंग, तसेच जप्तीविरोधी तेल साहित्य, जसे की तळण्याचे दिवे तयार करताना गॅस एक्स्ट्रॅक्टर.
फॉस्फरस (फॉस्फेट्स म्हणून ओळखले जाते) हे एटीपीच्या संश्लेषणामध्ये सहभागी असलेल्या तीन सर्वात महत्त्वाच्या बायोजेनिक घटकांपैकी एक आहे. virobled एक मोठा भाग फॉस्फरिक आम्लमी फॉस्फरस ऍडिटीव्ह्स काढण्यासाठी जातो - सुपरफॉस्फेट, प्रिसिपिटेट, अॅमोफॉस्फेट इ.
फॉस्फेट्स मोठ्या प्रमाणात व्हायकोराइज्ड आहेत:
- कॉम्प्लेक्सच्या कंटेनरमध्ये (पाणी मऊ करण्यासाठी कॉम्प्लेक्स),
- वेअरहाऊसमध्ये धातूच्या पृष्ठभागासाठी पॅसिव्हेटर (गंज-विरोधी संरक्षण, उदाहरणार्थ, तथाकथित माजेफ वेअरहाऊस).
फॉस्फेट ट्रायव्हीमर पॉलिमर नेटवर्कमध्ये तयार करण्याची क्षमता फॉस्फेट आणि अॅल्युमिनोफॉस्फेट बाईंडर तयार करण्यासाठी वापरली जाते.
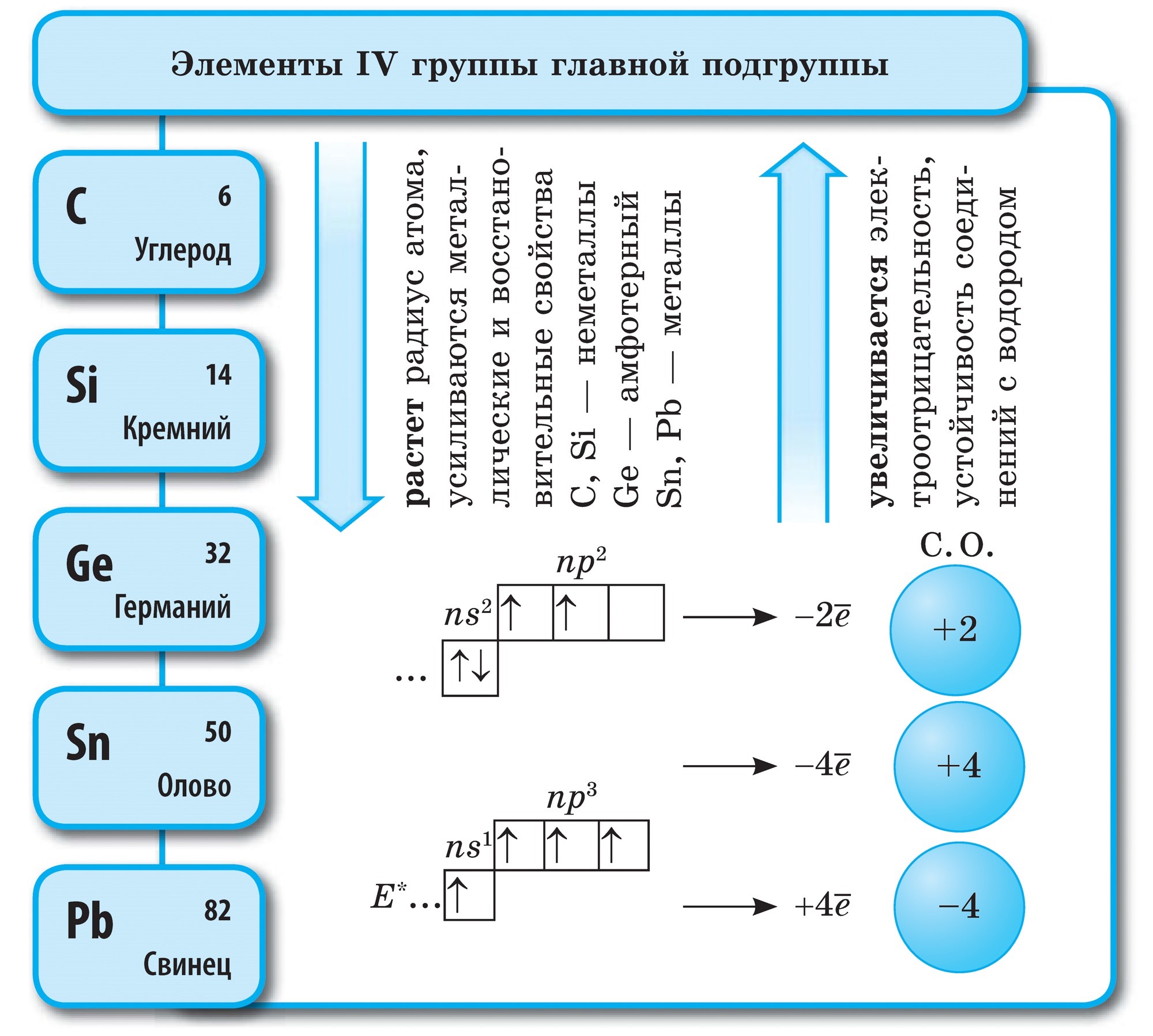
vuglets
Vuglets (C)- आवर्त सारणीच्या गट VI च्या मुख्य उपसमूहाचा पहिला घटक. तुमच्या अणूमध्ये इतर स्तरावर 4 इलेक्ट्रॉन असणे आवश्यक आहे, त्यामुळे त्यांना अनेक इलेक्ट्रॉन मिळू शकतात, ज्या ऑक्सिडेशनच्या टप्प्यावर सूज येते. -4 , म्हणजे, ऑक्साईडची शक्ती प्रकट करा आणि त्यांचे इलेक्ट्रॉन अधिक इलेक्ट्रोनेगेटिव्ह घटक सोडून द्या, म्हणजे नवीन शक्ती प्रकट करा, ऑक्सिडेशनच्या या टप्प्यावर सूज +4.
Vuglets एक साधे भाषण आहे
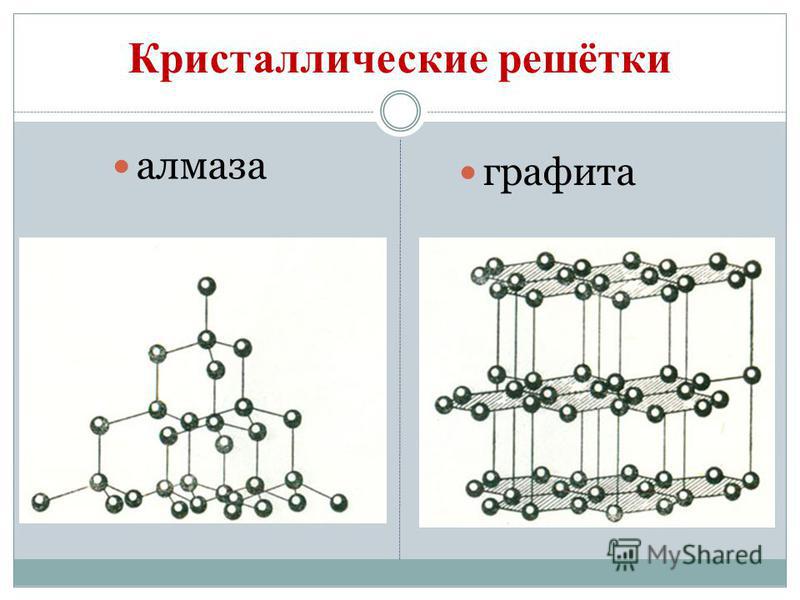
Vuglets allotropic बदल तयार करते हिरा आणि ग्रेफाइट. डायमंड एक स्पष्ट स्फटिकासारखे प्रवाह आहे, सर्व नैसर्गिक प्रवाहांपैकी सर्वात कठीण. हे कडकपणाचे मानक म्हणून काम करते, जसे की दहा-पॉइंट सिस्टममध्ये 10 च्या सर्वोच्च स्कोअरने त्याचे मूल्यांकन केले जाते. हिऱ्याची कठोरता त्याच्या अणू क्रिस्टलीय चाळणीच्या विशेष संरचनेद्वारे निर्धारित केली जाते. तिच्यामध्ये समान अणूंनी भरलेला एक त्वचा अणू आहे, जो नियमित टेट्राहेड्रॉनच्या शिरोबिंदूंवर पसरलेला आहे.
डायमंड क्रिस्टल्स बारलेस असतात आणि ते निळ्या, काळा, लाल आणि काळ्या रंगात येतात. दुर्गंधी त्याच्या उच्च अपवर्तक आणि प्रकाश-उत्सर्जक गुणधर्मांमुळे आणखी मजबूत चमक निर्माण करते. आणि विशेषतः उच्च कडकपणा, ड्रिल, ड्रिल्स तयार करण्यासाठी दुर्गंधी तयार होते. ग्राइंडिंग साधने, Rizanya skla.
हिऱ्यांची सर्वात मोठी प्रजाती नवीन आफ्रिकेत आढळते आणि रशियामध्ये ते याकुतियामध्ये आढळतात.
ग्रेफाइट एक गडद राखाडी, किंचित जाड क्रिस्टलीय सामग्री आहे ज्यामध्ये धातूची चमक असते. डायमंडऐवजी, ग्रेफाइट मऊ (कागदावरील चिन्ह काढून टाकते) आणि अपारदर्शक आहे, ते उष्णता आणि वीज अधिक चांगल्या प्रकारे चालवते. ग्रेफाइटचा मऊपणा गोलाकार रचनेमुळे तयार होतो. क्रिस्टल जाळीवर, ग्रेफाइट आणि कार्बन अणू, जे एकाच समतलात असतात, नियमित षटकोनीमध्ये घट्ट विणलेले असतात. मालोमित्स्ना बॉल्समधील दुवे. विन अगदी रेफ्रेक्ट्री आहे. ग्रेफाइटचा वापर इलेक्ट्रोड, घन तेले, अणुभट्ट्यांमध्ये न्यूट्रॉन-पुरवठा करणारे एजंट आणि मेंढ्यांसाठी कातरणे तयार करण्यासाठी केला जातो. उच्च तापमानात आणि ग्रेफाइटच्या दुर्गुणांवर, तुकडा हिरे धरले जातात, जे तंत्रज्ञानामध्ये मोठ्या प्रमाणावर वापरले जातात.
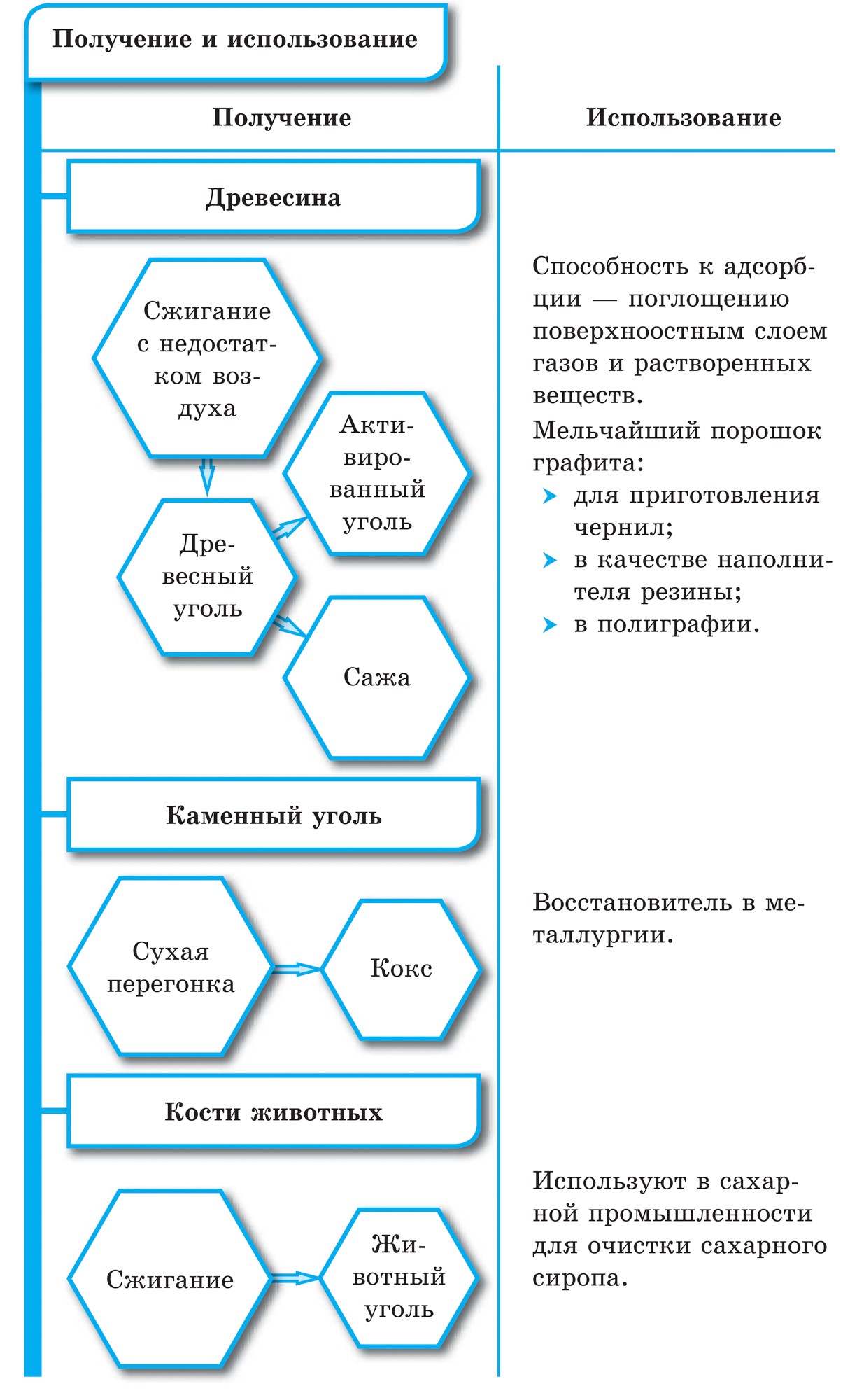
वुगिला गावातील काजळी ग्रेफाइटसारखीच आहे. वुजिला गाव लाकूड कोरड्या ऊर्धपातन करून काढले जाते. या वुजिला, त्याच्या सच्छिद्र पृष्ठभागामुळे, वायू शोषून घेण्याची आणि भाषण तोडण्याची चमत्कारी क्षमता आहे. या शक्तीला शोषण म्हणतात. लाकूड कोळशाची सच्छिद्रता जितकी जास्त असेल तितके शोषण अधिक प्रभावी होईल. दफन मूल्य वाढविण्यासाठी, वुगिला गावात गरम पाण्याच्या वाफेने फवारणी केली जाते. अशा प्रकारे निर्मितीला सक्रिय किंवा सक्रिय म्हणतात. फार्मेसीमध्ये आपण कार्बोलिन गोळ्या काळ्या गोळ्याच्या स्वरूपात विकू शकता.
कोळशाची रासायनिक शक्ती
डायमंड आणि ग्रेफाइट अतिशय उच्च तापमानात आम्लासह एकत्र होतात. काजळी आणि वुजिला आंबटांशी अगदी सहज संवाद साधतात, नवीनमध्ये ज्वलन करतात. परंतु कोणत्याही परिस्थितीत, अशा परस्परसंवादाचा परिणाम सारखाच असतो - कार्बन डायऑक्साइड तयार होतो:
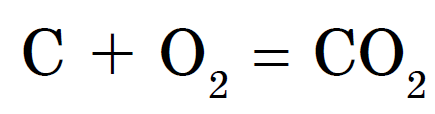
गरम केल्यावर, कार्बन धातूंवर प्रतिक्रिया देतो कार्बाइड्स:
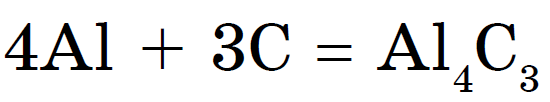
अॅल्युमिनियम कार्बाइड- हलका-पिवळा क्रिस्टल व्हिजन. कॅल्शियम कार्बाइड Sas 2 राखाडी रंगात घाला. एसिटिलीन काढण्यासाठी गॅस वेल्डर वापरा:
ऍसिटिलीनधातू कापण्यासाठी आणि वेल्डिंगसाठी व्हिकोर वापरा, विशेष तोरणांमध्ये अतिरिक्त टारसह जाळणे.
जेव्हा अॅल्युमिनियम कार्बाइडला पाणी लावले जाते तेव्हा आणखी एक वायू सोडला जाईल - मिथेन CH 4:
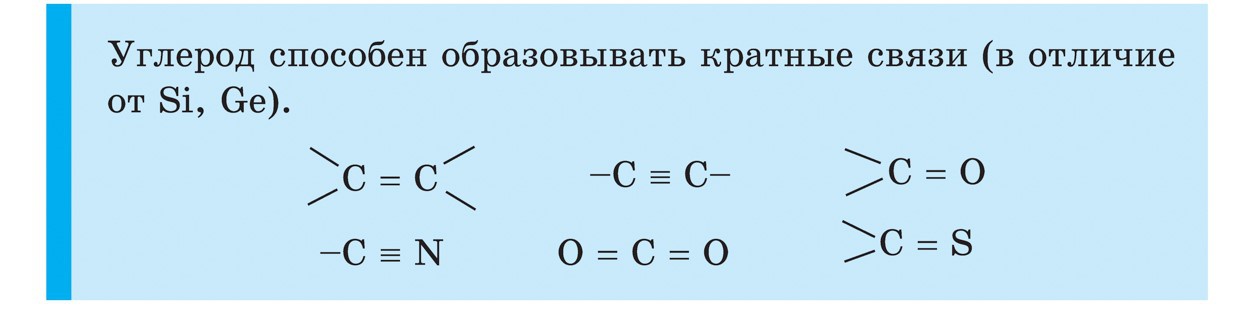
सिलिकॉन
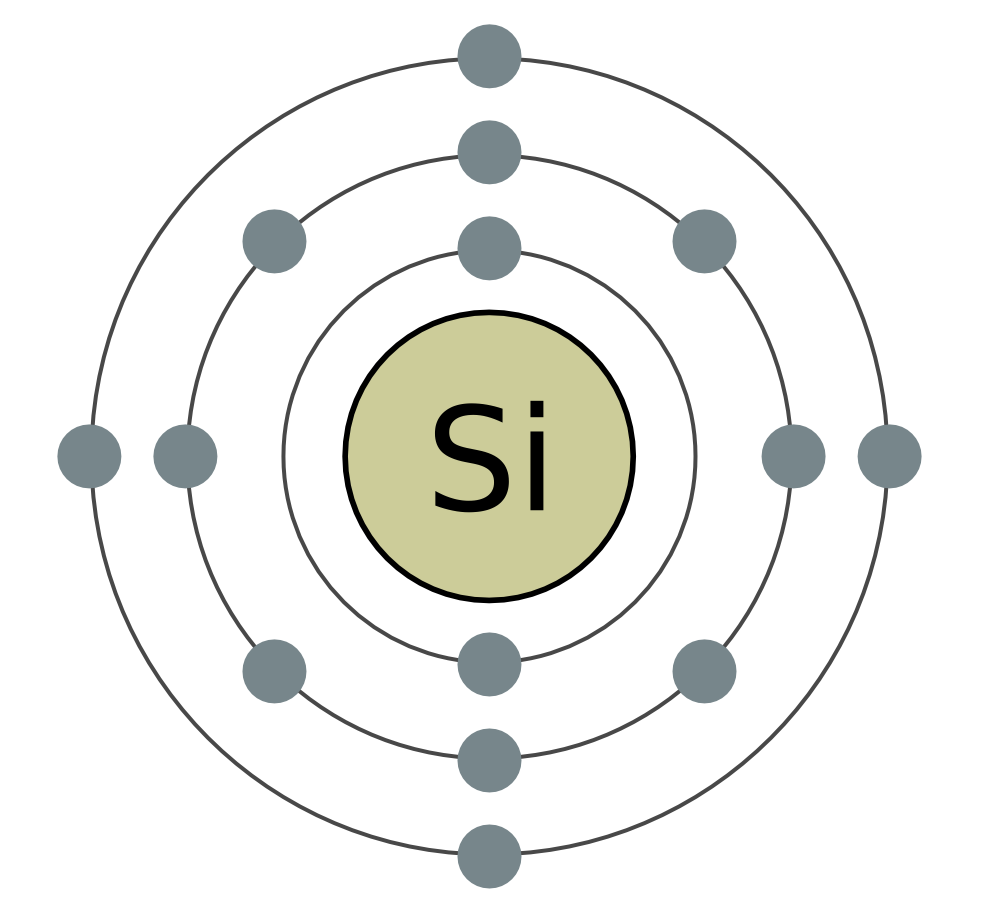
सिलिकॉन (Si) हा नियतकालिक प्रणालीच्या गट IV च्या मुख्य उपसमूहाचा आणखी एक घटक आहे. निसर्गात, आंबटपणानंतर सिलिकॉन हा आणखी एक रासायनिक घटक आहे. पृथ्वीचे कवच एका बाजूपासून दुस-या बाजूस एक चतुर्थांश दुमडलेले आहे. सर्वात मोठ्या प्रमाणावर वापरले जाणारे सिलिकॉन हे त्याचे डायऑक्साइड SiO 2 - सिलिका आहे. निसर्गात, खनिज क्वार्ट्ज आणि अनेक जातींनी बनलेले आहे, जसे की माउंटन क्रिस्टल आणि त्याचे प्रसिद्ध जांभळे स्वरूप - अॅमेथिस्ट, तसेच ऍगेट, ओपल, जास्पर, चाल्सेडनी, कार्नेलियन. सिलिकॉन डायऑक्साइड क्वार्ट्ज वाळू प्रमाणेच आहे. नैसर्गिक सिलिकॉन संयुगेचा आणखी एक प्रकार म्हणजे सिलिकेट. त्यापैकी, सर्वात मुबलक अॅल्युमिनोसिलिकेट ग्रॅनाइट आहे, भिन्न दृश्येचिकणमाती, अभ्रक. सिलिकेट, जे अॅल्युमिनियममध्ये मिसळत नाही, किंवा, उदाहरणार्थ, एस्बेस्टोस. सिलिकॉन ऑक्साईड वनस्पती आणि प्राण्यांच्या जीवनासाठी आवश्यक आहे. वाइन वनस्पतींच्या देठांना आणि प्राण्यांच्या कोरड्या कोटिंगला महत्त्व देते. सिलिकॉन मानवी ब्रशेसमध्ये गुळगुळीत आणि मऊपणा जोडते. सिलिकॉन खालच्या सजीवांच्या गोदामात प्रवेश करतो - डायटम शैवाल आणि रेडिओलेरियन्स.
सिलिकॉनची रासायनिक शक्ती
चकमक आंबटपणात जळते, सिलिकॉन डायऑक्साइड किंवा सिलिकॉन (IV) ऑक्साईडसह उपचार:
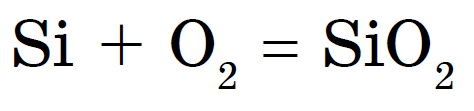
नॉन-मेटल असल्याने, जेव्हा गरम केले जाते तेव्हा ते संयुगेसह धातूसह एकत्र होते silicides:
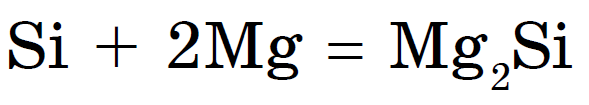
सिलीसाईड्स पाण्याने किंवा ऍसिडद्वारे सहजपणे विघटित होतात, परिणामी गॅससारखे पाणी सिलिकॉनला बांधले जाते - silane:
4HCl + Mg 2 Si → SiH 4 + 2MgCl 2
कार्बोहायड्रेट्सने बदलल्यास, हवेतील सिलेन स्वयं-प्राइमिंग असते आणि सिलिका आणि पाण्याने जळते:
CH4 मधील सिलेनची मिथेनच्या बरोबरीची वर्धित प्रतिक्रिया या वस्तुस्थितीद्वारे स्पष्ट केली जाते की सिलिकॉनचा अणु आकार कार्बनपेक्षा मोठा आहे, म्हणून रासायनिक बंध Si-H C-H बॉण्ड्सपेक्षा कमकुवत आहे.
सिलिकॉन कुरणातील एकाग्र पाण्याच्या साठ्यांशी संवाद साधतो, सिलिकेट्स आणि पाणी बरे करणे:
सिलिकॉन जिंकेल, मॅग्नेशियम डायऑक्साइड किंवा कार्बनसह अद्यतने:
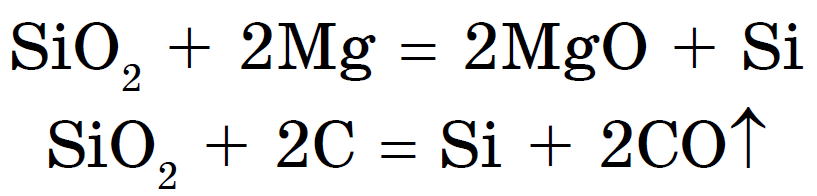
सिलिकॉन (IV) ऑक्साईड, किंवा सिलिकॉन डायऑक्साइड, किंवा सिलिका, SiO 2, किंवा CO 2, किंवा ऍसिड ऑक्साईड. तथापि, CO 2 व्यतिरिक्त, ते आण्विक नाही, परंतु अणू आहे क्रिस्टल जाळी. म्हणून, SiO 2 एक कठोर आणि अपवर्तक पदार्थ आहे. हायड्रोफ्लोरिक ऍसिडसह वाइन पाण्यात आणि ऍसिडमध्ये विरघळत नाही, परंतु विरघळलेल्या सिलिकिक ऍसिड क्षारांसह उच्च तापमानावर प्रतिक्रिया देते - सिलिकेट:
सिलिकेट मेटल ऑक्साईड किंवा कार्बोनेटसह सिलिकॉन डायऑक्साइडचे मिश्र धातु म्हणून देखील तयार केले जाऊ शकतात:
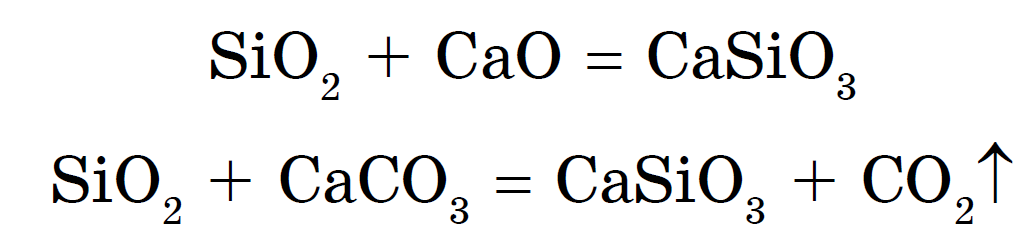
सोडियम आणि पोटॅशियम सिलिकेटला सामान्य खडक म्हणतात. їх पाणी विभाग- हे चांगले सिलिकेट गोंद आहे. सिलिकेट्समुळे, त्यांच्याकडे अधिक मजबूत ऍसिड असतात - हायड्रोक्लोरिक, अम्लीय, गरम आणि कार्बनिक - सिलिकिक ऍसिड एच बाहेर येते 2 SiO 3 :
अरे बरं, एच 2 SiO 3 - खूप कमकुवत ऍसिड. हे पाण्यात अघुलनशील असते आणि प्रतिक्रिया मिश्रणातून एक अवक्षेपित अवक्षेपणाच्या रूपात बाहेर पडते, काहीवेळा ते संपूर्ण मिश्रण कॉम्पॅक्टपणे भरून काढते, जेली केलेले मांस, जेली सारखे घन वस्तुमानात बदलते. जेव्हा मिश्रण सुकते तेव्हा एक अत्यंत सच्छिद्र पदार्थ - सिलिका जेल - बरा होतो, शोषक कंटेनरमध्ये मोठ्या प्रमाणात मिसळला जातो - इतर पदार्थांची चिकणमाती काढून टाकली जाते.



चाचणीसाठी प्री-डॉक्टर साहित्य:
आवर्तसारणी
ग्रेड सारणी