
영양에 대한 조언 제공: 1. 불활성 기체의 피부 분자를 구성하는 원자 수는 몇 개입니까? 2. 어원을 보고 “불활성 기체”라고 부른다. 3. 친구의 이름은 무엇입니까? 4. 불활성 기체에 도달하는 가장 빠른 방법은 무엇입니까? 재주꾼에게서



네온의 선택 네온은 가장 효율적인 연상 광고 유형입니다. 네온 광고 및 라이트 박스는 전 세계 모든 국가에서 인기가 있습니다. 네온 또는 아르곤으로 채워진 유리관은 라이트 박스에 짜여져 빅토리아 방식으로 승리하거나 가벼운 광고를 기념하고 효과적이고 효과적으로 강탈하는 편지로 승리했습니다.


Allotropia - 집사 XE의 건물은 일상과 권력을 위해 나누어지는 간단한 연설의 뿌리를 확립합니다. Z - 다이아몬드, 흑연, 풀러렌. O - 키스, 오존. S - 마름모꼴, 단사정계, 플라스틱. P - 흰색, 빨간색, 검은색. 동소체 현상은 두 가지 이유 때문입니다. 1) 산소 O2와 오존 O3와 같이 분자 내 원자 수가 다릅니다. 2) 다이아몬드 및 흑연과 같은 다양한 결정 형태의 채택.



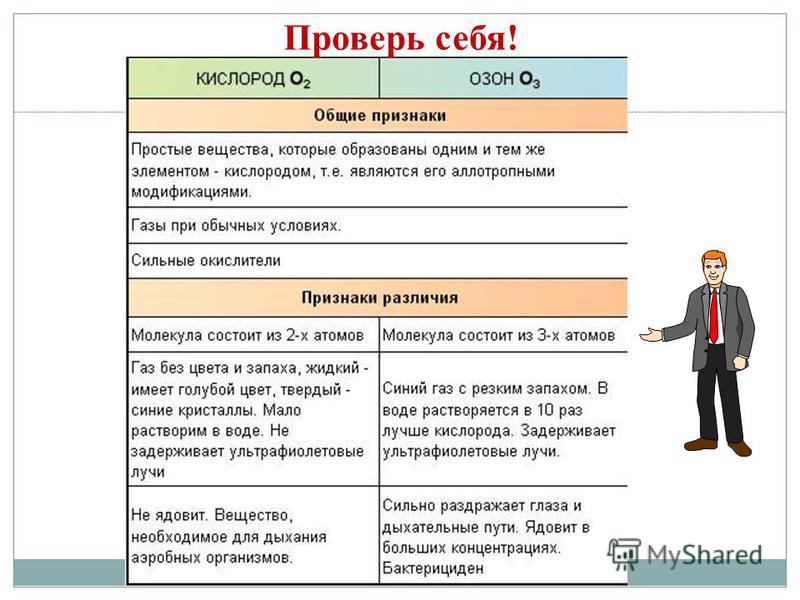






내포된 이동에서 다이아몬드와 흑연의 힘 특성을 선택합니다. 1. 수정같이 맑은 말투 2. 열과 스트럼을 전도합니다. . 열을 가하거나 스트럼을 가하지 마십시오.
 금속 비금속 1. 고체음성(크림은수은) 1, 경성음성(sirka S, 체르보늄 인 및 백린 P4, 요오드 I 2, 다이아몬드 및 흑연 C), 가스상 음성(산소O2, 오존O3, 질소 N 2 , 물 H 2, 염소 C1 2, 불소 F 2, 희가스) 및 rіdina (브롬 Br 2) 2. 금속 눈부심을 만듭니다 2. 금속 눈부심을 씻지 마십시오 (요오드 I 2, 흑연 C 만들기) 3 .전기 및 열전도율 3. 전기 충격을 더 이상 전도하지 않음(도체 є, 예를 들어 실리콘, 흑연)
금속 비금속 1. 고체음성(크림은수은) 1, 경성음성(sirka S, 체르보늄 인 및 백린 P4, 요오드 I 2, 다이아몬드 및 흑연 C), 가스상 음성(산소O2, 오존O3, 질소 N 2 , 물 H 2, 염소 C1 2, 불소 F 2, 희가스) 및 rіdina (브롬 Br 2) 2. 금속 눈부심을 만듭니다 2. 금속 눈부심을 씻지 마십시오 (요오드 I 2, 흑연 C 만들기) 3 .전기 및 열전도율 3. 전기 충격을 더 이상 전도하지 않음(도체 є, 예를 들어 실리콘, 흑연)
![]()
영양에 대한 조언을 해주세요. allotropic 변형을 지정하십시오. 동소체 viklikano의 발현은 왜입니까? 왜 연설의 다양성에 대한 이유 중 하나가 있습니까? "창문에서 뇌우 냄새가 났다"는 화학적으로 비도덕적인 시적 표현인 이유는 무엇입니까? 왜 던지고 던지지 않고 rozpodіl 했습니까? 왜 던지고 던지지 않고 rozpodіl 했습니까?


화학 원소 - 던지지 않는 선수
총 16종의 비금속 화학 원소가 있으며, 그 중 2종인 산소와 규소가 지구 홍역 질량의 76%를 차지합니다. 던지지 않는 사람은 로슬린의 질량에서 98.5%, 사람의 질량에서 97.6% 접힙니다. 석탄, 물, 사워, 시르카, 인 및 질소와 함께 가장 중요한 유기적 음성이 모두 추가되며 악취는 생명의 요소입니다. 물과 헬륨은 전 세계의 주요 요소이며 태양을 포함한 모든 우주 물체는 이들로 구성됩니다. 비금속의 전하 없이는 우리의 삶을 드러내는 것이 불가능하며, 특히 삶이 중요한 것이 무엇인지 짐작할 수 있습니다. 화학 공장- 물 - 물과 신맛으로 접혀 있습니다.
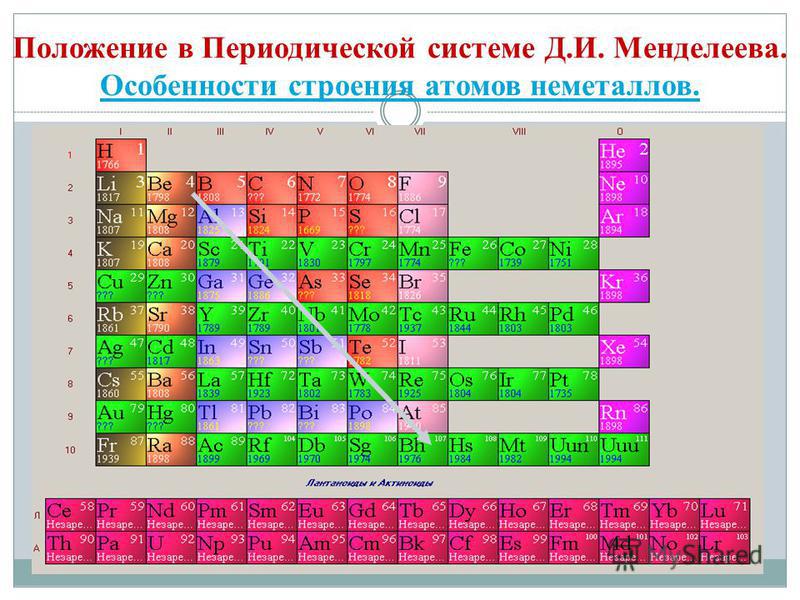
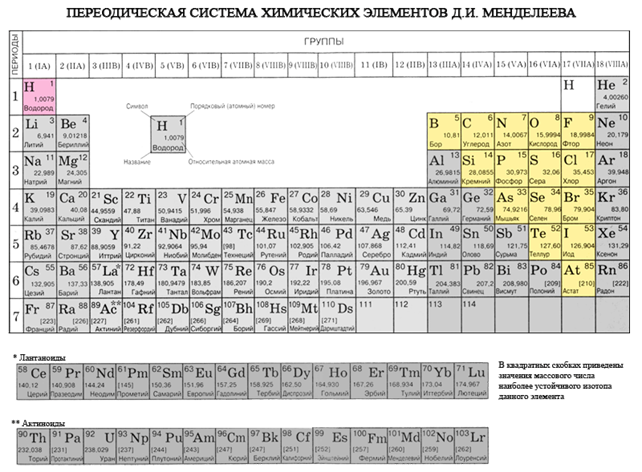
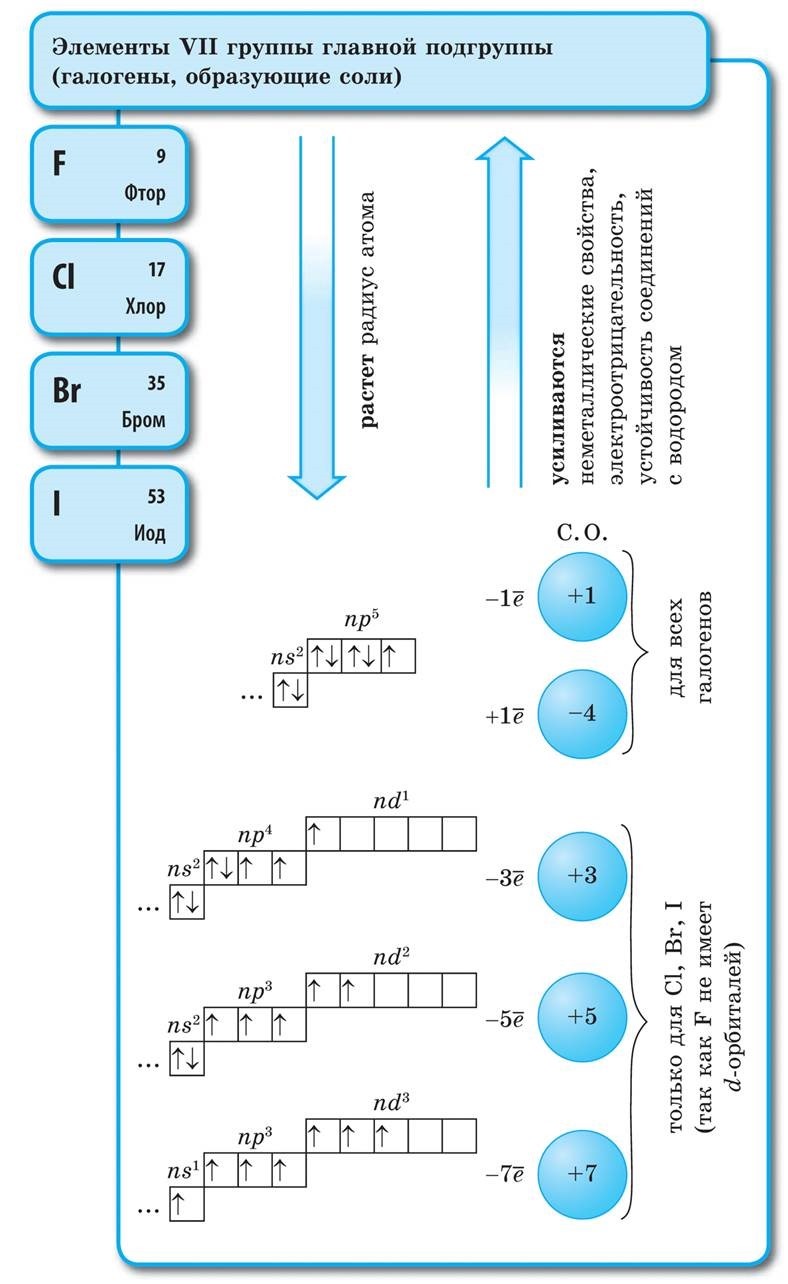
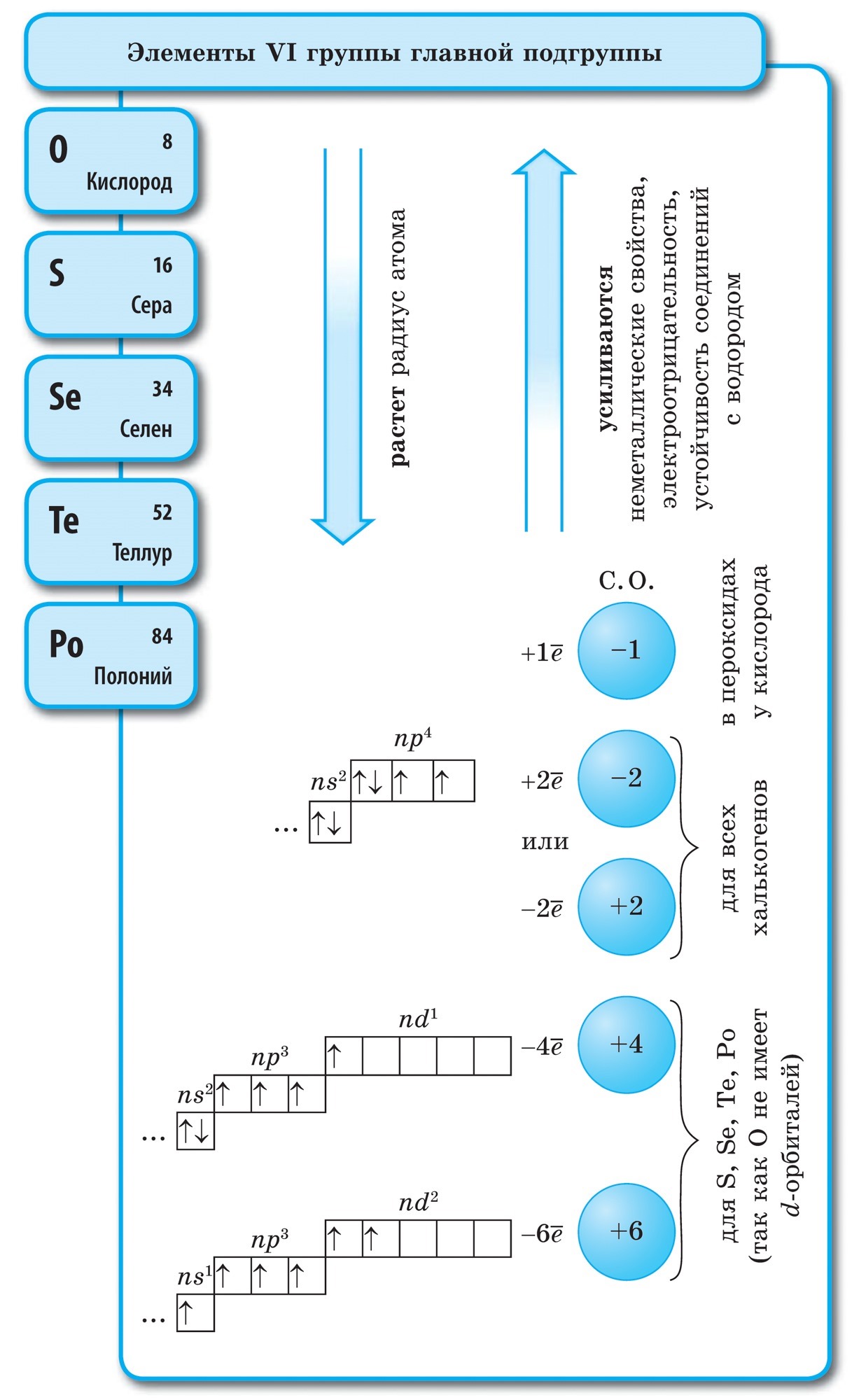
주기율표에서 베릴륨에서 아스타틴까지 대각선을 그리면 대각선을 따라 오른쪽 오르막에는 비금속 원소가 있고 바닥에는 금속이 있으며 그 앞에는 모든 측면 그룹, 란탄 족 및 악티늄 족의 원소가 있습니다. , 볼 수 있습니다. 예를 들어 베릴륨, 알루미늄, 티타늄, 게르마늄, 안티몬과 같이 대각선 근처에 퍼져 있는 원소는 이중 특성을 가질 수 있으며 Metaloid까지 볼 수 있습니다. 던지지 않는 엘레멘티: s-엘리먼트 - 홍수; r-요소 13족 - 붕소; 14개 그룹 - 석탄과 규소; 15군 - 질소, 인 및 미쉬야크, 16개 그룹 - 키센, 시르카, 셀레늄 및 텔루르및 17번째 그룹의 모든 요소 - 불소, 염소, 브롬, 요오드 및 아스타틴. 18군 원소 - 불활성 가스, 특수 진영을 차지하면 악취가 외부 전자구의 완성으로 가득 차서 금속과 비금속 사이의 중간 위치를 차지할 수 있습니다. 비금속이라고도 하지만 공식적으로는 물리적 기호 뒤에 있습니다.
네메탈리- CE 화학 원소, 완벽한 에너지 준위를 완성하기 위해 전자를 취하는 원자는 음전하를 띌 때 만족합니다.
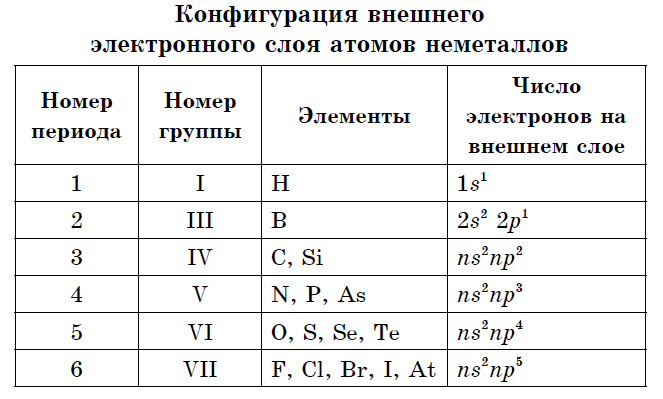
비금속 원자의 외부 전자구에는 3~8개의 전자가 있습니다.
실질적으로 모든 비 방사체는 4에서 7의 외부 에너지 수준에서 똑같이 작은 반경과 많은 수의 전자를 가질 수 있으며 높은 전기 음성도 값과 전력 산화물. 그렇기 때문에 금속 원자와 관련하여 비금속은 다음과 같은 특징이 있습니다.
· 더 작은 원자 반경;
· 외부 에너지 수준에서 Chotiri 및 더 많은 전자;
별과 비금속 원자의 중요한 힘 - 하루에 최대 8 개의 전자를받는 경향, 즉 힘의 산화물입니다. 비금속 원자의 특성으로 비금속성 자체의 세계인 전자 상거래가 가능하여 화학 원소의 원자 힘이 화학 결합을 분극화하고 높은 전자를 자신에게 끌어들입니다.
화학 원소의 가장 큰 과학적 분류는 금속과 비금속으로 나뉩니다. Tsya 분류는 현재 그 중요성을 잃지 않았습니다. 비금속은 원자의 주요 화학 원소이며, 일반적으로 가시성의 외부 공이 완성될 때까지 전자를 받아들이는 것이 특징이며, 일반적으로 전자의 외부 공에는 점점 더 많은 전자와 작은 반경의 원자가 있습니다. 원자 금속.
주요 하위 그룹의 VIII 그룹 요소 외부의 Tse vyznachennya - 불활성 또는 고귀한 가스, 원자 및 외부 전자 공의 일부 끝. 이러한 원소 원자의 전자 구성은 금속 또는 비금속에 기인할 수 없습니다. 금속과 비금속에 원소를 더하는 것 같은 이 물체들의 악취는 그들 사이의 경계선 위치를 차지한다. 비활성, 그렇지 않으면 고귀한 가지("귀족"은 비활성으로 표현됨)는 때때로 비금속 또는 더 공식적으로는 물리적 기호 뒤에 가져올 수 있습니다. Cі rechovina zberіgayut gazopodіbny 밀은 저온 아크까지 바로 올라갑니다. 따라서 헬륨 Chi는 t ° \u003d -268.9 ° С에서 드문 상태로 가지 않습니다.
이러한 원소의 화학적 적용에 있어 비활성은 명백합니다. 불소 및 산과 조합된 크세논 및 크립톤의 경우: KrF 2, XeF 2, XeF 4 및 in. 의심할 여지 없이 요즘 시대에 비활성 기체가 기여 요인으로 작용했습니다. 원자에 대해 높은 전기음성도 값을 특징으로 하는 비금속 흔적의 지정. 2와 4 사이의 경계에서 변경됩니다. Nemetals는 헤드 하위 그룹의 요소이고 p 요소는 더 중요하며 덩굴은 물인 s 요소가됩니다.
모든 비금속 원소(크림수)는 화학 원소 D의 주기율표에서 차지합니다. I. Mendeliev의 오른쪽 상단 kut, utvoryuyuchi tricutnik, 상단은 불소 F이고 지지대는 대각선 B - At입니다. 그러나 주기율표에서 I 및 VII 그룹의 헤드 하위 그룹에 있는 모호한 물 역에 특히 중점을 둡니다. Tse는 vipadkovo가 아닙니다. 한쪽에서 물 원자는 웅덩이 금속의 원자와 유사하지만 외부(신형의 경우 단일) 전자 공에는 건물의 전력인 하나의 전자(전자 구성 1s 1)의 전력을 보여줍니다. 지도자.
대부분의 날에는 웅덩이와 같은 물이 있어 +1의 산화 수준을 나타냅니다. 에일, 원자에 전자를 주는 것이 물보다 더 중요하고, 달 금속의 원자가 적습니다. 한편, 물의 원자는 할로겐의 원자와 마찬가지로 타원형의 전자구를 완성하기 위해 하나의 전자를 거부하는데, 그 물의 원자는 하나의 전자를 받아들일 수 있어 산화력과 할로겐 산화 단계 -1의 특징을 보인다. 수소화물 (금속, 할로겐과 유사한 결합 금속 - 할로겐화물 포함). 그러나 원자에 하나의 전자를 추가하는 것이 할로겐보다 더 중요합니다.
~에 마음물 H 2 - 가스. 할로겐과 같은 Yogo 분자는 이원자입니다. 비금속 원자에서 전력 산화물, 즉 전자를 추가하는 능력이 더 중요합니다. Qiu 건물은 기간과 하위 그룹에서 자연스럽게 변하기 때문에 전기 음성도의 값을 특징으로 합니다. 불소는 가장 강력한 산화제이며 화학 반응에서 불소 원자는 전자를 생성하지 않습니다. 즉, 상당한 힘을 나타냅니다. 다른 비 던지는 사람은 금속 순위에서 훨씬 더 약하지만 큰 힘을 보여줄 수 있습니다. 기간 및 하위 그룹에서 중요한 건물은 산화 순서의 역순으로 변경됩니다.
- 헤드 하위 그룹 III-VIII 그룹 PS D.I의 요소 비 던져진 roztashovani. Mendeliev, 오른쪽 상단 모서리를 차지합니다.
- 외부 전자구에는 3~8개의 전자가 있습니다.
- 원소의 비금속 힘은 주기적으로 증가하고 원소의 서수가 증가함에 따라 하위 그룹에서 약해집니다.
- 비금속의 가장 산성인 형태는 산성 특성(산 산화물 및 수산화물)을 가지고 있습니다.
- 건물의 비금속 원소의 원자는 전자를 받아들이는 것과 같이 산화 기능을 나타내므로 필수 기능을 나타냅니다.
Budov와 비금속의 물리적 힘
간단한 연설에서는 비금속 원자가 묶여 있습니다. 공유 비극성 결합. Zavdyaki tsomu는 전자 시스템의 더 큰 층, 낮은 절연 원자를 형성합니다. 이 경우 단일 (예 : 물 분자 H 2, 할로겐 F 2, Br 2, I 2), 종속 (예 : 황 S 2 분자), 손실 (예 : 질소 N 분자) 2) 공유 결합.
- gnuchkist vіdsutnya
- 눈부심이 없다
- 열전도율(흑연만 해당)
- 색 구성표는 노란색, 황록색, 적갈색으로 다릅니다.
- 전기 전도성(흑연 및 흑색 인광체만 해당)
골재 분쇄기:
- 국토 - Br 2;
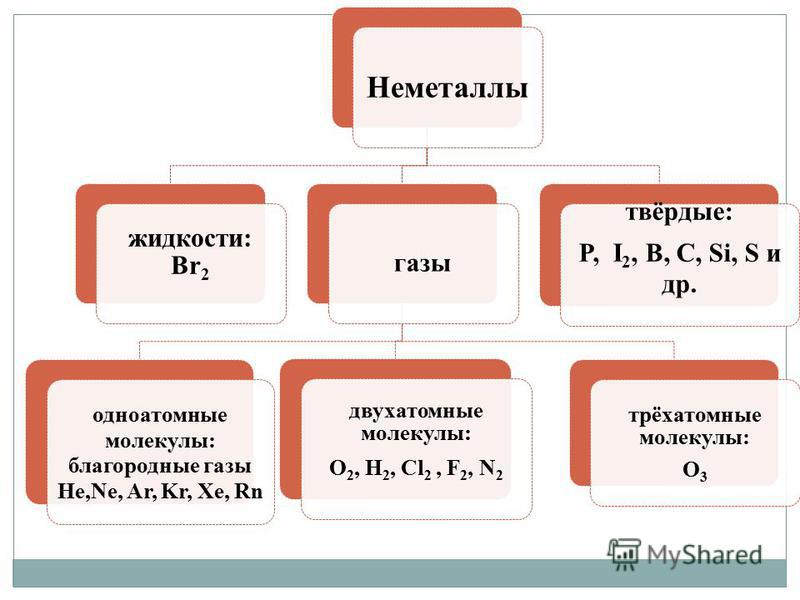
vіdmіnu vіd metalіv 비 던지기 - 그냥 얘기, 권위의 다양성이 특징입니다. Nemetali는 가장 높은 마음에서 다른 집계 캠프를 할 수 있습니다.
- 가스 - H 2, O 2, O 3, N 2, F 2, Cl 2;
- 국토 - Br 2;
- 하드 스피치 - sirka, 인, 실리콘, 석탄 및 인의 수정.
비금속의 경우 색상 스펙트럼이 더 풍부합니다. 빨간색 - 인, 붉은 부륨 - 브롬, 노란색 - 시르 카, 황록색 - 염소, 보라색 - 파리 요오드. 요소 - 동소체에 금속과 쌍으로 더 큰 zdatnі의 비금속.
하나의 화학 원소의 원자가 몇 가지 단순한 연설을 하는 능력을 동소체(allotropy)라고 하고, 간단한 연설의 수를 동소체 종(alotropic species)이라고 합니다.
연설을 용서하십시오 - 어머니는 던질 수 없습니다 :
1. 분자 부도프.위대한 마음으로 그러한 연설의 대부분은 가스 (H 2, N 2, O 2, F 2, Cl 2, O 3) 또는 고체 연설 (I 2, P 4, S 8)이며 하나 이상의 단일 브롬 (Br 2 ) 고향입니다. 연설의 모든 단어는 분자적으로 budovu, 그것에 날아갑니다. 고체 상태에서 악취는 약한 분자간 상호 작용으로 인해 녹을 수 있으며, 이는 결정의 분자를 감소시키고 승화를 형성합니다.
2. 원자 생활.연설의 색은 원자의 두 창(Cn, Bn, Sin, Sen, Ten)에 의해 만들어집니다. 공유 결합의 큰 광물성을 통해 악취는 일반적으로 높은 경도를 만들고 변화 여부에 관계없이 큰 유리체 에너지 ї로 결정의 공유 결합을 결합합니다 (용융, 증발). 이러한 연설은 녹는점과 끓는점이 높고 변동성은 더욱 낮습니다.
던지지 않는 많은 요소가 간단한 연설을 구성합니다. 동종 변형. 원자의 힘을 동소체라고합니다. 동질성은 다른 분자 창고(O 2, O 3) 및 다른 새싹 결정과 연관될 수 있습니다. 탄소 및 흑연, 다이아몬드, 카빈, 풀러렌의 알로트로픽 변형. 모든 비금속의 특징인 우세를 나타내기 위해서는 주기율표의 원소 분포에 주의를 기울이고 외부 전자구의 구성을 결정할 필요가 있습니다.
기간:
- 핵의 전하가 증가합니다.
- 원자의 반경이 변경됩니다.
- 외부 구의 전자 수가 증가하고 있습니다.
- 전자 상거래가 성장하고 있습니다.
- 권위의 산화물이 강화됩니다.
- 비금속 힘이 상승합니다.
헤드 하위 그룹에서:
- 핵의 전하가 증가합니다.
- 원자의 반경이 증가합니다.
- 외부 볼의 전자 수는 변하지 않습니다.
- 전기 음성도 변화;
- 힘의 산화물이 약해집니다.
- 비금속의 힘이 약해지고 있습니다.
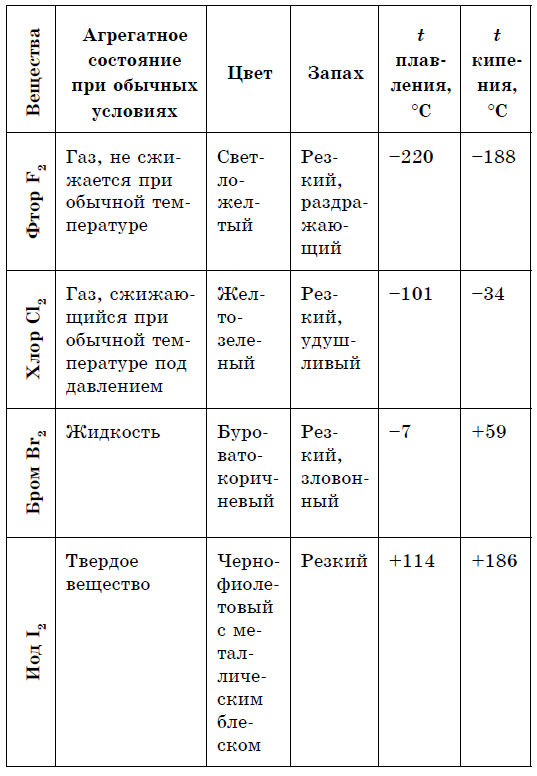
대부분의 금속의 경우 희귀 한 vinyatka (금, 구리 및 deaks іnshі)의 경우 은백색 zabarvlennia가 특징입니다. 간단한 연설의 축은 비금속 감마 색상으로 크게 다릅니다. P, Se - 노란색; B - 갈색; O 2 (g) - 블라키트늄; Si, As (만난) - сірі; P 4 - 옅은 노란색; I - 메탈릭 광택이 있는 바이올렛 블랙; Br 2 (g) - 붕사 천연; C1 2 (d) - 황록색; F 2 (r) - 옅은 녹색; S 8 (TV) - Zhovta. 비금속 결정은 비소성이며 변형이 공유 결합의 붕괴로 이어지는지 여부. 대부분의 비금속은 금속 섬광을 내지 않습니다.

총 16개의 화학 원소-비금속이 있습니다! 글쎄요, 114개의 요소가 보인다는 것은 부자가 아니라 거짓말과 같습니다. 두 개의 던지지 않은 요소는 지구 홍역의 76%를 더합니다. 체키센(49%) 및 실리콘(27%). 대기 중에 지각에 있는 신맛의 질량은 0.03%입니다. Nemetali는 로슬린 질량의 98.5%, 인체 질량의 97.6%가 됩니다. 비금속 C, H, O, N, S는 단백질, 지방, 탄수화물, 핵산과 같이 살아있는 세포의 가장 중요한 유기적 언어를 구성하는 생체 요소입니다. 다시 창고까지 마치 mi dihaєmo처럼 들어가기 쉽습니다. 접을 수 있는 연설, 또한 비금속 원소 (산소 O 2, 질소 N 2, 이산화탄소 CO 2, 수증기 H 2 O 및 in.)에 의해 용해됩니다.
간단한 연설의 힘의 산화물 - 비금속
비금속 원자의 경우, 그리고 나중에 간단한 연설을 조명하기 위해 특징적입니다. 산화, 그래서 나는 영감을주는힘.
1. 비금속의 전력 산화물첫 번째 줄에 나타납니다 금속과의 상호작용으로(금속 zavzhdi vodnovniki):

염소 Cl 2의 산화력은 산화 단계 +2 및 +3의 동일한 줄기에 있을 수 있는 금속 Fe보다 시르카에서 더 강하고 더 낮으며 더 높은 높은 산화 단계로 산화됩니다.
1. 대부분의 비금속 쇼 전력 산화물 물과 상호 작용할 때. 결과적으로 날아 다니는 물새싹이 형성됩니다.
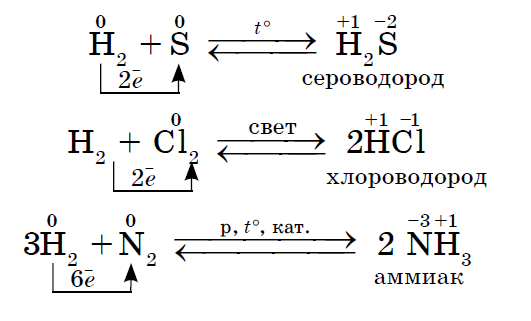
2. 비금속이 이러한 비금속과의 반응에서 산화제로 작용하는지 여부는 더 낮은 전기음성도 값을 가질 수 있습니다.
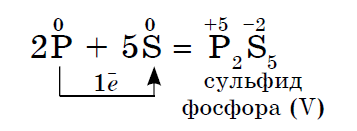
시르카의 전기음성도는 더 크고, 인은 더 낮기 때문에 전력의 산화물을 나타낸다.
불소의 전기음성도는 다른 모든 화학 원소에서 더 크고 더 낮으므로 vin은 산화제의 힘을 나타냅니다. 불소F2는 비금속 중에서 가장 강한 산화제로서 반응시 산화력만 발휘한다.
3. 비금속의 힘의 산화물이 접는 연설과 함께 반응에 나타납니다..
접는 연설과의 반응에서 비금속 산도의 힘의 첫 번째 산화 라인에서 크게 :
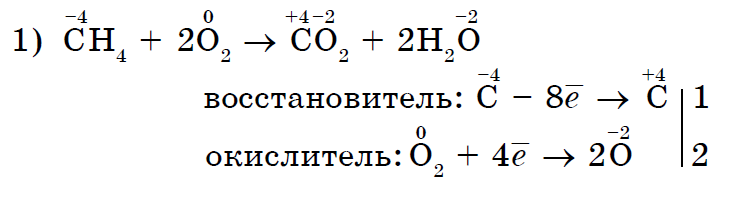
kisen뿐만 아니라 다른 non-throwers도 접는 연설과의 반응에서 산화제가 될 수 있습니다.- 무기(1, 2) 및 유기(3, 4):
강한 산화 염소 Cl 2는 염화 식염수(II)를 염화 식염수(III)로 산화시킨다.
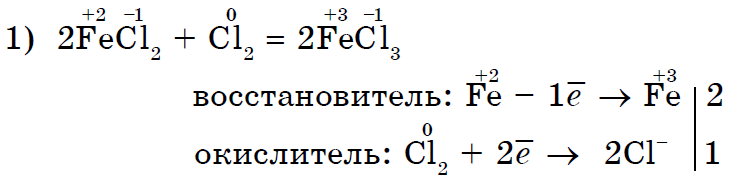
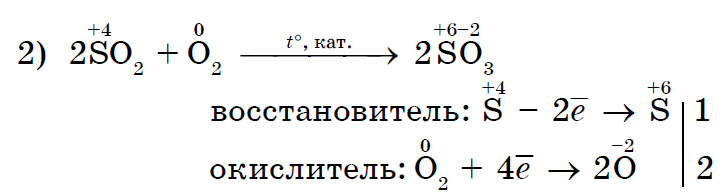
더 강력한 산화제인 염소 Cl 2 요오드 I 2는 요오드화 칼륨과 더 유사합니다.
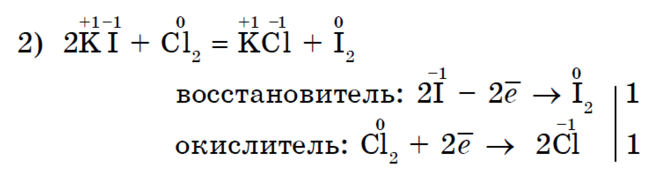
메탄으로의 할로겐화는 알칸의 전형적인 반응입니다.
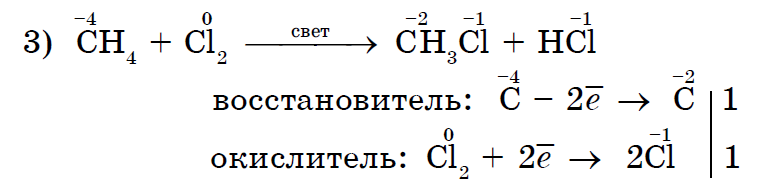
존재하지 않는 spoluchy에 대한 Yakіsnoy 반응은 znebarvlennya 그들에게 물을 브롬화합니다.
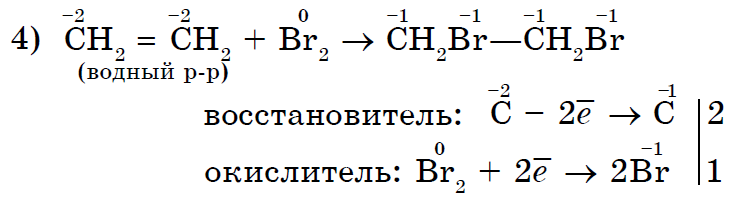
간단한 연설의 힘에 대한 통찰 - 비금속
볼 때 비금속의 반응을 하나씩, 그러나 그들의 전기 음성도 값의 휴경지에서 그들 중 하나는 산화제의 힘을 나타내고 다른 하나는 대리인의 힘을 보여줍니다.
1. 불소 소개에 따르면 모두가 던지지 않았다(navit kisen) 그들은 권위의 힘을 보여줍니다.
2. 합리적으로 볼 때, 크림에서 불소에 이르는 비금속은 신맛과 상호 작용하는 환원제 역할을 합니다.

반응의 결과로 확립됩니다. 비금속 산화물: 비염 형성 및 염 형성 산. 나는 산화물에서 신맛이없는 신맛이없는 할로겐을 원합니다 : Cl 2 +1 O -2, Cl 2 +4 O 2 -2, Cl 2 +7 O 7 -2, Br 2 +1 O -2, Br +4 O 2 -2, I 2 +5 O 5 -2, i in., yakі는 간접 경로를 취합니다.
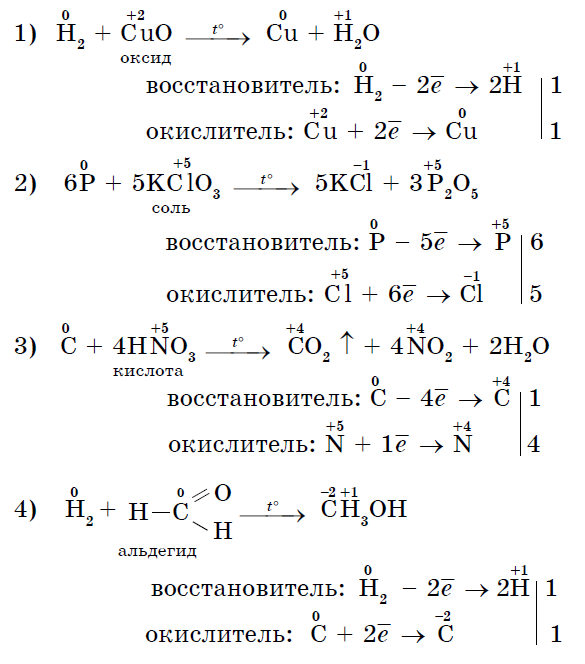
3. Bagato non-throwers는 접는 연설-산화제와의 반응에서 가이드 역할을 할 수 있습니다.
Іsnuyut 및 하나의 동일한 비금속이 동시에 산화되는 반응 및 vodnovnik. 자기 산화 자기 재생의 Tse 반응(불균형):
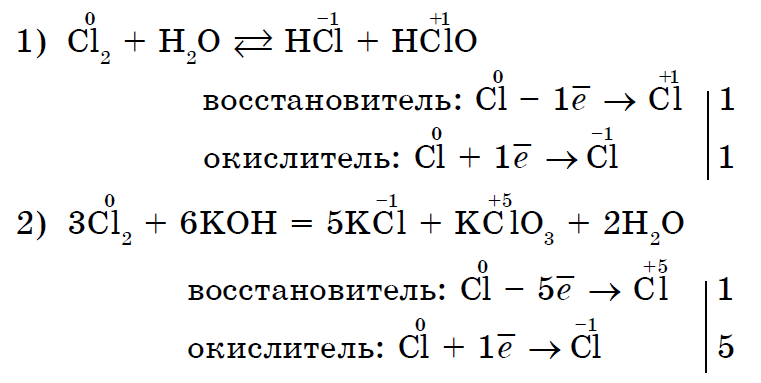
이러한 방식으로 대부분의 비금속은 화학 반응산화제의 역할과 리더의 역할(불소 F2에만 부착되지 않은 영향력).
수성 비금속
vіdmіnu vіd metalіv nemetali utvoryuyut 가스와 같은 물 spoluki에. Їx 창고는 비금속 산화 단계에서 침전됩니다.
RH 4 → RH 3 → H 2 R → HR
모든 비금속의 신성한 힘 є 여름 바다 z'єdnan의 해상도, 대부분의 경우 비금속은 산화 정도가 낮을 수 있습니다. 연설의 공식 중 침묵, 우세, zastosuvannya 및 otrimannya vyvchali가 이전에 풍부합니다 : CH 4, NH 3, H 2 O, H 2 S, HCl.
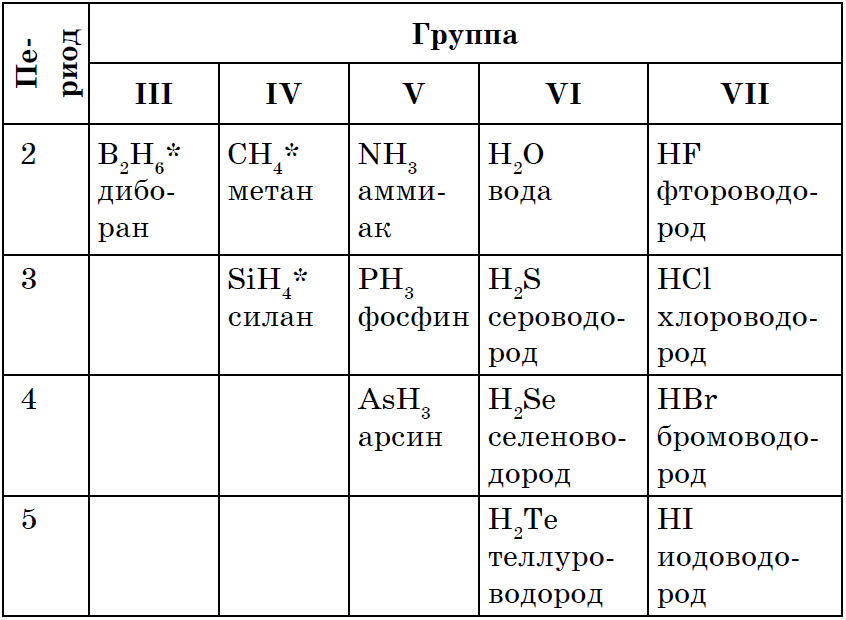
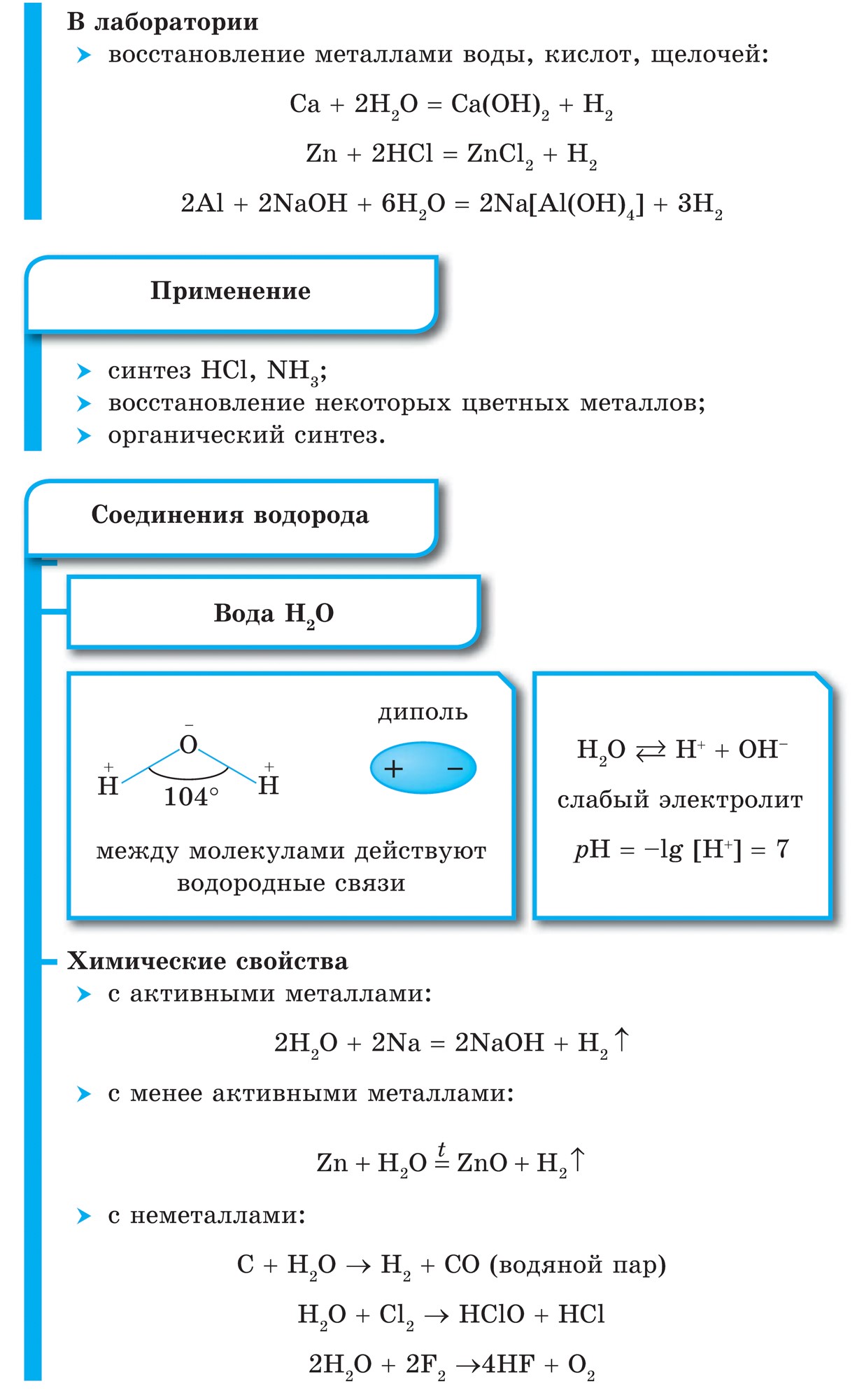
Vіdomo, scho 가장 간단하게 qі spoluky는 중간없이 취할 수 있습니다 비금속과 물의 상호 작용, 토브토 합성:
![]()
비금속의 모든 물은 공유 극성 결합으로 구현됩니다. 물 z'ednan 비금속의 경우 물로 설정하는 차이가 특징입니다. 메탄과 실란은 거의 구별할 수 없습니다. 암모니아가 물에 용해되면 NH 3 H 2 O의 약한 염기가 용해됩니다. 물에 용해되면 셀렌화수소, 텔루르화수소 및 할로겐화수소가 용해되며 산은 동일한 공식으로 용해되며, 이는 물 자체입니다: H 2 S, H2Se, H2Te, HF, HCl, HBr, HI.
한 기간의 비금속, 예를 들어 다른 기간(NH 3, H 2 O, HF) 또는 세 번째 기간(PH 3, H 2 S, HCl)에 의해 침전된 물의 산-염기력의 균형을 맞추기 위해, 그런 다음 강도 산성 우세 i, vіdpovіdno, 약화 된 기본 법칙에 대해 wisps를 만들 수 있습니다. 이것은 분명히 극성이 증가한다는 사실 때문입니다. 즈바즈쿠 E-N(De E는 비금속입니다).
한 하위 그룹에서 수계 비금속의 산-염기 능력도 도전받습니다. 예를 들어 일련의 할로겐화 수소 HF, HCl, HBr, HI에서 결합이 증가하기 때문에 결합 E-H의 강도가 변경됩니다. 다른 수준에서 HCl, HBr, HI는 가장 강한 산인 실질적으로 더 해리되며 강도는 HF에서 HI로 증가합니다. HF가 약산에 추가되면 분자간 상호 작용, 물 결합 설정 ... HF ... HF .... 물 원자는 자체 분자뿐만 아니라 불소 원자 F에 결합됩니다. , 그러나 또한 사법.
우자갈뉴유치 동등한 특성비금속 물의 산-염기 힘, 기간 동안 이러한 연설의 산성 및 약화 기본 힘의 강화에 대한 zrobimo vysnovkas 및 더 많은 원자 번호 ututvoryut їх 요소의 주요 하위 그룹.
화학 원소의 PS 기간 동안 비금속 원소의 일련 번호가 증가하면 수생 식물의 산성 특성이 증가합니다.
SiH4 → PH3 → H2S → HCl
Krіm은 당국을 보았고, 산화물-물 반응에서 비금속 절반의 물은 비금속이 산화 정도가 낮더라도 항상 리더의 힘을 보여줍니다.
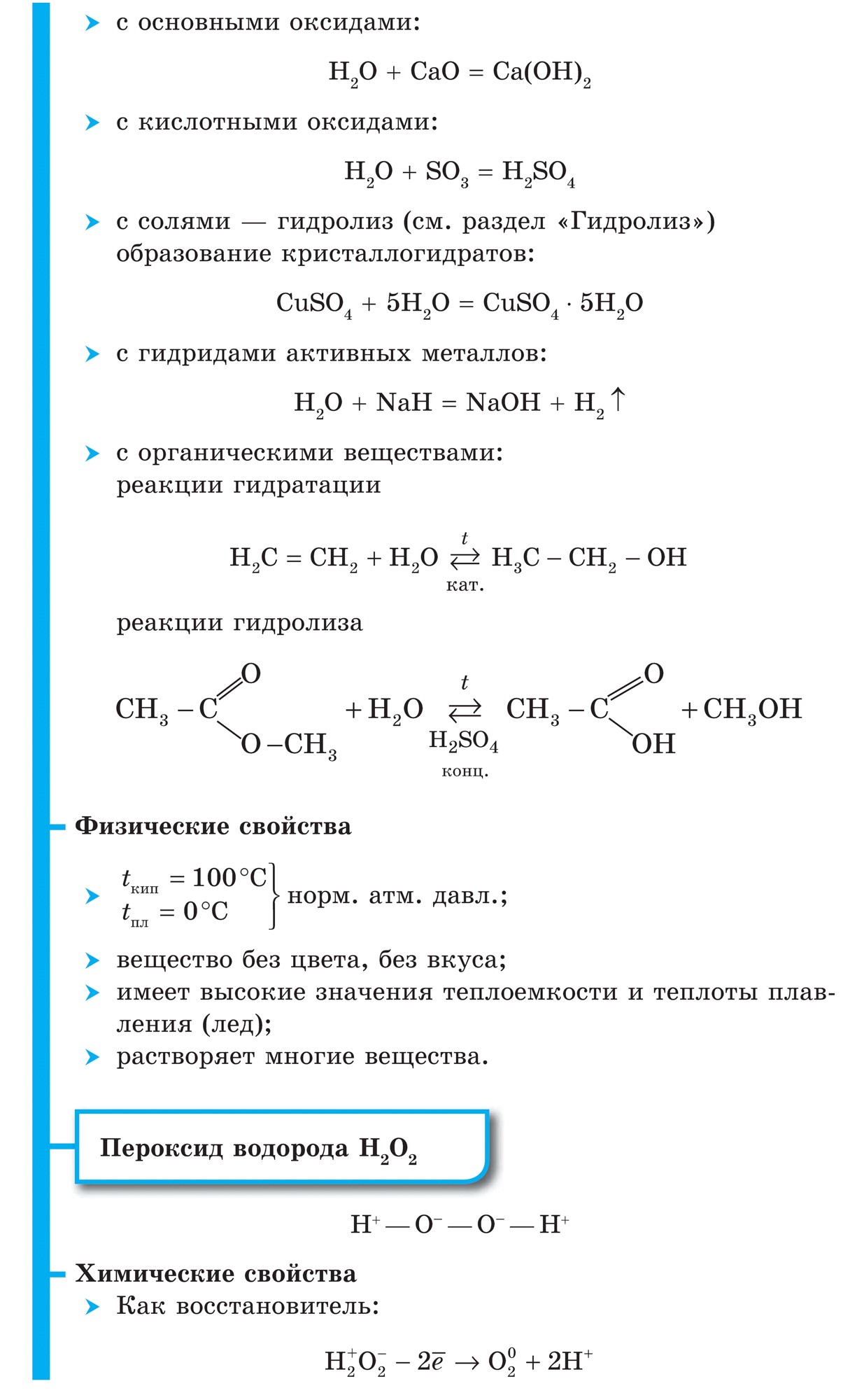
홍수
물 - 헤드 요소전세계. 많은 우주 물체(태양을 포함한 가스 어둠, 별)가 절반 이상을 합하면 물이 됩니다. 대기, 수권, 암석권을 포함한 지구에서는 0.88%에 불과합니다. Alece의 무게와 물의 원자량은 훨씬 작습니다. 따라서 소량의 요가 만 포기하고 지구 17의 100 원자 피부에서 물 원자를 얻습니다.
자유 캠프에서 물은 분자에 결합된 원자인 H 2 분자의 시야에서 보입니다. 공유 비극성 결합.
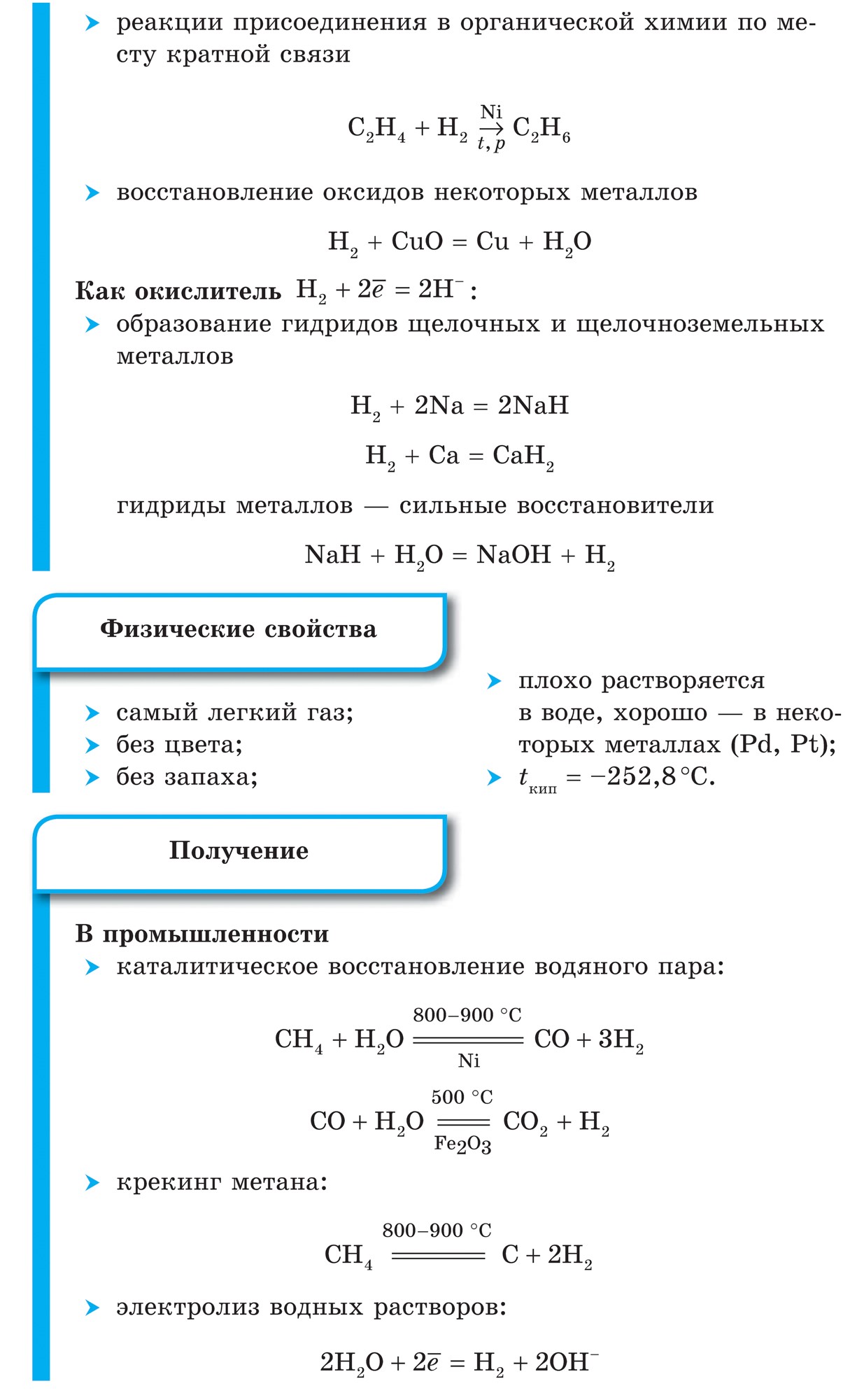
Voden (H 2)은 건조한 가스와 같은 강에서 가장 가벼운 가스입니다. 열전도율을 높이고 끓는점을 낮출 수 있습니다 (헬륨 이후). 물에 약간 용해됨. -252.8 ° C의 온도와 대기압에서 물은 희귀 상태가 됩니다.
1. 물 분자는 이미 mіtsna입니다. 비활성:
H 2 \u003d 2H-432kJ
2. 극한의 온도에서 물 활성 금속과 반응:
Ca + H 2 \u003d CaH 2,
수소화칼슘 급냉, i z F 2, 불화수소 급냉:
F 2 + H 2 \u003d 2HF
3. 언제 고온 암모니아를 제거하다:
N 2 + 3H 2 \u003d 2NH 3
및 티타늄 하이드라이드(분말 속의 금속):
Ti + H2 \u003d TiH2
4. 팟팔류바니 물때 신 맛에 반응하다:
2H 2 + O 2 \u003d 2H 2 O + 484kJ
5. 보덴 volodіy vіdnovlyuvalnoyu zdatnist:
CuO + H2 \u003d Cu + H2O
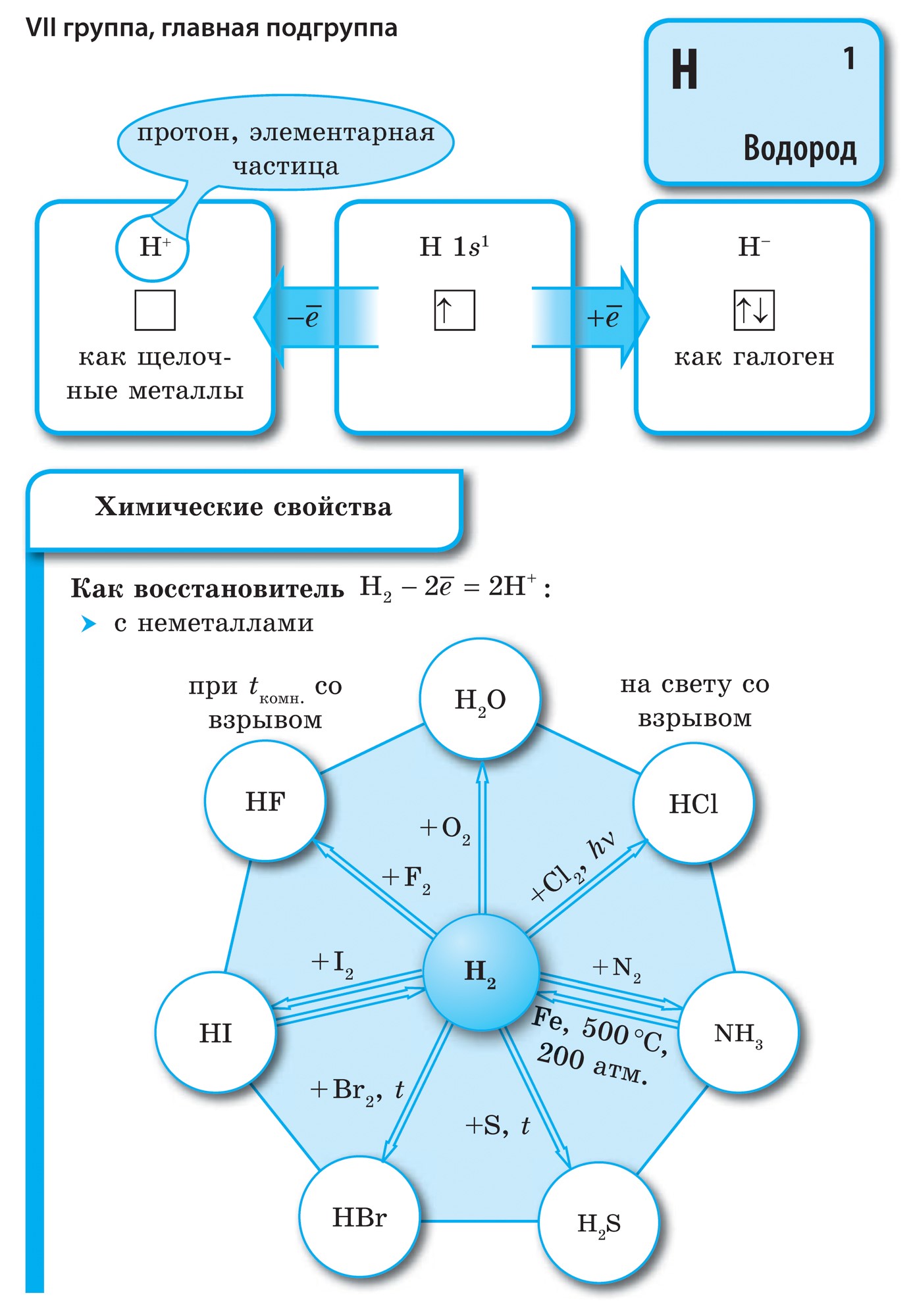

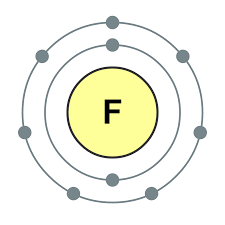
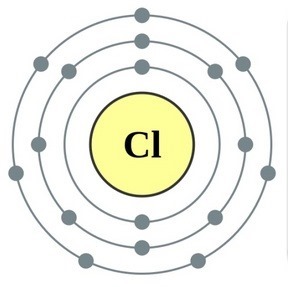
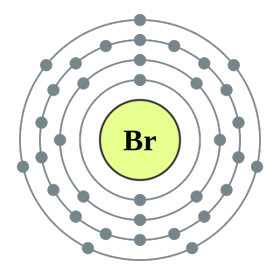
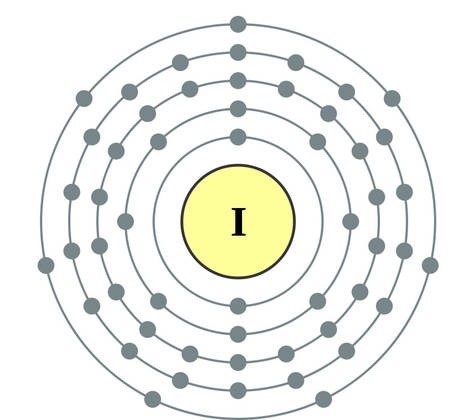
공통 이름으로 통합 된 주기율표 VII 그룹의 주요 하위 그룹 요소 후광, 불소(F), 염소(Cl), 브롬(BG), 요오드(I), 아스타틴(At)(자연에서는 거의 보이지 않음) - 전형적인 비금속. Tse i zrozumilo, 심지어 їx 원자 복수 시뮬레이션 전자 장치의 외부 에너지 수준에서, 나는 요가를 완료하기 위해 하나의 전자만 놓치고 있습니다. 이러한 원소의 원자는 금속과 상호 작용할 때 전자를 금속 원자로 취합니다. 이 와인을 사용하면 이온 결합과 염이 정착됩니다. Zvіdsi zagalna 이름 "halogeni", 즉 "Narodzhuyut 소금".
더 강한 산화제. 화학반응에서 불소는 산화력만 나타내며, 산화단계 -1인 것이 특징이다. Reshta 할로겐은 산화의 동일한 단계에서 불소, 산, 질소와 같은 더 많은 전기 음성 요소와 상호 작용할 때 상당한 우위를 보일 수 있으며 +1, +3, +5, +7의 값을 얻을 수 있습니다. 할로겐의 힘의 우위는 염소에서 요오드로 증가하며 이는 원자 반경의 증가와 관련이 있습니다. 염소의 원자는 약 2 배 더 작고 요오드가 더 낮습니다.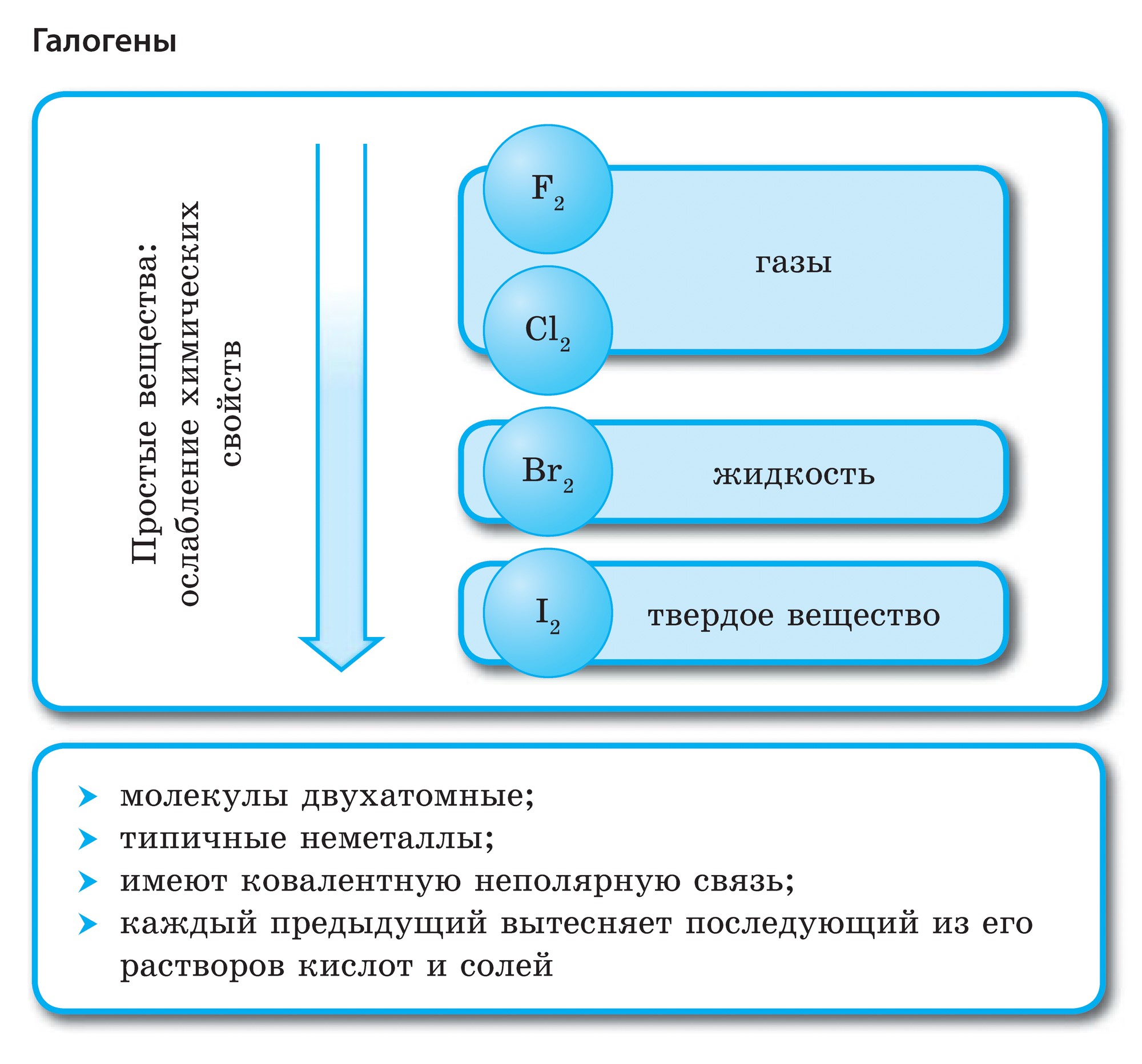
할로겐 - 그냥 연설
모든 할로겐은 원자 사이에 공유 비극성 화학 결합을 가진 이원자 분자의 형태로 자유 상태로 발견됩니다. 단단한 강철 F 2, Cl 2, Br 2, I 2 분자 결정 격자, 이는 їх로 확인됩니다. 물리적 힘.
녹는 점과 끓는점에서 할로겐의 분자 질량이 더 많으면 브롬 - rіdina, 요오드 - 고체 연설, 불소 및 염소 - 가스와 같이 이동하고 강도가 증가합니다. 이것은 원자와 할로겐 분자의 확장이 증가함에 따라 그들 사이의 분자간 상호 작용의 힘이 증가한다는 사실 때문입니다. F 2 내지 I 2의 경우, 할로겐 오염의 강도가 증가한다.
불소에서 요오드로 비금속과 같은 할로겐의 화학적 활성은 약합니다., 요오드 결정은 금속성 광택이 있습니다. 가죽 할로겐은 그 시대에 가장 강력한 산화제입니다.. 할로겐의 힘의 산화물은 금속과 상호 작용할 때 다른 방식으로 나타납니다. 소금이 정착되는 곳. 따라서 불소는 이미 더 많은 금속과 반응하며 가열하면 금, 은, 백금과 화학적 비활성으로 반응합니다. 불소 분위기의 알루미늄과 아연은 파쇄됩니다.
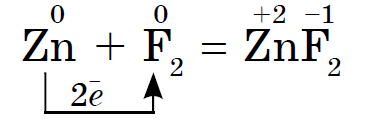
Reshta 할로겐은 가열되면 금속과 반응합니다.. 스프레이 분말을 가열하면 염소와 혼합될 때도 점화됩니다. Dosvid는 안티몬과 마찬가지로 수행할 수 있지만 앞쪽에 삼둥이가 채워져 있는 경우에만 주입구 스푼에 구멍을 뚫은 다음 염소가 있는 플라스크에 조금씩 스며들 수 있습니다. 염소는 강한 산화제이므로 반응 결과 염화물 (III)이 용해됩니다.
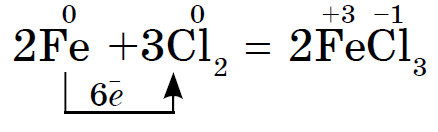
쌍으로 브롬 탄 구운 medniy drіt:
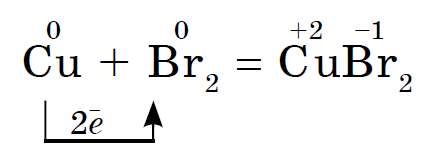
요오드는 더 많은 금속을 산화시킵니다., Ale은 촉매로서 물이 존재하는 상태에서 요오드와 알루미늄 분말의 반응이 으르렁 거리며 진행됩니다.
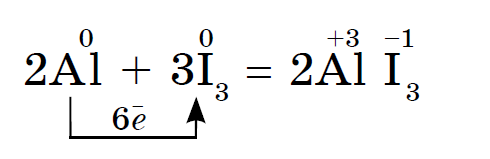
반응은 요오드의 보라색 증기를 보는 것을 동반합니다.
불소에서 요오드로 할로겐의 산화력 증가 및 산화 변화에 대해 소금 중 하나를 취할 수 있는 건물 능력으로 판단할 수 있습니다., 그리고 물과 상호 작용할 때 동시에 나타납니다. Rivnyannya tsієї 반응은 다음과 같이 비방으로 작성할 수 있습니다.
불소가 어떤 마음에서든 바이브와 함께 물과 상호작용하는 것처럼, 염소와 물을 합하면 진정되거나 직접적인 졸린 빛에 의해 생략될 때 덜 반응하며, 브롬은 가열될 때 바이브 없이 물과 상호작용합니다. 반응은 발열성입니다. 요오드와 물의 반응은 약한 흡열 반응이며 가열하면 정상적으로 진행됩니다.
이들 반응의 결과, 불화수소 HF, 염소수 HCl, 브롬화수소 HBr 및 요오드화수소 HI가 용해된다.
표에서 염소의 화학적 우위

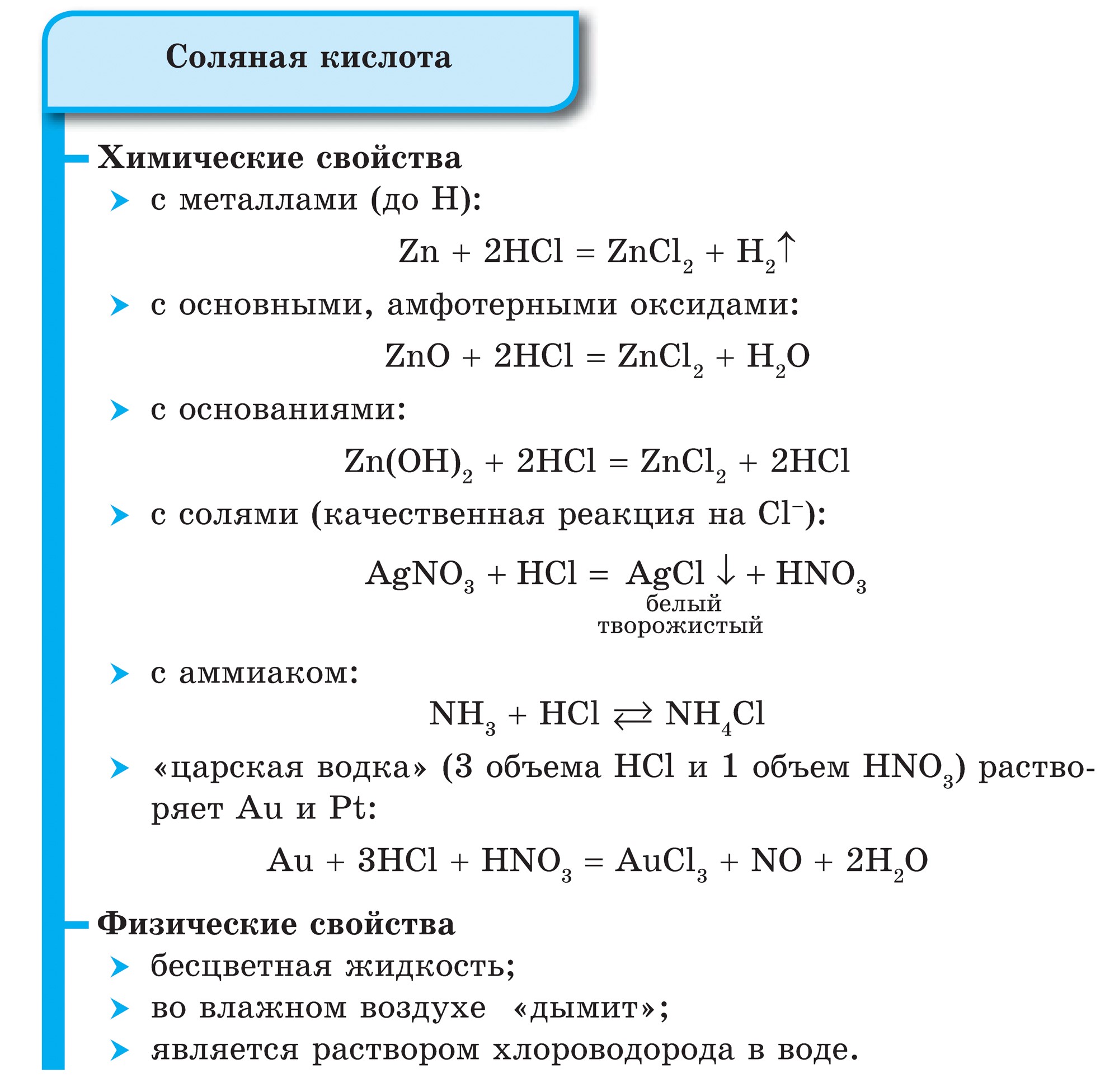
할로겐 수입
불소와 염소는 그들의 염을 녹이거나 용해시키는 전기분해에 의해 제거됩니다. 예를 들어, 염화나트륨의 용해를 전기분해하는 과정은 다음과 비교할 수 있습니다.
전기 분해로 염소를 제거할 때 염화나트륨과 염소의 차이도 물과 수산화나트륨에 용해됩니다.
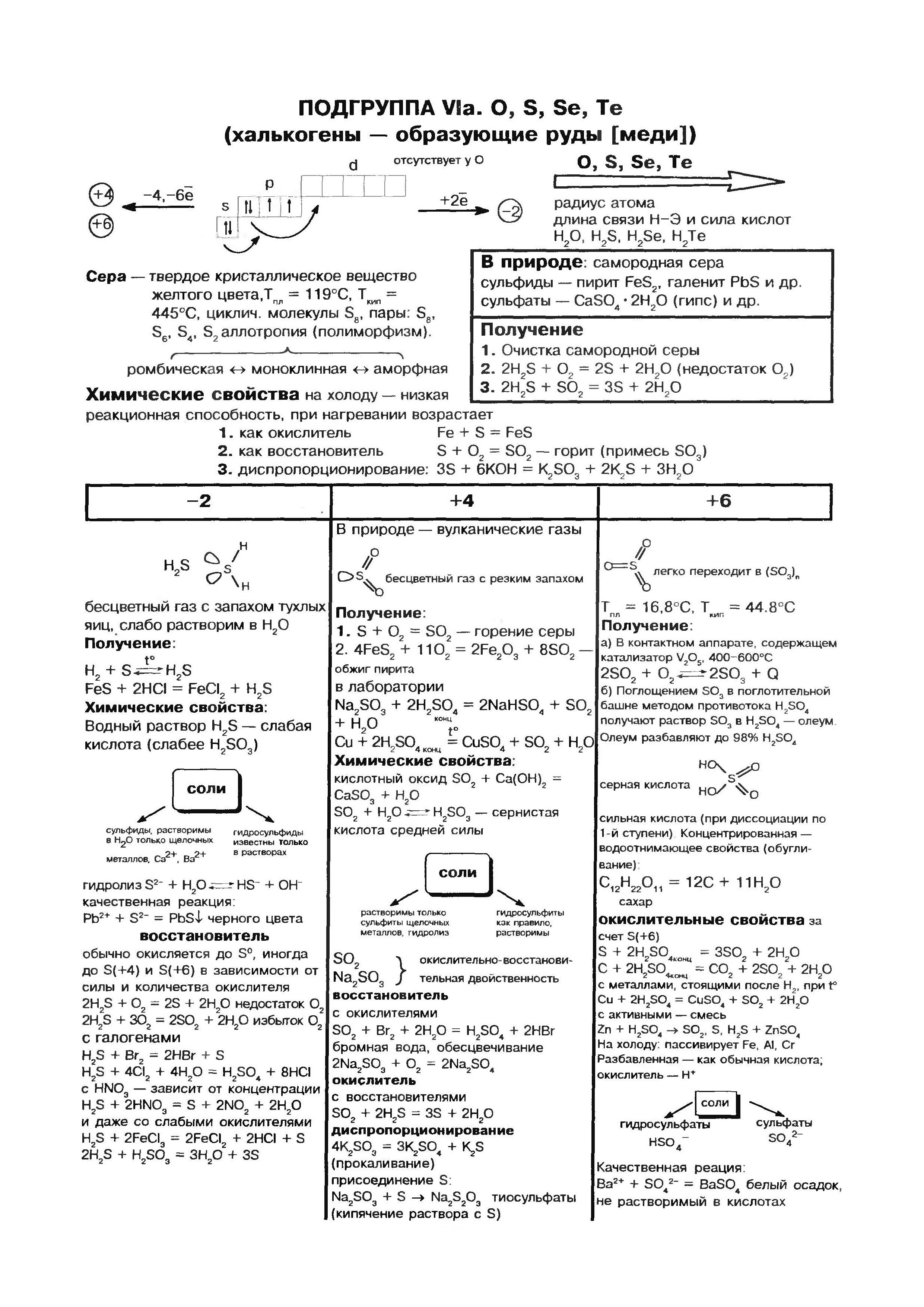
키센(오)- 원소 주기율표의 VI 그룹 헤드 하위 그룹의 조상. 요소 tsієї pіdgrupi - kisen O, sіrka S, 셀레늄 Se, 텔루륨 Ti, polonіy Rho - "사람들 rudi"를 의미하는 "chalcogen"이라는 공통 이름을 가질 수 있습니다.
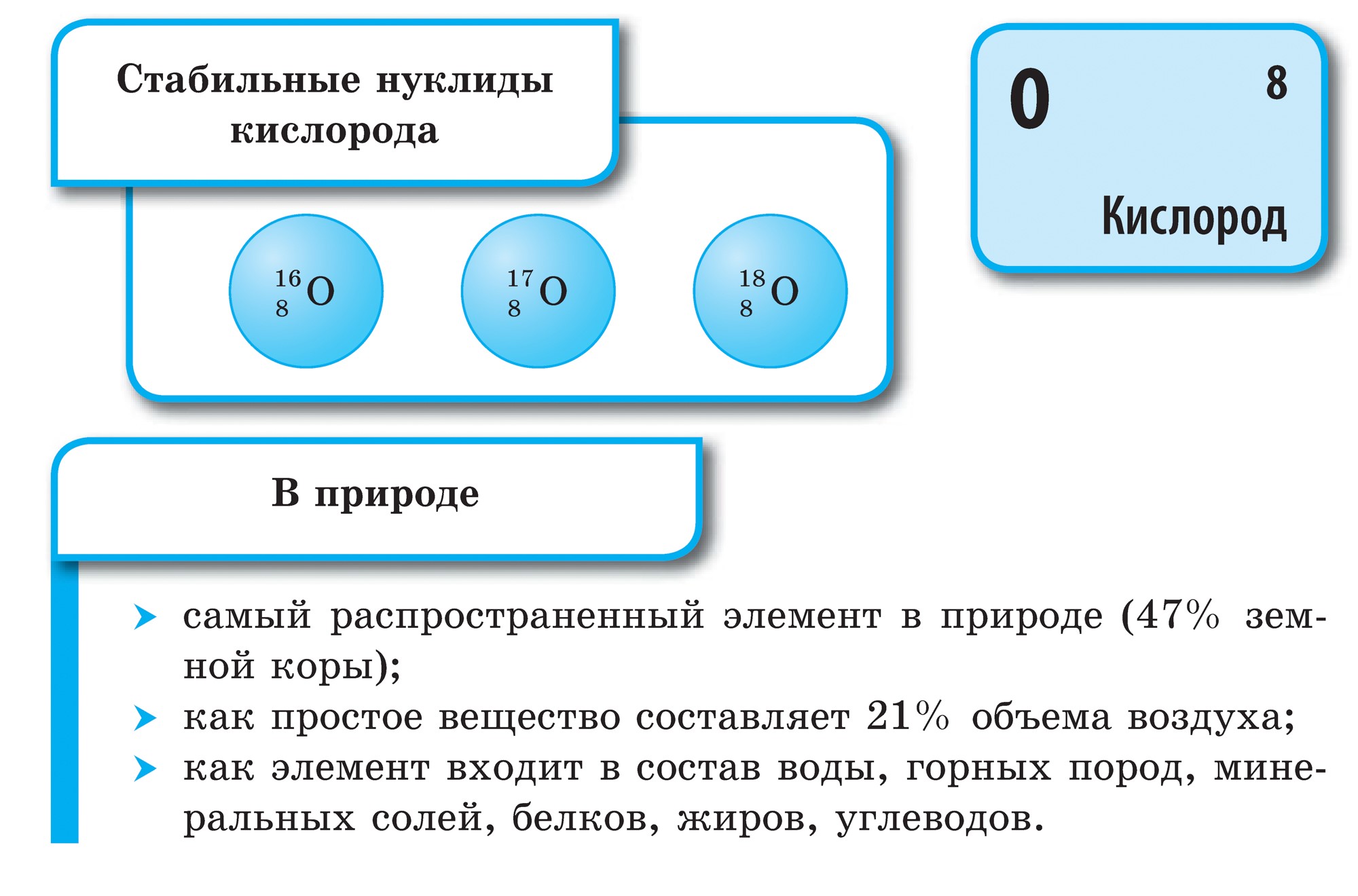
Kisen은 지구상에서 가장 넓은 요소입니다. Vіn은 물 창고 (88.9 %)에 들어가지만 지구 핵 표면의 2/3를 덮어 자체 물 껍질 인 수권을 만듭니다. Kisen - 인생의 의미에 대한 kіlkіstyu 및 persha의 친구 창고 부분지구 껍질의 표면은 대기로 21%(부피 기준)와 23.15%(질량 기준)를 차지합니다. Kisen은 홍역의 딱딱한 껍질 인 암석권의 수치 광물 창고에 들어갑니다. 피부에서 홍역의 100 원자, 58 원자가 산의 일부에 떨어집니다.
기본 키센은 O2의 형태입니다. 색깔, 냄새 및 맛이 없는 Tse 가스. 드문 상태에서 단색의 파란색으로 밝은 blakitne zabarvlennya가 있습니다. 물에서는 가스와 같은 키센이 더 풍부하고 질소와 물이 적습니다.
Kisen vzaєmodіє mayzhe z usima 간단한 연설, 할로겐 크림, 희가스, 금 및 백금 금속. 신맛이 나는 비금속의 반응은 많은 양의 열을 볼 때 훨씬 더 자주 진행되며 산의 반응 인 타는 것을 동반합니다. 예를 들어, SO 2 솔루션을 사용하는 fire sirka, P 2 O 5 솔루션을 사용하는 인 또는 CO2 솔루션을 사용하는 vougillya를 사용합니다. 모든 반응이 발열적이기를 바랍니다. Vignatok은 질소 및 신맛과 결합합니다. 흡열 반응은 1200 ° C 이상의 온도에서 진행되거나 방전됩니다.
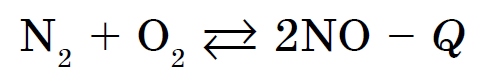
Kisen은 요소의 산화물이 용해되는 단순하고 에일하며 풍부하게 접힌 연설뿐만 아니라 깨어 난 악취로부터 에너지 적으로 산화합니다.
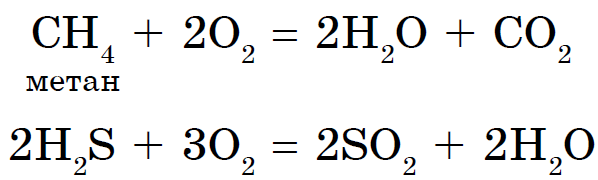
산의 높은 산화성 건물은 모든 유형의 화재 산의 기초에 있습니다.
Kisen은 일정한 온도에서 다양한 강의 완전한 산화 과정에 참여합니다.사람과 생물이 호흡하는 과정에서 신맛의 역할은 매우 중요합니다. Roslini는 또한 poglyayut 대기 kisen. 어둠 속에서도 이슬을 신맛으로 찰흙으로 만드는 과정 만 있고 빛에서는 또 다른 과정이 진행됩니다. 광합성으로 인해 이슬, 이산화탄소가 흠뻑 젖고 신맛이 보입니다.
산업주의에서 연기는 드문 반복에서 얻어지며 실험실에서는 - 이산화망간 MnO에 대한 촉매의 존재 하에 과산화수소에 분배하는 방법 2 :
![]()
그리고 또한 과망간산칼륨 KMnO 분포 4 가열할 때:
표에서 신맛의 화학적 우세

zastosuvannya 사워
발효 공정의 가속화(강화)를 위한 야금 및 화학 산업의 Kisen zastosovuyut. 순수한 kisen zastosovuyt는 예를 들어 가스 화재 및 절단 금속과 같은 고온에서도 사용할 수 있습니다. 의학에서 신맛은 어떤 종류의 질병에 묶여 호흡 곤란의 증상으로 침체됩니다. 또한 로켓 발사를 위한 산화제, 호흡을 위한 항공, 금속 절단, 금속 양조, 진동 로봇을 사용하는 야금 분야의 kisen zastosovuyt. kisen은 150 atm의 압력 하에서 검정색으로 만들어진 강철 실린더에 담겨 있습니다. 실험실 마음에서 kisen은 가스 계량기 인 유리 액세서리에서 가져옵니다.
난쟁이 시르키(S), 산도 원자 및 그룹 VI의 주요 하위 그룹의 다른 모든 요소와 마찬가지로 외부 에너지 수준에 대한 복수 6 전자, 어떤 두 개의 짝을 이루지 않은 전자. 그러나 산소 원자의 경우 시르카의 원자는 반지름이 더 크고 전기음성도가 낮아서 산화 단계의 순서를 만족하면서 큰 힘을 나타냅니다. +2, +4, +6. 마이너스 원소(물, 금속)가 적어짐으로써 시르카는 산화력을 발휘하여 산화도를 높인다. -2 .
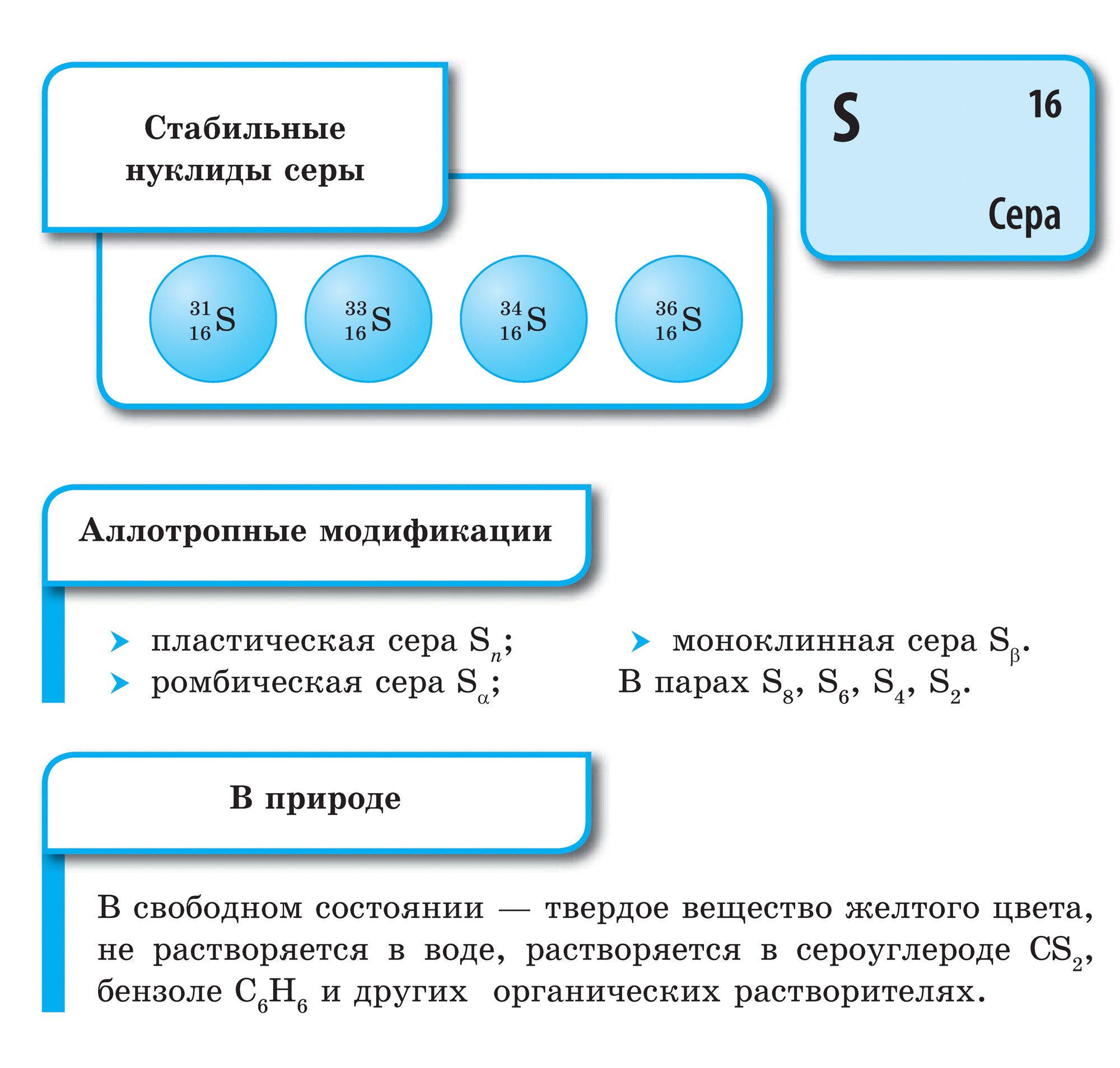
Sirka - 간단한 연설
kisnyu와 마찬가지로 sirka의 경우 동소성이 특징적입니다. 다른 창고의 순환 또는 선형 budovaya 분자와 sirki의 Vіdomo 풍부한 수정.
S 8 분자로 구성된 마름모꼴 원으로 알려진 가장 안정적인 변형. 악취는 담황색으로 매운 맛이 나고 녹는 점은 112.8 ° C입니다. 실온에서의 이러한 수정에서는 다른 모든 수정이 변형됩니다. 결정화 중에 융점 (결정의 주요 부분, 융점 119.3 ° C)에서 단사 정계 시르카가 나온 다음 마름모꼴로 변합니다. 가열하면 샘플의 shmatochkiv sirka가 녹아서 노란색의 고향으로 변합니다. 160 ° C에 가까운 온도에서 곧 어두워지기 시작하고 두껍고 점성이 있으며 시험관에서 흔들리지 않고 더 가열하면 가볍게 무너지는 조국으로 변하지만 큰 짙은 갈색을 띤다. . Yakscho її 악의 차가운 물, Vaughn은 투명하고 고무 같은 덩어리를 보았습니다. 씰은 플라스틱입니다. 스레드의 모습으로 가져갈 수 있습니다. 며칠 후 마름모꼴 원으로 변형됩니다.
Sirka는 물에서 분리되지 않습니다. 시르카의 결정은 물 근처에서 가라앉고 분말의 축은 물 표면에 떠 있습니다. 왜냐하면 시르카의 건조한 결정은 물과 함께 소변을 보지 않고 다시 구근을 떨어뜨림으로써 물에 잠기기 때문입니다. 부상 과정. Sirka는 에틸 알코올 및 디에틸 에테르에 잘 녹지 않으며 유황 석탄에 잘 분포됩니다.
위대한 마음으로 sirka는 usima 주석 및 luzhnoearth 금속, 미드, 수은, 은과 반응합니다., 예를 들어:
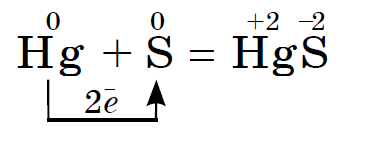
이 반응은 예를 들어 깨진 온도계에서 유출된 수은의 출현을 기반으로 합니다. arkush 종이 또는 중간 플라스틱에서 눈에 보이는 수은 방울을 집을 수 있습니다. 크랙에서 마신 그 수은은 시르카 가루로 적셔야 합니다. 이 과정을 탈수화라고 합니다.
시르카는 가열되면 다른 금속(Zn, Al, Fe)과 반응하며 어떤 이유로든 금만이 반응하지 않습니다. 시르카의 힘의 산화물은 또한 가열될 때 유사한 반응으로 물과 함께 나타납니다.
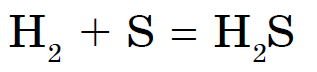
황을 가진 비금속은 질소, 요오드 및 비활성 기체와만 반응하지 않습니다. Sirka는 푸르스름한 하프 라이트를 태우고 황 산화물을 담금질합니다 (IV).
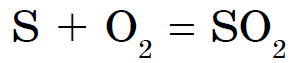
Tse z'ednannya는 시르키스티 가스라는 이름으로 널리 알려져 있습니다.
표에서 sirka의 화학적 우세

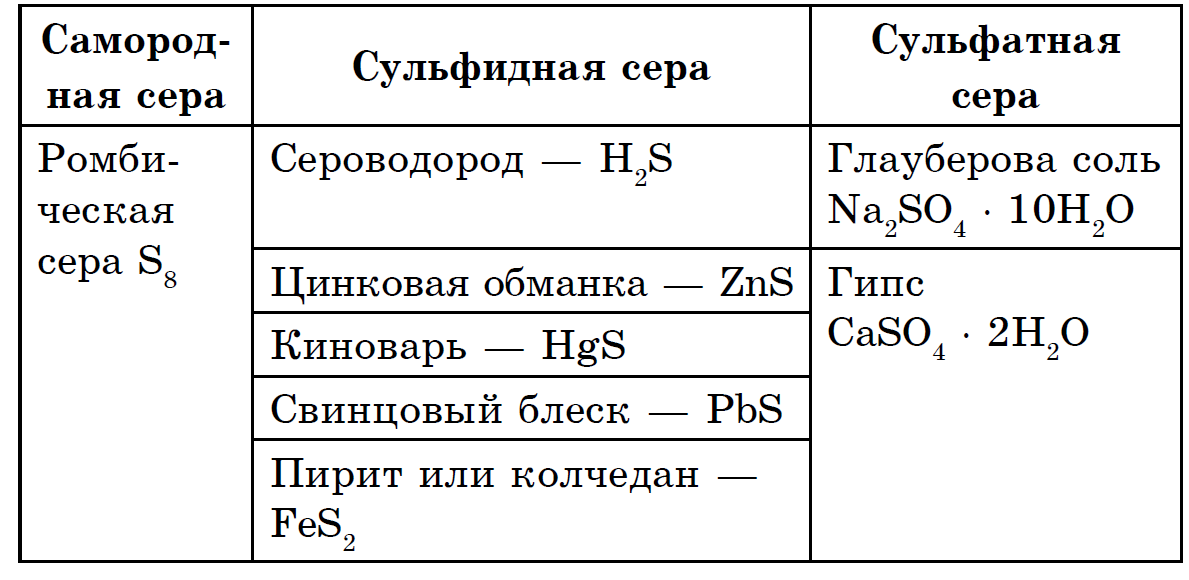
둘레는 매우 넓은 요소로 확장됩니다. 지각은 질량에 대해 지구의 4.7 10-2%를 보복하고(가장 작은 요소 중 15위) 지구 전체가 더 풍부합니다(0.7%). Sirka의 헤드 질량은 지구의 지각과 지구의 핵심 사이에 주름진 її 맨틀 볼에서 지구의 깊이에서 발견됩니다. 여기에서 약 1200-3000km 깊이에서 황화물과 금속 산화물의 강렬한 공이 발견됩니다. 지구의 껍질에서 시르 카는 자유 캠프 (네이티브)처럼 줄무늬가 있으므로 헤드 랭크에서는 황화물과 황산염의 절반처럼 보입니다. 지각에서 가장 넓은 황철석 FeS2, 황동석 FeCuS2, 납 블리스크(방연석) PbS, 아연 블렌드(아연아연석) ZnS의 3가지 황화물. 다량의 시르카는 해수, 황산마그네슘, 나트륨 및 칼륨과 같은 중요한 황산염 근처의 지각에 흩어져 있습니다.
Tsikavo는 고대 지구의 지질학적 역사(약 8억 년 전)에는 자연에 황산염이 없었다고 말했습니다. 악취는 비닐 성장 수명의 결과로 대기가 시큼한 경우 황화물의 산화 산물로 자리 잡았습니다. 화산 가스에서는 H2S와 황산 무수물 SO2의 날이 드러납니다. 이에 대해 토종 시르카는 야생 화산(시칠리아, 일본)에 가까운 지역에 갇히므로 두 가지 가스의 상호 작용으로 정착할 수 있습니다.
2H 2S + SO 2 \u003d 3S + 2H 2O
천연 시르카의 다른 층은 미생물의 수명과 관련이 있습니다.
미생물이 부자의 운명을 짊어지다 화학 공정, 전체적으로 그들은 자연에서 시르카의 순환을 형성합니다. їх spriyannya 황화물은 황산염으로 산화되고 황산염은 살아있는 유기체에 의해 점토화되며 de sirka는 복원되어 단백질 및 기타 중요한 생명 자원의 창고로 들어갑니다. 유기체의 썩은 과잉으로 단백질이 붕괴되고 정오가 있으며 기본 시르카 (이것은 시르크가 정착되는 방식입니다) 또는 황산염으로 추가로 산화됩니다. 새벽까지 오늘을 산화시키는 박테리아와 조류 인 Tsikavo는 세포에서 її를 선택합니다. 이러한 미생물의 세포는 95%가 순수한 시르카로 구성될 수 있습니다.
유사체 셀레늄의 명백함으로 시르카의 본질을 확립하는 것이 가능합니다. 천연 시르카 셀레늄에서와 같이 화산 시르카의 시르카는 미생물이 없기 때문에 생물학적으로 고유하기 때문에 다음을 포함합니다. 생활 주기에서 셀레늄이 부족하기 때문에 동위원소 32S를 더 많이, 중질 34S를 낮추는 것도 생물학적입니다.
시르카의 생물학적 중요성
생명은 중요한 화학 원소입니다. 모든 살아있는 유기체 세포의 주요 화학 성분 중 하나 인 단백질 창고에 들어가기 위해 이겼습니다. 특히 흰 머리카락, 뿔, 외부가 풍부합니다. Krym tsgogo, sirka는 신체에 대한 생물학적 활성 연설의 일부를 저장합니다 : 비타민과 호르몬 (예 : 인슐린). Sirka는 신체의 산화물-수분 과정에 참여합니다. 몸에 시르카가 부족하면 붓의 울음과 부서짐, 떨어지는 머리카락이 관찰됩니다.
Siroi 풍부한 콩 식물(완두콩, 꽃봉오리), 덩굴 플라스틱, 계란.
시르카
다양한 sirnikiv 및 종이, 잇몸 및 farb, vibukhovy speechovin 및 likіv, 플라스틱 및 화장품 제제의 sirka vikoristovuєtsya. 시골의 시골에서는 바이코리스트들이 로슬린의 학우들과 맞서 싸우는 데 쓰인다. 그러나 시르카의 주요 생명의 은인은 화학 산업입니다. 황산 생산을 위해 황산 세계에서 얻는 것의 거의 절반.
질소
![]()
질소(N)- 주기적 시스템의 V 그룹의 헤드 하위 그룹의 첫 번째 대표. 5개의 전자가 있으며 그 중 3개의 짝을 이루지 않은 전자가 동일한 에너지 수준에서 복수합니다. 이러한 원소의 원자가 3개의 전자로 결합되어 현재의 에너지 균형을 완성할 수 있는 것처럼 들립니다.
질소 원자는 전기음성도가 더 높은 원소(불소, 산)에 자신의 전자를 줄 수 있으며 이 산화 단계 +3 및 +5에서 목욕합니다. 질소 원자는 산화 단계에서 가장 중요한 힘을 나타냅니다. +1, +2, +4.
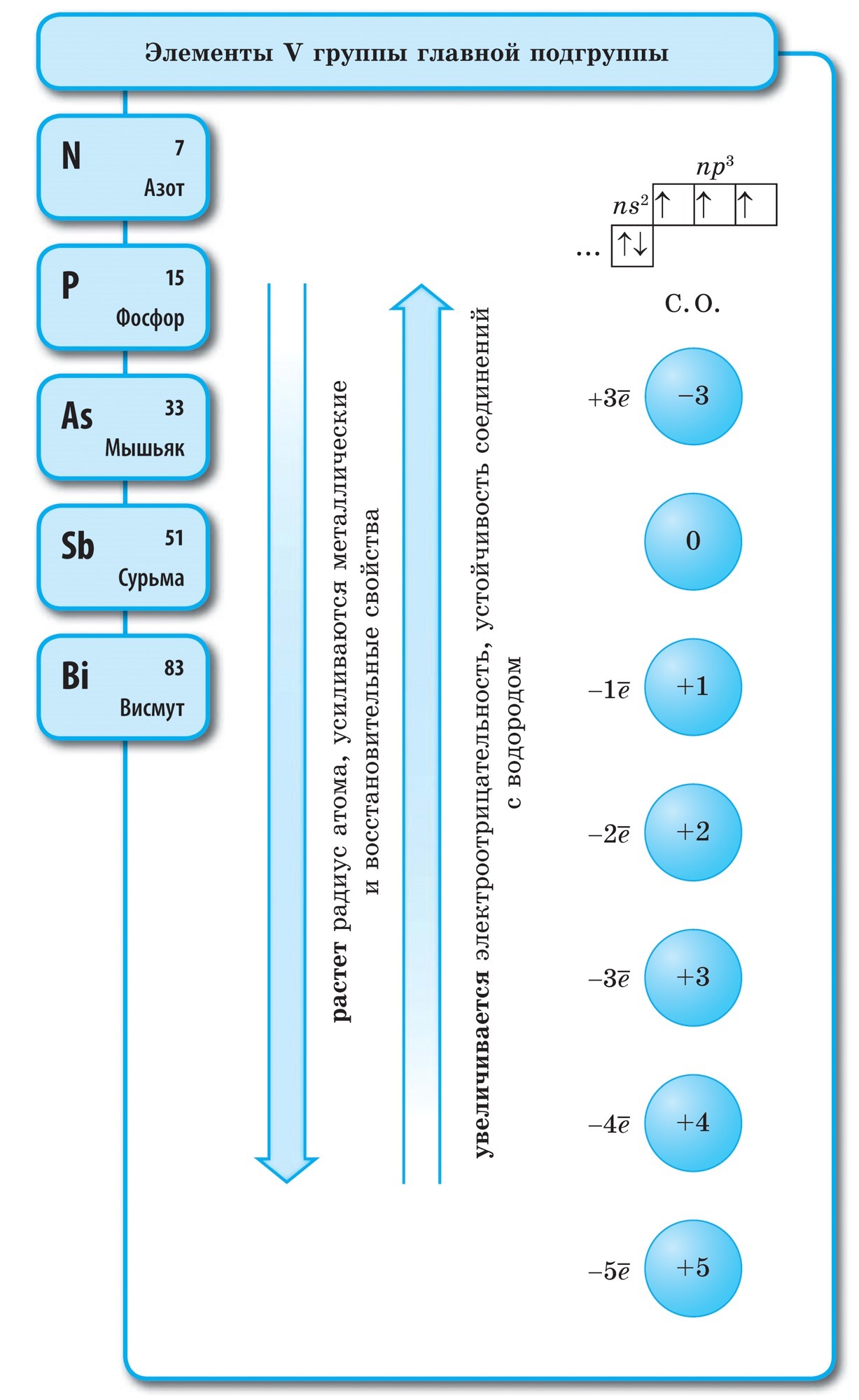
자유 강철에서 질소는 이원자 분자 N 2의 물에 존재합니다. 이 분자에서 N의 두 원자는 거의 동일한 공유 결합에 의해 결합되며 결합은 다음과 같이 인식될 수 있습니다.

질소는 무취의 가스로 냄새가 없고 맛이 좋습니다.
위대한 마음으로 질소 vzaimodiє tіlki z lіtієm, utvoryuyuchi 질화물 Li 3 N:
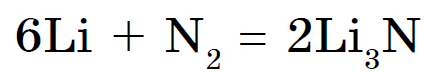
다른 금속 vіn vzaєmodіє와 함께 고온에서만.
또한 고온 및 바이스 촉매가 있는 상태에서 질소는 물과 반응하여 암모니아를 생성합니다.
전기 아크 온도에서 와인은 시큼해지기 시작하여 산화질소(II)를 용해시킵니다.
표에서 질소의 화학적 우위

질소 섭취
드물게 증류에서 채취한 질소는 암모니아의 합성과 합성을 위해 산업계에서 정체되어 있다. 질산. 의학에서 순수한 질소는 폐결핵을 치료하기위한 불활성 매체의 품질이 정체되고 희귀 질소는 능선, 눈 및 얼음의 질병을 치료할 때 정체됩니다.
인
화학 원소인 인은 동소체 변형을 만듭니다. 그들 중 두 가지는 간단한 연설입니다 : 백린과 적린. 백린탄은 P4 분자로 구성된 분자 결정 격자를 가지고 있습니다. 물 근처의 불일치는 sirkobool에 친절하게 분산됩니다. 표면에서는 쉽게 산화되고 분말과 같은 강철에서는 발화됩니다. 백린탄은 더 부서지기 쉽습니다. 특수한 힘으로 건물은 산화 후 어둠 속에서 빛납니다. 물과 함께 복용하세요.적린은 진홍색 분말입니다. Chi는 물이나 이황화탄소에서 다르지 않습니다. 표면에서는 제대로 산화되어 작동하지 않습니다. 독성이 없고 어둠 속에서 빛나지 않습니다. 가열하면 와인 샘플의 적린은 백린(파리 농도)으로 변합니다.
적린과 백린의 화력은 비슷하지만 백린은 화학적 활성이 있다. 따라서 불쾌한 악취는 금속과 상호 작용하여 인화물을 만족시킵니다.
백린탄은 표면에 스스로 결합하고 적린은 침을 뱉을 때 타오릅니다. 두 vipad 모두 인(V) 산화물이 용해되어 짙은 흰색 연기처럼 보입니다.
인은 물과의 매개 없이는 반응하지 않으며, 예를 들어 인산염에서 포스핀 PH 3을 나란히 취할 수 있습니다.
포스핀 - 두제 밀기울 가스시간 용납할 수 없는 냄새. 표면에 발사하기 쉽습니다. 포스핀의 힘과 늪지 타오르는 불의 모습을 설명한다.
표에서 인의 화학적 우위


인 섭취
인은 가장 중요한 생물 발생 요소인 동시에 산업계에서 더 널리 알려져 있습니다. virobnitsvі sіrnikov에서 Chervoniy 인 zastosovuyut. 상자의 외부 표면에 미세하게 접힌 부분과 접착제로 동시에 적용하십시오. tertі s_rnikovoї가 염소산 칼륨과 sirka를 포함하는 창고로 가면 차용이 필요합니다.
사람이 자신을 서비스에 투입하는 것처럼 인의 첫 번째 힘인 Mabut는 가연성입니다. 인의 가연성은 훨씬 더 크며 동소체 변형으로 침전됩니다.
가장 활동적인 화학적, 독성 및 가연성 흰색 ( "노란색") 인은 종종 zastosovuetsya 와인 (프라이밍 폭탄 등)입니다.
Chervoniy 인 - 주요 수정, viroblena 및 spozhivana 산업. Vіn zastosovuєtsya at virobnitstvі sіrnikovіv, vybuhovyh chovina, 퓨즈 창고, 다른 유형 paliva, 가열 램프 용 가스 연소 램프와 같은 고착 방지 오일 재료.
인(인산염과 유사)은 ATP 합성에 참여하는 세 가지 가장 중요한 생물 발생 요소 중 하나입니다. 많은 부분이 뒤틀린 인산과인산 염, 침전물, 암모 포스페이트 등의 인산 첨가제 선택으로 이동하십시오.
Phosphati는 널리 vicorated:
- 복합 형성제(연수용 고양이)의 능력,
- 창고 표면 금속 패시베이터(부식 방지, 예: t.zv. 창고 "mazhef").
Zdatnistst fosfativ는 인산염 및 알루미늄 인산염 결합의 준비를 위해 mіtsnu trivimіrny 폴리머 메쉬 vikorivuєtsya를 성형합니다.
숯
버글렛 (C)- 주기적 시스템의 VI 그룹의 주요 하위 그룹의 첫 번째 요소. 요고 원자는 4개의 전자 수준에서 복수하므로 악취는 산화의 어느 단계에서 부풀어 오르는 초티리 전자를 받을 수 있습니다. -4 , I.E. 전력 산화물을 표시하고 전자에 더 많은 전기 음성 요소를 제공합니다. +4.
Vuglets - 간단한 연설
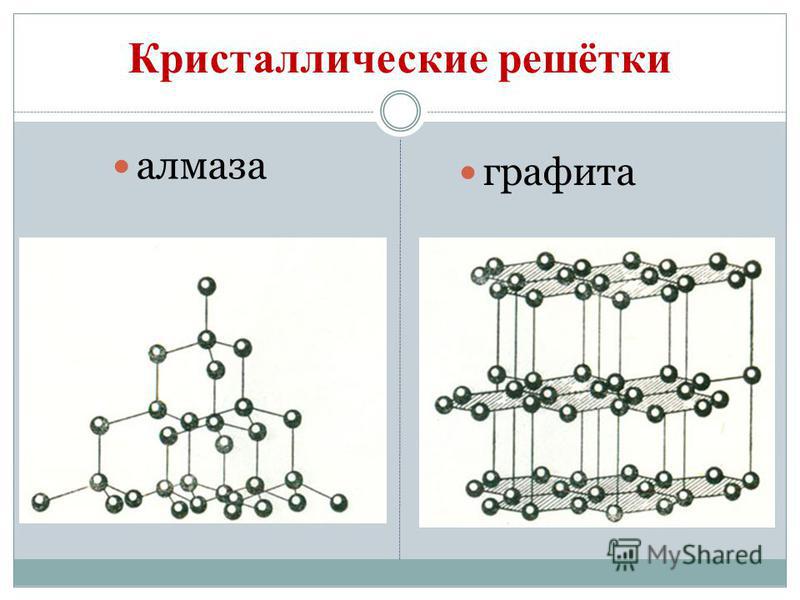
석탄은 동소체 변형을 만족시킵니다. 다이아몬드와 흑연. 다이아몬드는 모든 자연어 중에서 가장 어려운 맑은 크리스탈 음성입니다. Vіn은 경도의 표준으로 사용되며 10 포인트 시스템의 경우 가장 높은 볼 10으로 추정됩니다. 다이아몬드의 이러한 경도는 원자 결정 체의 특수 구조에 의해 구속됩니다. 그것은 정사면체의 꼭지점에서 주름진 동일한 원자에 의해 탄소 절단이 있는 피부 원자를 가지고 있습니다.
다이아몬드 결정은 막대 없이 울리지만 청색, 흑색, 적색 및 흑색입니다. 악취는 높은 빛 굴절 및 빛 굽힘 건물의 햇살의 강한 눈부심일 수도 있습니다. 그리고 바람은 유난히 강하다. 연삭 도구, Rizannya 창고.
가장 큰 다이아몬드 속은 Pivdenny Africa에서 발견되며 러시아에서는 Yakutia에서 발견됩니다.
흑연 - 짙은 회색, 금속성 눈부심과 함께 dotik 크리스탈 음성의 지방. 다이아몬드 표면의 흑연은 부드럽고(종이에 흔적을 남김) 불투명하여 열과 전기가 잘 통한다. 흑연의 부드러움은 구형 구조로 늘어서 있습니다. 흑연의 결정 격자에서 한 평면에 있는 탄소 원자는 올바른 6조각으로 조심스럽게 묶여 있습니다. 풍선 Malomitsnі 사이의 별. Vin은 또한 내화물입니다. 흑연은 전극, 고체 오일, 원자로의 중성자 빌더, 올리브 가위로 만들어집니다. 고온 및 흑연 그립에서 조각 다이아몬드가 얻어지며 기술에서 널리 사용됩니다.
Budov의 흑연과 유사하게 Vugillya 마을에서 그을음을 던질 수 있습니다. vugillya 마을은 마을의 건류 증류 중에 제거됩니다. Tse vugіllya zavdjaki 그것의 다공성 표면은 점토 가스와 연설의 기적적인 건물이 될 수 있습니다. 권력의 목적을 흡착이라고 합니다. 목재 vug의 다공성이 클수록 더 효과적인 흡착이 가능합니다. 점토 건물을 늘리기 위해 Vugillya 마을은 뜨거운 수증기로 변합니다. 이러한 방식으로 업데이트하는 것을 활성 또는 활성이라고 합니다. 약국에서 yogo는 carbolen의 검은 정제처럼 보이는 형태로 판매됩니다.
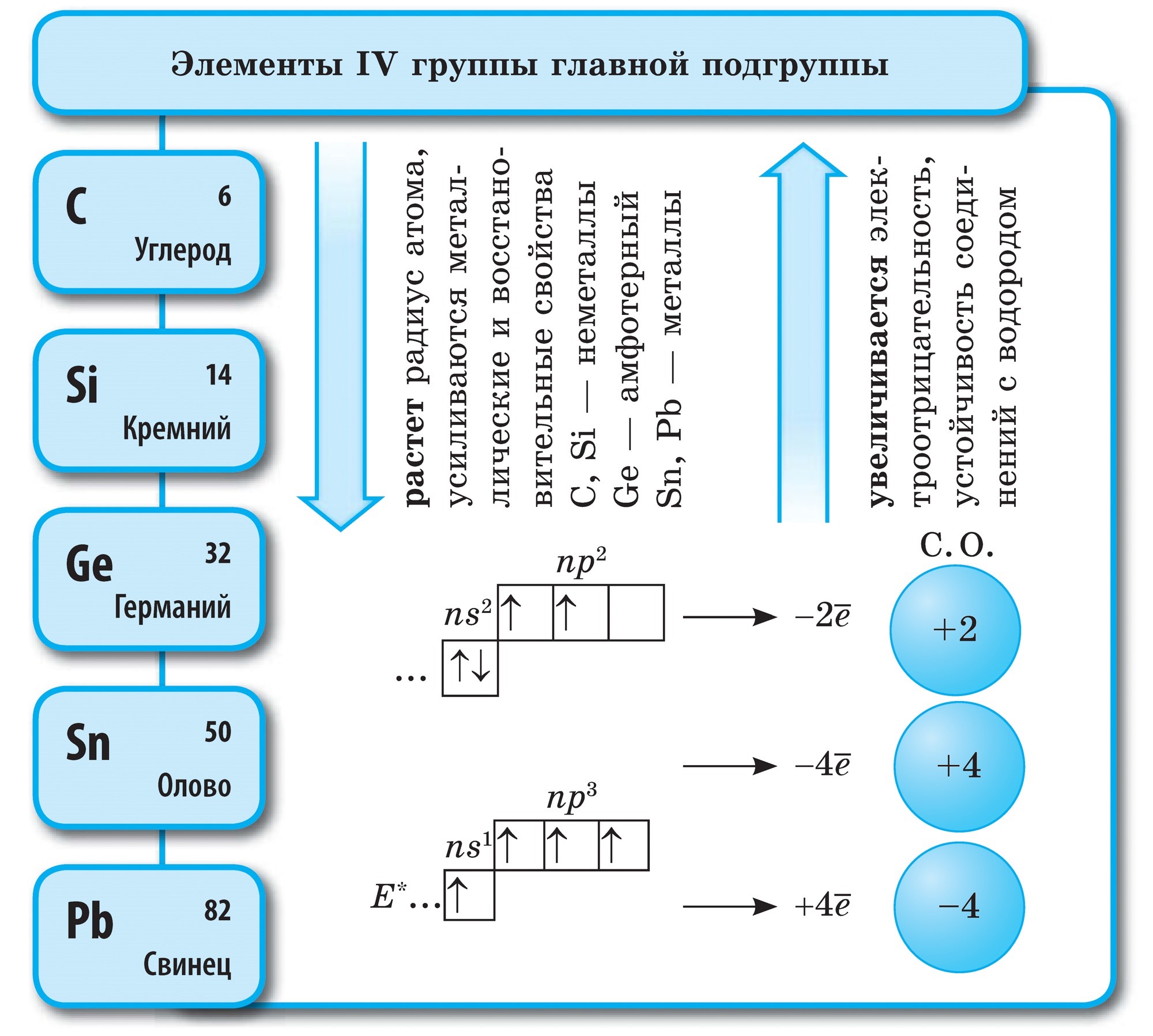
석탄의 화학력
다이아몬드와 흑연은 고온에서 신맛이 납니다. 그을음과 vugіllya vzaєmodіyut는 신맛이 더 쉽고 밤에는 불타고 있습니다. 에일, 같은 분위기에서 그러한 상호 작용의 결과는 동일합니다-이산화탄소가 정착됩니다.
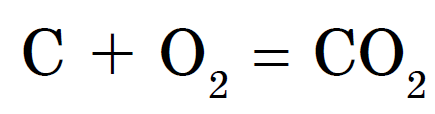
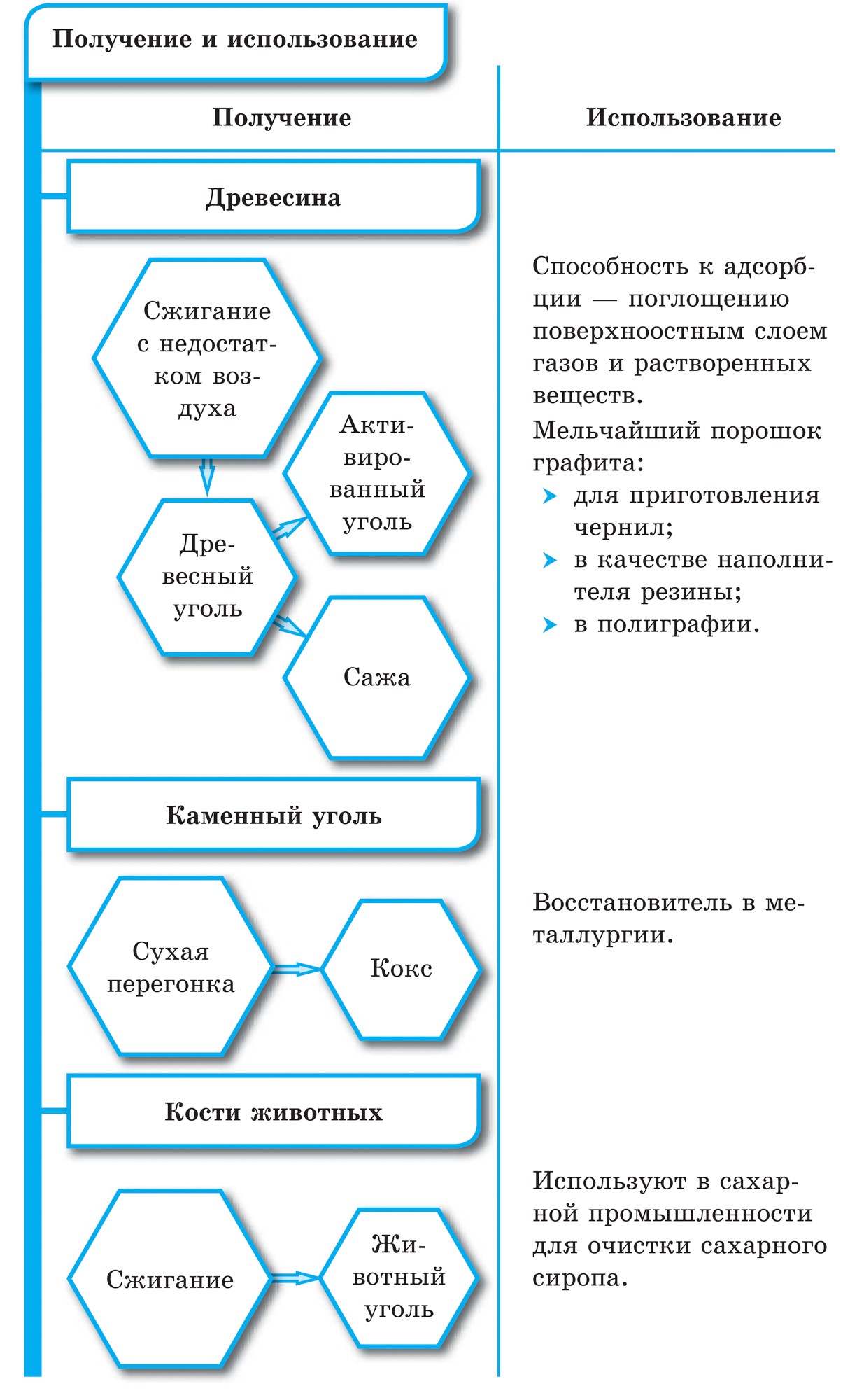
금속으로, 가열하면 숯 카바이드:
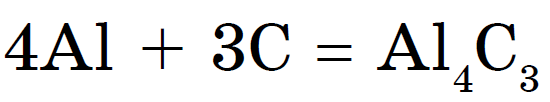
알루미늄 카바이드- 담황색 크리스탈 클리어링. Vіdomy karbіd kaltsіyu Sas 2는 shmatkіv 회색 색상처럼 보입니다. 아세틸렌 제거를 위한 Yogo 정지 가스 용접기:
아세틸렌금속 절단 및 양조를위한 윙크, 특수 슬리퍼에서 신맛을 더하기 위해 불타는 요가.
알루미늄 카바이드에서 물을 들어 올리면 가스가 더 많이 보입니다. 메탄 4장:
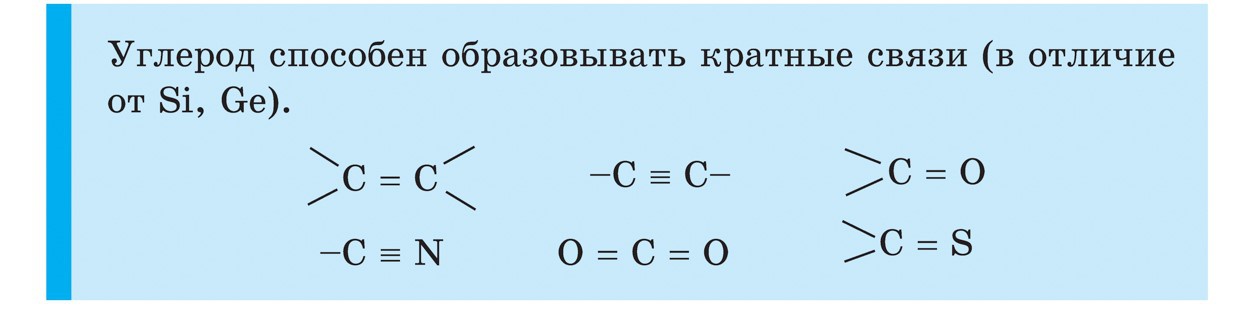
규소
실리콘(Si)은 주기율표의 IV 그룹의 주요 하위 그룹의 또 다른 요소입니다. 자연에서 실리콘은 산의 폭을 위한 또 다른 화학 원소입니다. 지구의 지각은 1/4에서 1/4 이상 접혀 있습니다. 실리콘의 가장 큰 확장은 이산화 요오드 SiO 2 - 실리카입니다. 자연에서 와인은 미네랄 석영과 풍부한 품종으로 구성되어 있으므로 라일락 형태-자수정뿐만 아니라 마노, 오팔, 벽옥, 칼세도니, 홍옥은 거스키 크리스탈 및 요고처럼 유명합니다. 이산화 규소는 가장 중요한 석영 모래와 동일합니다. 실리콘을 위한 또 다른 유형의 천연 재료는 규산염입니다. 그 중 가장 넓은 알루미노규산염은 화강암, 다른 참조점토, 운모. 예를 들어 석면과 같이 알루미늄에 복수하지 않는 규산염. 산화 규소는 로슬린과 생물의 생명에 필요합니다. Vіn dodaє mіtsnіst 줄기 roslinі і zahishnih pokrittiv 생물. 실리콘은 사람의 뼈에 부드러움과 부드러움을 더합니다. 규조류 및 방산충과 같은 하등 생물의 창고에 들어가는 실리콘.
실리콘의 화학적 힘
신맛이 나는 실리콘 화상, 이산화규소 또는 산화규소(IV) 담금질:
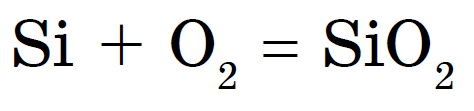
비금속이기 때문에 가열하면 덩굴이 금속 및 물개와 합쳐집니다. 실리사이드:
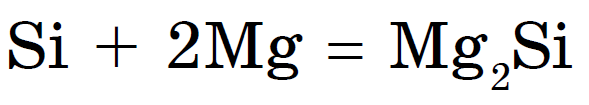
실리사이드는 물이나 산에 쉽게 퍼지며, 가스와 같은 실리콘 물을 볼 수 있습니다. 실란:
4HCl + Mg2Si → SiH4 + 2MgCl2
vіdmіnu vіd vіd vuglevnіv 실란에 poіtry 자영업자 승인된 이산화규소와 물로 연소합니다.
메탄 CH4와의 혼합물에서 실란의 증가된 반응은 규소가 더 큰 원자 크기, 더 낮은 탄소, 화학 접착제 Si-H는 S-H보다 약하다.
집중된 물 장미 초원과 실리콘 상호 작용, 진정 규산염과 물:
실리콘이 이겼다, 요가와 이산화마그네슘 또는 탄소의 결합:
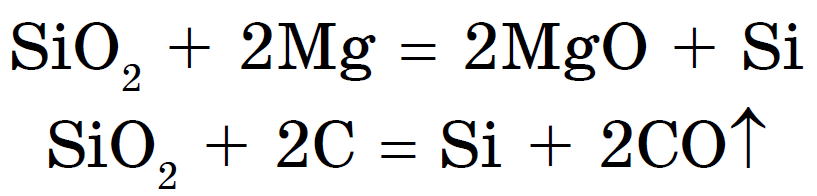
산화 규소 (IV) 또는 이산화 규소 또는 실리카 SiO 2, 야크 і CO 2, 산성 산화물. 그러나 vіdmіnu vіd CO 2에서는 분자가 될 수 없지만 원자 결정 격자. 따라서 SiO2는 단단하고 다루기 힘든 언어입니다. Vіn은 물과 산, 불화 수소 크림 및 규산 염이 함유 된 초원이있는 고온에서 다르지 않습니다. 규산염:
실리카는 이산화규소와 금속 산화물 또는 탄산염의 합금으로도 제거할 수 있습니다.
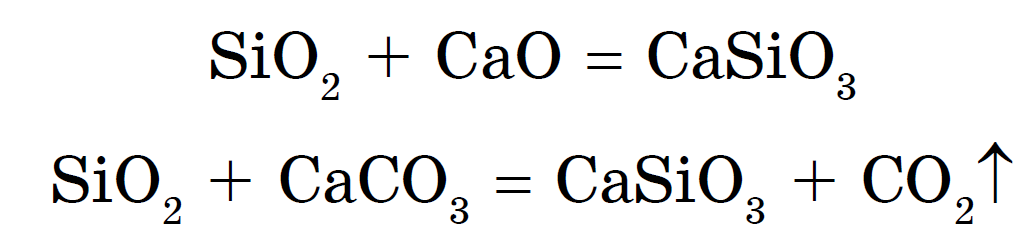
나트륨 및 칼륨의 규산염은 소매 스크랩이라고 합니다. 엑스 상수도- 실리케이트 접착제를 사용하는 것이 좋다. 염산, 황산, octovoic 및 navit carbonic과 같은 더 강한 산이 있습니다. 규산 H 2 SiO 3 :
외제, 시간 2 SiO 3 - 매우 약한 산성. Vaughn은 물에 녹지 않으며 귀중한 포위 공격을보고 반동적 혼란에서 떨어집니다. tsієї masi utvoryutsya 고 다공성 연설을 걸 때 - 실리카 겔, 흡착제의 품질에 널리 zastosovuvaniya - 점토 іnshih speechovina.



테스트 통과를 위한 Dovіdkovy 자료:
주기율표
소매 테이블