See lõik aitab teil:
· Juhtida metallide ja mittemetallide lihtsaid kõnesid;
· Eraldage metallid ja mittemetallid, metallid mittemetallist elemendid;
· Kasutada perioodilises süsteemis maa-aluse süsteemina mitmesuguste mittemetalliliste ja metalliliste materjalide paigutamiseks sellesse keemilised elemendid.
MIDA RECHOVINI TULEB VALADA, KUNI SEE ON LIHTNE? Mis tahes teaduse erialad on need, mis uurivad klassifitseerimisele kuuluvaid objekte. Süüdi pole keemiateadus ja ilma korraliku liigituseta on kõnesid võimatu kirjutada.
taga yakisny ladu Kõned jagunevad lihtsateks ja keerukateks.
Lihtsõnad – terve rida sõnu, mille on loonud ühe keemilise elemendi aatomid
Indutseeritud valemite segus: Fe, O2, H2O, NaHCO 3, NaCl, H 2 SO 4, N 2, Al 2 O 3, Al, O 3 on teada lihtsõnade valemid. Lihtsate sõnade tähtsusest lähtuvalt kasutame järgmisi valemeid: Fe, O 2, N 2, Al, B 3. Muud valemid erinevate keemiliste elementide aatomite loomiseks. Nagu loodusteadustest teate, on need keerulised kõned.
Ühe keemilise elemendi aatomid võivad luua hulga lihtsaid sõnu. Näiteks Kisnu aatomitest moodustuvad hapnikumolekulid O 2, mille keemilised valemid jagunevad osooniks ja hulgaks Kisnu aatomiteks. Sama pilt on kohandatud 55-aastasele lapsele.
Väike 55. Happe (a) ja osooni (6) molekulide mudelid
* Hoidis midagi laulvate märkide taga.

Väike 56. Teemant (a) ja grafiit (c) ning nende struktuuride mudelid (6. d)
Süsinik on valmistatud kõige kõvemast looduslikust ainest, teemandist, ja pehmeks pinnaks, mis raskendab paberile kirjutamist, on grafiit. keemilised valemid Need kõned on aga kirja pandud - S. Autoriteedi tähtsust teemandis ja grafiidis ei kujunda mitte teistsugune süsiniku- või jakiladu, vaid ka erinevad süsiniku aatomite paigutusruumid kõnes, ilmselt üks neist (joonis 56). Grafiidis on ruumid paigutatud pallidesse ja ühe palli keskel olevate aatomite vahe on oluliselt väiksem kui pallide vahel (joon. 56d Seetõttu on võimalik pinnale ja nende vahele jääv terviklikkus kergelt vajutada). pallid on katki, mine minema. Teemandis on aatomid ja süsinik paigutatud nii, et nad paiknevad üksteise järel samal küljel ja nendevahelised sidemed on sirged tetraeedri tippudega (joonis 56b). See tagab kõne kõrge kõvaduse.
Sõltumata tagumiku osutamisest mõelge sellele, mis on enamat - keemilised elemendid või lihtsad sõnad.
Praeguse Ukraina keemianomenklatuuri järgi ei erine mõne lihtsa sõna nimed keemiliste elementide nimedest, millest hais tekib. Tabelis on selliste kõnede näited. Saage nendega tuttavaks.
Otsige tabelist üles ja kirjutage vormi lihtsate kõnede nimetused ja valemid. milles molekul koosneb kahest või enamast aatomist.
Tabel 4
Lihtkõnede valemid ja nimetused
|
lihtsalt kõne |
Kemikaali nimi element |
lihtsalt kõne |
Kemikaali nimi element |
||
|
Nimi |
Nimi |
||||
|
Argentum |
|||||
|
kisen |
|||||
|
elavhõbe |
grafiit, teemant |
||||
Suurendage oma lugupidamist! Lihtkõnede nimed kirjutatakse väikeste tähtedega, keemiliste elementide nimed suurte tähtedega.
Metallid ja mittemetallid. Lihtsad sõnad jagunevad metallideks ja mittemetallideks. Enne metalle on tsink Zn, kaalium K, kaltsium Ca, magneesium Mg, tina Sn, plii Pb, vask Cu, raud Fe, alumiinium Al, hõbe Ag, kuld A jt (joon. 57).
Mittemetallide näidete hulka kuuluvad vesi H 2 oksiid O 2 ja osoon O3, lämmastik N 2, heelium He, neoon Ne, argoon Ar, süsinik C (nii tugev segu tegelikkuses kõigi lihtsate sõnadega süsinikule), sirka S, fosfor P, kloor Cl 2, jood I 2 ja teised (joon. 58).
Keemiliste elementide hulgas on olulisemad metallid. Tänapäeval tuntud keemilistest elementidest mittemetalliliste elementideni 22.
Lõigetes 6 ja 7 vaadeldi kõnede peamisi füüsilisi jõude. Sellele keskendudes võtame kokku metallide ja mittemetallide lihtsate ühendite omadused.
Kõikide metallide peamised omadused on kõrge soojusjuhtivus ja elektrijuhtivus; hall, hõbehall värv (tagumikud: kuld - kollane, vask - terve punane); lõhna olemasolu; plastilisus - neid on lihtne rullida, venitada, plaate rullida. Kõik metallid toatemperatuuril on tahkes agregaadis, välja arvatud elavhõbe (radiina).
Ülesäritatud võimsus ei ole mittemetallide jaoks tüüpiline. Nii et võite nende kohta öelda anna mulle sõnad andeks, Nad ei trampi vasakpoolsed võimud. Niisiis, mittemetallid ei juhi või juhivad halvasti soojust ja elektrit ning on rabedad ega ole plastilised. Vett, hapugaasi, lämmastikku, fluori, kloori, heeliumi, argooni ja muud hoitakse gaasitaolises agregaadis toatemperatuuril. Fosfor, süsinik, väävel, jood ja tahked ained, broom - vedel. Mittemetallidel on rohkem värvieelistust kui metallidel. Niisiis, hapu ja vesi on traadita, hapu on kollane, kloor on kollakasroheline, broom on tumepruun.
Väike 57. Metallitüübid: a - tsink; b - alumiinium, c - metall, d - vask

Väike 58. Mittemetallide liigid: a - jood, sirka, c - fosfor, d - kloor
Tuleb märkida, et lihtsate kõnede arv ainult füüsiliste autoriteetide taga metalli ja mittemetalli kohta on ebatäpne. Näiteks mittemetallilisel joodil on metalliline heledus ja mittemetallist grafiidil on kõrge elektrijuhtivus. Järgmistes tundides avardad teadmisi lihtkõnede jagamisest metallideks ja mittemetallideks nende aatomite ja keemiliste jõudude ülimuslikkuse alusel.
METALLIDE JA MITTEMETALLIDE JAOTAMINE PERIOODILISES SÜSTEEMIS. Keemilisi elemente, mille aatomid on valmistatud lihtainest, nimetatakse metallideks ja keemilisi elemente, mille aatomid on valmistatud lihtainest, nimetatakse mittemetallideks – mittemetallilisteks.
Lõikes 12 õppisite esmakordselt tundma keemiliste elementide perioodilisustabelit. Nüüd teate, et keemilised elemendid on paigutatud aatomituumade kõrgema laengu alla ja üks rakk on alati nahaelemendi külge kinnitatud. Milline on metallide ja mittemetallide elementide paigutuse põhimuster perioodilises süsteemis? Toiduahelale vastuse leidmiseks vaadake tabelit. Valige ülevaatamiseks 1., 2. ja 3. periood. Esimesel perioodil olid levinud metallelemendid. Teine periood algab metallielemendiga liitium Li. Ründav element Berüllium võib jõuda ka metallideni. Teised selle perioodi elemendid on mittemetallist.
Kolmas periood algab samuti metallielemendiga Naatrium Na, pärast veel kahe metallelemendi - Magneesium Mg ja Alumiinium Al - paigutamist. Lisaks, nagu ka teisel perioodil, asetatakse mittemetallist elemendid.
Lugege ette 1., 2. ja 3. perioodi elementide nimetused.
Erineval viisil paigutatakse metallist ja mittemetallist elemendid tabeli vertikaalsetesse veergudesse - rühmad, mis on nummerdatud rooma numbritega vahemikus i kuni VIII. Seega on kõik I ja II rühma keskmised elemendid (kaasa arvatud esimene rühm I) täidetud metallelementidega. Mittemetallilised elemendid asetatakse teiste rühmade algusesse ja metallid lõppu.
Uurige koos oma õpetajaga ja lugege valjusti III-VIII rühma moodustavate mittemetalliliste elementide nimetused.
Vaadeldavad näited illustreerivad põhireeglit metallide ja mittemetallide elementide paigutamiseks perioodilise süsteemi perioodidesse ja rühmadesse:
Metallelemendid paigutatakse perioodilisse keemiliste elementide süsteemi D.I. Mendelev perioodide alguses ja rühmade lõpus ning mittemetallid - perioodide lõpus ja rühmade alguses.
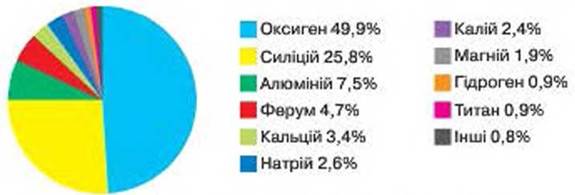
Väike 59. Keemiliste elementide paisumine Maal (massi järgi)
Laiendatud ELEMENDID LOODUSES. Kuigi looduses on erinevate ainete hoidlas ligi 90 keemilist elementi, paisub hais ebaühtlaselt. Elemendid-juhid ja ka sellised, isegi väikeste asemel.
Joonise fig. 59 Selgitage, et kolm metallist ja kolm mittemetallist elementi on Maal kõige rikkalikumad. Kas metallist või mittemetallist keemilised elemendid on olulised materjalide säilitamisel planeedil Maa?
polümaadi aardeleit
Lihtsamate sõnavõttude hulgas on nende ja teiste seas oma "tšempionid". füüsilised autoriteedid. Seega on teemant kõige kõvem metall, volframmetall aga kõige tulekindlam. Kergeim metall on liitium ja kergeim mittemetall on vesi. Suurima soojusjuhtivusega metallide hulgas on hõbe, vask ja alumiinium. Vismuti ja elavhõbeda madal soojusjuhtivus. On pehmeid metalle, mida saab noaga lõigata, näiteks naatrium, kaalium, kaltsium ja metallide kõrgeim kõvadus on kroom - seda saab kõvaks lõigata. Kullal on kõrge plastilisus. See võimaldab teil sellest sulamist toota kõike vähem kui 0,003 mm materjali.
1. Milliseid kõnesid nimetatakse andeks antud? Suunake oma tagumikku.
2. Millistele rühmadele lihtsad kõned satuvad? Millises rühmas on rohkem esindajaid?
3. Nimeta metallide peidetud füüsikalised jõud.
4. Mida sa tead metallide ja mittemetallide elementide jaotusest perioodilisuse süsteemis?
5. Millise metallielemendiga algab 4. periood?
6. Millise mittemetallilise elemendiga algab rühm V?
7. Nimeta kolme tüüpi mittemetallilisi ja metallist keemilisi elemente Maal.
8. Keemiliste elementide segust vali mittemetallilised ja lahusta need suurema vedela aatommassi järjekorras: Magneesium, Kisen, Vesi, Lõhe, Lämmastik, Kloor.
9. Nimetage keemiliste elementide perioodilisuse süsteemi alusel 3. perioodis ja VIII rühmas paiknev keemiline element. Mida peaksime tegema metalli või mittemetallist elementidega? Kui palju prootoneid ja elektrone on selle aatomi laos?
10. Täitke lausetes olevad lüngad sõnadega "metallik", "mittemetalliline" ja sarnaste elementide nimetused. Perioodilisuse tabeli teine periood algab elemendiga _________ ja lõpeb ________ elemendiga ___________.
Perioodilise tabeli viimane rühm algab elemendiga _________ ja lõpeb elemendiga ________,
11. Väljendage võimalikult palju märki, mille taga on lihtsate sõnade read:
a) kislen, lämmastik, vesi;
6) hakitud, lõigatud, alumiinium?
Koostage projekt teemal "Keemilised elemendid erinevate taevakehade laos".
Teemal: Metallid. Mittemetallid
SISSEMINE
Kogu meie looduskeskkonna mitmekesisus tuleneb võrdselt väikese arvu keemiliste elementide koosmõjust.
Erinevatel ajalooperioodidel on mõistel “element” erinev tähendus. Vana-Kreeka filosoofid pidasid "elemente" "elementideks" - soojust, külma, kuivust ja niiskust. Paarikaupa tulles lõid haisud kõikide kõnede – tule, tuule, vee ja maa – “algused”. Kesksajandil lisati nendele tõlvikutele soola, hapukoort ja elavhõbedat. 17. sajandil juhtis R. Boyle tähelepanu sellele, et kõik elemendid on materiaalset laadi ja nende arv võib olla suur.
1787. aastal lõi prantsuse keemik A. Lavoisier "Lihtsate kehade tabeli". Kõik tol ajal teadaolevad elemendid olid enne teda läinud. Ülejäänute all mõisteti lihtsaid kehasid, mida ei saanud keemiliste meetoditega eraldada veelgi lihtsamaks. Aastate jooksul on selgunud, et tabelisse on tulnud mitmeid kõnekeelseid kõnesid.
Tänapäeval on mõiste "keemiline element" täpselt määratletud.
Keemiline element koosneb aatomitest, millel on siiski positiivne tuumalaeng. (Ülejäänud kuupäev on seotud perioodilisuse tabeli elemendi järjekorranumbriga.)
Praegu on teada 107 elementi. Umbes 90 neist leidub looduses. Rashta eemaldati tükkhaaval täiendavate tuumareaktsioonide jaoks. 104-107 elementi sünteesisid Dubnas asuva Tuumauuringute Ühisinstituudi füüsikud. Praegu tegelevad robotid kõrgema järgu elementidega keemiliste elementide individuaalse ekstraheerimisega.
Kõik elemendid jagunevad metallideks ja mittemetallideks. 3 107 elementi 85 asetatakse enne metalle. Mittemetallide hulka kuuluvad järgmised elemendid: heelium, neoon, argoon, krüptoon, ksenoon, radoon, fluor, kloor, broom, jood, astatiin, kisen, sirka, seleen, teluurium, lämmastik, fosfor, tuhk, süsinik, räni, boor, Voden. Siiski pole see vaimne. Hea meelega võivad metalliteod avaldada mittemetallilist jõudu ja mittemetallilised teod metalli jõudu.
Mittemetallid
Mittemetalliliste elementide asukohad keemiliste elementide perioodilises süsteemis. Looduses tuntud. Väline keemiline ja füüsikaline jõud
Võrreldes metalliliste elementidega on mittemetallilisi elemente väga vähe. Nende paigutamine keemiliste elementide perioodilisse süsteemi D.I. Mendelev on näidatud tabelis nr 1.
Mittemetalliliste elementide paigutamine perioodilistesse süsteemidesse teemad rühmade kaupa |
||||||||
VIII (väärisgaasid) |
||||||||
Tabel nr 1.
Nagu näha tabelist nr 1, on mittemetallilised elemendid jaotunud peamiselt perioodilise süsteemi ülemises paremas osas. Kuna paremale nihkumise perioodidel elemendiaatomite tuumalaengud suurenevad ja aatomiraadiused muutuvad ning rühmades allapoole ka aatomiraadiused suurenevad, on arusaadav, et mittemetallide aatomite külgetõmme on tugevam kui sealsete metalliaatomite oma on väline elektroonika. Mittemetallides on ühendus tsümiga olulisem jõuoksiidid. Eriti tugev oksüdatiivne jõud, mille tulemuseks on elektronide lisandumine, paljastab mittemetallid, mis on VI-VII rühma 2. ja 3. perioodis. Tugevaim oksüdeerija on fluor. Mittemetallide oksiidisisaldus suureneb elektronegatiivsete väärtuste arvväärtusteni järgmises järjekorras: Si, B, H, P, C, S, I, N, Cl, O, F. koostoime vee ja fluori metallidega:
Mensch reageerib kisenile energiliselt:
2H2 + O2 ja 2H2 Pro
Fluor on kõrgekvaliteediline mittemetall, mida ei iseloomusta äärmuslik võimsus ja mis võib keemilistes reaktsioonides toota elektrone.
Kisen, otsustades selle mõju põhjal fluorile, võib avaldada positiivset oksüdatsioonifaasi, olles seega ürgne aine.
Kõik muud mittemetallid paljastavad peamised jõud. Veelgi enam, need jõud kasvavad järk-järgult happesusest räni: O, Cl, N, I, S, C, P, H, B, Si. Näiteks kloor ei interakteeru otseselt happesusega, kuid selle oksiide (Cl2O, ClO2, Cl2O2) saab kaudselt eraldada, milles klooril on positiivne oksüdatsiooniaste. Kõrgel temperatuuril ühineb lämmastik kohe happega ja avaldab seetõttu äärmist jõudu. Väävel reageerib hapuga veelgi kergemini: see näitab jõuoksiide.
Vaatame edasi mittemetallide tegelikke molekule. Mittemetallid moodustavad nii ühe- kui ka kaheaatomilisi molekule.
Üheaatomilised mittemetallid puutuvad kokku inertgaasidega, mis praktiliselt ei reageeri kõige aktiivsemate ainetega. Inertgaasid klassifitseeritakse perioodilise süsteemi VIII rühma ning vastavate lihtühendite keemilised valemid on: He, Ne, Ar, Kr, Xe ja Rn.
Mittemetallide toimel tekivad kaheaatomilised molekulid. Need on H2, F2, Cl2, Br2, I2 (perioodisüsteemi VII rühma elemendid), aga ka hapnik O2 ja lämmastik N2. Osoongaas (O3) moodustub kolmeaatomilistest molekulidest.
Tahkes olekus esinevate mittemetalliliste ühendite puhul on keemilist valemit raske koostada. Grafiidi süsinikuaatomid on üksteisega ühendatud erineval viisil. Juhtstruktuurides on oluline näha molekuli struktuuri. Selliste sõnade keemiliste valemite kirjutamisel nagu koos metallidega, võetakse kasutusele eeldus, et sellised sõnad koosnevad ainult aatomitest. Seetõttu kirjutatakse keemilised valemid ilma indeksiteta - C, Si, S jne.
Võimsuse erinevuseks võivad olla sellised lihtsad sõnad nagu osoon ja hapukus, mis moodustavad uue happelao (need mõlemad koosnevad ühest ja samast elemendist - hapukus), kuid võitlevad molekulis aatomite arvu pärast. Niisiis, hapukus ei lõhna, samas kui osoonil on terav lõhn, mida tunneme äikese ajal. Tahkete mittemetallide, grafiidi ja teemandi võimsust leidub ka uues tuhalaos, samuti teemante ja see varieerub järsult (grafiit on kõva, teemant on kõva). Seega ei näita kõne võimsust mitte ainult selle selge struktuur, vaid ka see, kui palju aatomeid kõne molekulides paikneb ja kuidas need omavahel seotud on.
Tundub, et mittemetalle leidub lihtsates kehades kas tahkes või gaasitaolises olekus (sealhulgas broom). Hais ei jää füüsilistele jõududele, võimsatele metallidele. Mittemetallilised tahked ained ei avalda metallidele iseloomulikku soojust, nad haisevad ning kipuvad halvasti elektrit ja soojust juhtima (peale grafiidi).
Mittemetallide maa-alune keemiline jõud.
Mittemetallide oksiidid viiakse happelisteks oksiidideks, mida nimetatakse hapeteks. Vesi ei tekitanud gaasitaolisi aineid (näiteks HCl, H2S, NH3). Nende veetüübid (näiteks vesinikhalogeniidid) on tugevad happed. Tüüpilised metallid ja mittemetallid on kombineeritud ioonse sidemega (näiteks NaCl). Mittemetallid võivad üksteisega reageerida, moodustades sidemeid kovalentsete polaarsete (H2O, HCl) ja mittepolaarsete sidemetega (CO2).
Veega kasutatakse surmavate vedelike lahustamiseks mittemetallilisi ühendeid, nagu näiteks vesinikfluoriid HF, sinine vesi H2S, ammoniaak NH3, metaan CH4. Halogeenide, väävli, seleeni ja teluuri lahustamisel vees lahustuvad veeühenditega sama valemiga happed: HF, HCl, HCl, HBr, HI, H2S, H2Se, H2Te.
Ammoniaagi lahustamisel vees moodustub ammoniaagivesi, mida tähistatakse valemiga NH4OH ja mida nimetatakse ammooniumhüdroksiidiks. Seda tähistatakse ka valemiga NH3 H2O ja seda nimetatakse ammooniumhüdraadiks.
Mittemetallide oksiidid lahustavad happelisi oksiide. Mõnes oksiidis on hais maksimaalne oksüdatsiooniaste, mis on sarnane rühmanumbriga (näiteks SO2, N2O5), teistes aga palju madalam (näiteks SO2, N2O3). Happelisi oksiide iseloomustavad happed ja ühe mittemetalli kaks happelist hapet on tugevamad kui see, milles veinil on kõrgem oksüdatsiooniaste. näiteks, lämmastikhape HNO3 on tugevam kui lämmastik HNO2 ja väävelhape H2SO4 on tugevam kui väävelhape H2SO3.
Budova ja lihtsate kõnede jõud – mittemetallid.
Leidke, et kõige rohkem mittemetalle on molekulaarsed ja kõige vähem mittemolekulaarseid metalle. See seletab nende võimude kõrkust. See on selgelt näidatud diagrammil nr 2.
Tabel nr 2
Kristalliline boor B (nagu ka kristalne räni) on väga kõrge sulamistemperatuuriga (2075 °C) ja kõrge vastupidavusega. elektrijuhtivus Vastupidavus temperatuurimuutustele suureneb oluliselt, mis võimaldab seda juhtmetehnoloogias laialdaselt isoleerida. Boori lisamine terasele ja alumiiniumi, vase, nikli jne sulamitele. Ma parandan nende mehaanilist jõudu.
Boriidid (teatud metallide poolboor, näiteks titaanist: TiB, TiB2) on vajalikud reaktiivmootorite ja gaasiturbiini labade osade valmistamisel.
Nagu on näha skeemidelt nr 2, kivisüsi C, räni Si, boor Maikuus lähen ma põrgusse ja vastutan selliste korrumpeerunud võimude eest. Nagu lihtsad sõnad, on ka hais kahel kujul – kristalne ja amorfne. Nende elementide kristalsed vormid on veelgi tahkemad, koos kõrged temperatuurid sulatamine Kristalliline räni kannab suunavat jõudu.
Kõik need elemendid kombineeritakse metallidega – karbiidid, silitsiidid ja boriidid (CaC2, Al4C3, Fe3C, Mg2Si, TiB, TiB2). Neil on suurem kõvadus, näiteks Fe3C, TiB. Atsetüleeni eemaldamiseks vikoriseeritakse kaltsiumkarbiidi.
Niipea kui elektronide jaotus orbitaalidel fluori, kloori ja teiste halogeenide aatomites on võrdsustatud, saame nende üle otsustada haldusasutused. Fluori aatomil ei ole vabu orbitaale. Seega võib fluori aatomitel olla kõrgem I valents ja oksüdatsiooniaste - 1. Teiste halogeenide aatomites, näiteks klooriaatomis, on samal energiatasemel vabad d-orbitaalid. Seetõttu võib elektronide lahtisidumine toimuda kolmel erineval viisil.
Esimeses faasis võib kloori oksüdatsiooniaste olla +3 ja tekitada kloorhapet HClO2, mida esindavad soolad - kloritid, näiteks kaaliumklorit KClO2.
Muudel juhtudel võib kloori kombineerida, mille puhul kloori oksüdatsiooniaste on +5. Need ühendid sisaldavad perkloorhapet HClO3 ja selle sooli - kloraati, näiteks kaaliumkloraati KClO3 (berthollet soola).
Kolmanda tüübi puhul on kloori oksüdatsiooniaste +7, näiteks perkloorhappes HClO4 ja selle soolades - perkloraadis, näiteks kaaliumperkloraadis KClO4.
Mittemetallide tuhmuvad ja vesised poolmetallid. Nende võimude lühikirjeldus.
Mittemetallide oksiidid lahustavad happelisi oksiide. Mõnes oksiidis on hais maksimaalne oksüdatsiooniaste, mis on sarnane rühmanumbriga (näiteks SO2, N2O5), teistes aga palju madalam (näiteks SO2, N2O3). Happelisi oksiide iseloomustavad happed ja ühe mittemetalli kaks happelist hapet on tugevamad kui see, milles veinil on kõrgem oksüdatsiooniaste. Näiteks lämmastikhape HNO3 on tugevam kui lämmastikhape HNO2 ja väävelhape H2SO4 on tugevam kui väävelhape H2SO3.
Määrdunud mittemetallide ühendite omadused:
1. Suure oksiidisisaldusega (need oksiidid, mis sisaldavad antud rühma kõrgema oksüdatsiooniastmega elementi) võimsus oksüdatsiooniperioodidel muutub järk-järgult aluselisest happeliseks paremale.
2. Rühmades allapoole nõrgeneb järk-järgult kõrgete oksiidide happeline jõud. Protsessi saab hinnata nendele oksiididele vastavate hapete tugevuse järgi.
3. Oluliste elementide kõigi oksiidide happelise võimsuse suurenemine paremale muutumise perioodidel on seletatav nende elementide ioonide positiivse laengu jätkuva suurenemisega.
4. Keemiliste elementide perioodilise süsteemi peamistes alarühmades muutub mittemetallide oksiidide happeline jõud otse allapoole.
Veeühendite üldvalemid keemiliste elementide perioodilise süsteemi rühmade järgi on toodud tabelis nr 3.
Tabel nr 3.
Vesi ühineb metallidega (lõppude lõpuks) mittemolekulaarsete ainete tahkete ainete abil. Seetõttu on nende sulamistemperatuur üsna kõrge.
Mittemetallide puhul tekitab vesi molekulaarstruktuuri auke. Suurimatel mõtetel on kas gaas või lendavad vaimud.
Paremale kurjuse perioodidel ühendab suvevete happeline jõud mittemetallid veeprobleemid saada tugevamaks. Seda seletatakse asjaoluga, et need on vabade elektronide aurudes happelised ja vees vabal orbitaalil, siis täheldatakse protsessi, mis näeb välja järgmine samm:
H2O + HF a H3O + F
Vesinikfluoriid vees lisab veele positiivseid ioone, nii et sellel on happelised omadused. See protsess ühildub järgmiste tingimustega: happelisel ioonil on üksik elektronpaar ja vesiioonil on vaba orbitaal, mistõttu tekivad doonor-aktseptor sidemed.
Kui ammoniaak on vees lahustunud, toimub pikaajaline protsess. Ja kuna need annavad lämmastikule üksiku elektronpaari ja veele vaba orbitaali, siis tekib täiendav side ja tekivad ammooniumioonid NH4 + ja hüdroksiidioonid OH. Rahutuste tulemusena on esile kerkimas peamised võimud. Seda protsessi saab väljendada järgmise valemiga:
H2O + NH3 a NH4 + OH
Vees leiduvatel ammoniaagi molekulidel on vees positiivsed ioonid, seega avaldab ammoniaak oma peamist jõudu.
Nüüd vaatame, miks fluor tekib vees - vesinikfluoriid HF - vees on see hape, nõrgem, vähem vesinikkloriid. Seda seletatakse asjaoluga, et fluoriioonide raadiused on oluliselt väiksemad kui klooriioonidel. Seetõttu tõmbavad fluor ja vesi vett tugevamini ligi kui kloor. Seoses sellega on vesinikfluoriidhappe dissotsiatsiooniaste oluliselt madalam kui vesinikfluoriidhappel, mis on madalam kui nõrgal vesinikkloriidhappel.
Tagumikke suunates saate luua järgmisi peidetud relvi:
1. Paremale kurjuse perioodidel suureneb elementide ioonide positiivne laeng. Seoses suviste veeelementide happelise jõuga muutuvad vees olevad elemendid tugevamaks.
2. Rühmades tõmbab allapoole negatiivse laenguga anioon positiivselt laetud ioonivett H + järjest vähem ligi. Seoses sellega hõlbustatakse ioonide eraldumise protsessi veest H + ja suureneb veeühendite happeline jõud.
3. Niitudel reageerivad mittemetallidest veepõhised pooljuhid, mis põhjustavad veealadel happelisi jõude. Vesi on mittemetallide kombinatsioon, mis esineb veealadel peamiste ametiasutuste poolt ja reageerib hapetega.
4. Vees levivate mittemetallide oksüdatiivne aktiivsus allapoole suunatud rühmades suureneb oluliselt. Näiteks oksüdeerige fluor veeühendus HF ei ole kemikaalidega võimalik, kuid kloori saab oksüdeerida HCl vesilahusest erinevate oksüdeerivate ainetega. Seda seletatakse asjaoluga, et rühmades allapoole suurenevad järsult aatomiraadiused, mille tulemusena muutub elektronide varustamine lihtsamaks.
Praegu on teada 105 keemilist elementi, enamik neist on metallid. Need on looduses väga levinud ja esinevad erineval kujul maapinnal, jõgede, järvede, merede, ookeanide vetes, loomade kehades, taimedes ja atmosfääris.
Oma võimsuse tõttu erinevad metallid järsult mittemetallidest. Esiteks tõi selle metallide ja mittemetallide erinevuse esile M. V. Lomonosov. "Metallid," kirjutas ta, "on kõvad kehad, tempermalmist aga läikivad."
Kindlustades selle või teise elemendi metallide kategooriasse, võime austada igaühe enesestmõistetavat, mis on määratud volituste kompleksile:
1. Tugev kristalne struktuur.
2.Iseloomulik metallist blisk.
3.Kõrge soojusjuhtivus ja elektrijuhtivus.
4. Elektrijuhtivuse muutused temperatuuri tõustes.
5. Madalad ionisatsioonipotentsiaali väärtused, et oleks lihtne toota elektrone.
6. Paindlikkus ja elastsus.
7. Sulamite heakskiitmise kuupäev.
Kõik metallid ja sulamid, mida saab praegu tehnoloogias tahkestada, võib jagada kahte põhirühma. Enne esimest tuuakse neist mustmetallid - sulamid ja sulamid, millest põhiosa koosneb. Need sulamid on chavun ja teras. Tehnikud kasutavad sageli nn legeerterast. Need puutuvad kokku terastega, mis sisaldavad kroomi, niklit, volframi, molübdeeni, vanaadiumi, koobaltit, titaani ja muid metalle. Mõnikord sisaldab legeeritud teras 5-6 erinevat metalli. Legeerimismeetodi abil saame sepistatud terased, mis mõnel juhul on suure plastilisusega, teistel - kõrge tõmbetugevusega kuni kulumiseni, teistel - korrosioonikindlusega, nii et ma ei tohi väliskeskkonna mõjul mureneda. .
Teise rühma kuuluvad värvilised metallid ja nende sulamid. Hais võttis ära niisuguse nimetuse rühi tapatalgule. Näiteks vask on helepunane, nikkel, tina, hõbe - valge, plii - tumevalge, kuld - kollane. Praktikas on sulamid muutunud tugevalt seisma: pronks on vase sulam tina ja muude metallidega, messing on vase ja tsingi sulam, babit on tina sulam antimoni ja muude metallidega.
See kant oli nutikalt musta ja värvilise metalliga. Must- ja värviliste metallide kõrval võib näha ka väärismetallide rühma: hõbe, kuld, plaatina, ruteenium jt. Lõhnad on saanud sellise nime, kuna need praktiliselt ei oksüdeeru kõrgel temperatuuril õhus ega kannata hapete ja heinamaa mõju neile.
II. Metallide füüsiline võimsus.
Väljastpoolt vaadates iseloomustab metalle ilmselt eriline "metallitaoline" sära, mis annab mõista, et nende välimust mõjutab tugevalt valguse muutus. Kuid selline lähenemine peab olema eriti ettevaatlik ainult juhul, kui metall loob täiesti kompaktse massi. Tõsi, magneesium ja alumiinium säilitavad oma sära pulbriks lahustades, kuid enamik peeneks purustatud välimusega metalle on musta või tumehalli värvi. Siis on tüüpilistel metallidel kõrge soojus- ja elektrijuhtivus ning vastavalt nende võimele juhtida soojust ja voolu tekivad nad samas järjekorras: parimad juhid on hõbe ja vask, halvimad juhid on plii ja elavhõbe. Temperatuuri tõustes elektrijuhtivus madalamatel temperatuuridel väheneb, kuid see suureneb.
Metallide teine oluline eelis on nende lihtne mehaaniline deformeeritavus. Metallid on plastsed, haisevad hästi sepistamiseks, tõmbuvad rämpsu sisse, rändavad lehtedesse jne.
Metallidele iseloomulikud füüsikalised jõud on seotud nende sisestruktuuri omadustega. Ilmselt koosnevad metallikristallid praeguseks positiivselt laetud ioonidest ja vabadest elektronidest, mis on jagatud subatomaarseteks aatomiteks. Kogu kristalli võib vaadelda kui avarat võret, mille sõlmed on hõivatud ioonidega ning ioonidevahelistes ruumides on kergesti haprad elektronid. Need elektronid liiguvad järk-järgult ühelt aatomilt teisele ja keerduvad ümber ühe või teise aatomi tuuma. Kuna elektronid ei ole aktiivsete ioonidega ühendatud, siis isegi väikese potentsiaalide erinevuse sissevoolu korral hakkavad ioonid liikuma vastupidises suunas, nii et tekib elektrivool.
Suurte elektronide olemasolu põhjustab metallide kõrge soojusjuhtivuse. Pidevalt lakkamatult liikudes suhtlevad elektronid pidevalt ioonidega ja vahetavad nendega energiat. Seetõttu kandub kuumutamise tulemusena metalli sellesse ossa kogunenud ioonide vibratsioon koheselt üle anumaioonidele, nendelt ründavatele jne ning metalli termiline seisund kiireneb kiiresti; kogu metall jääb samale temperatuurile.
Metallid jagunevad paksuse järgi kahte suurde rühma: kergmetallid, mille paksus ei ületa 5 g/cm3, ja olulised metallid - kõik teised.
Tahkes ja haruldases olekus leiduvate metallide osad on seotud spetsiaalse keemilise sidemega – nn metallisidemega. Seda näitab primaarsete kovalentsete sidemete hetkeline olemasolu neutraalsete aatomite ja Coulombi tüvede ioonide ja vabade elektronide vahel. Seega on metallisideme jõud mitte üksikute osakeste, vaid nende agregaadi jõud.
III. Metallide keemiline jõud.
Metallide peamine keemiline jõud seisneb selles, et nende aatomid loobuvad kergesti oma valentselektronidest ja muutuvad positiivselt laetud ioonideks. Tüüpilised metallid ei neela elektrone; Nad on alati positiivselt laetud.
Loobuvad kergesti oma valentselektronidest keemilistes reaktsioonides, nagu metallid ja energiaallikad. Elektronide olemasolu enne elektronide tarnimist on leitud teatud metallides, maailmas kaugeltki mitte. Mida kergem metall oma elektronidest loobub, seda aktiivsem ta on, seda energilisem on ta suhtlemisel muu kõnega. Lisame lisaks pliisoolale veidi tsinki. Tsink hakkab riknema ja riknemise tagajärjel ilmub plii. Reaktsiooni väljendatakse kaaslastele:
Zn + Pb (NO3) 2 \u003d Pb + Zn (NO3) 2
On ilmne, et see reaktsioon on tüüpiline oksüdatsiooni-uuenemisreaktsioon. Selle olemus taandub asjaolule, et tsingi aatomid annavad oma valentselektronid kahevalentsetele pliioonidele, muundudes seeläbi tsingioonideks, mis muunduvad pliiks ja paistavad metalli pliina. Kui kastate pliitüki kogemata tsingisoola sisse, siis reaktsiooni ei toimu. See näitab, et tsink on aktiivsem kui plii, et selle aatomitest on kergem loobuda ning nende jaoks on olulisem võtta vastu elektrone, vähem aatomeid ja ioone kui pliid.
Mõnede metallide sadestumisest nende vastetest teiste metallide poolt teatas esmakordselt Vene teadlane Beketov, kes klassifitseeris metallid nende keemilise aktiivsuse järgi niinimetatud "metalliseeriatesse". Sel ajal nimetatakse Beketovi vitisnyuvalny rida naprugi rida.
Metallid, mida kasvatatakse nende standardsete kasvu järjekorras
elektrokeemilisi potentsiaale ja luua pingemetallide elektrokeemiline vahemik: Li, Rb, K, Ba, Sr, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb,
H, Sb, Bi, Cu, Hg, Ag, Pd, Pt, Au.
Metallide keemilist jõudu iseloomustavad mitmed pinged:
- Mida madalam on metalli elektroodipotentsiaal, seda suurem on selle vastupidavus.
- Hoone nahkmetall eemaldatakse (tugevdatakse) soolade ja metallide tasemetelt, mis seisavad pingega pärast uut.
- Kõik metallid, millel on negatiivne standardelektroodipotentsiaal, on veest kõrgema pinge vahemikus ja eemaldavad selle seetõttu hapetest.
Tuleb märkida, et mitmed ideed iseloomustavad metallide ja nende soolade reaktsiooni ainult vees ja toatemperatuuril.
Lisaks peate teadma, et metallide kõrge elektrokeemiline aktiivsus ei tähenda alati kõrget keemilist aktiivsust. Näiteks saavad mitmed pinged alguse liitiumist, kuna rubiid ja kaalium on keemilises reaktsioonis aktiivsemad ja leitakse olevat liitiumist paremal. Selle põhjuseks on liitiumioonide hüdratatsiooniprotsessi suhteliselt kõrge energia, mis on võrdne teiste mitteväärismetallide ioonidega.
IV. Metallide korrosioon.
Enamik metalle, mis puutuvad kokku liiga suure osa gaasitaolise ja haruldase keskainega, alluvad enam-vähem kergesti pinnalt hävimisele. Selle põhjuseks on metallide keemiline koostoime õhus lahustunud gaasidega, samuti vee ja selles lahustunud ainetega.
Igasugust metallide keemilise hävitamise protsessi liigse keskkonna mõjul nimetatakse korrosiooniks.
Korrosioon tekib kõige lihtsamalt siis, kui metallid kombineeritakse gaasidega. Metalli pinnale tekivad järgmised ühendid: oksiidid, väävliühendid, süsihappe aluselised soolad, mis sageli katavad pinna paksu palliga, mis kaitseb metalli järgneva sama gaasi infusiooni eest.
Teine paremal on metalli kombinatsioon haruldase keskainega - vee ja selles lahustunud jõgedega.
Sellisel juhul võivad tooted ebaõnnestuda, mille tagajärjel levib korrosioon metalli edasi. Lisaks on vesi, mis takistab kõne katkemist, elektrivoolu juht, mille tulemusena tekivad järk-järgult elektrokeemilised protsessid, mis on üks peamisi korrosiooni arendavaid ja kiirendavaid tegureid.
Puhtad metallid ei allu enamikul juhtudel korrosioonile. Selline täiesti puhta välimusega metall, nagu salz, ei pruugi roosteta. Samuti lõhuvad esmased tehnilised metallid alati erinevaid maju, mis loob soodsa keskkonna korrosiooni tekkeks.
jne...................
mittemetallid nimetage keemilised elemendid, mis toimivad hea välja näha Lihtsamalt öeldes ei põhjusta hais metallide füüsiline jõud. 109 keemilisest elemendist 87 saab lisada metallidele, 22 є mittemetallid.
juures suurimates mõtetes mittemetalle võib leida gaasitaoline, haruldane, sama hästi kui seista kindlalt.
gaasidє heelium He, neoon Ne, argoon Ar, krüptoon Kr, ksenoon Xe, radoon Rn. See on kõik Inertgaasid. Inertgaasi nahamolekul koosneb ühest aatomist. Praegusel elektroonikaturul on inertgaaside aatomid (va heelium) kaotanud kõik oma elektronid. Heeliumi on ainult kaks. Keemilise vastupidavuse tõttu saab inertgaase võrrelda väärisväärismetallidega - kulla ja plaatinaga, neil on ka teine nimi - väärisgaasid. Parem on läheneda inertgaasidele, nagu neid nimetatakse, kuna lõhnad võivad siseneda keemilised reaktsioonid ja luua Keemiatooted. 1962. aastal sai selgeks, et ksenoon ja fluor võivad ravida haigusi. Sellest ajast alates on tuvastatud üle 150 keemilise reaktsiooni: ksenoon, krüptoon, radoon fluoriga, hape, kloor ja lämmastik.
Informatsioon vääris- ja inertgaaside keemiliste omaduste kohta ei osutunud täiesti õigeks, mistõttu tuvastatud inertgaaside nullrühma asemel kanti need perioodilise süsteemi kaheksandasse rühma.
Gaasid nagu vesi, hapu, lämmastik, kloor ja fluor lahustavad meile juba tuntud kaheaatomilisi molekule: H 2, O 2, N 2, CL 2, F 2.
Kõne tüübi saate määrata täiendavate keemiliste ja matemaatiliste sümbolite - keemilise valemi - abil. Nagu me juba teame, saab reeniumi molekulmassi (Mr) arvutamiseks kasutada keemilist valemit. Lihtsa ühendi vee molekulmass on iidne vee aatommassi lisamine molekuli aatomite arvu kohta, näiteks hape: O 2
Hr (O 2) \u003d Ar (O) · 2 \u003d 16 · 2\u003d 32
Prote, kiseni võib tekitada teine gaasitaoline aine - osoon, enne kui osooni molekul sisaldab kolme kiseni aatomit. Keemiline valem O3.
Nimetatakse ühe keemilise elemendi aatomite võimet luua mitmeid lihtsaid ühendeid allotroopia, Ja need on lihtsad sõnad - alotroopne madudele, Neid nimetatakse ka modifikatsioonid.
Keemilise elemendi hapu allotroopsete modifikatsioonide võimsus: lihtühendid O 2 ja osoon O 3 erineb suuresti.
Kisenil ei ole osooniga asendamisel iseloomulikku lõhna (sellest pärineb ka nimetus osoon – kreeka keeles tähendab osoon “lõhn”). Sarnast aroomi võib tuvastada ka äikese ajal, gaas tekib tuules elektrilahenduste tõttu.
Kisen ei muuda värvi, kui see asendatakse osooniga, mille saab ära tunda selle kahvatulilla varjundi järgi. Osoonil on bakteritsiidne toime. Vini kasutatakse ka mittenakatamiseks joogivesi. Osoon võib häirida ultraviolettkiirguse läbimist päikesespektris, mis on kahjulik kõigile Maa elusorganismidele. Osooniekraan (pall), mis asub 20-35 km kõrgusel, kaitseb kõike elavat kahjulike uniste muutuste eest.
3 22 lihtsat kõnet-mittemetalli, millel on erakordne meel vedelikutaoline See on ainult broom, mis on kaheaatomiline molekul. Broomi valem: Br 2.
Broom jätab booraksi tähtsuse maha, ebameeldiv lõhn rіdina (vanakreeka keelest pärit bromos on tõlgitud kui "haisev").
Selliseid kõvasid mittemetallilisi sõnu nagu sirka ja kivisüsi on nähtud juba iidsetest aegadest (Vugilla külas).
taevalaotus ka mittemetallilised kõned on sama peened kui allotroopia ilming. Kivisüsi võib luua selliseid lihtsaid asju nagu teemant, grafiit jne. Teemandi ja grafiidi erinevus seisneb kristallvõredes.
Toit otsas? Kas te ei tea, kuidas kodutöid teha?
Juhendajalt abi saamiseks registreeruge.
Esimene õppetund - pole kahju!
www.sait, materjali täieliku või osalise kopeerimisega, saadeti Pershodzherel ob'yazkovile.
Mittemetallid, keemilised elemendid, mis ei kannata metallidele iseloomulikke jõude. Mittemetallid haisevad tavaliselt soojusjuhtide ja elektrikomponentidena (haisevad soojusisolaatorite ja elektrikomponentidena). Mittemetallid puutuvad kokku süsinikuga, ... ... Teaduslik ja tehniline entsüklopeediline sõnastik
Keemilised elemendid, mis moodustavad lihtsaid kehasid, allumata metallidele iseloomulikele jõududele. Mittemetallide hulka kuulub 22 elementi: gaasid: vesi, lämmastik, hapugaas, fluor, kloor ja inertgaasid; Ridina broom; tahked ained boor, ...... Suur entsüklopeediline sõnaraamat
Mittemetallid- keemia. elemendid, mis on loodud vabas olekus, on lihtsad sõnad, mis ei vähenda füüsilist tegevust. i chem. ametiasutused (div.); Metalli nimi on aegunud. N.-le on aktsepteeritud 22 elementide perioodilist tabelit D. I. Mendeleva (div.): Voden... Suur polütehniline entsüklopeedia
Keemilised elemendid, mis moodustavad lihtsaid kehasid, allumata metallidele iseloomulikele jõududele. Mittemetallide hulka kuulub 22 elementi: gaasid: vesi, lämmastik, hapugaas, fluor, kloor ja inertgaasid; Ridina broom; tahked ained boor, ...... entsüklopeediline sõnaraamat
Mittemetallid- keemilised elemendid, mis loovad lihtsaid kehasid ilma metallidele iseloomulike jõududeta. Mittemetallid sisaldavad 22 elementi. Neist on toatemperatuuril gaasitaolises olekus H, N, O, F, Cl ... Metallurgia entsüklopeediline sõnaraamat
Keemilised elemendid, mis moodustavad lihtsaid kehasid, allumata metallidele iseloomulikele jõududele (Div. Metals). Nimi on Metaloidid, mis on N.-le stagnatsiooni allikaks, et elust välja tulla. N-le on nähtavad 22 elementi. Nendega...... Suur Radyanska entsüklopeedia
Mul on kahju, et te ei lase oma metallidel enda kätte kukkuda. Kuigi metallide ja lämmastiku vahele pole võimalik selgeid piire tõmmata, viiakse N. tavaliselt väärisgaase, vett, halogeene, oksiidi, kalkogeeni, lämmastikku, fosforit, arseeni, süsinikku, räni ja boori. ... Suur entsüklopeediline polütehniline sõnaraamat
Chem. elemendid, mis siiski loovad lihtsaid kehasid, allumata metallidele iseloomulikele jõududele. N.-le on 22 elementi: gaasid: vesi, lämmastik, hapugaas, fluor, kloor ja inertgaasid; Ridina broom; TV tahke boor, süsinik, räni, fosfor, ... ... Loodusõpetus. entsüklopeediline sõnaraamat
Mittemetallid- lihtsalt öelge, ärge laske end metallide jõust kõigutada: hais ei tekita metallist läiget, see ei ole tempermalmist, soojust ja elektrit on halb juhtida. Mittemetallide ja metallide vahel pole teravat vahet. Mittemetallid sisaldavad 22 elementi. Nendega normaalselt ...... metallurgia sõnastik
Anorgaaniline keemia, keemia jaotused, seosed keemiliste reaktsioonidega, kõigi keemiliste elementide ja nende reaktsiooniomadused ja võimsused anorgaanilised tulemused. See ala on kaetud kõigi keemiliste ainetega, orgaanilise... ... Wikipedia vihjega
raamatuid
- Lauakomplekt. Keemia. Mittemetallid (tabel 18). Esialgne album 18 arkushiniga. Art. 5-8688-018 Halogeen. Halogeenide keemia. Sirka. Allotroopia. Sirka keemia. Süürhaanhape. Lämmastiku keemia. Lämmastikoksiidid. Lämmastikhape on oksüdeerija. Fosfor. ...
- Keemia. Viskas. Nad ei metallinud. 9. klass Tööline õmbleb, Antonina Stepanivna Koroštšenko. Töötaja soovib 9. klassis läbi viia suure hulga ülesandeid, mille abil on võimalik saavutada keemia õpetamise aine-, metaaine- ja eritulemusi. Pos_bnik…
- Keemiakatsed: 9. klass. : Mittemetallid. Keemia süvendatud teadmised põhikooli kursuseks. Ettevalmistus peamise suveräänsuse testi jaoks. Föderaalne osariigi haridusstandard, Rjabov, Mihhailo Oleksijovitš. See juhend vastab täielikult föderaalvalitsuse valgustusstandardile (teine põlvkond). Posіbnik, et maksta kätte äiale, kes vannub O. S. Gabrielyani assistendi kahe teema juures...
MNOU "lütseum"
Teema kokkuvõte keemiast:
"Mittemetallid"
viconali:
õpilasi 11 "A" klass
Kutšerenko Maria,
Šadrina Ksenia.
uuesti kinnitatud:
keemia õpetaja
Štšerbakova jahisadam
Oleksandrivna.
Kemerovo - 2002
Sissejuhatus ................................................... .... ........................... ..3
§1. Mittemetalliliste elementide asukohad keemiliste elementide perioodilises süsteemis. Looduses tuntud. Väline keemiline ja füüsikaline jõud .................................................. ........ 4
§2. Mittemetallide negatiivne keemiline jõud ........................... ..6
§3. Budova ja lihtsate kõnede jõud - mittemetallid ......... 7
§4. Mittemetallide tuhmuvad ja vesised poolmetallid. Lühike kirjeldus Nende võimud ................................................ ... ... 9
katsetada
Wikilistide loend
Sisenema .
Kogu meie looduskeskkonna mitmekesisus tuleneb võrdselt väikese arvu keemiliste elementide koosmõjust.
Erinevatel ajalooperioodidel on mõistel “element” erinev tähendus. Vana-Kreeka filosoofid pidasid "elemente" "elementideks" - soojust, külma, kuivust ja niiskust. Paarikaupa tulles lõid haisud kõikide kõnede – tule, tuule, vee ja maa – “algused”. Kesksajandil lisati nendele tõlvikutele soola, hapukoort ja elavhõbedat. 17. sajandil juhtis R. Boyle tähelepanu sellele, et kõik elemendid on materiaalset laadi ja nende arv võib olla suur.
1787. aastal lõi prantsuse keemik A. Lavoisier "Lihtsate kehade tabeli". Kõik tol ajal teadaolevad elemendid olid enne teda läinud. Ülejäänute all mõisteti lihtsaid kehasid, mida ei saanud keemiliste meetoditega eraldada veelgi lihtsamaks. Aastate jooksul on selgunud, et tabelisse on tulnud mitmeid kõnekeelseid kõnesid.
Tänapäeval on mõiste "keemiline element" täpselt määratletud.
Keemiline element koosneb aatomitest, millel on siiski positiivne tuumalaeng. (Ülejäänud kuupäev on seotud perioodilisuse tabeli elemendi järjekorranumbriga.)
Praegu on teada 107 elementi. Umbes 90 neist leidub looduses. Rashta eemaldati tükkhaaval täiendavate tuumareaktsioonide jaoks. 104-107 elementi sünteesisid Dubnas asuva Tuumauuringute Ühisinstituudi füüsikud. Praegu tegelevad robotid kõrgema järgu elementidega keemiliste elementide individuaalse ekstraheerimisega.
Kõik elemendid jagunevad metallideks ja mittemetallideks. 3 107 elementi 85 asetatakse enne metalle. Mittemetallide hulka kuuluvad järgmised elemendid: heelium, neoon, argoon, krüptoon, ksenoon, radoon, fluor, kloor, broom, jood, astatiin, kisen, sirka, seleen, teluurium, lämmastik, fosfor, tuhk, süsinik, räni, boor, Voden. Siiski pole see vaimne. Hea meelega võivad metalliteod avaldada mittemetallilist jõudu ja mittemetallilised teod metalli jõudu.
§1. Mittemetalliliste elementide asukohad keemiliste elementide perioodilises süsteemis. Looduses tuntud. Liigne keemiline ja füüsiline jõud.
Võrreldes metalliliste elementidega on mittemetallilisi elemente väga vähe. Nende paigutamine keemiliste elementide perioodilisse süsteemi D.I. Mendelev on näidatud tabelis nr 1.
Tabel nr 1.
Nagu näha tabelist nr 1, on mittemetallilised elemendid jaotunud peamiselt perioodilise süsteemi ülemises paremas osas. Kuna paremale nihkumise perioodidel elemendiaatomite tuumalaengud suurenevad ja aatomiraadiused muutuvad ning rühmades allapoole ka aatomiraadiused suurenevad, on arusaadav, et mittemetallide aatomite külgetõmme on tugevam kui sealsete metalliaatomite oma on väline elektroonika. Seoses sellega soosivad mittemetalle jõuoksiidid. Eriti tugev oksüdatiivne jõud, mille tulemuseks on elektronide lisandumine, paljastab mittemetallid, mis on VI-VII rühma 2. ja 3. perioodis. Tugevaim oksüdeerija on fluor. Mittemetallide oksiidisisaldus suureneb elektronegatiivsete väärtuste arvväärtusteni järgmises järjekorras: Si, B, H, P, C, S, I, N, Cl, O, F. koostoime vee ja fluori metallidega:
Mensch reageerib kisenile energiliselt:
Fluor on kõrgekvaliteediline mittemetall, mida ei iseloomusta äärmuslik võimsus ja mis võib keemilistes reaktsioonides toota elektrone.
Kisen, otsustades selle mõju põhjal fluorile, võib avaldada positiivset oksüdatsioonifaasi, olles seega ürgne aine.
Kõik muud mittemetallid paljastavad peamised jõud. Veelgi enam, need jõud kasvavad järk-järgult happesusest räni: O, Cl, N, I, S, C, P, H, B, Si. Näiteks kloor ei interakteeru otseselt happesusega, kuid selle oksiide (Cl2O, ClO2, Cl2O2) saab kaudselt eraldada, milles klooril on positiivne oksüdatsiooniaste. Kõrgel temperatuuril ühineb lämmastik kohe happega ja avaldab seetõttu äärmist jõudu. Väävel reageerib hapuga veelgi kergemini: see näitab jõuoksiide.
Vaatame edasi mittemetallide tegelikke molekule. Mittemetallid moodustavad nii ühe- kui ka kaheaatomilisi molekule.
Üheaatomilised mittemetallid puutuvad kokku inertgaasidega, mis praktiliselt ei reageeri kõige aktiivsemate ainetega. Inertgaasid klassifitseeritakse perioodilise süsteemi VIII rühma ning vastavate lihtühendite keemilised valemid on: He, Ne, Ar, Kr, Xe ja Rn.
Mittemetallide toimel tekivad kaheaatomilised molekulid. Need on H2, F2, Cl2, Br2, I2 (perioodisüsteemi VII rühma elemendid), aga ka hapnik O2 ja lämmastik N2. Osoongaas (O3) moodustub kolmeaatomilistest molekulidest.
Tahkes olekus esinevate mittemetalliliste ühendite puhul on keemilist valemit raske koostada. Grafiidi süsinikuaatomid on üksteisega ühendatud erineval viisil. Juhtstruktuurides on oluline näha molekuli struktuuri. Selliste sõnade keemiliste valemite kirjutamisel nagu koos metallidega, võetakse kasutusele eeldus, et sellised sõnad koosnevad ainult aatomitest. Seetõttu kirjutatakse keemilised valemid ilma indeksiteta - C, Si, S jne.
Võimsuse erinevuseks võivad olla sellised lihtsad sõnad nagu osoon ja hapukus, mis moodustavad uue happelao (need mõlemad koosnevad ühest ja samast elemendist - hapukus), kuid võitlevad molekulis aatomite arvu pärast. Niisiis, hapukus ei lõhna, samas kui osoonil on terav lõhn, mida tunneme äikese ajal. Tahkete mittemetallide, grafiidi ja teemandi võimsust leidub ka uues tuhalaos, samuti teemante ja see varieerub järsult (grafiit on kõva, teemant on kõva). Seega ei näita kõne võimsust mitte ainult selle selge struktuur, vaid ka see, kui palju aatomeid kõne molekulides paikneb ja kuidas need omavahel seotud on.
Tundub, et mittemetalle leidub lihtsates kehades kas tahkes või gaasitaolises olekus (sealhulgas broom). Hais ei jää füüsilistele jõududele, võimsatele metallidele. Mittemetallilised tahked ained ei avalda metallidele iseloomulikku soojust, nad haisevad ning kipuvad halvasti elektrit ja soojust juhtima (peale grafiidi).
§2. Mittemetallide maa-alune keemiline jõud.
Mittemetallide oksiidid viiakse happelisteks oksiidideks, mida nimetatakse hapeteks. Vesi ei tekitanud gaasitaolisi aineid (näiteks HCl, H2S, NH3). Nende veetüübid (näiteks vesinikhalogeniidid) on tugevad happed. Tüüpilised metallid ja mittemetallid on kombineeritud ioonse sidemega (näiteks NaCl). Mittemetallid võivad üksteisega reageerida, moodustades sidemeid kovalentsete polaarsete (H2O, HCl) ja mittepolaarsete sidemetega (CO2).
Veega kasutatakse surmavate vedelike lahustamiseks mittemetallilisi ühendeid, nagu näiteks vesinikfluoriid HF, sinine vesi H2S, ammoniaak NH3, metaan CH4. Halogeenide, väävli, seleeni ja teluuri lahustamisel vees lahustuvad veeühenditega sama valemiga happed: HF, HCl, HCl, HBr, HI, H2S, H2Se, H2Te.
Ammoniaagi lahustamisel vees moodustub ammoniaagivesi, mida tähistatakse valemiga NH4OH ja mida nimetatakse ammooniumhüdroksiidiks. Seda tähistatakse ka valemiga NH3 H2O ja seda nimetatakse ammooniumhüdraadiks.
Mittemetallide oksiidid lahustavad happelisi oksiide. Mõnes oksiidis on hais maksimaalne oksüdatsiooniaste, mis on sarnane rühmanumbriga (näiteks SO2, N2O5), teistes aga palju madalam (näiteks SO2, N2O3). Happelisi oksiide iseloomustavad happed ja ühe mittemetalli kaks happelist hapet on tugevamad kui see, milles veinil on kõrgem oksüdatsiooniaste. Näiteks lämmastikhape HNO3 on tugevam kui lämmastikhape HNO2 ja väävelhape H2SO4 on tugevam kui väävelhape H2SO3.
§3. Budova ja lihtsate kõnede jõud – mittemetallid.
Leidke, et kõige rohkem mittemetalle on molekulaarsed ja kõige vähem mittemolekulaarseid metalle. See seletab nende võimude kõrkust. See on selgelt näidatud diagrammil nr 2.
Tabel nr 2
Kristalliline boor B (nagu ka kristalne räni) on väga kõrge sulamistemperatuuriga (2075 °C) ja kõrge vastupidavusega. Boori elektrijuhtivus suureneb oluliselt temperatuuri tõustes, mis võimaldab seda laialdaselt kasutada juhtmetehnoloogias. Boori lisamine terasele ja alumiiniumi, vase, nikli jne sulamitele. Ma parandan nende mehaanilist jõudu.
Boriidid (teatud metallide poolboor, näiteks titaanist: TiB, TiB2) on vajalikud reaktiivmootorite ja gaasiturbiini labade osade valmistamisel.
Nagu on näha skeemidelt nr 2, kivisüsi C, räni Si, boor Maikuus lähen ma põrgusse ja vastutan selliste korrumpeerunud võimude eest. Nagu lihtsad sõnad, on ka hais kahel kujul – kristalne ja amorfne. Nende elementide kristalsed vormid on tahkemad, kõrge sulamistemperatuuriga. Kristalliline räni kannab suunavat jõudu.
Kõik need elemendid kombineeritakse metallidega – karbiidid, silitsiidid ja boriidid (CaC2, Al4C3, Fe3C, Mg2Si, TiB, TiB2). Neil on suurem kõvadus, näiteks Fe3C, TiB. Atsetüleeni eemaldamiseks vikoriseeritakse kaltsiumkarbiidi.
Kuna elektronide jaotus fluori, kloori ja teiste halogeenide aatomite orbitaalides on ühtlustunud, saab otsustada nende haldusasutuste üle. Fluori aatomil ei ole vabu orbitaale. Seega võib fluori aatomitel olla kõrgem I valents ja oksüdatsiooniaste - 1. Teiste halogeenide aatomites, näiteks klooriaatomis, on samal energiatasemel vabad d-orbitaalid. Seetõttu võib elektronide lahtisidumine toimuda kolmel erineval viisil.
Esimeses faasis võib kloori oksüdatsiooniaste olla +3 ja tekitada kloorhapet HClO2, mida esindavad soolad - kloritid, näiteks kaaliumklorit KClO2.
Muudel juhtudel võib kloori kombineerida, mille puhul kloori oksüdatsiooniaste on +5. Need ühendid sisaldavad kloorhapet HClO3 ja selle sooli - kloraati, näiteks kaaliumkloraati KClO3 (berthollet soola).
Kolmanda tüübi puhul on kloori oksüdatsiooniaste +7, näiteks perkloorhappes HClO4 ja selle soolades - perkloraadis, näiteks kaaliumperkloraadis KClO4.
§4. Mittemetallide tuhmuvad ja vesised poolmetallid. Nende võimude lühikirjeldus.
Mittemetallide oksiidid lahustavad happelisi oksiide. Mõnes oksiidis on hais maksimaalne oksüdatsiooniaste, mis on sarnane rühmanumbriga (näiteks SO2, N2O5), teistes aga palju madalam (näiteks SO2, N2O3). Happelisi oksiide iseloomustavad happed ja ühe mittemetalli kaks happelist hapet on tugevamad kui see, milles veinil on kõrgem oksüdatsiooniaste. Näiteks lämmastikhape HNO3 on tugevam kui lämmastikhape HNO2 ja väävelhape H2SO4 on tugevam kui väävelhape H2SO3.
Omadused mittemetallide tuhmunud ühendused:
1. Suure oksiidisisaldusega (need oksiidid, mis sisaldavad antud rühma kõrgema oksüdatsiooniastmega elementi) võimsus oksüdatsiooniperioodidel muutub järk-järgult aluselisest happeliseks paremale.
2. Rühmades allapoole nõrgeneb järk-järgult kõrgete oksiidide happeline jõud. Protsessi saab hinnata nendele oksiididele vastavate hapete tugevuse järgi.
3. Oluliste elementide kõigi oksiidide happelise võimsuse suurenemine paremale muutumise perioodidel on seletatav nende elementide ioonide positiivse laengu jätkuva suurenemisega.
4. Keemiliste elementide perioodilise süsteemi peamistes alarühmades muutub mittemetallide oksiidide happeline jõud otse allapoole.
Veeühendite üldvalemid keemiliste elementide perioodilise süsteemi rühmade järgi on toodud tabelis nr 3.
Tabel nr 3.
Vesi ühineb metallidega (lõppude lõpuks) mittemolekulaarsete ainete tahkete ainete abil. Seetõttu on nende sulamistemperatuur üsna kõrge.
Mittemetallide puhul tekitab vesi molekulaarstruktuuri auke. Suurimatel mõtetel on kas gaas või lendavad vaimud.
Paremale kurjuse perioodidel tugevneb suvevete ja veealade mittemetallide happeline jõud. Seda seletatakse asjaoluga, et need on vabade elektronide aurudes happelised ja nad on veevabas orbitaalis, siis toimub protsess, mis näib olevat otsene:
H2O + HF - H3O + F
Vesinikfluoriid vees lisab veele positiivseid ioone, nii et sellel on happelised omadused. See protsess ühildub järgmiste tingimustega: happelisel ioonil on üksik elektronpaar ja vesiioonil on vaba orbitaal, mistõttu tekivad doonor-aktseptor sidemed.
Kui ammoniaak on vees lahustunud, toimub pikaajaline protsess. Ja kuna need annavad lämmastikule üksiku elektronpaari ja veele vaba orbitaali, siis tekib täiendav side ja tekivad ammooniumioonid NH4 + ja hüdroksiidioonid OH. Rahutuste tulemusena on esile kerkimas peamised võimud. Seda protsessi saab väljendada järgmise valemiga:
H2O + NH3- NH4 + OH
Vees leiduvatel ammoniaagi molekulidel on vees positiivsed ioonid, seega avaldab ammoniaak oma peamist jõudu.
Nüüd vaatame, miks fluor tekib vees - vesinikfluoriid HF - vees on see hape, nõrgem, vähem vesinikkloriid. Seda seletatakse asjaoluga, et fluoriioonide raadiused on oluliselt väiksemad kui klooriioonidel. Seetõttu tõmbavad fluor ja vesi vett tugevamini ligi kui kloor. Seoses sellega on vesinikfluoriidhappe dissotsiatsiooniaste oluliselt madalam kui vesinikfluoriidhappel, mis on madalam kui nõrgal vesinikkloriidhappel.
Tuharate suunas suunates saad tekitada rünnaku maa-alune visnovki:
1. Paremale kurjuse perioodidel suureneb elementide ioonide positiivne laeng. Seoses suviste veeelementide happelise jõuga muutuvad vees olevad elemendid tugevamaks.
2. Rühmades tõmbab allapoole negatiivse laenguga anioon positiivselt laetud ioonivett H + järjest vähem ligi. Seoses sellega hõlbustatakse ioonide eraldumise protsessi veest H + ja suureneb veeühendite happeline jõud.
3. Niitudel reageerivad mittemetallidest veepõhised pooljuhid, mis põhjustavad veealadel happelisi jõude. Vesi on mittemetallide kombinatsioon, mis esineb veealadel peamiste ametiasutuste poolt ja reageerib hapetega.
4. Vees levivate mittemetallide oksüdatiivne aktiivsus allapoole suunatud rühmades suureneb oluliselt. Näiteks ei ole võimalik fluori oksüdeerida HF vesilahusest keemilise lahusega, küll aga saab kloori oksüdeerida HCl vesilahusest erinevate oksüdeerivate ainetega. Seda seletatakse asjaoluga, et rühmades allapoole suurenevad järsult aatomiraadiused, mille tulemusena muutub elektronide varustamine lihtsamaks.
Vikipeedia kirjanduse loend.
1. Rudzitis G.E., Feldman F.G. Khimiya-11 - M.: Haridus, 1992.
2. Kremenchutska M., Vassiljev S. Õpilase juhend - M.: AST, 1999..
3. Khomchenko G.P. Keemia kuni VNZ õpilastele - M.: Vishcha kool, 1993.
