
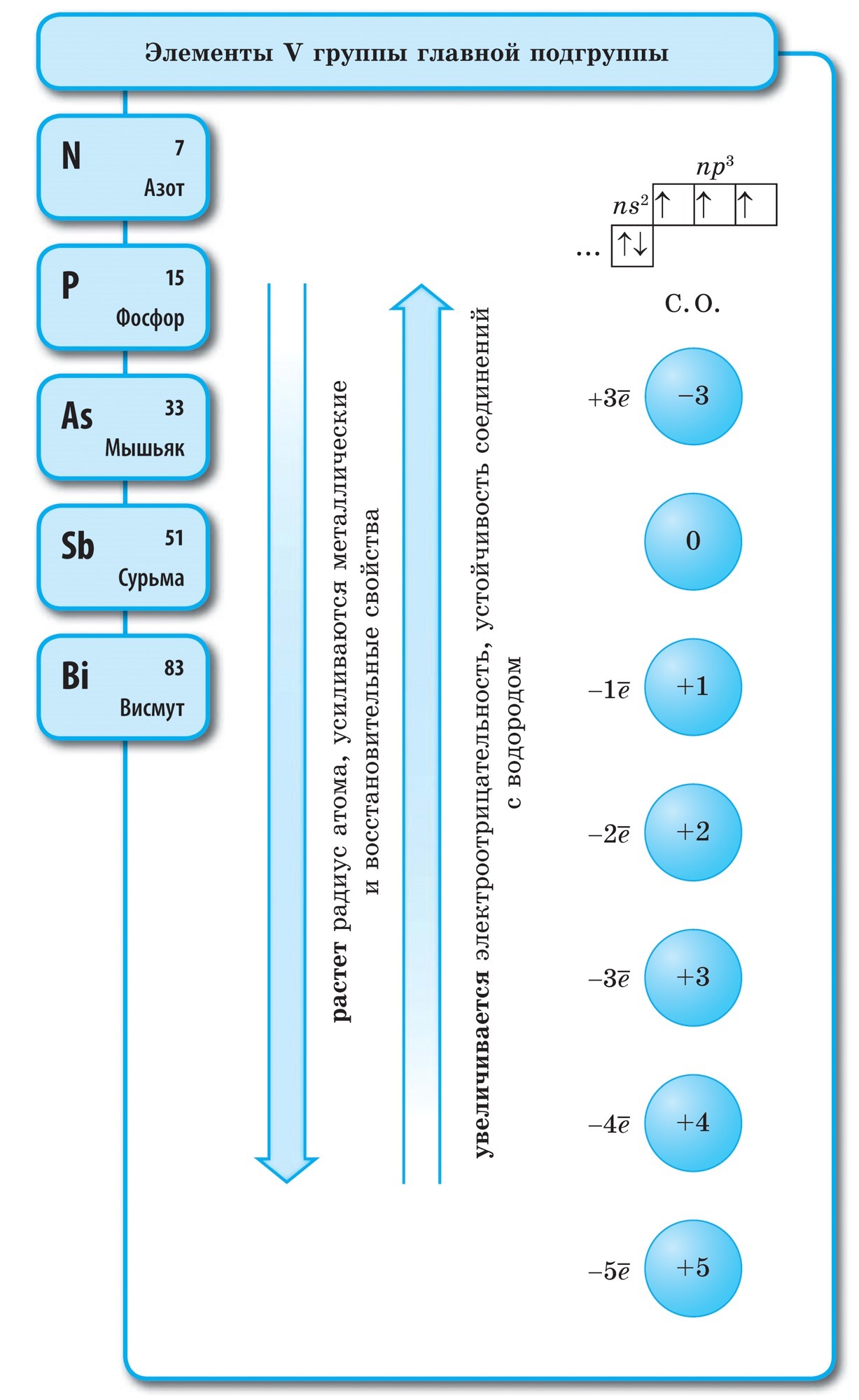
Andke nõu toitumise kohta: 1. Mitu aatomit moodustavad inertgaasi nahamolekuli? 2. Vaadake etümoloogiat ja nimetage seda "inertgaasideks". 3. Mis on su sõbra nimi? 4. Kuidas on kiireim viis inertgaasideni jõudmiseks? meistrimehe käest



Neoonvärvi valik Neoon on kõige tõhusam meeli tekitava reklaami tüüp. Neoonreklaam ja valguskastid on populaarsed kõigis maailma riikides. Neooni või argooniga täidetud klaastoru oli kootud valguskasti ja võidukas viktoriaanlikult ehk valgusreklaami röövimise kirjaga, mälestuslik, efektne ja efektne.


Allotroopia - diakonite XE hoone, et luua lihtsate kõnede puistamine, mis on jagatud igapäevaseks ja võimuks. Z - teemant, grafiit, fullereen. O - suudle, osoon. S - rombiline, monokliiniline, plastiline. P - valge, punane, must. Allotroopia nähtus on tingitud kahest põhjusest: 1) erinev arv aatomeid molekulis, näiteks hapnik O2 ja osoon O3. 2) mitmesuguste kristallvormide, näiteks teemant ja grafiit, kasutuselevõtt.



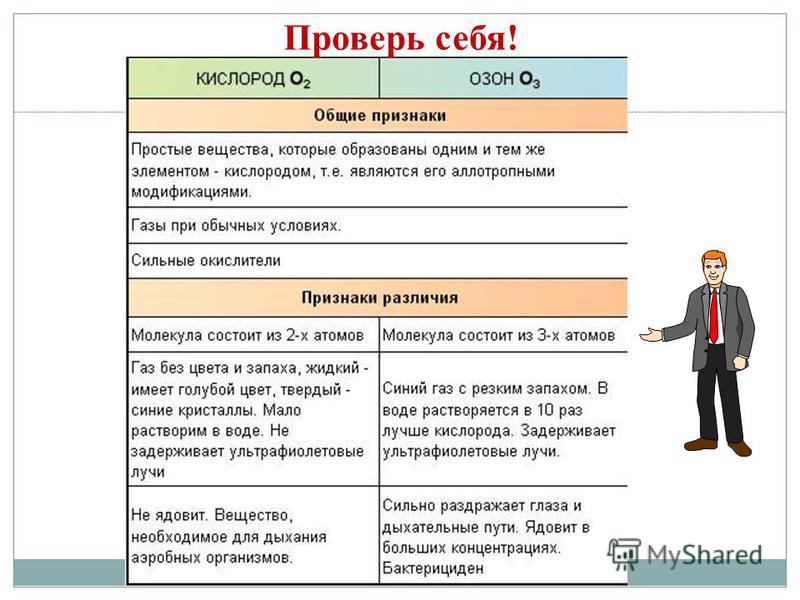






Proponeeritud nihke hulgast valige teemandile ja grafiidile iseloomulik võimsus: 1. kristallselge kõne 2. juhib soojust ja kohin 3. võib olla tugeva säraga 4. tumehall, paksum dotikristallkõne jaoks 5. kõige raskem loomulikust kõnest 6 .ei juhi soojust ega löö
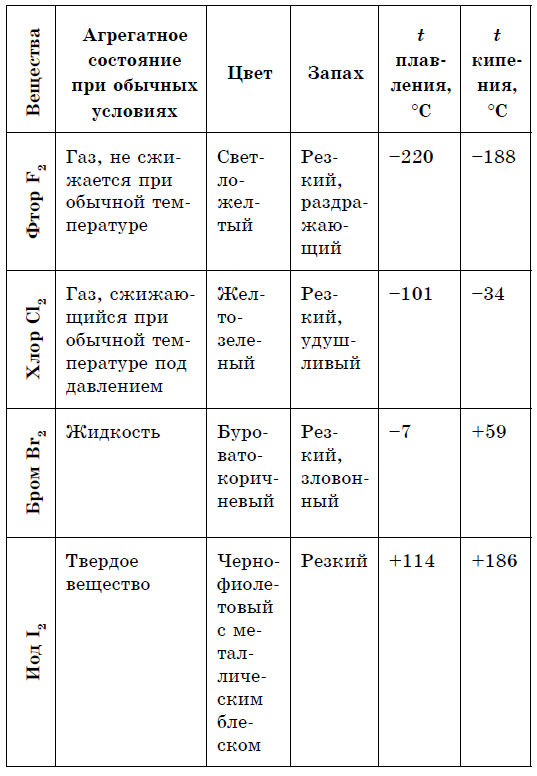
 Metallid Mittemetallid 1. Tahke kõne (krimmerhõbe Hg) 1, kõva kõne (sirka S, tšervoniumfosfor ja valge fosfor P 4, jood I 2, teemant ja grafiit C), gaasitaoline kõne (hapnik O2, osoon O3, lämmastik N 2, vesi H 2, kloor C1 2, fluor F 2, väärisgaasid) ja rіdina (broom Br 2) 2. tekitavad metallist läikima 2. Ärge peske metallist läikivat (jood I 2, grafiit C valmistamiseks) 3 . Elektri- ja soojusjuhtivus 3. Rohkem mitte juhtida elektrilist trummi (juhid є nt räni, grafiit)
Metallid Mittemetallid 1. Tahke kõne (krimmerhõbe Hg) 1, kõva kõne (sirka S, tšervoniumfosfor ja valge fosfor P 4, jood I 2, teemant ja grafiit C), gaasitaoline kõne (hapnik O2, osoon O3, lämmastik N 2, vesi H 2, kloor C1 2, fluor F 2, väärisgaasid) ja rіdina (broom Br 2) 2. tekitavad metallist läikima 2. Ärge peske metallist läikivat (jood I 2, grafiit C valmistamiseks) 3 . Elektri- ja soojusjuhtivus 3. Rohkem mitte juhtida elektrilist trummi (juhid є nt räni, grafiit)
![]()
Anna nõu toitumise kohta Mis on allotroopia? Andke allotroopsete modifikatsioonide tähistus. Miks on allotroopia ilming viklikano? Miks on kõnede mitmekesisuse üks põhjusi? Miks on see keemiliselt mittevirtuaalselt poeetiline väljend: "Aknas oli äikese lõhn"? Miks sa rozpodіl kohta viskamine ja mitte viskamine? Miks sa rozpodіl kohta viskamine ja mitte viskamine?


Keemilised elemendid - mitteheitjad
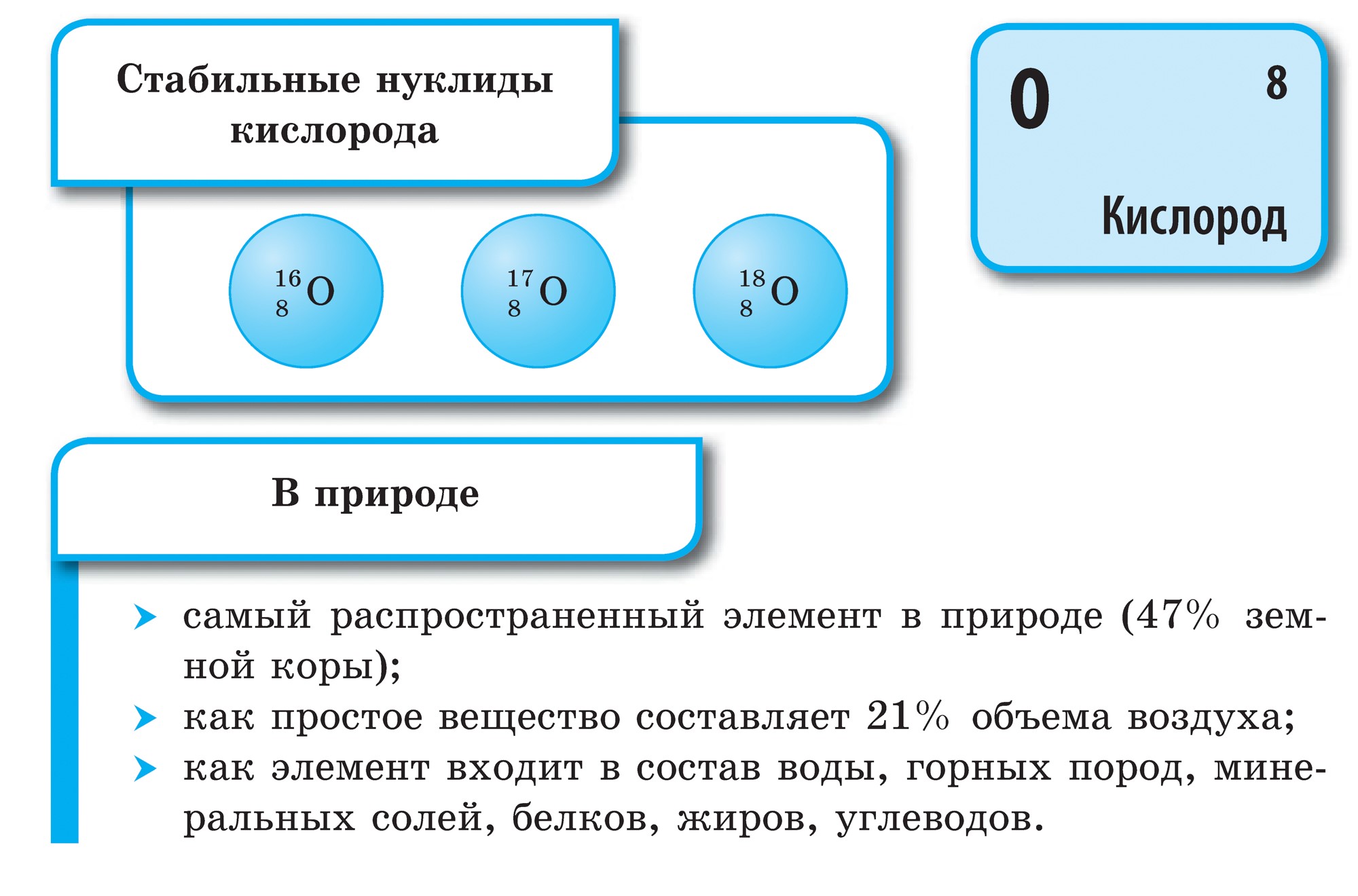
Keemilisi elemente - mittemetalle - on kokku 16 ja kaks neist, hapnikukütus ja räni, moodustavad 76% maa leetrite massist. Mitteviskajad on volditud 98,5% rosliini massist ja 97,6% inimeste massist. Söe, vee, hapu, sirka, fosfori ja lämmastikuga lisandub kogu kõige olulisem orgaaniline kõne, hais on elu elemendid. Vesi ja heelium on kogu maailma peamised elemendid, kõik kosmilised objektid, sealhulgas meie Päike, koosnevad neist. Ilma mittemetallide laenguta on võimatu oma elu paljastada, eriti aimata, mis elu on oluline keemiatehas- vesi - volditud veeks ja hapuks.
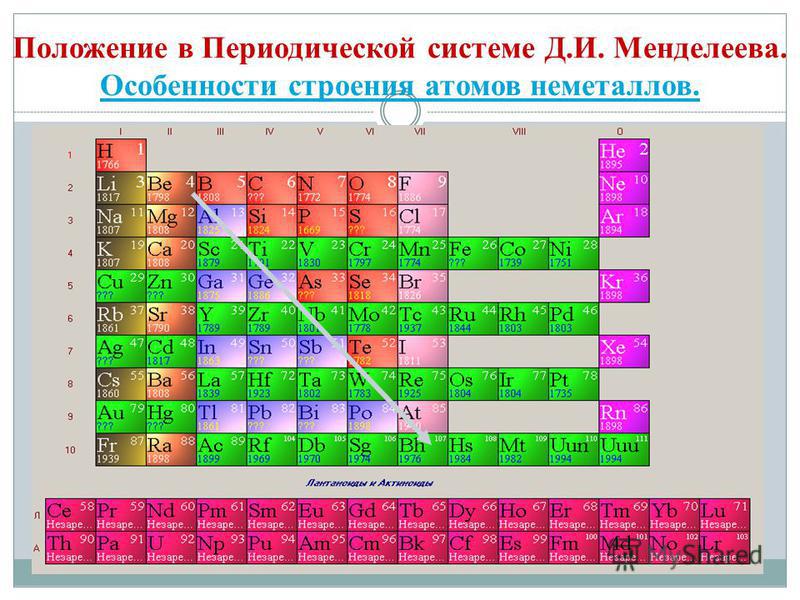
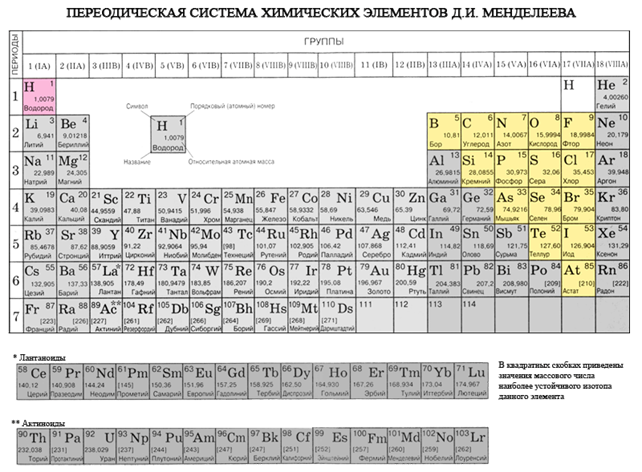
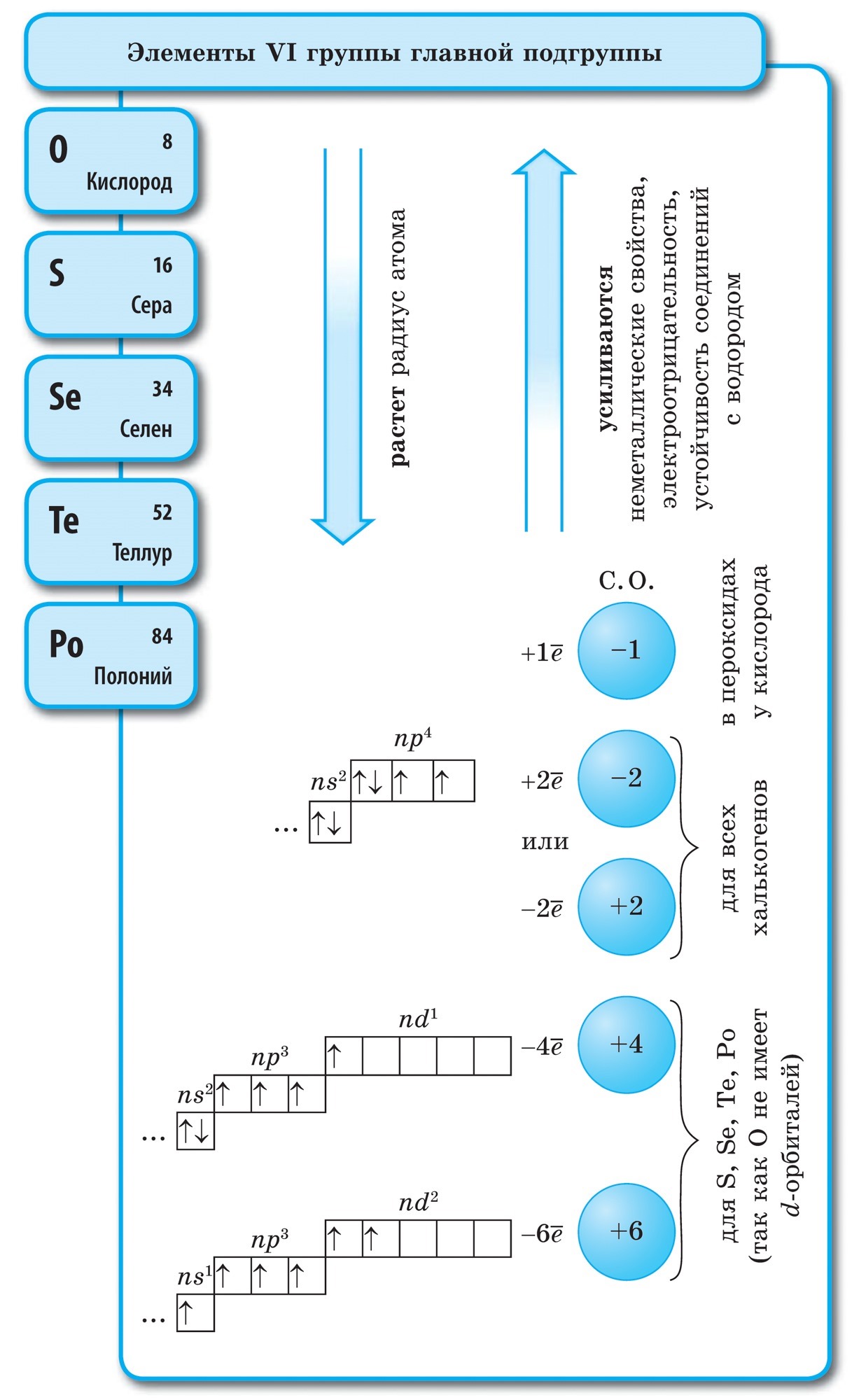
Kui joonistate perioodilises süsteemis diagonaali berülliumist astatiinile, siis paremal ülesmäge piki diagonaali on mittemetallilised elemendid ja põhjas metallid ning nende ees kõigi külgrühmade elemendid, lantaniidid ja aktiniidid. , saab näha. Diagonaali lähedale laotatud elemendid, näiteks berüllium, alumiinium, titaan, germaanium, antimon, võivad olla kahesuguse iseloomuga ja neid võib näha kuni metaloidini. Elementi-mitteviskajad: s-element - üleujutus; r-elementi 13 groupi - boor; 14 rühma - kivisüsi ja räni; 15 grupp - lämmastik, fosfor ja mish'yak, 16 rühma - kissen, sirka, seleen ja telur ja kõik 17. rühma elemendid - fluor, kloor, broom, jood ja astatiin. Elementi 18 groupi - inertgaasid, Hõljuge spetsiaalses laagris, hais võib olla täis välimise elektronkuuli lõpetamisi ja asuda metallide ja mittemetallide vahel. Neid nimetatakse mõnikord mittemetallideks, kuid formaalselt füüsiliste märkide taga.
Nemetali- ce keemilised elemendid, Aatomid, mis võtavad elektrone täiusliku energiataseme saavutamiseks, rahuldades neid, kui nad on negatiivselt laetud.
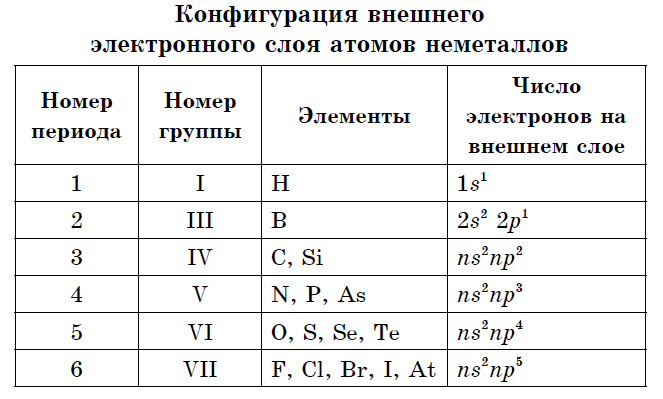
Mittemetallide aatomite välisel elektronkuulil on kolm kuni kaheksa elektroni.
Praktiliselt kõigil mitteheitjatel võib välisenergia tasemel 4 kuni 7 olla võrdselt väike raadius ja suur hulk elektrone, neid iseloomustavad kõrged elektronegatiivsuse väärtused ja jõuoksiidid. Sellele on metalliaatomite ja mittemetallide vahekorras iseloomulik:
· Väiksem aatomiraadius;
· Chotiri ja rohkem elektrone välisel energiatasandil;
Tähed ja nii oluline mittemetallide aatomite jõud - kalduvus saada kuni 8 elektroni päevas, see on võimsuse oksiid. Mittemetallide aatomite tunnusena, et nende endi mittemetallilisuse maailm saaks toimida elektrooniline kaubandus, et aatomite jõud keemilistes elementides polariseerib keemilist sidet, tõmbab enda juurde kõrgeid elektrone.
Suurim keemiliste elementide teaduslik klassifikatsioon jagunes metalliks ja mittemetalliks. Tsya klassifikatsioon pole selle tunni jooksul oma tähtsust kaotanud. Mittemetallid on peamised keemilised elemendid, mille aatomitele on iseloomulik elektronide vastuvõtmine kuni heleda laigu välimise kuuli valmimiseni, välisel elektronkuulil reeglina üha rohkem elektrone ja väikese raadiusega. aatomid aatomite puhul metallid.
Tse vyznachennya väljaspool põhialarühma VIII rühma elemente - inertsed või väärisgaasid, aatomid ja mõned välise elektroonilise palli otsad. Nende elementide aatomite elektrooniline konfiguratsioon on selline, et neid ei saa omistada ei metallidele ega mittemetallidele. Nende objektide hais, nagu metallile ja mittemetallile elementide lisamine, hõivab nendevahelise kordoni asendi. Inertne, muidu üllas, ghazi (“aadel” väljendub inertsuses) võib mõnikord tuua mittemetallideni või veelgi formaalsemalt füüsiliste märkide taha. Cі rechovina zberіgayut gazopodіbny veski kuni kaare madalatel temperatuuridel. Niisiis ei lähe heelium Chi temperatuuril t ° \u003d -268,9 ° С haruldasesse olekusse.
Nende elementide keemilise kasutamise inertsus on ilmne. Ksenoonile ja krüptoonile kombinatsioonis fluori ja happega: KrF 2, XeF 2, XeF 4 ja sisse. Kahtlemata toimisid nende päevade valguses kaasa inertgaasid. Mittemetallide jälgede tähistamine, mida nende aatomite jaoks iseloomustab kõrge elektronegatiivsuse väärtus. See muutub piirides 2 ja 4 vahel. Nemetaalid on pea alarühmade elemendid, olulisemad on p-elemendid, viinapuudest saab vesi - s-element.
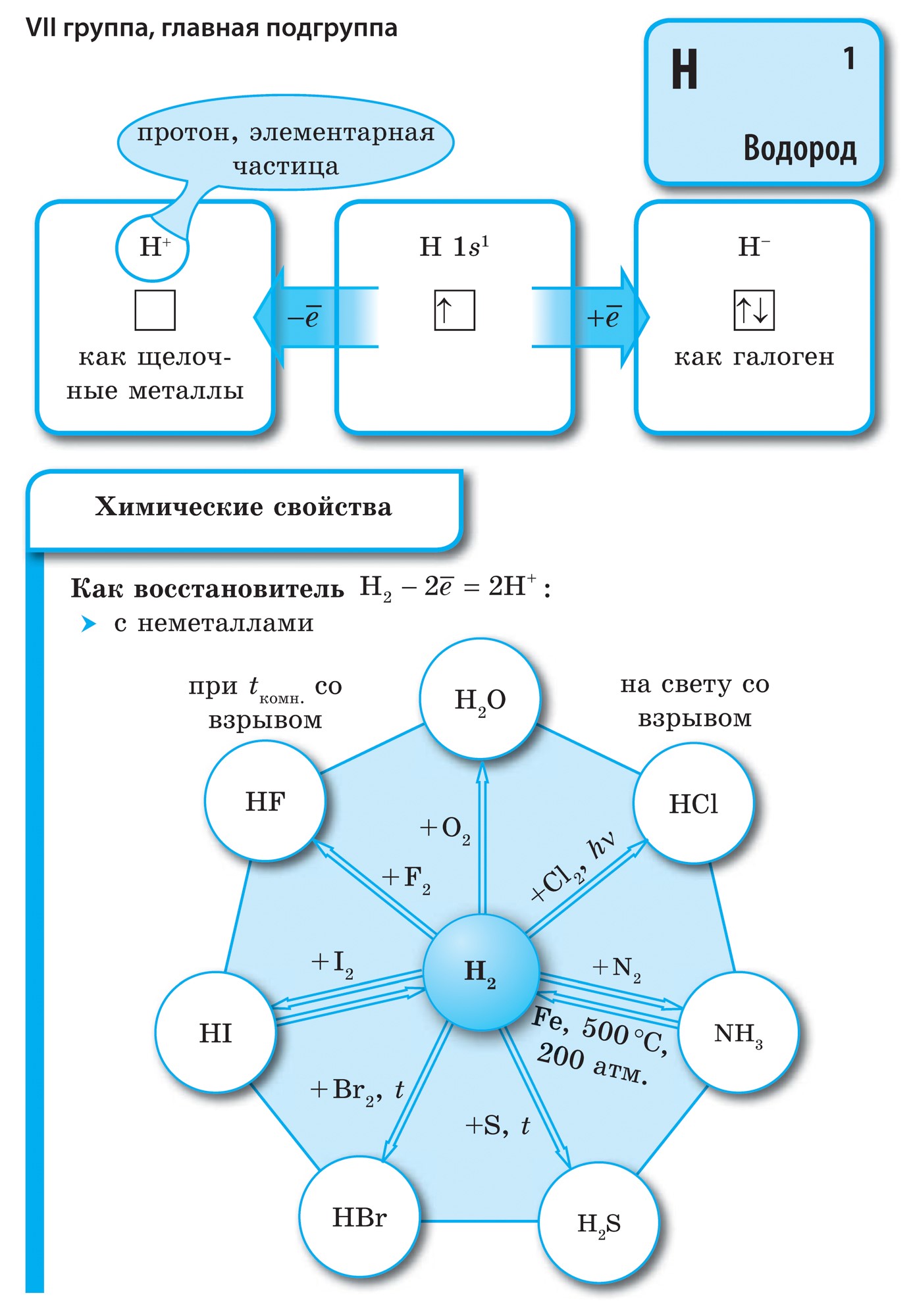
Kõik mittemetallilised elemendid (koorevesi) on hõivatud keemiliste elementide perioodilises süsteemis D. I. Mendeljevi ülemine parempoolne kut, utvoryuyuchi tricutnik, mille ülemine osa on fluor F ja tugi on diagonaal B - At. Siiski on erilist tähelepanu pööratud vee mitmetähenduslikule jaamale perioodilises süsteemis: I ja VII rühma peamistes alarühmades. Tse ei ole vipadkovo. Ühelt poolt on veeaatom sarnane lombimetallide aatomitega, kuid välimisel (ja uuel) elektroonilisel kuulil on üks elektron (elektrooniline konfiguratsioon 1s 1), mis on hoone võimsus, mis näitab juht.
Enamikul nende päevadest on vesi, nagu lombid, mille oksüdatsioonitase on +1. Ale, elektroni andmine aatomile on tähtsam kui vesi, Kuu metallide aatomites madalam. Teisest küljest lükkab veeaatom, nagu ka halogeenide aatomid, ovaalse elektronkuuli lõpuleviimiseks tagasi ühe elektroni, see veeaatom suudab vastu võtta ühe elektroni, mis näitab oksüdeerivat jõudu ja on iseloomulik halogeeni oksüdatsiooniastmele -1 in hüdriidid (metallidega, sarnased metallide ühendamine halogeenidega - halogeniidid). Halogeenide omast olulisem on aga ühe elektroni lisamine aatomile.
juures meeled vesi H 2 - gaas. Joogo molekul, nagu halogeenid, on kaheaatomiline. Mittemetallide aatomite juures on olulisemad võimsusoksiidid, st võime lisada elektrone. Qiu hoone iseloomustab elektronegatiivsuse väärtust, kuna see muutub loomulikult perioodide ja alarühmade kaupa. Fluor on tugevaim oksüdeerija ja selle aatomid keemilistes reaktsioonides ei tooda elektrone, st neil on märkimisväärne võimsus. Teised mitteviskajad võivad näidata suurt jõudu, kuigi metallidega on nad oluliselt nõrgemad; perioodidel ja nende alarühmades muutub märkimisväärne hoone oksüdeerumise järjekorras vastupidises järjekorras.
- Elemendid-mittevisatud roztashovani pea alarühmades III-VIII rühmad PS D.I. Mendeliev, hõivates paremas ülanurgas.
- Välimisel elektronkuulil on 3 kuni 8 elektroni.
- Elementide mittemetallilised võimsused suurenevad periooditi ja nõrgenevad alarühmades elemendi järjekorranumbri suurenemisega.
- Mittemetallide kõige happelisematel vormidel on happeline iseloom (happeoksiidid ja hüdroksiidid).
- Ehitise elementide-mittemetallide aatomid, nagu elektronide vastuvõtt, näitavad oksiidfunktsioone, seega näitavad nad olulisi funktsioone.
Budov ja mittemetallide füüsiline jõud
Lihtsates kõnedes on mittemetallide aatomid seotud kovalentne mittepolaarne side. Zavdyaki tsomu moodustavad elektroonilise süsteemi suurema kihi, madalamad isoleeritud aatomid. Sel juhul on üksikud (näiteks vee H 2 molekulides, halogeenides F 2, Br 2, I 2), sõltuvad (näiteks väävli S 2 molekulides), kaod (näiteks lämmastiku N molekulides 2) kovalentsed sidemed.
- gnuchkist vіdsutnya
- ei ole sära
- Soojusjuhtivus (ainult grafiit)
- Värvilahendus on erinev: kollane, kollakasroheline, punakaspruun.
- Elektrijuhtivus (ainult grafiit ja must fosfor.)
Täitematerjali veski:
- kodumaa - Br 2;
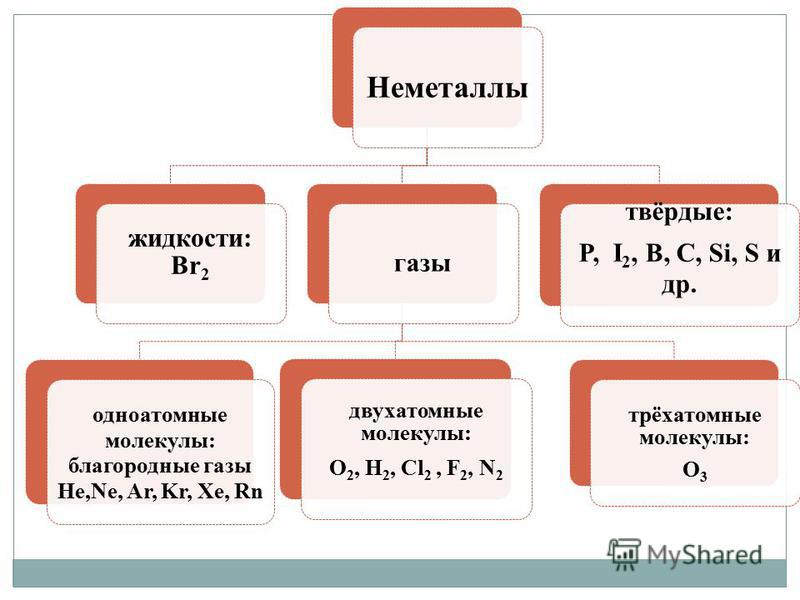
On vіdmіnu vіd metalіv mittevisatud - lihtsalt räägi, Iseloomustab suur autoriteetide mitmekesisus. Nemetali võib korraldada erinevaid koondamislaagreid kõrgeimatel mõtetel:
- gaasid - H 2, O 2, O 3, N 2, F 2, Cl 2;
- kodumaa - Br 2;
- kõva kõne - sirka, fosfori, räni, kivisöe ja sisse modifikatsioonid.
Mittemetallide värvide spekter on rikkalikum: punane - fosfori jaoks, punane-burium - broomi jaoks, kollane - sirka, kollakasroheline - kloori jaoks, violetne - pari joodi jaoks. Elemendid - mittemetallid suurema zdatnі, paaris metallidega, et allotroopia.
Ühe keemilise elemendi aatomite võimet pidada paar lihtsat kõnet nimetatakse allotroopiaks ja lihtsate kõnede arvu nimetatakse alotroopseteks liikideks.
Andestage kõned - emad ei saa visata:
1. Molekulaarne Budov. Suure mõistuse korral on enamik sellistest kõnedest gaasid (H 2, N 2, O 2, F 2, Cl 2, O 3) või tahked kõned (I 2, P 4, S 8) ja rohkem kui üks broom. (Br 2 ) on kodumaa. Kõik kõnesõnad on molekulaarselt budovu, lendavad sellele. Tahkes olekus on hais sulav nõrga molekulidevahelise interaktsiooni tõttu, mis vähendab kristallis leiduvaid molekule, ja tekib sublimatsioonini.
2. Aatomielu. Kõne värvi annavad kaks aatomite lantsi (C n, B n, Si n, Se n, Te n). Kovalentsete sidemete suure mineraalsuse tõttu teeb hais reeglina suure kõvaduse ja olenemata sellest, kas see muutub või mitte, seob kovalentsed sidemed nende kristallides (sulamine, aurustamine) suure vitratoenergiaga ї. Sellised kõned on rikkad kõrge sulamis- ja keemistemperatuuri poolest ning volatiilsus on veelgi väiksem.
Paljud elemendid-mitteviskajad moodustavad lihtsate kõnede puistata - allotroopsed modifikatsioonid. Aatomite võimsust nimetatakse allotroopiaks. Allotroopiat võib seostada erineva molekulide laoga (O 2, O 3) ja erinevate pungakristallidega. Süsiniku ja grafiidi, teemandi, karabiini, fullereeni alotroopsed modifikatsioonid. Kõigile mittemetallidele omase domineerimise näitamiseks tuleb pöörata tähelepanu nende jaotusele elementide perioodilises süsteemis ning määrata välise elektronkuuli konfiguratsioon.
Ajavahemikul:
- tuuma laeng suureneb;
- aatomi raadius muutub;
- elektronide arv välissfääris suureneb;
- e-kaubandus kasvab;
- autoriteedioksiidid on tugevdatud;
- mittemetallilised jõud tõusevad.
Peaalagrupis:
- tuuma laeng suureneb;
- aatomi raadius on suurenenud;
- välimise kuuli elektronide arv ei muutu;
- elektronegatiivsuse muutused;
- võimsusoksiidid nõrgenevad;
- mittemetallilised jõud nõrgenevad.
Enamiku metallide jaoks on haruldase vinyatka (kuld, vask ja deaks іnshі) jaoks iseloomulik hõbevalge zabarvlennia. Ja lihtsate kõnede telg on mittemetallist gammavärvid, oluliselt erinevad: P, Se - kollane; B - pruun; O2 (g) - blakütnium; Si, As (met) - сірі; P 4 - kahvatukollane; I - violetne-must metallilise läikega; Br2 (g) - natiivne booraks; C1 2 (d) - kollakasroheline; F 2 (r) - kahvaturohelised; S 8 (televiisor) - Zhovta. Mittemetallist kristallid ei ole plastilised ja kas deformatsioon põhjustab kovalentsete sidemete kokkuvarisemist või mitte. Enamik mittemetalle ei tekita metallist sära.

Kokku on 16 keemilist elementi-mittemetalli! Noh, see pole rikas, see on nagu valetamine, et 114 elementi on näha. Kaks mitteviskavat elementi moodustavad kuni 76% maakera leetritest. Tse kisen (49%) ja räni (27%). Atmosfääris on 0,03% maakoore hapu massist. Nemetali moodustab 98,5% rosliini massist, 97,6% inimkeha massist. Mittemetallid C, H, O, N, S on biogeensed elemendid, mis moodustavad elusrakkude tähtsaima orgaanilise kõne: valgud, rasvad, süsivesikud, nukleiinhapped. Kuni uuesti lattu, justkui mi dihaєmo, on lihtne siseneda kokkupandavad kõned, Lahustuvad ka mittemetallilistes elementides (hapnik O 2, lämmastik N 2, süsinikdioksiid CO 2, veeaur H 2 O ja sisse).
Lihtkõnede jõuoksiidid - mittemetallid
Mittemetallide aatomitele ja hiljem nende poolt lihtsate kõnede valgustamiseks on see iseloomulik oksüdeeriv, seega ma inspireeriv võimsus.
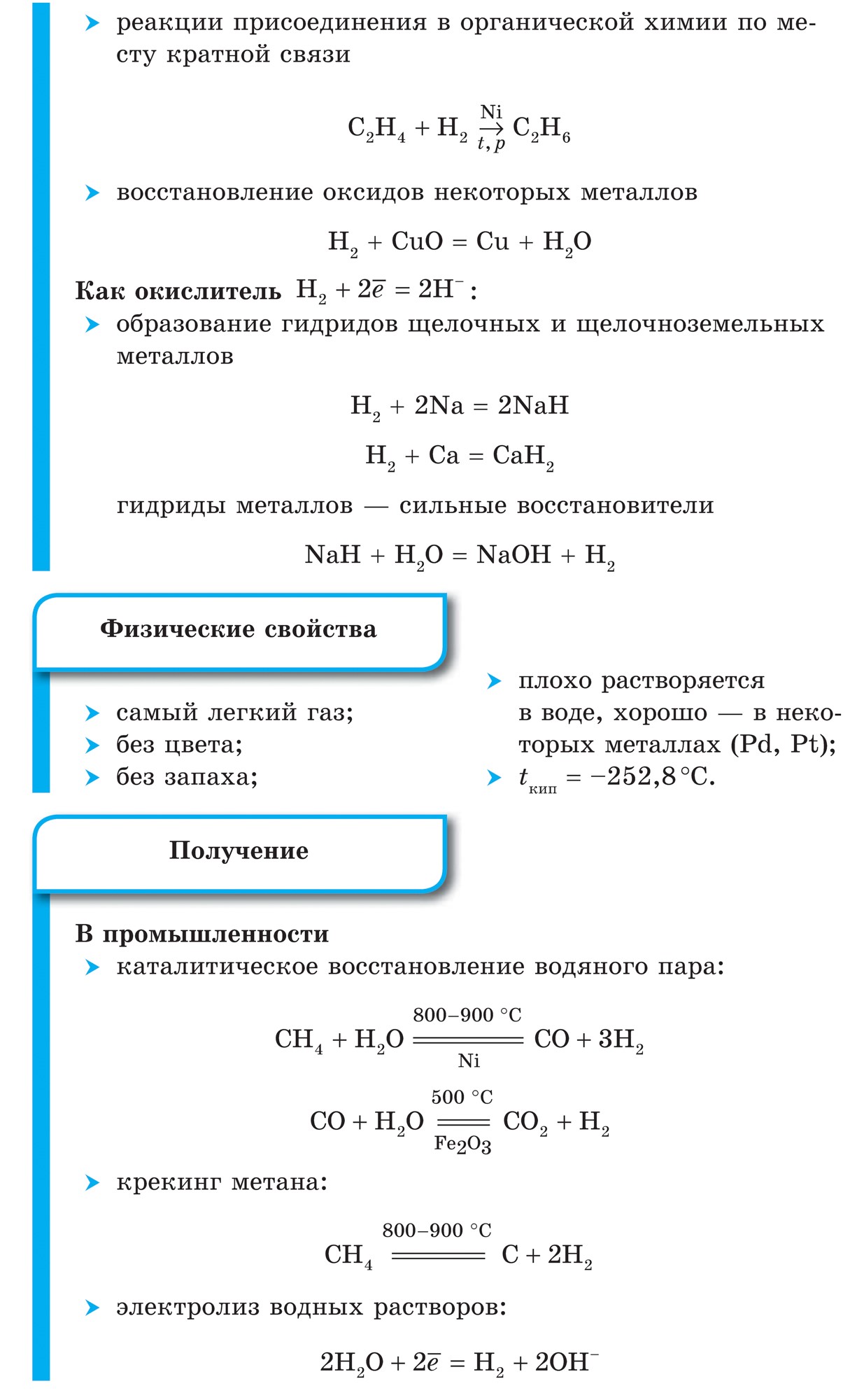
1. Mittemetallide võimsusoksiidid kuvatakse esimesel real nende vastasmõju metallidega(Metali zavzhdi vodnovniki):

Kloori Cl 2 oksüdatsioonivõime on tugevam, sirka madalam, sellele metallile Fe, mis võib olla samas oksüdatsiooniastme +2 ja +3 varres, oksüdeerub tema poolt kõrgema kõrge oksüdatsiooniastmeni.
1. Enamik mittemetalle näitab jõuoksiidid veega suhtlemisel. Selle tulemusena tekivad lendava vee võrsed.
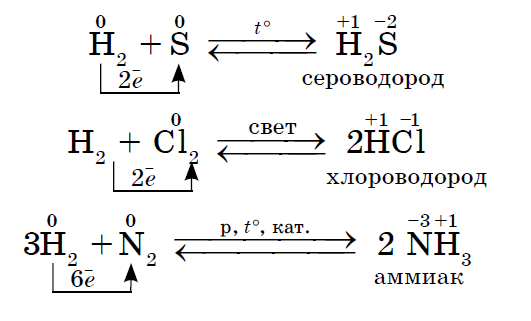
2. Olenemata sellest, kas mõni mittemetall toimib reaktsioonides nende mittemetallidega oksüdeeriva ainena, võib selle elektronegatiivsuse väärtus olla väiksem:
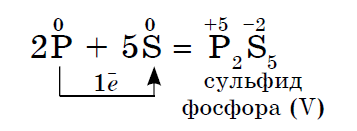
Sirka elektronegatiivsus on suurem, fosforisisaldus madalam, seega näitab võimsusoksiide.
Fluori elektronegatiivsus on suurem, madalam kõigis teistes keemilistes elementides, et vin näitab oksüdeeriva aine võimsust. Fluor F 2 on mittemetallide seas tugevaim oksüdeeriv aine, millel on reaktsioonides ainult oksüdeeriv toime.
3. Mittemetalli võimsuse oksiidid ilmnevad reaktsioonides mõne voltimiskõnega.
Märkimisväärselt mittemetallilise happesuse jõu oksüdatsiooni esimeses reas reaktsioonides voltimiskõnedega:
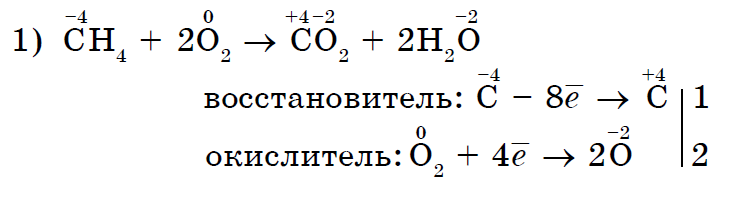
Mitte ainult kisen, vaid ka teised mitteviskajad võivad olla oksüdeerivad ained reaktsioonis voltimiskõnega- anorgaanilised (1, 2) ja orgaanilised (3, 4):
Tugevalt oksüdeeriv kloor Cl 2 oksüdeerib soolalahuse kloriidi (II) soolalahuseks kloriidiks (III);
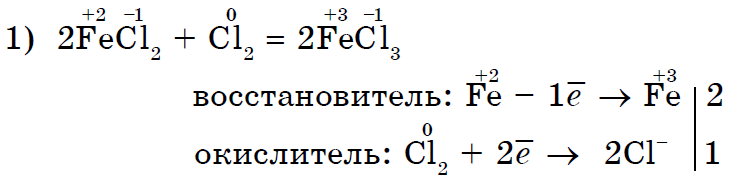
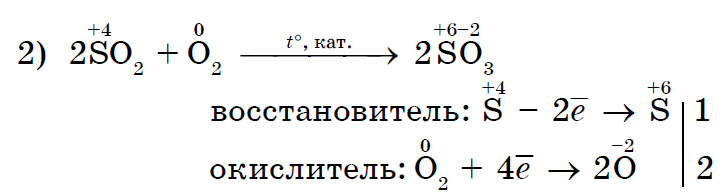
Kloor Cl 2 kui tugevam oksüdeerija jood I 2 sarnaneb rohkem kaaliumjodiidiga;
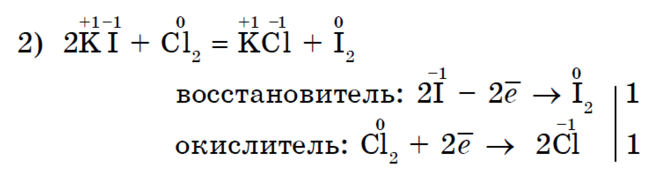
Metaani halogeenimine on alkaanide tüüpiline reaktsioon;
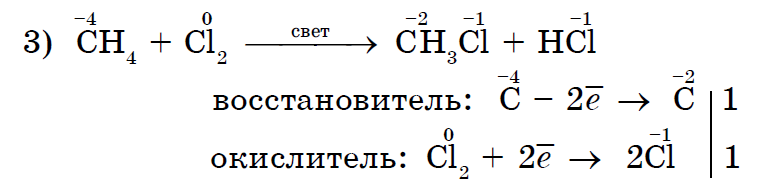
Yakіsnoy reaktsioon olematu spoluki є znebarvlenna neile broomi vett.
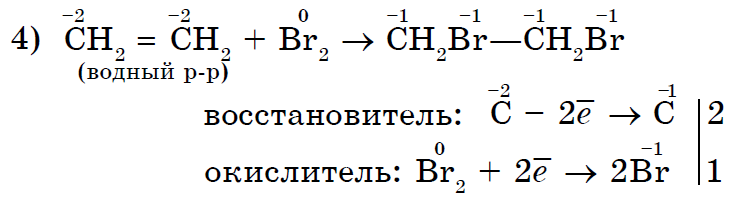
Ülevaadet lihtsate kõnede jõust – mittemetallid
vaadates mittemetallide reaktsioonid ükshaaval, Kuid kesas nende elektronegatiivsuse väärtuses näitab üks neist oksüdeeriva aine võimsust ja teine aine võimsust.
1. Fluori sissejuhatuse järgi kõik ei visanud (navit kisen) nad näitavad autoriteedi jõudu.
2. Mittemetallid, koorest fluorini, toimivad koostoimes hapuga redutseerivate ainetena.

Reaktsioonide tulemusena need kinnistuvad mittemetalli oksiid: Soola mittemoodustavad ja soola moodustavad happed. Soovin halogeene ilma haputa ilma haputa, nende oksiidides: Cl 2 +1 O -2, Cl 2 +4 O 2 -2, Cl 2 +7 O 7 -2, Br 2 +1 O -2, Br +4 O 2 -2, I 2 +5 O 5 -2, i in., yakі võtta kaudset teed.
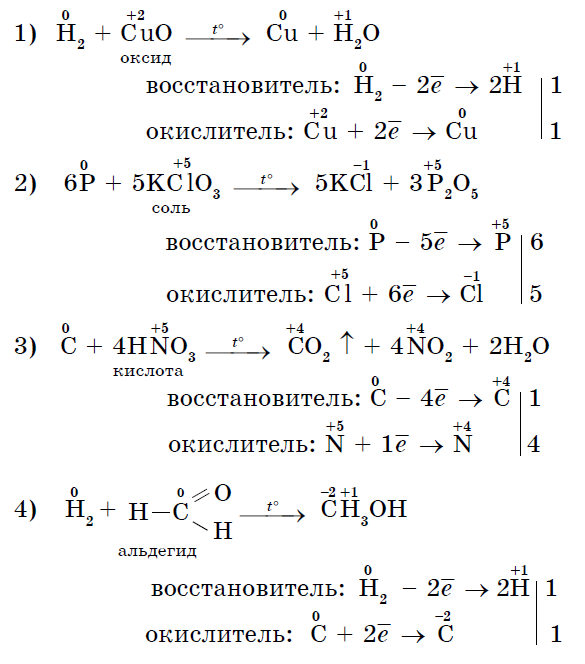
3. Bagato mitteheitjad võivad olla juhiks reaktsioonides voltimiskõnega - oksüdeerijad:
Іsnuyut ja sellised reaktsioonid, mille käigus oksüdeerub samaaegselt üks ja sama mittemetall, ja vodnovnik. Iseoksüdatsiooni-eneseuuenemise (ebaproportsionaalsuse) reaktsioonid:
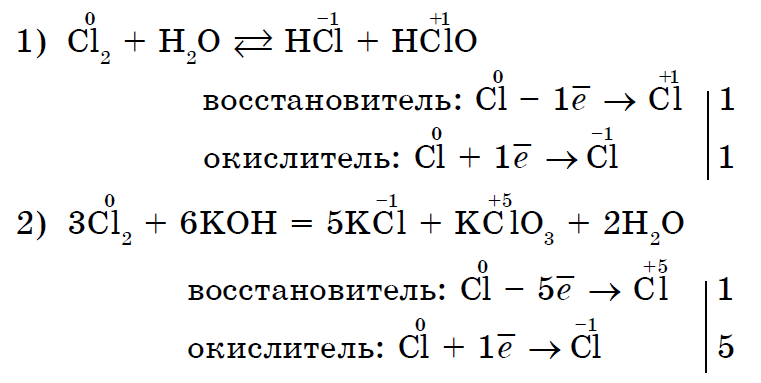
Sel viisil saab enamik mittemetalle sisse töötada keemilised reaktsioonid nii oksüdeerija rollis kui ka liidri rollis (mõjutusjõud ei ole seotud ainult fluoriga F 2).
Veepõhised mittemetallid
On vіdmіnu vіd metalіv nemetali utvoryuyut gaasitaoline vesi spoluki. Їx ladu deponeerimiseks mittemetallide oksüdatsiooni staadiumis.
RH 4 → RH 3 → H 2 R → HR
Kõigi mittemetallide püha jõud є resolutsioon suveveed z'єdnan, Enamikul juhtudel võib mittemetallide oksüdatsiooniaste olla madalam. Kõnede valemite hulgas on see rikas vaikuse, domineerimise, zastosuvannya ja otrimannya vyvchali poolest varem: CH 4, NH 3, H 2 O, H 2 S, HCl.
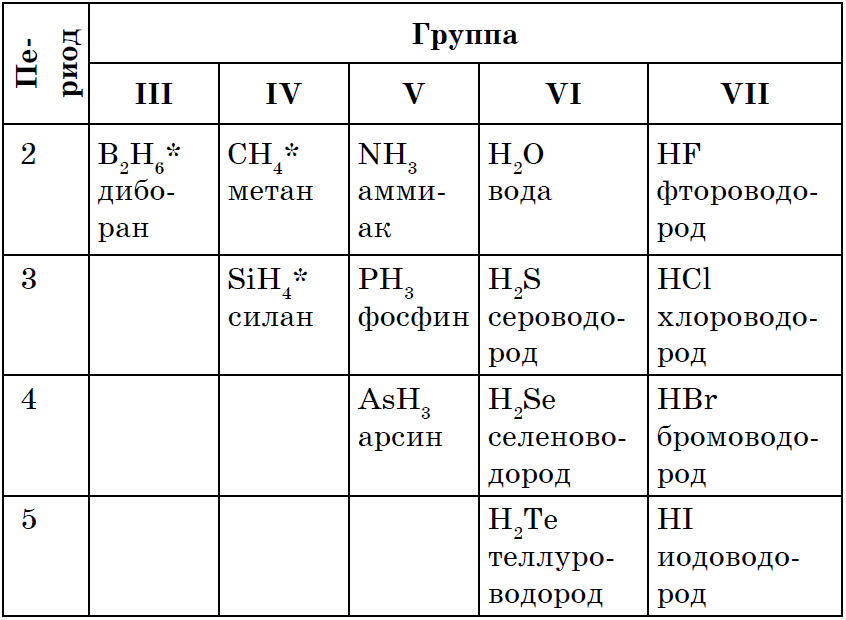
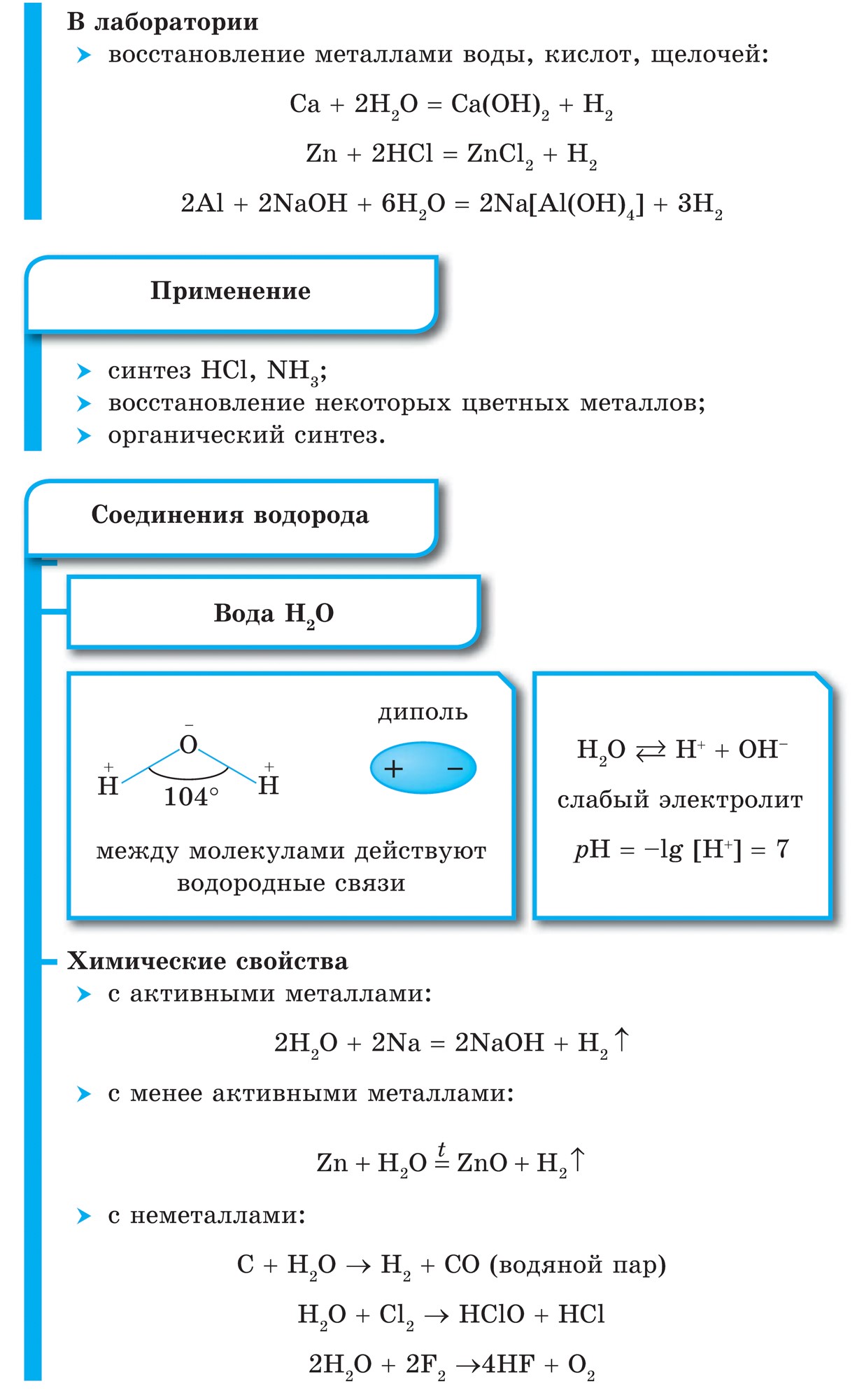
Vіdomo, scho kõige lihtsalt qі spoluky saab võtta ilma keskel mittemetallide koostoime veega, Tobto süntees:
![]()
Kõik mittemetallide veed on kehastatud kovalentsetes polaarsetes sidemetes; Vee z'ednan mittemetallide puhul on see iseloomulik vee hangumise erinevusele. Metaan ja silaan selles on praktiliselt eristamatud. Kui ammoniaak lahustatakse vees, lahustab see nõrga NH 3 H 2 O aluse. Vees lahustatuna vesinikseleniidis, vesiniktelluriidis ja ka vesinikhalogeniidides lahustatakse happed sama valemiga, mis ise on vesi: H 2 S, H2Se, H2Te, HF, HCl, HBr, HI.
Ühe perioodi mittemetallide, näiteks teise (NH 3, H 2 O, HF) või kolmanda (PH 3, H 2 S, HCl) mittemetallidega settivate vete happe-aluse võimsuse tasakaalustamiseks, siis saate teha vibu tugevuse seadusest happeline domineerimine i, vіdpovіdno, nõrgestatud aluselised. Ilmselgelt on see tingitud sellest, et polaarsus suureneb zv'azku E-N(De E on mittemetall).
Ühe alarühma veepõhiste mittemetallide happe-aluse võimsus on samuti vaidlustatud. Näiteks vesinikhalogeniidide reas HF, HCl, HBr, HI sideme E-H intensiivsus muutub, kuna side suureneb. Erinevatel tasemetel dissotsieeruvad praktiliselt rohkem HCl, HBr, HI - tugevaimad happed ja nende tugevus suureneb HF-lt HI-le. Kui nõrkadele hapetele lisatakse HF, mis on seotud veel ühe teguriga - molekulidevaheline interaktsioon, veesidemete loomine ... HF ... HF .... Vee aatomid on seotud fluori aatomitega F mitte ainult oma molekulidega , vaid ka ja kohtulik.
Uzagalnyuyuchi võrdne omadus mittemetallide vete happe-aluselised võimsused, zrobimo vysnovkas nende kõnede happeliste ja nõrgenenud põhiliste jõudude tugevnemise kohta perioodide jooksul ja aatomnumbrite peamised alarühmad ututvoryut їх elemendid.
Keemiliste elementide PS-i perioodi jooksul suurendab elemendi - mittemetalli - seerianumbri suurenemine veetaime happelisust.
SiH 4 → PH 3 → H 2 S → HCl
Krіm vaatas võimude poole, oksiid-vesi reaktsioonides esinevate mittemetallide poolte vesi näitab alati liidrite jõudu, isegi kui neis sisalduvatel mittemetallidel võib olla madalam oksüdatsiooniaste.
üleujutus
vesi - pea element Kogu maailm. Paljudest kosmilistest objektidest (gaashämarused, tähed, sealhulgas Päike) moodustavad üle poole vee. Maal, sealhulgas atmosfäär, hüdrosfäär ja litosfäär, ainult 0,88%. Alece kaalu järgi ja vee aatommass on veelgi väiksem. Seetõttu loobutakse vaid vähesest joogast ja 100 aatomist koosnevast nahast Maal 17 - veeaatomist.
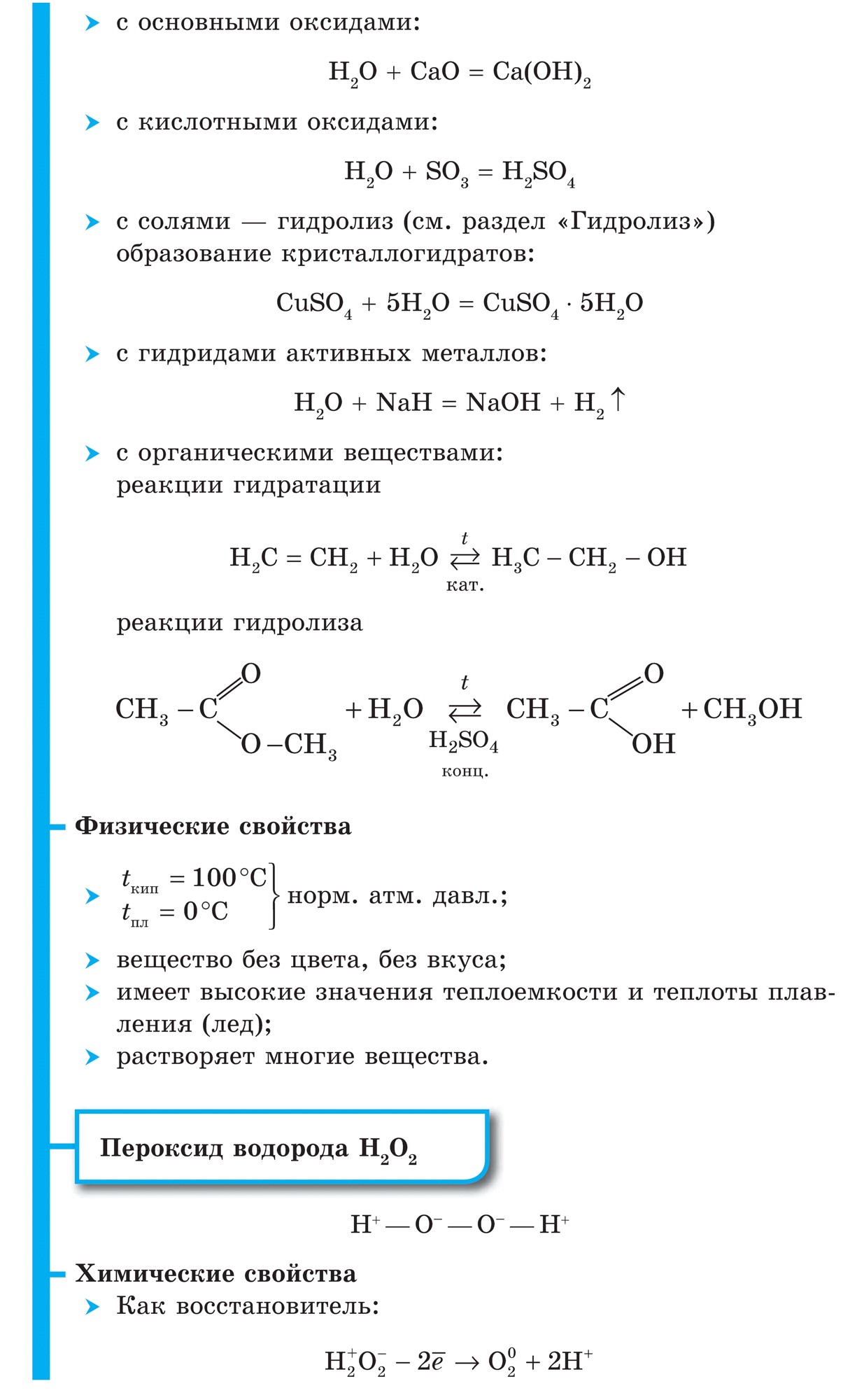
Vabas laagris nähakse vett H 2 molekulide, molekuliks seotud aatomite vaateväljas kovalentne mittepolaarne side.
Voden (H 2) on kõige kergem gaas kuivadest gaasitaolistest jõgedest. Kas ma võin suurendada soojusjuhtivust ja langetada keemistemperatuuri (pärast heeliumi). Vees vähe lahustuv. Temperatuuril -252,8 ° C ja atmosfäärirõhul läheb vesi haruldasesse olekusse.
1. Veemolekul on juba mіtsna, mida röövida її mitteaktiivne:
H 2 \u003d 2H - 432 kJ
2. Äärmuslikel temperatuuridel vesi reageerib aktiivsete metallidega:
Ca + H 2 \u003d CaH 2,
kustutav kaltsiumhüdriid, i z F 2, kustutav vesinikfluoriid:
F 2 + H 2 \u003d 2HF
3. Millal kõrged temperatuurid eemaldage ammoniaak:
N2 + 3H2 \u003d 2NH3
ja titaanhüdriid (metall pulbrina):
Ti + H 2 \u003d TiH 2
4. Kui podpalyuvanni vett reageerida hapuga:
2H 2 + O 2 \u003d 2H 2 O + 484 kJ
5. Voden volodіy vіdnovlyuvalnoyu zdatnist:
CuO + H2 \u003d Cu + H2O

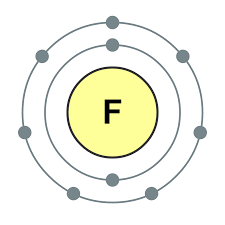
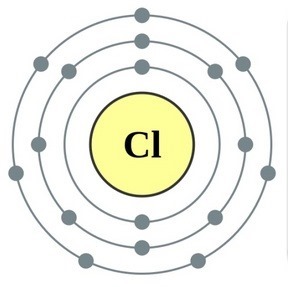
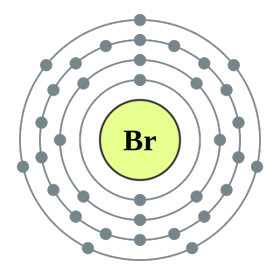
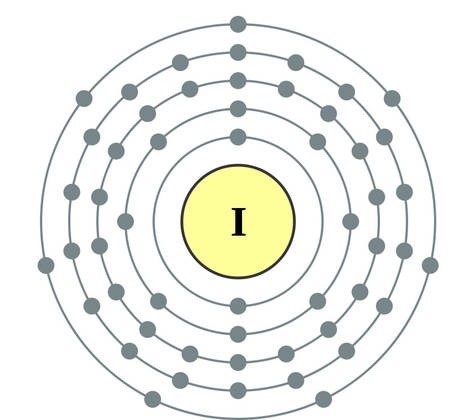
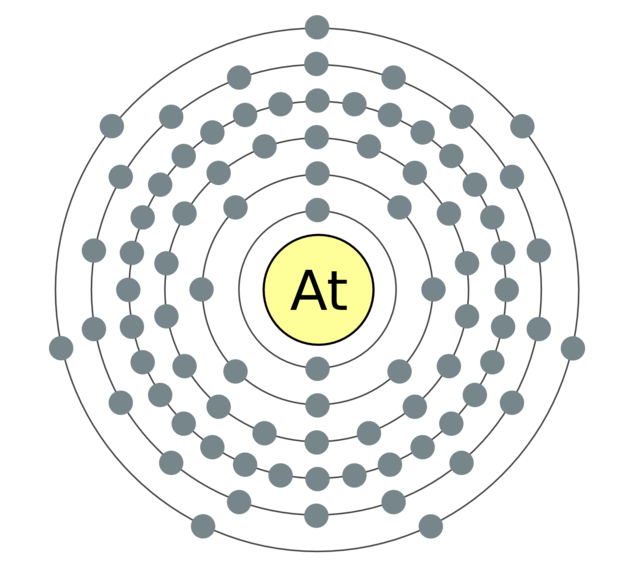
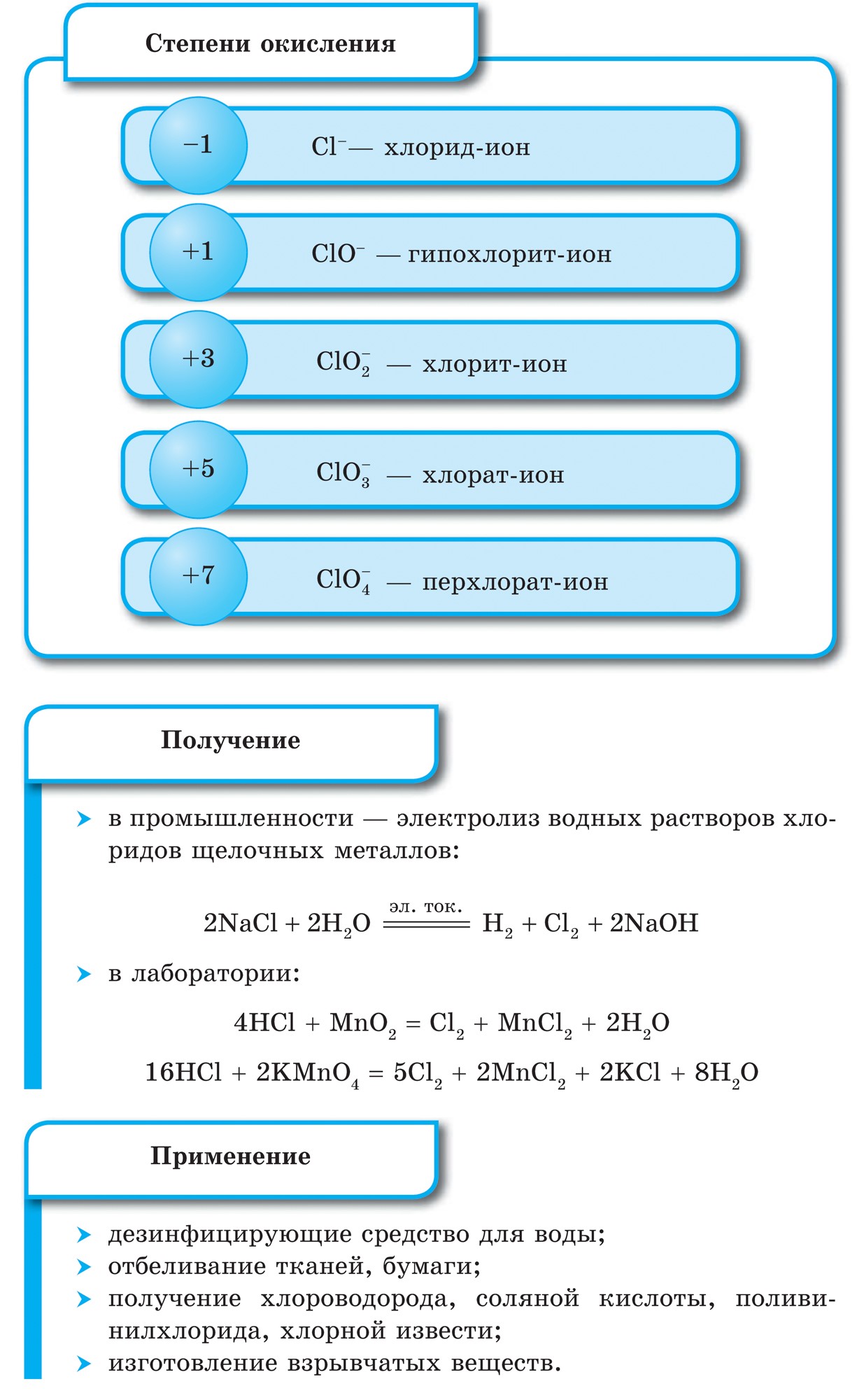
Perioodilise süsteemi VII rühma põhialarühma elemendid, mis on ühendatud üldnimetuse alla halo, Fluor (F), kloor (Cl), broom (BG), jood (I), astatiin (At) (looduses harva nähtav) - tüüpilised mittemetallid. Tse i zrozumilo, isegi їx aatomit kätte maksta sim-elektroonika välise energiataseme kohta, Mul on jooga lõpetamiseks puudu vaid üks elektron. Nende elementide aatomid võtavad metallidega suhtlemisel elektroni metallide aatomitena. Selle veiniga settivad ioonlüli ja soolad. Zvіdsi zagalna nimi "halogeni", st "Narodzhuyut sool".
veelgi tugevamad oksüdeerijad. Fluor keemilistes reaktsioonides näitab ainult oksüdatsioonivõimet ja seda iseloomustab oksüdatsiooniaste -1. Reshta halogeenid võivad avaldada märkimisväärset domineerimist, kui nad suhtlevad rohkem elektronegatiivsete elementidega - fluor, hape, lämmastik, nende oksüdatsiooni samal etapil võivad nad saada väärtuse +1, +3, +5, +7. Halogeenide võimsuse domineerimine suureneb kloorilt joodile, mis on seotud nende aatomite raadiuse suurenemisega: kloori aatomid on ligikaudu kaks korda väiksemad, joodis vähem.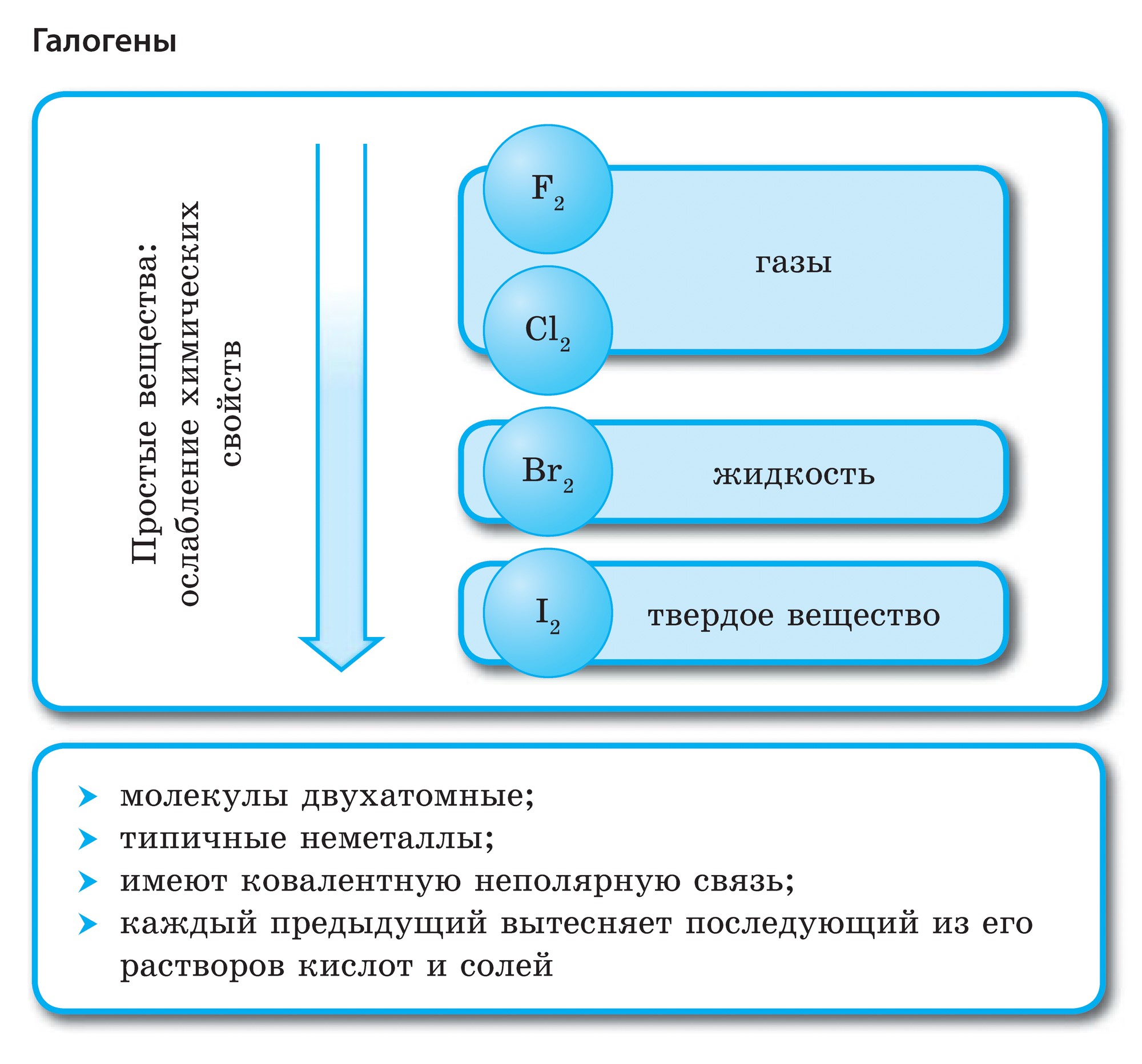
Halogeenid – lihtsalt kõned
Kõik halogeenid on vabas olekus kaheaatomiliste molekulide kujul, mille aatomite vahel on kovalentne mittepolaarne keemiline side. Tugevas terases F 2, Cl 2, Br 2, I 2 molekulaarsed kristallvõred, mida kinnitab їх füüsilised jõud.
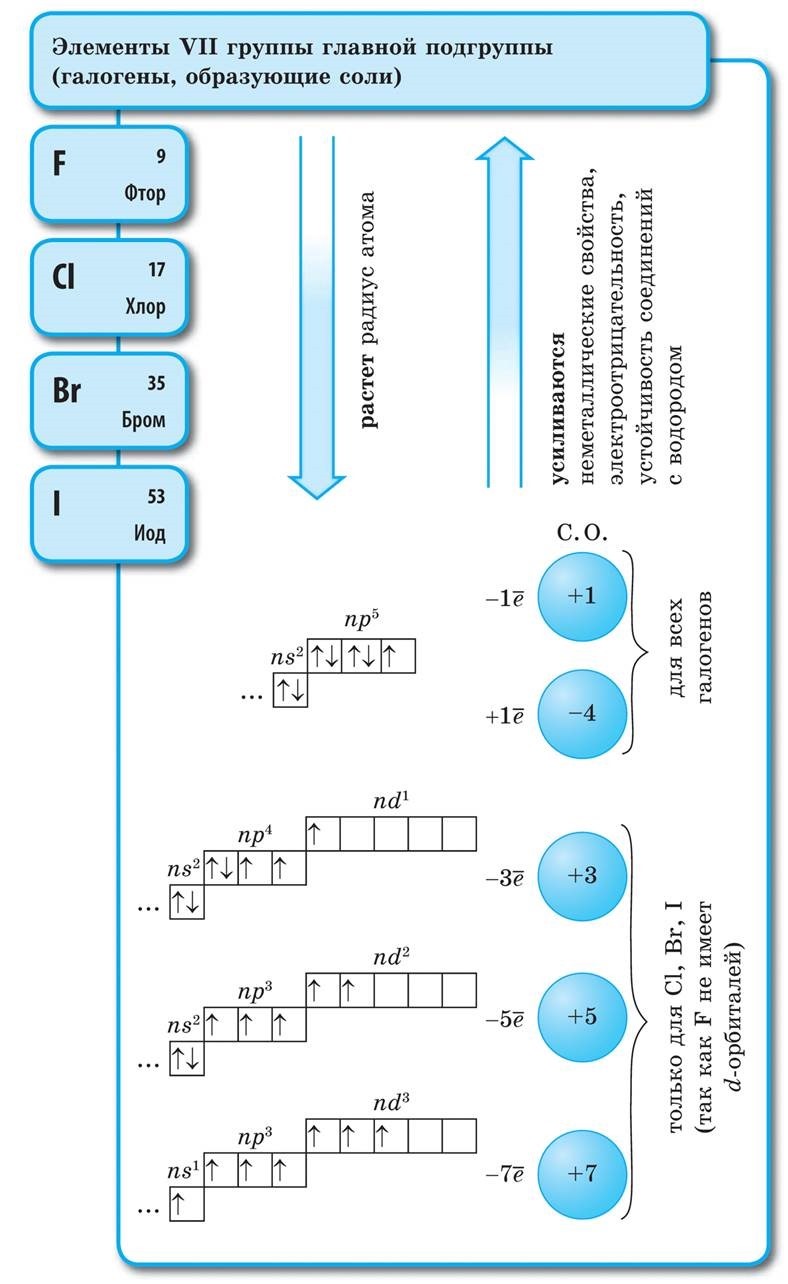
Halogeenide suurema molekulmassiga sulamis- ja keemistemperatuurides liiguvad nad, suurendades tugevust: broom - ridina, jood - tahke kõne, fluor ja kloor - gaasid. See on tingitud asjaolust, et halogeenide aatomite ja molekulide paisumise suurenemisega suurenevad nendevahelise molekulidevahelise interaktsiooni jõud. F 2 kuni I 2 korral suureneb halogeenide saastumise intensiivsus.
Halogeenide, nagu ka mittemetallide keemiline aktiivsus fluorist joodini on nõrk, Joodikristallidel on metalliline sära. Nahahalogeen on oma perioodi tugevaim oksüdeerija. Halogeenide võimsusoksiidid avalduvad metallidega suhtlemisel erineval viisil. Mille juures soolad settivad. Niisiis, fluor reageerib juba rohkemate metallidega ja kuumutamisel kulla, hõbeda, plaatinaga reageerib see keemilise passiivsusega. Alumiinium ja tsink on fluori atmosfääris laialivalguvad:
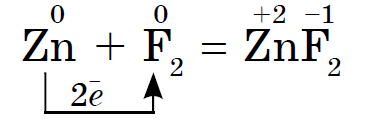
Reshta halogeenid reageerivad kuumutamisel metallidega. Soojendage pihustuspulbrit ja see süttib ka klooriga segades. Dosvidi saab läbi viia nagu antimoniga, kuid ainult siis, kui janu on ees täidetud, on vaja see sisselaskelusikasse torgata ja siis saame selle väikeste portsjonitena klooriga kolbi imbuda. Kuna kloor on tugev oksüdeerija, siis reaktsiooni tulemusena lahustub kloriid (III):
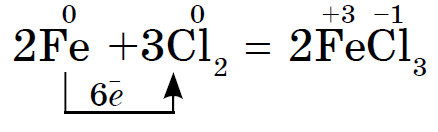
Paarikaupa broom põletatud küpsetatud medniy drіt:
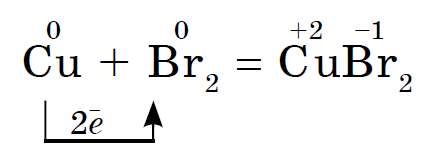
Jood oksüdeerib rohkem metalli, Ale vee juuresolekul katalüsaatorina kulgeb joodi reaktsioon alumiiniumipulbriga isegi vulisevalt:
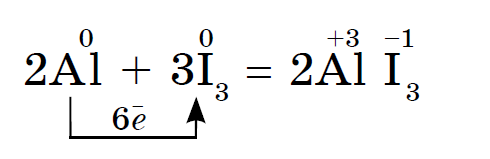
Reaktsiooniga kaasneb violetsete joodiaurude nägemine.
Halogeenide oksüdeerumise muutumisest ja võimsuse suurendamisest fluorilt joodiks saab hinnata nende ehitusvõime järgi võtta üht sooladest, Ja see avaldub ka samal ajal, kui nad suhtlevad veega. Rivnyannya tsієї reaktsioonid saab kirjutada sellise laimu kujul:
Nii nagu fluor suhtleb veega igas mõttes vibratsiooniga, reageerib kloori ja vee summa vähem, kui seda rahustatakse või jäetakse välja otsese unise valguse käes, nii toimib broom veega kuumutamisel ja ilma vibratsioonita. Reaktsioonid on eksotermilised. Joodi reaktsioon veega on nõrgalt endotermiline, kuumutamisel kulgeb see normaalselt.
Nende reaktsioonide tulemusena lahustuvad vesinikfluoriid HF, kloorivesi HCl, vesinikbromiid HBr ja vesinikjodiid HI.
Kloori keemiline domineerimine tabelites

halogeenide import
Fluor ja kloor eemaldatakse nende soolade sulamise või lahustamise elektrolüüsi teel. Näiteks võib naatriumkloriidi sulamise elektrolüüsi protsessi võrrelda:
Kloori eemaldamisel elektrolüüsiga lahustatakse naatriumkloriidi ja kloori vahe ka vees ja naatriumhüdroksiidis:
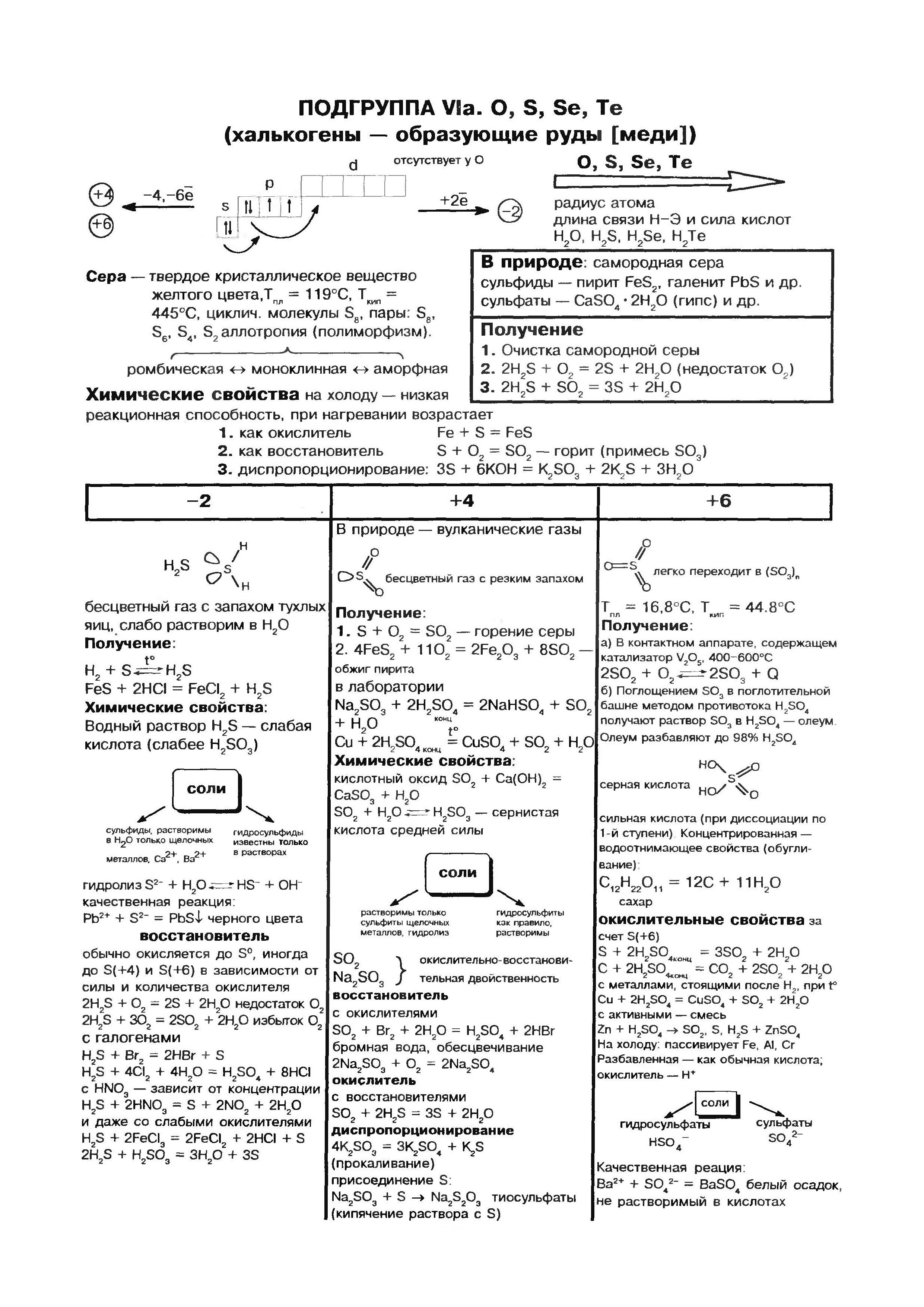
Kisen (oh)- perioodilise elementide süsteemi VI rühma pea alamrühma esivanem. Elemendid tsієї pіdgrupi - kisen O, sіrka S, seleen Se, telurium Ti, polonіy Rho - võib olla üldnimetusega "kalkogeen", mis tähendab "inimesed rudi".
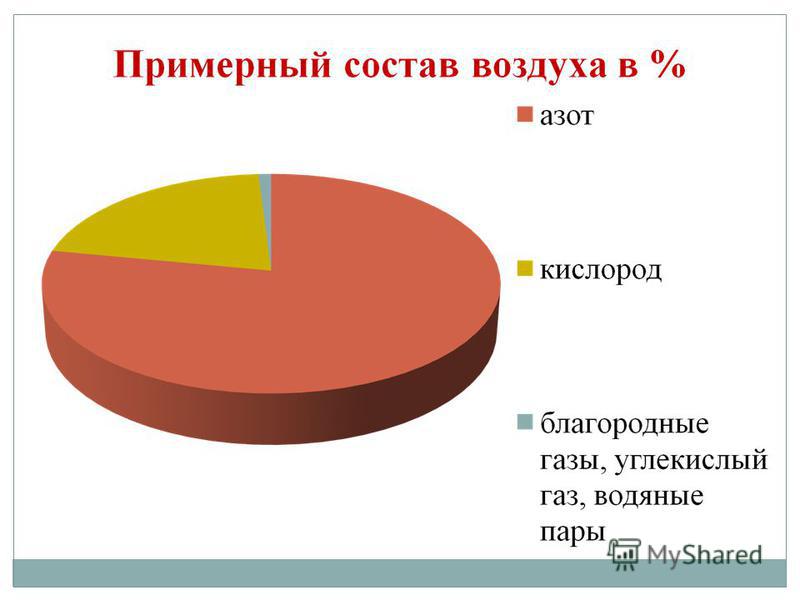
Kisen on meie planeedi kõige laiem element. Vіn siseneb vee lattu (88,9%), kuid see katab 2/3 maakera tuuma pinnast, luues oma veekesta - hüdrosfääri. Kisen - sõber kilkіstyu ja persha jaoks elu tähenduste jaoks laoosa Maa kesta pind on atmosfäär, mis moodustab 21% (mahu järgi) ja 23,15% (massi järgi). Kisen siseneb maa leetrite kõva kesta - litosfääri - arvuliste mineraalide lattu: maakera leetrite nahast langeb 100 aatomit happe osale 58 aatomit.
Esmane kisen on O2 kujul. Tse gaas ilma värvi, lõhna ja maitseta. Haruldases olekus on hele-blakitne zabarvlennya, tahkes - sinine. Vees on gaasitaolist kisenit rohkem, lämmastikku ja vett vähem.
Kisen vzaєmodіє mayzhe z usima lihtsaid kõnesid, halogeenide, väärisgaaside, kulla ja plaatina metallide kreem. Mittemetallide reaktsioonid hapuga kulgevad veelgi sagedamini suure kuumuse nägemisega ja nendega kaasneb põletamine - mäe reaktsioonid. Näiteks tulekahju sirka SO 2 lahustega, fosfor - P 2 O 5 lahustega või vougillya - CO2 lahustega. Kõik reaktsioonid võivad olla eksotermilised. Vignatok muutub koos lämmastiku ja hapuga: endotermiline reaktsioon, kui see toimub temperatuuril üle 1200 ° C või elektrilahendusega:
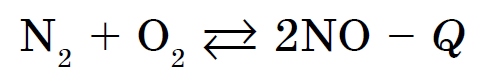
Kisen oksüdeerib energiliselt mitte ainult lihtsat, ale- ja rikkalikult volditud kõnet, millega elementide oksiidid lahustuvad, vaid sellisest haisust äratatakse:
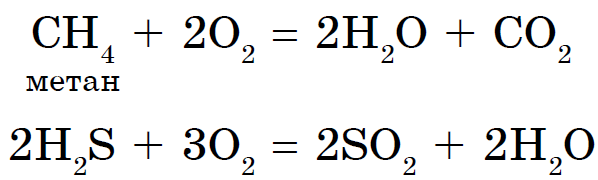
Happe kõrge oksüdatsioonivõimega ehitus on igat tüüpi tulekahjude mäe aluseks.
Kisen osaleb erinevate jõgede täieliku oksüdatsiooni protsessides konstantsel temperatuuril. Hapukuse roll inimeste ja olendite hingamisprotsessis on äärmiselt oluline. Roslini ka poglyayut atmosfääri kisen. Kuigi pimedas toimub ainult kaste hapuga savistumine, siis valguses toimub teine protsess - fotosüntees, mille tulemusena kaste, süsihappegaas on läbimärjaks ja näeb hapu.
Industrialismis saadakse suitsu harvaesinevast kordusest ja laboris - jaotades vesiperoksiidiks katalüsaatori juuresolekul mangaandioksiidiks MnO 2 :
![]()
ja ka kaaliumpermanganaadi KMnO jaotus 4 kuumutamisel:
Hapukuse keemiline domineerimine tabelites

zastosuvannya hapu
Kisen zastosovuyut metallurgia- ja keemiatööstuses fermentatsiooniprotsesside kiirendamiseks (intensiivistamiseks). Puhas kisen zastosovuyt ka kõrgetele temperatuuridele, näiteks gaasitulega ja lõigatud metalliga. Meditsiinis jääb hapukus timchase hingamisraskuse sümptomiteks, mis on seotud mingi haigusega. Samuti kisen zastosovuyt metallurgias oksüdeerijana rakettide tulistamisel, lennunduses hingamisel, metallide lõikamisel, metallide pruulimisel, vibreerivate robotitega. Kisen on võetud musta värvi terassilindritesse rõhu all 150 atm. Laboratoorsetes mõtetes on kisen võetud klaasist tarvikutest - gaasimeetrist.
aatom Sirki (S), Nagu happeaatomid ja kõik teised VI rühma peamise alarühma elemendid, on kättemaks välisenergia tasandil 6 elektroonikat, mille jaoks kaks paaristamata elektroni. Kuid hapnikuaatomite puhul võivad sirka aatomid olla suurema raadiusega, väiksema elektronegatiivse väärtusega, milleni nad näitavad suure võimsuse ilminguid, rahuldades oksüdatsiooniastmete järjekorda. +2, +4, +6. Suurendades vähem negatiivsetele elementidele (vesi, metall), näitab sirka oksüdatsioonivõimet ja suurendab oksüdatsioonitaset -2 .
Sirka - lihtne kõne
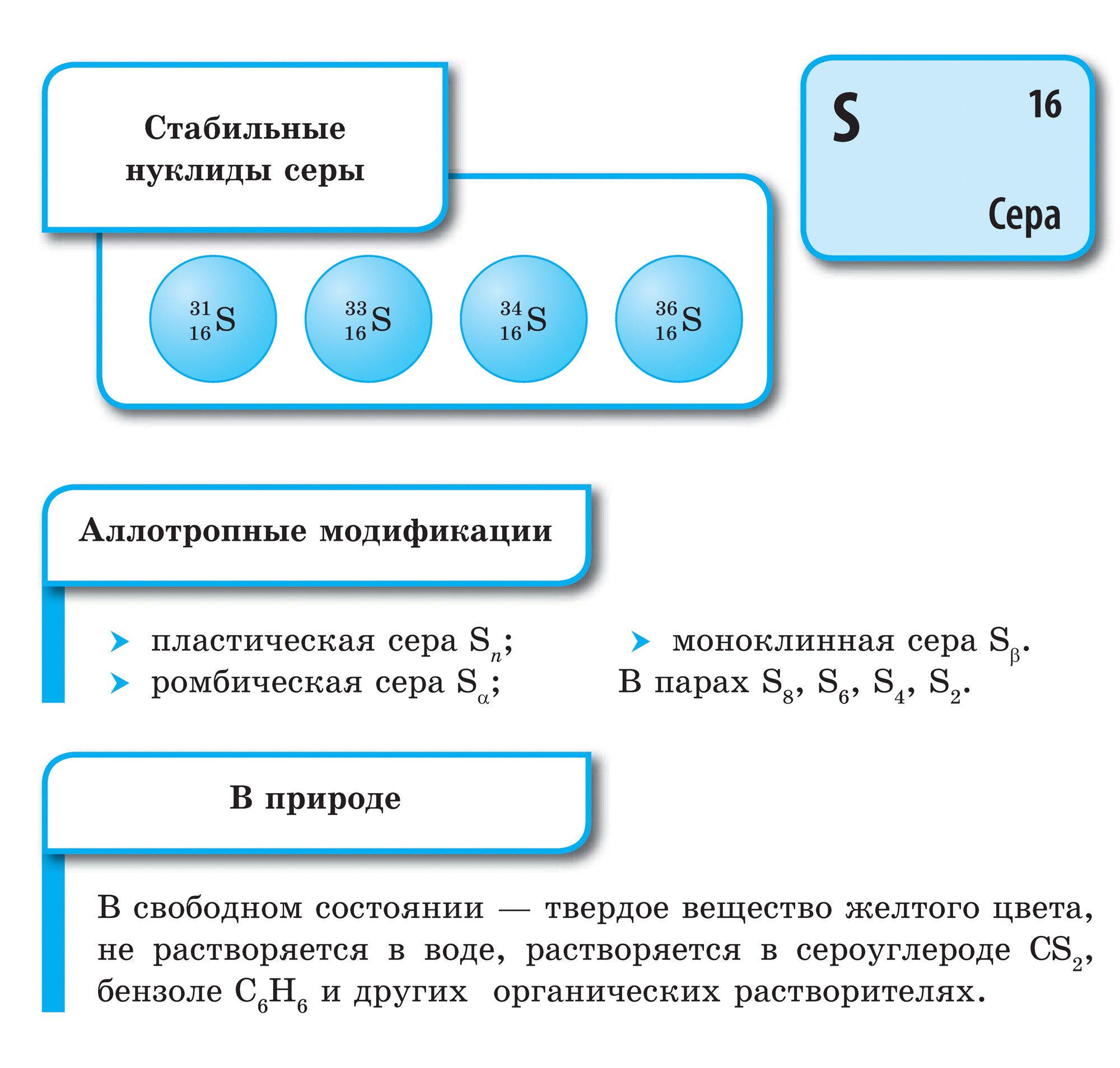
Sirkale, nagu kisnyule, on iseloomulik allotroopia. Sirki Vіdomo rikkalik modifikatsioon erinevate lao tsükliliste või lineaarsete budovaya molekulidega.
Kõige stabiilsem modifikatsioon, mida tuntakse rombilise ringina, mis koosneb S8 molekulidest. Lõhn on sidrunkollase värvusega vürtsikas ja joovastav, sulamistemperatuur on 112,8 ° C. Selles toatemperatuuril modifikatsioonis muudetakse kõik muud modifikatsioonid. Kristalliseerumise ajal väljub sulamistemperatuurist (kristalli põhiosa, sulamistemperatuur 119,3 ° C) monokliiniline sirka ja seejärel muutume rombikujuliseks. Kuumutamisel proovides olev shmatochkiv sirka sulab, muutudes kollaseks kodumaaks. Temperatuuril 160 ° C lähedal hakkab see peagi tumenema, muutub paksuks ja viskoosseks, ei vingerda katseklaasist välja, edasisel kuumutamisel muutub see kergelt murenevaks emamaaks, kuid omandab suure tumepruuni värvi. . Yakscho її vility sisse külm vesi, jäi Vaughnile silma läbipaistev kummine mass. Tihend on plastikust. Saate seda niitide väljanägemise järgi võtta. Mõne päeva pärast muutub see ka rombikujuliseks ringiks.
Sirka ei eraldu veest. Sirka kristallid vajuvad vee lähedale ja pulbri telg hõljub veepinnal, kuna sirka kuivad kristallid ei urineeri veega ja need uputatakse uuesti tilkuvate sibulate abil veepinnale. Flotatsiooni protsess. Sirka lahustub halvasti etüülalkoholis ja dietüüleetris, jaotub hästi väävlisöes.
Suure vaimuga sirka reageerib usima tina ja luzhnoearth metallidega, mõdu, elavhõbeda, hõbedaga, Näiteks:
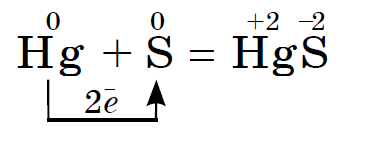
See reaktsioon on tingitud elavhõbeda väljavoolust, näiteks katkisest termomeetrist. Nähtavad elavhõbedatilgad saab koguda arkushi paberile või keskmisele plastikule. Seda elavhõbedat, mida ma pragudesse jõin, tuleb sirkapulbriga leotada. Seda protsessi nimetatakse demercuriseerimiseks.
Kuumutamisel reageerib sirka teiste metallidega (Zn, Al, Fe) ja ainult kuld ei suhtle sellega mingil põhjusel. Sirka võimsuse oksiidid näitavad ka veega, kuumutamisel on sarnane reaktsioon:
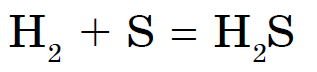
Väävliga mittemetallid ei reageeri ainult lämmastiku, joodi ja väärisgaasidega. Sirka põlevad sinakad pooltuled, kustutades vääveloksiidi (IV):
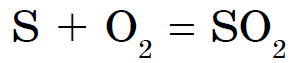
Tse z'ednannya on laialt tuntud syrchisty gaasi nime all.
Sirka keemiline domineerimine tabelites

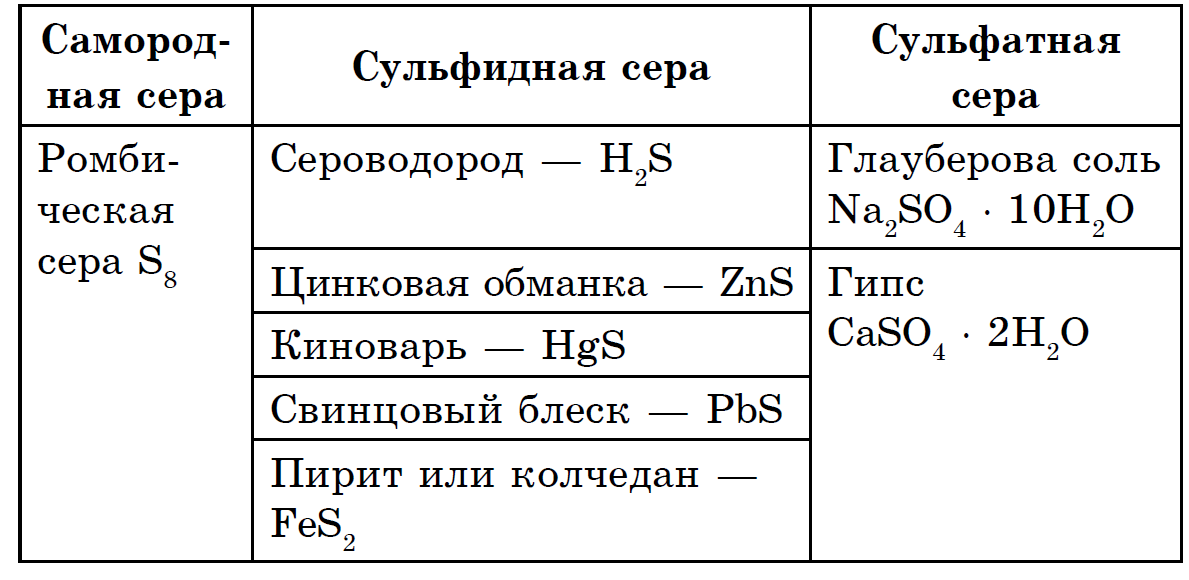
Ümbermõõt on viidud väga laiade elementideni: maakoor maksab massi eest 4,7 10-2% maapinnast (väikseimate elementide seas 15. koht) ja Maa tervikuna on rikkam (0,7%). Sirka peamass leidub maasügavustes, її vahevööpallides maakoore ja Maa tuuma vahel turrituna. Siin, umbes 1200–3000 km sügavusel, leitakse intensiivne sulfiidide ja metallioksiidide pall. Maakoores triibutab sirka nagu vabas laagris (põliselanik), seega näeb peaastmes välja nagu pool sulfiide ja sulfaate. 3 sulfiidi maakoores kõige laiem püriit FeS2, kalkopiriit FeCuS2, plii blisk (galena) PbS, tsingi segu (sfaleriit) ZnS. Sirka on suurtes kogustes hajutatud maapõues oluliste sulfaatide - kips CaSO4 · 2H2O, bariit BaSO4, merevees, magneesiumsulfaadi, naatriumi ja kaaliumi läheduses.
Tsikavo, et Maa geoloogilise ajaloo iidsetel aegadel (umbes 800 miljonit aastat tagasi) ei olnud looduses sulfaate. Hais on settinud sulfiidide oksüdatsiooniproduktina, kui atmosfäär on vinüülkasvu eluea tõttu hapu. Vulkaanilistes gaasides ilmnevad H2S ja väävelanhüdriid SO2 päev. Selleks võib looduslike vulkaanide (Sitsiilia, Jaapan) lähedal asuvates piirkondades lõksu jäänud sirka kahe gaasi koosmõjul asuda:
2H 2S + SO 2 \u003d 3S + 2H 2O.
Teised loodusliku sirka kihid on seotud mikroorganismide eluga.
Mikroorganismid võtavad rikaste saatuse keemilised protsessid, Tervikuna moodustavad nad sirka ringluse looduses. Sest їх spriyanya sulfiidid oksüdeeritakse sulfaatideks, sulfaadid savistatakse elusorganismide poolt, de sirka taastatakse ja siseneb valkude ja muude oluliste eluressursside lattu. Mädanenud liialdustega organismides lagunevad valgud kokku ja saabub keskpäev, mis oksüdeerub edasi kas elementaarseks sirkaks (nii sirkid settivad) või sulfaatideks. Tsikavo, et bakterid ja vetikad, mis oksüdeerivad jooksva päeva kuni sirka, korjavad oma rakkudesse її. Selliste mikroorganismide rakud võivad 95% ulatuses koosneda puhtast sirkast.
Sirka olemust on võimalik kindlaks teha selle ilmselguse järgi tema analoogis - seleenis: nagu looduslikus sirkas kasvab seleen, siis vulkaanilise sirka sirka, kuna seda pole - biogeenne, nii et mikroorganism on ainulaadne, hõlmavad Seleeni oma elutsüklis, on ka biogeenne maksta rohkem isotoobi 32S, madalama raske 34S eest.
Sirka bioloogiline tähtsus
Elu on oluline keemiline element. Võitis siseneda valkude lattu - kõigi elusorganismide rakkude üks peamisi keemilisi komponente. Eriti rikkalikult valgeid juukseid, sarvi, väljast. Krym tsgogo, sirka є osa bioloogiliselt aktiivsetest kõnedest kehale: vitamiinid ja hormoonid (näiteks insuliin). Sirka osaleb organismi oksiid-vesi protsessides. Kui kehas on sirka puudus, täheldatakse nutmist ja harjade haprust ning juuste väljalangemist.
Siroi rikkad oataimed (herned, pungad), viinapuu plastid, munad.
sirka
Sirka vikoristovuєtsya mitmesuguste sirniki- ja paberi-, närimiskummide ja farbi, vibuhovi- ja likvi-, plasti- ja kosmeetikatoodetega. Maakohtades kasutatakse vikoriste võitluseks roslyni koolilaste vastu. Sirka peamine elupäästja on aga keemiatööstus. Ligi pool sellest, mida väävelhappe maailmas väävelhappe tootmiseks saadakse.
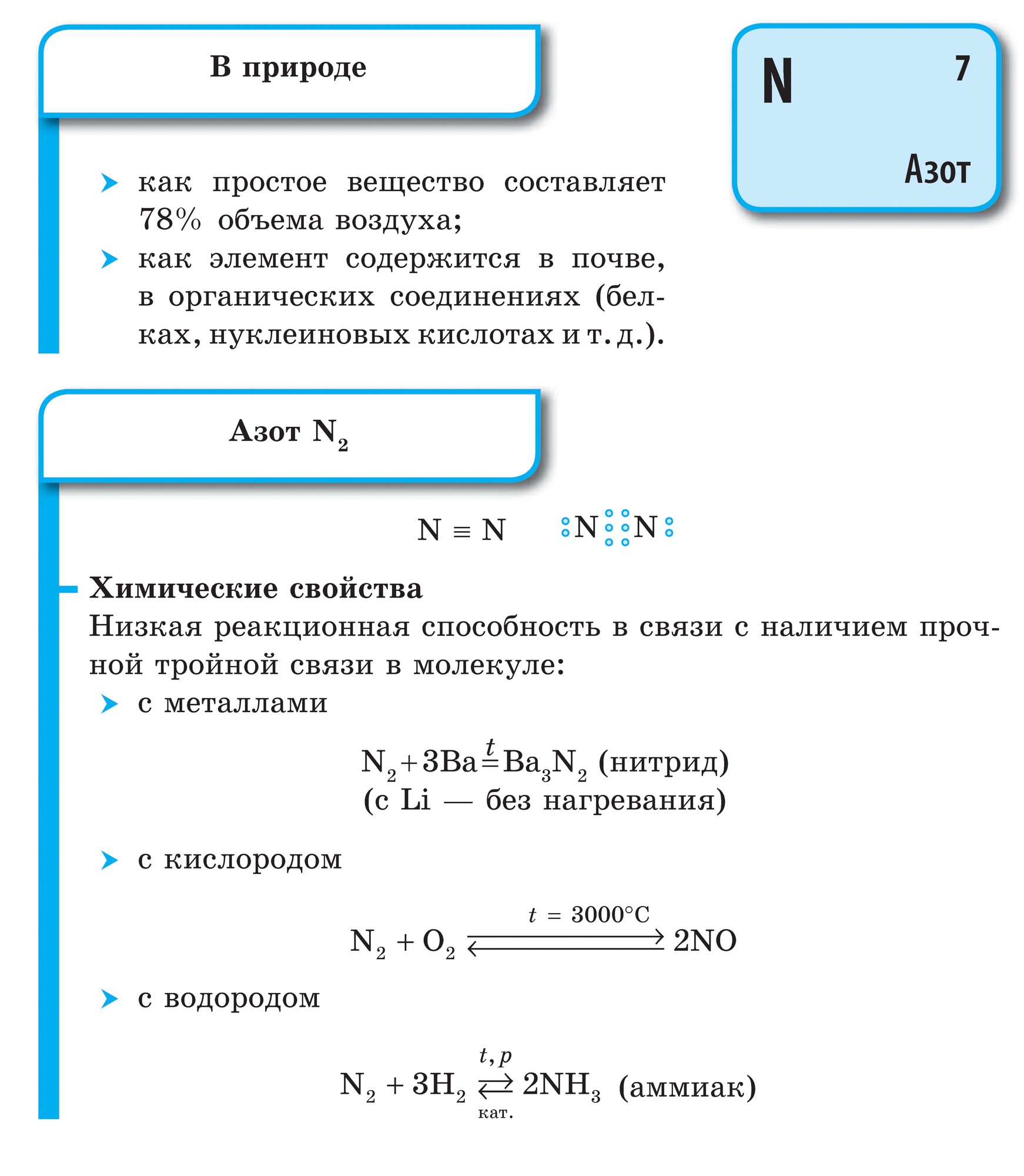
lämmastik
![]()
Lämmastik (N)- perioodilise süsteemi V rühma peaalarühma esimene esindaja. Võrdse energiataseme eest tuleb kätte maksta viis elektroni, millest kolm paaritu elektroni. Tundub, et nende elementide aatomeid saab ühendada kolm elektroni, mis viib praeguse energiabilansi lõpule.
Lämmastikuaatomid võivad anda oma elektrone rohkem elektronegatiivsetele elementidele (fluor, hape) ja ujuda selles oksüdatsiooniastmes +3 ja +5. Lämmastikuaatomitel on oksüdatsioonifaasis kõige olulisem jõud +1, +2, +4.
Vabas terases on lämmastik kaheaatomiliste molekulide N 2 vees. Selles molekulis on kaks N aatomit seotud peaaegu identse kovalentse sidemega, sidemeid saab ära tunda järgmiselt:

Lämmastik on traadita gaas, lõhnatu ja maitsev.
Suure vaimuga lämmastik vzaimodiє tіlki z lіtієm, utvoryuyuchi nitriid Li 3 N:
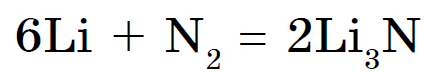
Teiste metallidega vіn vzaєmodіє ainult kõrgel temperatuuril.
Ka kõrgetel temperatuuridel ja kruustangidel katalüsaatori juuresolekul reageerib lämmastik veega, moodustades ammoniaagi:
Elektrikaare temperatuuril hakkavad veinid hapuks minema, lahustades lämmastikoksiidi (II):
Lämmastiku keemiline domineerimine tabelites

lämmastiku tarbimine
Harva destilleerimisel saadud lämmastik on ammoniaagi sünteesi ja sünteesi tööstuses seisma jäänud lämmastikhape. Meditsiinis on puhas lämmastik kopsutuberkuloosi ravimiseks inertses keskkonnas seisev ja haruldane lämmastik harja-, lume- ja jäähaiguse ravimisel.
fosforit
Keemiline element fosfor moodustab allotroopsete modifikatsioonide kilu. Kaks neist on lihtsad kõned: valge fosfor ja punane fosfor. Valgel fosforil on molekulaarne kristallvõre, mis koosneb P4 molekulidest. Ebaühtlused vee lähedal, sirkovoolus lahkesti laiali. Pinnal on see kergesti oksüdeeruv ja pulbritaolises terases süttib. Valge fosfor on rabedam. Erilise jõuga särab hoone pärast oksüdatsiooni pimeduses. Võtke see veega Punane fosfor on tume karmiinpunane pulber. Chi ei erine ei vee ega süsinikdisulfiidi poolest. Pealtnäha oksüdeerub korralikult ja ei tööta. See ei ole mürgine ega sära pimeduses. Kuumutamisel muutub veiniproovides sisalduv punane fosfor valgeks fosforiks (pari kontsentratsioon).
Punase ja valge fosfori keemiline jõud on lähedane, kuid valge fosfor on keemiliselt aktiivne. Niisiis suhtlevad solvavad haisud metallidega, rahuldades fosfiidi:
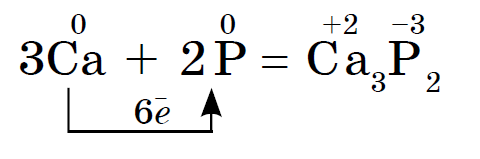
Valge fosfor haakub pinnal ise ja punane fosfor põleb sülitades. Mõlemas vipadis on lahustunud fosfor (V) oksiid, mis on näha paksu valge suitsuna:
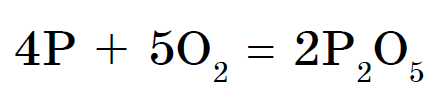
Fosfor ei reageeri ilma vahenduseta veega, fosfiini PH 3 saab kõrvuti võtta näiteks fosfiididest:
Fosfiin – duje kliid gaas h vastuvõetamatu lõhn. Pinnal on kerge põletada. Fosfiini jõud ja seletab rabades lõõmavate tulekahjude väljanägemist.
Fosfori keemiline domineerimine tabelites


fosfori tarbimine
Fosfor on kõige olulisem biogeenne element ja samal ajal tööstuses laiemalt tuntud. Chervoniy fosfori zastosovuyut kell virobnitsvі sіrnikov. Kandke samaaegselt peeneks lõigatud voldi ja liimiga karbi välispinnale. Kui tertі s_rnikovoї pea, lattu, mis sisaldab kaaliumkloraati ja sirka, on vaja laenutada.
Mabut, fosfori esimene jõud, nagu inimene end teenistusse paneb, on põlevus. Fosfori põlevus on veelgi suurem ja ladestub allotroopsete modifikatsioonidena.
Kõige aktiivsem keemiliselt, mürgine ja põlev valge ("kollane") fosfor, mis sageli zastosovuetsya veini (in kruntimispommid jne).
Chervoniy fosfor - peamine modifikatsioon, viroblena ja spozhivana tööstus. Vіn zastosovuєtsya at virobnitstvі sіrnikovіv, vybuhovyh chovina, kaitsmete laod, erinevad tüübid paliva, aga ka kinnijäämisvastased õlimaterjalid, nagu gaasipõletavad lambid lampide soojendamiseks.
Fosfor (nagu fosfaadid) on üks kolmest kõige olulisemast biogeensest elemendist, mis osaleb ATP sünteesis. Suur osa väändunud fosforhappe minge fosforilisandite valikule - superfosfaat, sade, ammofosfaat ja sisse.
Fosfaate levitatakse laialdaselt:
- kompleksi moodustavate ainetena (kassid vee pehmendamiseks),
- laos Pasivator pinnametallist (korrosioonikaitse nt t. zv. ladu "mazhef").
Zdatnistst fosfativ vormimiseks mіtsnu trivimіrny polümeervõrk vikorivuєtsya fosfaat- ja aluminofosfaatsidemete valmistamiseks.
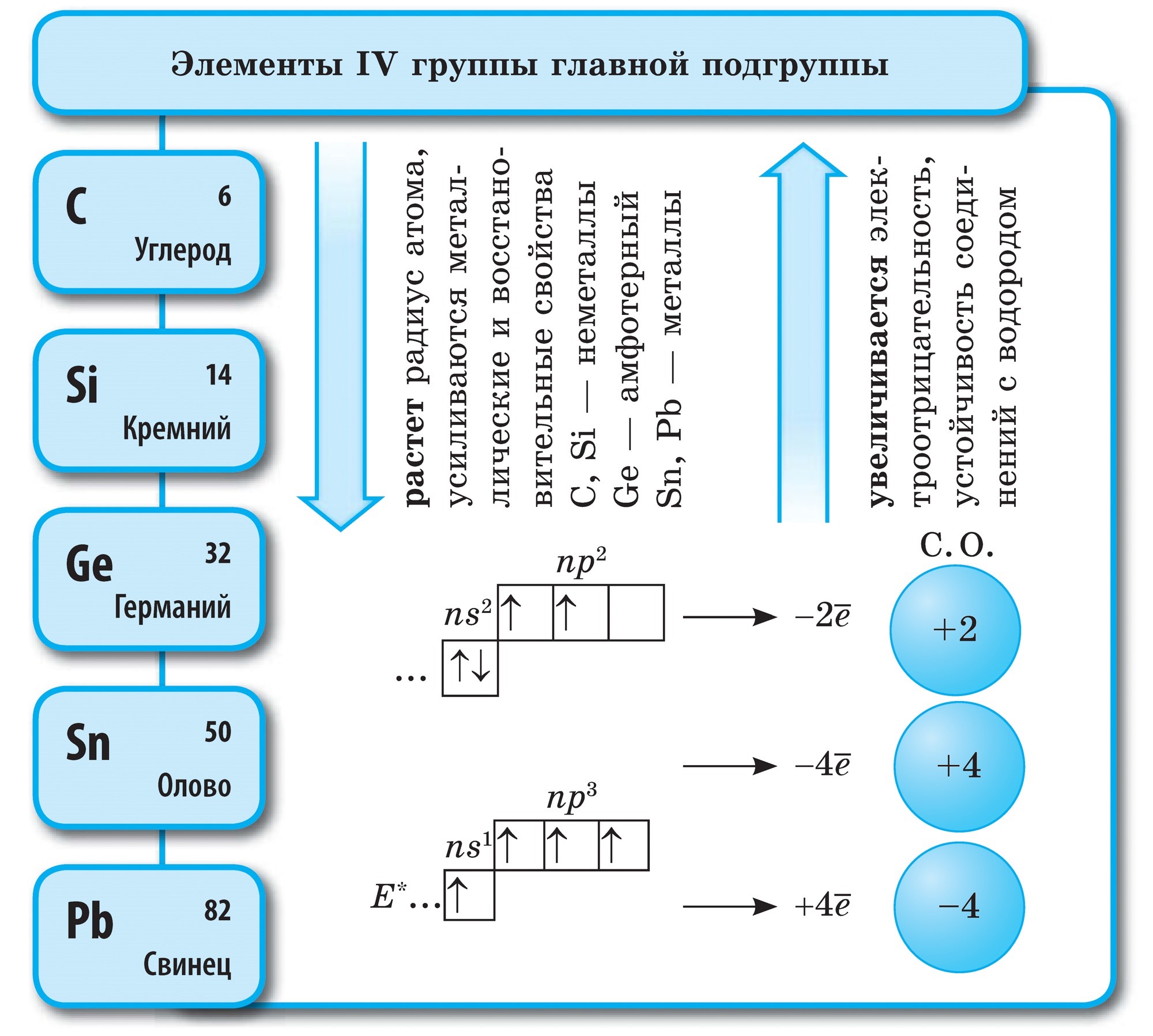
süsi
Vugletid (C)- perioodilise süsteemi VI rühma põhialarühma esimene element. Joogo aatom ja kättemaks 4 elektroni tasemel, nii et hais võib vastu võtta chotiri elektroni, mis paisub, millises oksüdatsioonifaasis -4 , I.E. Näidake võimsuse oksiide ja andke nende elektronidele rohkem elektronegatiivseid elemente, st. +4.
Vuglets – lihtne kõne
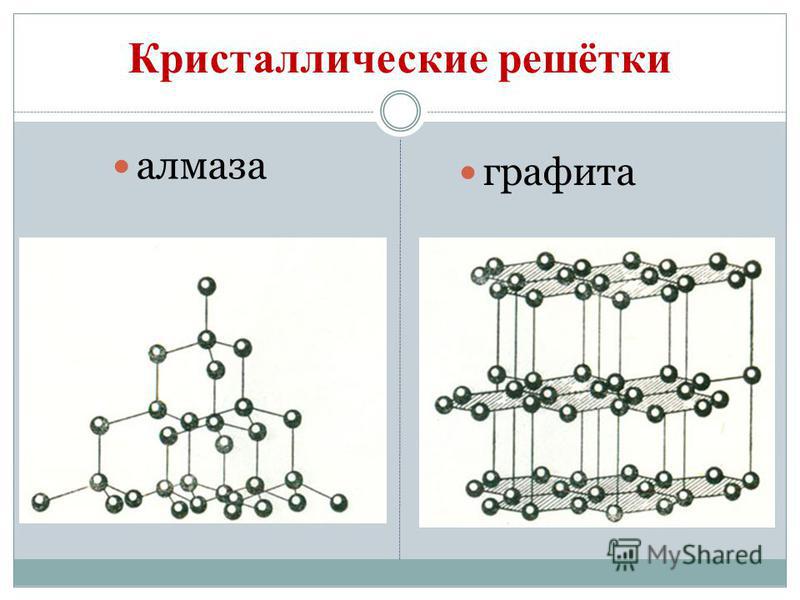
Kivisüsi rahuldab allotroopseid modifikatsioone teemant ja grafiit. Teemant on selge kristallkõne, kõige raskem loomulikest kõnedest. Vіn on kõvaduse etalon, kuna kümnepallisüsteemi puhul hinnatakse seda kõrgeima palliga 10. Teemandi sellist kõvadust seob selle aatomkristallsõela eriline struktuur. Sellel on nahaaatom, mille süsinikulõiked on samade aatomitega ja mis on korrapärase tetraeedri tippudes volditud.
Teemantkristallid helisevad ilma ribata, kuid need on sinist, musta, punast ja musta värvi. Hais võib olla isegi suure valgust murdva ja valgust painduva hoone päikesepaisu tugev peegeldus. Ja tuuled on erakordselt kõrge karedusega; lihvimistööriistad, Rizannya ladu.
Suurimad teemantide perekonnad asuvad Pivdenny Aafrikas ja Venemaal Jakuutias.
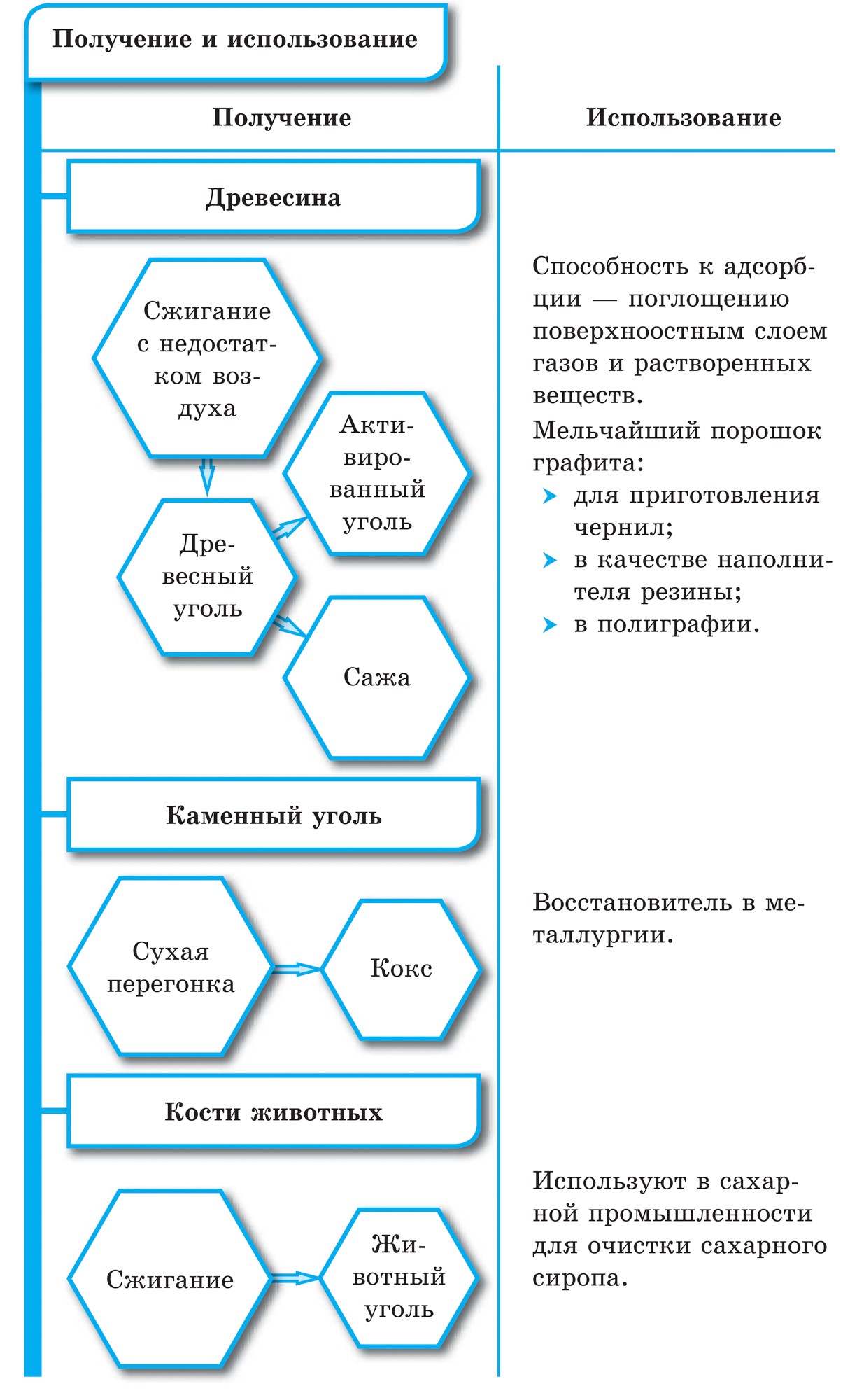
Grafiit – tumehall, rasvane dotikkristallilisel kõnel, millel on metalne sära. Teemandi esiküljel on grafiit pehme (jätab paberile jälje) ja läbipaistmatu, juhib hästi soojust ja elektrit. Grafiidi pehmus on vooderdatud sfäärilise struktuuriga. Grafiidi kristallvõres on süsiniku aatomid, mis asuvad ühes tasapinnas, hoolikalt seotud õigeks kuueks tükiks. Tähed õhupallide vahel Malomitsnі. Vin on ka tulekindel. Grafiiti valmistatakse elektroodidest, tahketest õlidest, tuumareaktorite neutronite ehitajatest ja oliivide kääridest. Kõrgete temperatuuride ja grafiidi haarde korral saadakse tükkteemandid, mida kasutatakse laialdaselt tehnoloogias.
Sarnaselt Budovi grafiidiga saab ka Vugillya külas tahma valada. Vugillya küla võetakse küla kuivdestilleerimise käigus ära. Tse vugіllya zavdjaki selle poorne pind võib imeline hoone savigaasi ja kõne. Võimsuse eesmärki nimetatakse adsorptsiooniks. Mida suurem on puidust vugi poorsus, seda tõhusam on adsorptsioon. Savihoone suurendamiseks muudetakse Vugillya küla kuumaks veeauruks. Sel viisil värskendamist nimetatakse aktiivseks või aktiivseks. Apteekides müüakse joogot, mis näeb välja nagu mustad karboleeni tabletid.
Söe keemiline jõud
Teemant ja grafiit muutuvad kõrgel temperatuuril hapuks. Tahm ja vugіllya vzaєmodіyut koos hapu kergemini, põletades öösel. Ale, olge sarnases meeleolus, on sellise interaktsiooni tulemus sama - süsinikdioksiid settib:
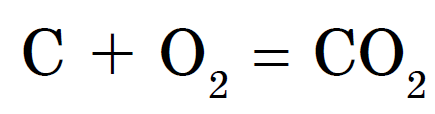
Metallidega, kuumutamisel süsi karbiid:
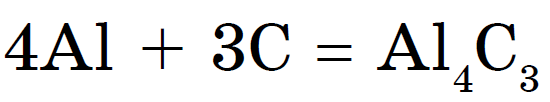
alumiiniumkarbiid- helekollased kristallpuhastused. Vidomy karbіd kaltsіyu Sas 2 näeb välja nagu shmatkіv halli värvi. Yogo stop gaaskeevitajad atsetüleeni eemaldamiseks:
atsetüleen silmapilk metallide lõikamiseks ja pruulimiseks, põletav jooga lisahappe saamiseks spetsiaalsetes sussides.
Kui tõstate vett alumiiniumkarbiidile, näete rohkem gaasi - metaan CH 4:
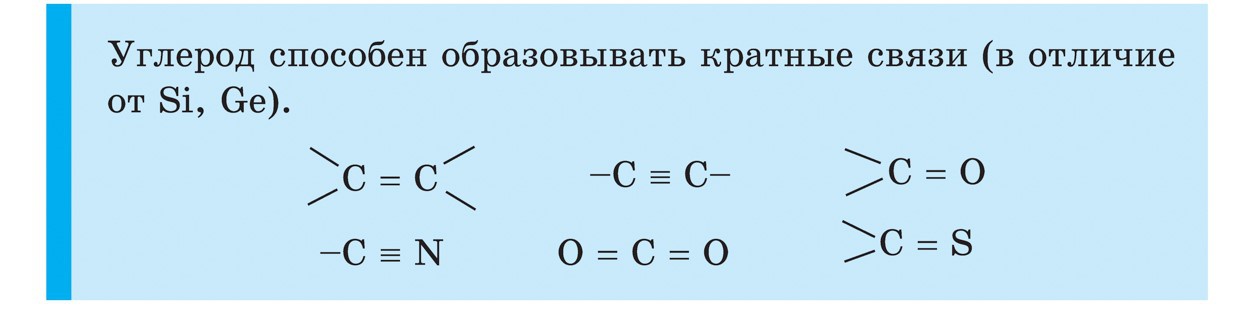
räni
Räni (Si) on perioodilisuse süsteemi IV rühma peamise alarühma teine element. Looduses on räni veel üks happe laiuse keemiline element. Maakoor on ühest neljandikust rohkem kui neljandiku volditud. Räni suurim paisutaja on jooddioksiid SiO 2 – ränidioksiid. Looduses koosnevad veinid mineraalsest kvartsist ja rikkalikust sordist, seega on lilla vorm – ametüst, aga ka ahhaat, opaal, jaspis, kaltsedon, karneool kuulus nagu girsky kristall ja joogo. Ränidioksiid on sama, mis kõige olulisem ja kvartsliiv. Teine räni looduslike materjalide tüüp on tse-silikaat. Nende hulgas on kõige laiemad alumosilikaadid graniit, näha erinevat savi, vilgukivi. Silikaat, mis ei maksa kätte alumiiniumi, näiteks asbesti. Ränioksiid on vajalik rosliini ja olendite eluks. Vіn dodaє mіtsnіst vars roslinі і zahishnih pokrittiv olendid. Räni lisab inimeste luudele siledust ja pehmust. Räni siseneda madalamate elusorganismide lattu – ränivetikate ja radiolaariumide lattu.
Räni keemiline jõud
Räni põleb hapus, kustutav ränidioksiid või räni(IV)oksiid:
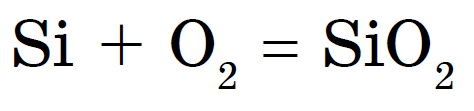
Kuna tegemist on mittemetalliga, sulanduvad viinapuud kuumutamisel metallide ja tihenditega silitsiidid:
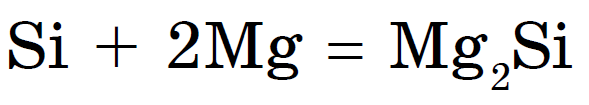
Silitsiidid levivad kergesti vee või hapetega, millega nähakse räni gaasitaolist vett - silaan:
4HCl + Mg2Si → SiH4 + 2MgCl2
On vіdmіnu vіd vіd vuglevnіv silaan on poіtry füüsilisest isikust ettevõtja ja põleb heakskiidetud ränidioksiidi ja veega:
Silaani suurenenud reaktsioon segus metaaniga CH4 on seletatav asjaoluga, et ränil on suurem aatomi suurus, väiksem süsinik, keemilised sidemed Si-H on nõrgem kui S-H.
Räni koosmõju kontsentreeritud vesirooside heinamaaga, rahustavad silikaadid ja vesi:
Räni on võidetud, jooga kombineerimine magneesiumdioksiidi või süsinikuga:
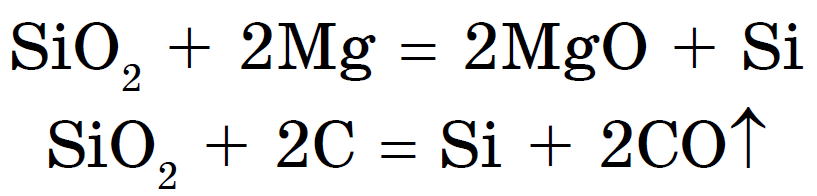
Ränioksiid (IV) või ränidioksiid või ränidioksiid SiO 2, jak і CO 2, є happeoksiid. Kuid vіdmіnu vіd CO 2 puhul ei saa see olla molekulaarne, vaid aatom kristallvõre. Seetõttu on SiO 2 kõva ja tulekindel kõne. Viin ei erine vee ja hapete, vesinikfluoriidse koore ja kõrgel temperatuuril ränihappe sooladega heinamaadel - silikaadid:
Räni võib eemaldada ka ränidioksiidi sulamiga metallioksiidide või karbonaatidega:
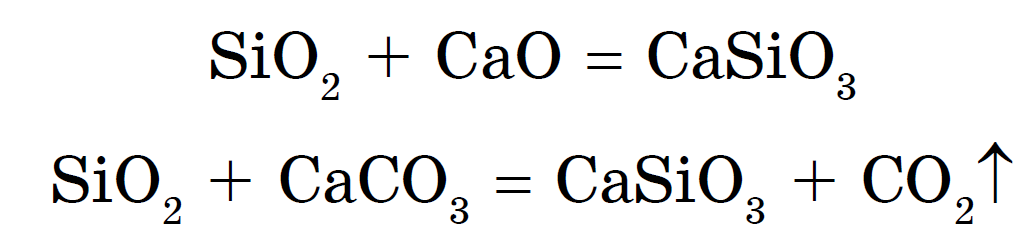
Naatriumi ja kaaliumi silikaate nimetatakse jaemüügijäätmeteks. x Veevarustus- hea on kasutada silikaatliimi. Neil on rohkem tugevaid happeid - vesinikkloriid-, väävel-, oktovoe- ja navitsüsihape - ränihape H 2 SiO 3 :
otzhe, H 2 SiO 3 - väga nõrk hape. Vaughn on vees lahustumatu ja langeb hinnalise piiramise nähes reaktsioonilise segaduse alt välja; Kui rippuvad tsієї masi utvoryutsya väga poorne kõne - silikageeli, laialdaselt zastosovuvaniya kvaliteedi adsorbendi - savi іnshih speakovina.



Dovidkovy materjal testi läbimiseks:
perioodilisustabel
Jaemüügi tabel