Страница 1
Кристалната решетка от алуминий е центриран върху лицето куб, който е стабилен при температури от 4 К до точката на топене.
Кристалната решетка на алуминия, както и много други метали, се състои от центрирани върху лицето кубчета (вж. Стр. Топлопроводимостта на алуминия е два пъти по-голяма от топлопроводимостта на желязото и е равна на половината от топлопроводимостта на медта. Електрическата й проводимост е много по-висока от тази на желязото и достига 60% от електропроводимостта на медта).
Изкривяването на кристалната решетка на алуминия поради пренасищането му с мед води до увеличаване на якостта и твърдостта на сплавта. Когато втвърдената сплав е във въздуха, в нея спонтанно протичат процеси, които променят структурата. Медните атоми, които се стремят да се откроят от кристалната решетка на алуминия, са групирани в отделни секции, разпределени равномерно в целия обем на сплавта. Това увеличава изкривяването на кристалната решетка и увеличава твърдостта и здравината на сплавта. В местата за натрупване на медни атоми се образува кристална решетка CuA12, в която атомите А1, разположени на границата, едновременно влизат в структурата на кристалната решетка CuAls и алуминиевата кристална решетка. Образуването на такава структура води до допълнително изкривяване на алуминиевата кристална решетка и като следствие до втвърдяване на сплавта.
И така, кристалната решетка от алуминий, мед, сребро има формата на лицево центриран куб; натрий, калий, барий - телесноцентриран куб, а магнезият, цинкът и кадмият кристализират в шестоъгълна решетка. Някои метали кристализират в две или повече полиморфни форми.
Тези елементи, разтварящи се в кристалната решетка на алуминия, значително я укрепват и само леко намаляват пластичността, осигурявайки добра деформируемост на сплавите.
Тъй като медта има голям атомен радиус (/ GU 1 275 A), тя изкривява кристалната решетка на алуминия (rAi 1 43 A) и увеличава механичните свойства на сплавта. Излагането при 150 - 180 С предизвиква изкуствено стареене, придружено от разлагане на твърдия разтвор с освобождаване на междинната 0-фаза в местата на концентрация на мед, която не се различава по химичен състав от стабилната фаза CuA12, но има изкривена тетрагонална решетка.
Тъй като медта има голям атомен радиус (r si 1 275 A), това изкривява кристалната решетка на алуминия / A1 1 43 A) и увеличава механичните свойства на сплавта. Излагането при 150 - 180 С предизвиква изкуствено стареене, придружено от разлагане на твърдия разтвор с освобождаване в местата на концентрация на мед на междинната b - фаза, която не се различава по химичен състав от стабилната CuA12 фаза, но има изкривена тетрагонална решетка.
Активността на А1 се дължи не само на участието в образуването на връзки на d - орбитали, но и на по-ниската якост на кристалната решетка на алуминия в сравнение с бор.
Активността на алуминия се дължи не само на участието му в образуването на връзки на rf - орбитали, но и на по-ниската якост на кристалната решетка на алуминия в сравнение с бор.
Електронен лъч, падащ върху алуминиева плоча, дава дифракционен модел при отражение и ъгловото отклонение (от центъра на този модел) на дифракционния максимум от втори ред в Г Периодът на алуминиевата кристална решетка (разстояние между атомните равнини) d 0 405 nm.
По този начин кристалната решетка от алуминий, мед и сребро има формата на лицево центриран куб; натрий, калий и барий - телесноцентриран куб, и магнезий, цинк и кадмий - шестоъгълна решетка. Някои метали кристализират в две или повече полиморфни форми.
Във въздуха алуминият бързо се покрива с тънък оксиден филм. Първите слоеве на този филм възпроизвеждат кристалната решетка на алуминия, образувайки много здрава връзка. През последните 15 години механизмът на растеж на оксидния филм се използва успешно за създаване на изключително високотемпературни сплави, подсилени от диспергирани частици алуминиев оксид. Чрез специално отглеждане на удебелен филм по химичен или електрохимичен метод и въвеждане на различни пълнители в него, можете да му придадете всякакъв цвят.
Прясно втвърденият дюралуминий има ниска якост и висока пластичност, въпреки наличието на пренаситен твърд разтвор на мед в алуминий. Това се дължи на факта, че структурата на кристалната решетка на алуминий и мед е еднаква (fcc) и параметрите на решетката се различават леко. Дуралуминът придобива високи якостни свойства само в резултат на последващо стареене. Стареенето е процесът на промени в структурата и свойствата на втвърдените сплави, който настъпва спонтанно при стайна или повишена температура.
Силумини, които се втвърдяват след термична обработка, например след закаляване при 520 - 530 и продължително изкуствено стареене за 10 - 30 часа. Тяхната висока якост след стареене се обяснява с изкривяването на кристалната решетка на алуминия и отделянето на зоните на Guinier-Preston.
„Химия на кристалните решетки“ - Молекулярните решетки се наричат \u200b\u200bкристални решетки, в възлите на които са разположени молекулите. Оценка на вашия собствен напредък. Твърдо вещество. В природата има малко вещества с атомна кристална решетка. Метален. Атомна. Йонните кристални решетки имат соли, някои метални оксиди и хидроксиди.
"Кристални и аморфни тела" - Druse Marion. Нобелови лауреати. Инсталация за отглеждане на оптични кристали. Аморфно тяло. Метален поликристал. Друзи кристали от скален кристал. Н.Г. Басов. Първата инсталация за отглеждане на ЛУЧ кристали. Аметист поликристал (вид кварц). Грубозърнест сярен кристал. Свойства на твърдите вещества.
"Свойства на алуминия" - Алуминият като просто вещество: получаване. Алуминият като просто вещество: химични свойства: Странно. Ar \u003d 27. Разгледайте диаграмата. В случай на затруднение поставете въпросителен знак до съответното свойство. Алумосиликатите съставляват по-голямата част от земната кора. Направете заключение относно разпространението на алуминия в земната кора в сравнение с други метали.
„Кристална решетка“ - Задача: Определете вида на химическата връзка в тези съединения: Характеристики на основните видове кристални решетки. темата на урока е КРИСТАЛНИ МРЕЖИ. Класификация на твърдите вещества. HCl, Cl2, H2O, NaBr, BaCl2, CaS, O2, NH3, CO2, C.
"Клас 9 алуминий" - Производство на алуминий. Амфотеричност на алуминия. Метали. Положението на алуминия в периодичната система на Д. И. Менделеев. Урок по химия в 9 клас на тема „Алуминий“. 3. С причини. AL. Физически свойства алуминий. Химични свойства алуминий. 2. С киселини (със сярна и солна (разредена). Електролизата е основният метод за производство на алуминий днес.
"Алуминиев метал" - приложение. Има амфотерни свойства. Взаимодействие с вода. Физически свойства. За първи път е получен от датския физик Ерстед през 1925 година. Способни да взаимодействат под въздействието на температурата със сяра, азот и въглерод. Най-разпространеният метал в природата. Взаимодействие с киселини. Бариев алуминат - за пречистване на вода от сулфатни, карбонатни и калциеви йони.





![]()








 Обратно напред
Обратно напред
Внимание! Прегледът на слайда се използва само за информационни цели и може да не представлява всички опции за презентация. Ако се интересувате от тази работа, моля изтеглете пълната версия.
Тип на урока: Комбиниран.
Основната цел на урока: Да даде на учениците конкретни идеи за аморфни и кристални вещества, видове кристални решетки, да установи връзката между структурата и свойствата на веществата.
Цели на урока.
Образователни: да се формират понятия за кристалното и аморфното състояние на твърдите вещества, да се запознаят студентите с различни видове кристални решетки, да се установи зависимостта на физичните свойства на кристала от естеството на химическата връзка в кристала и вида на кристалната решетка, да се дадат на учениците основни идеи за ефекта от естеството на химичните връзки и видовете кристални решетки върху свойства на веществото, за да даде на учениците представа за закона за постоянството на състава.
Образователни: продължават формирането на мирогледа на учениците, обмислят взаимното влияние на компонентите на цялостно-структурните частици на веществата, в резултат на което се появяват нови свойства, възпитават способността да организират образователната си работа, спазват правилата за работа в екип.
Развиване: развиват познавателния интерес на учениците, използвайки проблемни ситуации; подобряване на уменията на учениците за установяване на причинно-следствената зависимост на физичните свойства на веществата от химическата връзка и вида на кристалната решетка, да се предскаже вида на кристалната решетка въз основа на физичните свойства на веществото.
Оборудване: Периодичната таблица на Д. И. Менделеев, събиране на метали, неметали: сяра, графит, червен фосфор, кислород; Презентация „Кристални решетки“, модели на кристални решетки от различни видове (готварска сол, диамант и графит, въглероден диоксид и йод, метали), проби от пластмаси и изделия от тях, стъкло, пластилин, смоли, восък, дъвки, шоколад, компютър, мултимедия инсталация, видео експеримент „Сублимация на бензоена киселина“.
По време на занятията
1. Организационен момент.
Учителят поздравява учениците, записва отсъстващите.
След това той съобщава темата на урока и целта на урока. Учениците пишат темата на урока в тетрадка. (Слайд 1, 2).
2. Проверка на домашното
(2 ученика на черната дъска: Определете вида на химическата връзка за веществата с формулите:
1) NaCl, CO 2, I 2; 2) Na, NaOH, H 2 S (запишете отговора на дъската и са включени в анкетата).
3. Анализ на ситуацията.
Учител: Какво изучава химията? Отговор: Химията е наука за веществата, техните свойства и трансформации на веществата.
Учител: Какво е вещество? Отговор: Субстанцията е това, от което се състои физическото тяло. (Слайд 3).
Учител: Какво състояние на агрегиране познавате?
Отговор: Има три състояния на агрегация: твърдо, течно и газообразно. (Слайд 4).
Учител: Дайте примери за вещества, които могат да съществуват при различни температури във всичките три агрегатни състояния.
Отговор: Вода. Кога нормални условия водата е в течно състояние, когато температурата падне под 0 0 C, водата се превръща в твърдо състояние - лед, а когато температурата се повиши до 100 0 C, получаваме водни пари (газообразно състояние).
Учител (допълнение): Всяко вещество може да се получи в твърда, течна и газообразна форма. В допълнение към водата това са метали, които при нормални условия са в твърдо състояние, започват да омекват при нагряване и при определена температура (t pl) се превръщат в течно състояние - стопяват се. При допълнително нагряване, до точката на кипене, металите започват да се изпаряват, т.е. отидете в газообразно състояние. Всеки газ може да се превърне в течно и твърдо състояние чрез понижаване на температурата: например кислород, който при температура (-194 0 С) се превръща в синя течност, а при температура (-218,8 0 С) се втвърдява в снегоподобна маса, състояща се от кристали от синьо. Днес в урока ще разгледаме твърдото състояние на материята.
Учител: Назовете какви твърди вещества има на вашите маси.
Отговор: Метали, пластилин, готварска сол: NaCl, графит.
Учител: Какво мислите? Кое от тези вещества е излишно?
Отговор: Пластилин.
Учител: Защо?
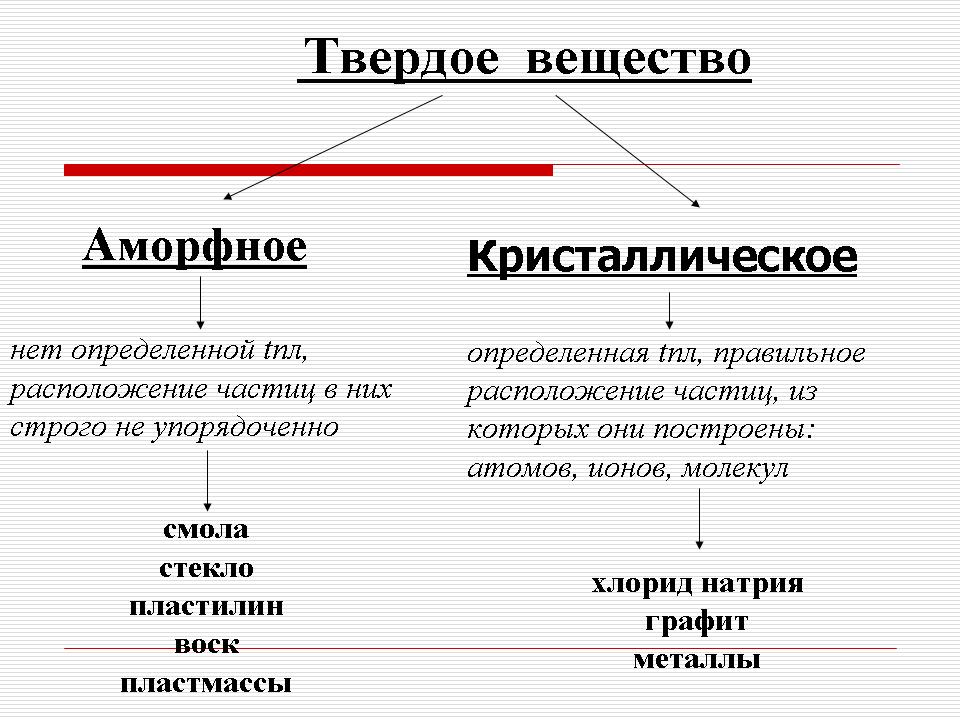
Правят се предположения. Ако на учениците им е трудно, тогава с помощта на учителя те стигат до извода, че пластилинът, за разлика от металите и натриевия хлорид, няма определена точка на топене - той (пластилинът) постепенно омеква и преминава в течно състояние. Това е например шоколад, който се топи в устата, или дъвка, както и стъкло, пластмаси, смоли, восък (по време на обяснението учителят показва класните проби от тези вещества). Такива вещества се наричат \u200b\u200bаморфни. (слайд 5), а металите и натриевият хлорид са кристални. (Слайд 6).
По този начин има два вида твърди вещества. : аморфни и кристален. (слайд 7).
1) Аморфните вещества нямат определена точка на топене и разположението на частиците в тях не е строго подредено.
Кристалните вещества имат строго определена точка на топене и най-важното се характеризират с правилното разположение на частиците, от които са изградени: атоми, молекули и йони. Тези частици са разположени в строго определени точки в пространството и ако тези възли са свързани с прави линии, тогава се формира пространствена рамка - кристална клетка.
Пита учителят проблемни въпроси
Как да обясня съществуването на твърди вещества с толкова различни свойства?
2) Защо кристалните вещества се разделят в определени равнини при удар, докато аморфните вещества не притежават това свойство?
Слушайте отговорите на учениците и ги насочвайте към тях заключение:
Свойствата на веществата в твърдо състояние зависят от вида на кристалната решетка (главно от това какви частици са в нейните възли), което от своя страна се дължи на вида на химическата връзка в дадено вещество.
Проверка на домашната работа:
1) NaCl - йонна връзка,
CO 2 - ковалентна полярна връзка
I 2 - ковалентна неполярна връзка
2) Na - метална връзка
NaOH - йонна връзка между Na + и OH - (O и H ковалентни)
H 2 S - ковалентен полярен
Фронтална анкета.
- Каква връзка се нарича йонна?
- Коя връзка се нарича ковалентна?
- Какво е името на ковалентната полярна връзка? неполярна?
- Какво се нарича електроотрицателност?
Заключение: Проследява се логическа последователност, връзката на явленията в природата: Структура на атома-\u003e ЕО-\u003e Видове химически връзки-\u003e Тип кристална решетка-\u003e Свойства на веществата . (слайд 10).
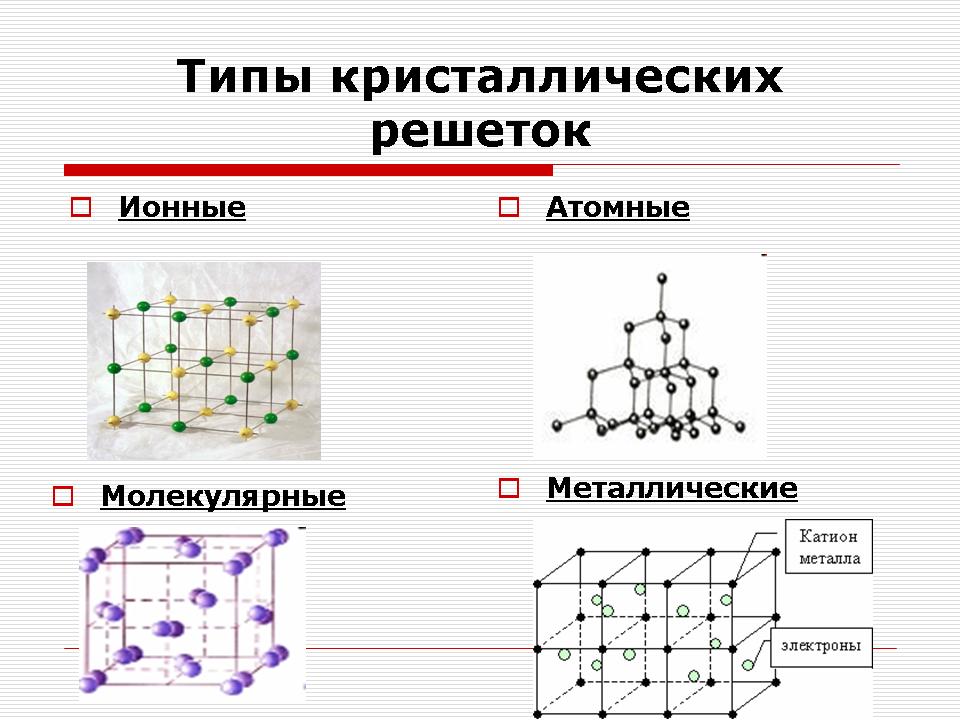
Учител: В зависимост от вида на частиците и от естеството на връзката между тях, те разграничават четири вида кристални решетки: йонни, молекулярни, атомни и метални. (Слайд 11).
Резултатите се записват в следващата таблица, примерна таблица за ученици на бюрото. (виж Приложение 1). (Слайд 12).
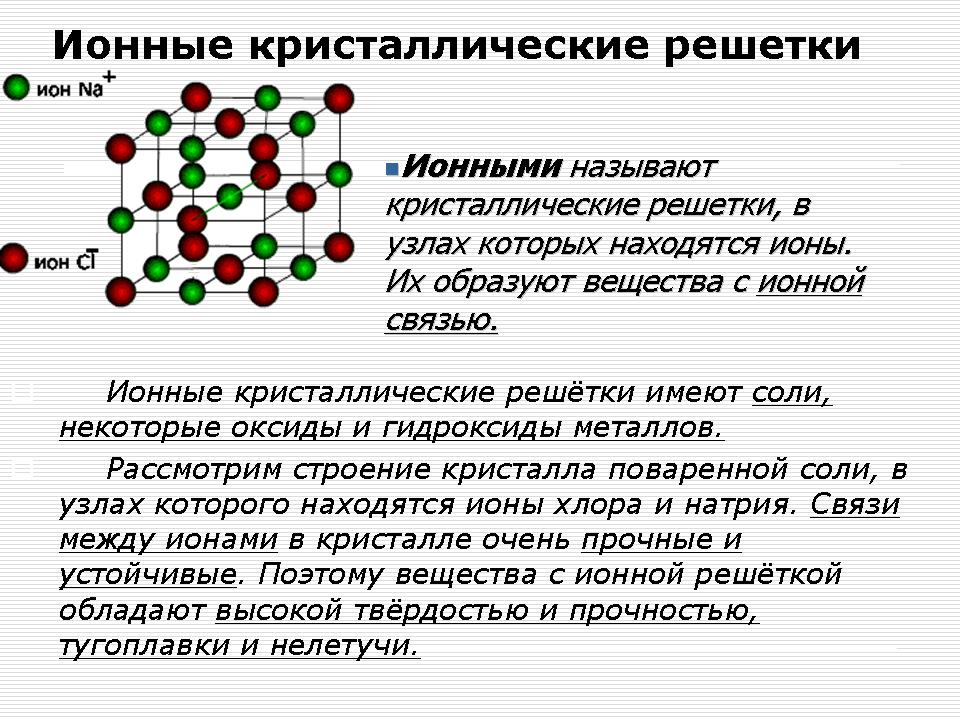
Йонни кристални решетки
Учител: Какво мислите? За вещества с каква химическа връзка този тип решетка ще бъде типичен?
Отговор: За вещества с йонна химическа връзка ще бъде характерна йонна решетка.
Учител: Какви частици ще бъдат във възлите на решетката?
Отговор: Йона.
Учител: Какви частици се наричат \u200b\u200bйони?
Отговор: Йони са частици, които имат положителен или отрицателен заряд.
Учител: Какви йони има в състава?
Отговор: Прост и сложен.
Демонстрация - модел на кристална решетка на натриев хлорид (NaCl).
Обяснение на учителя: В възлите на кристалната решетка на натриевия хлорид са натриеви и хлорни йони.

Отделни молекули натриев хлорид не съществуват в кристали NaCl. Целият кристал трябва да се разглежда като гигантска макромолекула, състояща се от равен брой Na + и Cl - йони, Na n Cl n, където n е голям брой.
Връзките между йони в такъв кристал са много силни. Следователно веществата с йонна решетка имат относително висока твърдост. Те са огнеупорни, нелетливи, крехки. Техните стопилки провеждат електрически ток (Защо?), Лесно се разтварят във вода.
Йонните съединения са бинарни метални съединения (I A и II A), соли, основи.
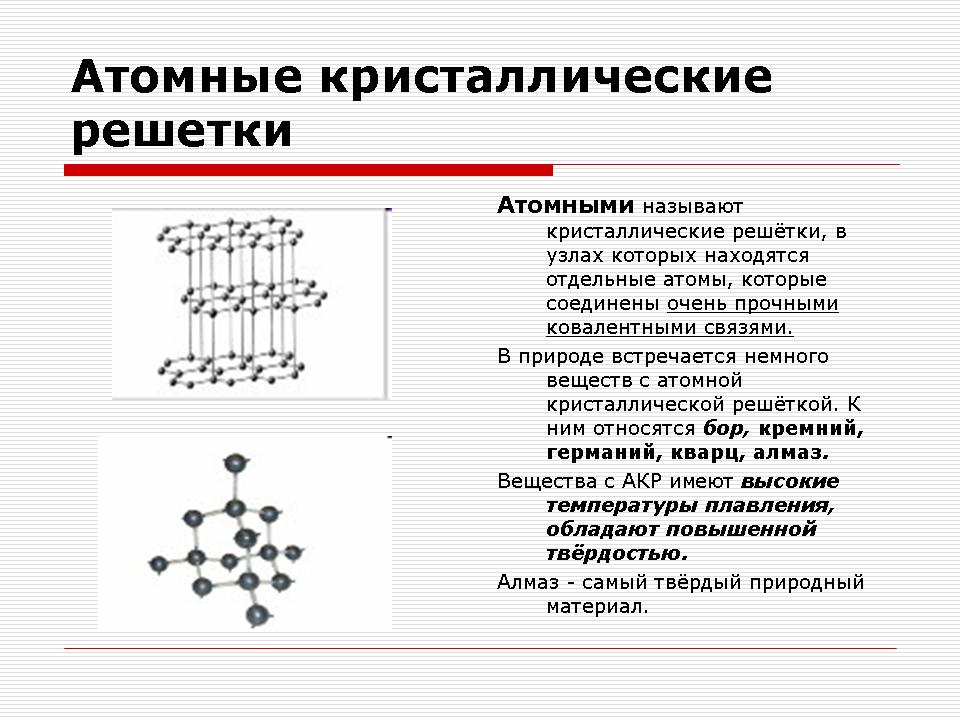
Атомни кристални решетки
Демонстрация на кристални решетки от диамант и графит.
Учениците имат графитни мостри на масата.
Учител: Какви частици ще бъдат във възлите на атомната кристална решетка?
Отговор: Във възлите на атомната кристална решетка има отделни атоми.
Учител: Каква химическа връзка ще възникне между атомите?
Отговор: Ковалентна химическа връзка.
Обяснения на учителя.
Всъщност на местата на атомните кристални решетки има отделни атоми, свързани с ковалентни връзки. Тъй като атомите, подобно на йони, могат да бъдат подредени по различни начини в пространството, се образуват кристали с различна форма.
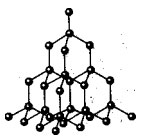
Атомна кристална решетка от диамант
В тези решетки няма молекули. Целият кристал трябва да се разглежда като гигантска молекула. Пример за вещества с този тип кристална решетка може да служи като алотропни модификации на въглерод: диамант, графит; както и бор, силиций, червен фосфор, германий. Въпрос: Какви са тези вещества по отношение на състава? Отговор: Прост по състав.
Атомните кристални решетки са не само прости, но и сложни. Например алуминиев оксид, силициев оксид. Всички тези вещества имат много високи температури топящ се (за диамант над 3500 0 С), силен и твърд, нелетлив, практически неразтворим в течности.
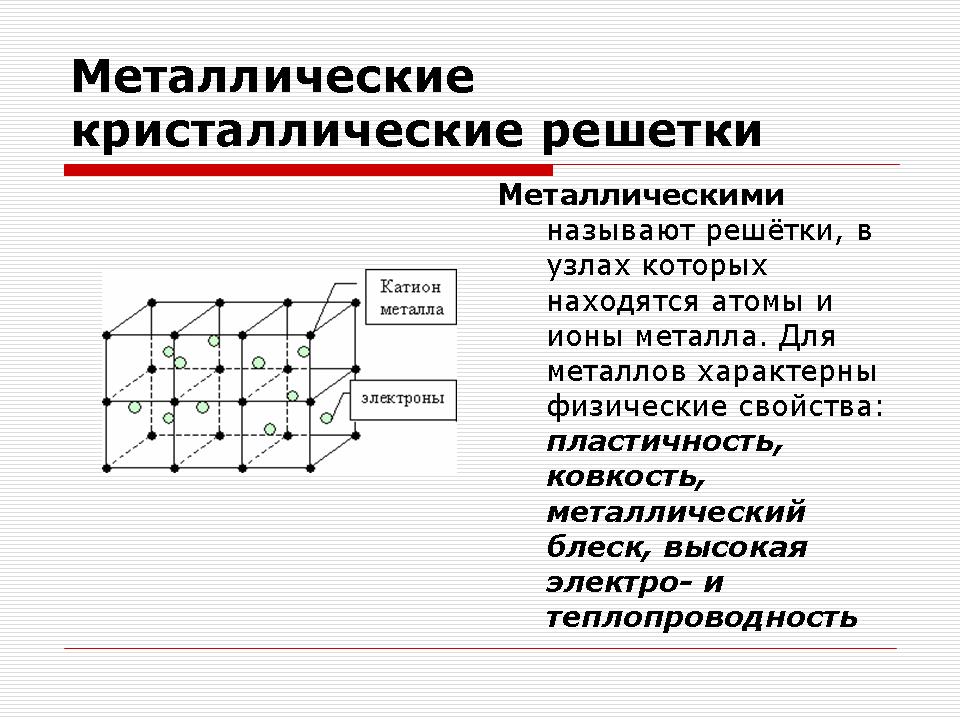
Метални кристални решетки
Учител: Момчета, имате колекция от метали на вашите маси, разгледайте тези проби.
Въпрос: Каква химическа връзка е характерна за металите?
Отговор: Метален. Комуникация в метали между положителни йони посредством споделени електрони.
Въпрос: Какви общи физични свойства са типични за металите?
Отговор: Блясък, електрическа проводимост, топлопроводимост, пластичност.
Въпрос: Обяснете каква е причината толкова много различни вещества да имат еднакви физични свойства?
Отговор: Металите имат една структура.
Демонстрация на модели на кристални решетки на метали.
Обяснение на учителя.
Веществата с метална връзка имат метални кристални решетки
На местата на такива решетки има атоми и положителни йони на металите, а валентните електрони свободно се движат в обема на кристала. Електроните електростатично привличат положителни метални йони. Това обяснява стабилността на решетката.
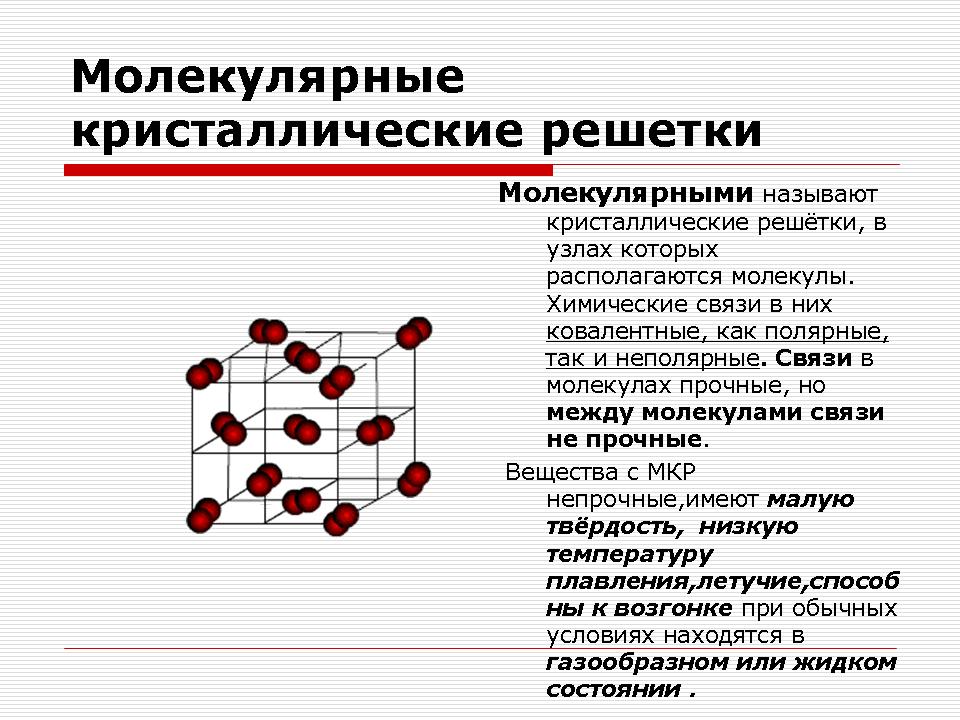
Молекулярна кристална решетка
Учителят демонстрира и назовава веществата: йод, сяра.
Въпрос: Какво обединява тези вещества?
Отговор: Тези вещества са неметали. Прост по състав.
Въпрос: Каква е химическата връзка вътре в молекулите?
Отговор: Химична връзка вътре в молекулите е ковалентен неполярен.
Въпрос: Какви физични свойства са характерни за тях?
Отговор: Летливи, слабо топящи се, слабо разтворими във вода.
Учител: Нека сравним свойствата на металите и неметалите. Учениците отговарят, че свойствата са коренно различни.
Въпрос: Защо свойствата на неметалите са толкова различни от тези на металите?
Отговор: Металите имат метална връзка, докато неметалите имат неполярна ковалентна връзка.
Учител: Следователно видът на решетката е различен. Молекулярна.
Въпрос: Какви частици има в решетъчните места?
Отговор: Молекули.
Демонстрация на кристални решетки от въглероден диоксид и йод.
Обяснение на учителя.
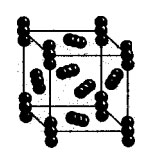
Молекулярна кристална решетка
Както можете да видите, молекулната кристална решетка може да има не само твърдо вещество просто вещества: благородни газове, H 2, O 2, N 2, I 2, O 3, бял фосфор P 4, но също така комплекс: твърда вода, твърд хлороводород и сероводород. Повечето твърди органични съединения имат молекулни кристални решетки (нафталин, глюкоза, захар).
Решетъчните места съдържат неполярни или полярни молекули. Въпреки факта, че атомите вътре в молекулите са свързани със силни ковалентни връзки, между самите молекули действат слаби сили на междумолекулно взаимодействие.
Заключение:Веществата са крехки, имат ниска твърдост, ниска точка на топене, летливи, способни на сублимация.
Въпрос : Какъв процес се нарича сублимация или сублимация?
Отговор : Преходът на веществото от твърдо агрегатно състояние директно в газообразно състояние, заобикаляйки течно състояние, се нарича сублимация или сублимация.
Демонстрация на опит: сублимация на бензоена киселина (видео експеримент).
Работа с попълнена маса.
Приложение 1. (Слайд 17)
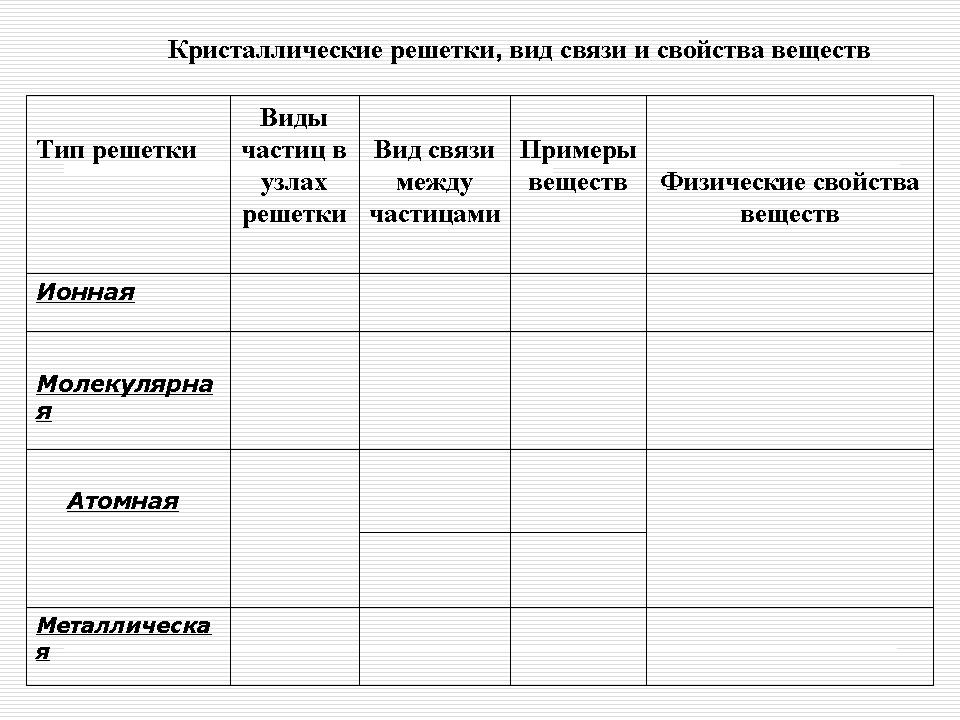
Кристални решетки, вид връзка и свойства на веществата
| Тип решетка | Видове частици на местата на решетката |
Връзка между частиците | Примери за вещества | Физични свойства на веществата |
| Йонийски | Йона | Йонна - силна връзка | Соли, халогениди (IA, IIA), оксиди и хидроксиди на типични метали | Твърди, трайни, нелетливи, чупливи, огнеупорни, много от тях са разтворими във вода, стопилките провеждат електрически ток |
| Атомна | Атоми | 1. Ковалентна неполярна - връзката е много силна 2. Ковалентен полярен - връзката е много силна |
Прости веществаа: диамант (C), графит (C), бор (B), силиций (Si).
Сложни вещества: алуминиев оксид (Al 2 O 3), силициев оксид (IY) -SiO 2 |
Много твърд, много огнеупорен, силен, нелетлив, неразтворим във вода |
| Молекулярна | Молекули | Между молекулите има слаби сили на междумолекулно привличане, но вътре в молекулите има силна ковалентна връзка | Твърди вещества при специални условия, които конвенционални - газове или течност (O2, H2, Cl2, N2, Br2, Н20, СО2, НС1); сяра, бял фосфор, йод; органична материя |
Крехки, летливи, стопяеми, способни на сублимация, имат лека твърдост |
| Метал | Атомни йони | Метал с различна якост | Метали и сплави | Ковък, лъскав, пластичен, топло и електропроводим |
Въпрос: Какъв тип кристална решетка от тези, разгледани по-горе, не се среща в простите вещества?
Отговор: Йонни кристални решетки.
Въпрос: Какви кристални решетки са типични за прости вещества?
Отговор: За прости вещества - метали - метална кристална решетка; за неметали - атомни или молекулярни.
Работа с периодичната система на Д. И. Менделеев.
Въпрос: Къде са металните елементи в Периодичната система и защо? Неметални елементи и защо?
Отговор: Ако нарисувате диагонал от бор до астат, тогава в долния ляв ъгъл на този диагонал ще има метални елементи, тъй като на последното енергийно ниво те съдържат от един до три електрона. Това са елементи I A, II A, III A (с изключение на бор), както и калай и олово, антимон и всички елементи от вторични подгрупи.
Неметалните елементи са разположени в горния десен ъгъл на този диагонал, тъй като на последното енергийно ниво съдържат четири до осем електрона. Това са елементите IY A, Y A, YI A, YII A, YIII A и бор.
Учител: Нека намерим неметални елементи, които имат прости вещества имат атомна кристална решетка (Отговор: C, B, Si) и молекулярни ( Отговор: N, S, O , халогени и благородни газове ).
Учител: Формулирайте заключение за това как можете да определите вида кристална решетка на просто вещество, в зависимост от положението на елементите в Периодичната таблица на Д. И. Менделеев.
Отговор: За метални елементи, които са в I A, II A, IIIA (с изключение на бор), както и калай и олово и всички елементи от вторични подгрупи в просто вещество, типът на решетката е метал.
За неметални елементи IY A и бор в просто вещество кристалната решетка е атомна; а елементите Y A, YI A, YII A, YIII A в прости вещества имат молекулярна кристална решетка.
Продължаваме да работим с попълнената таблица.
Учител: Погледнете внимателно масата. Какъв е моделът?
Внимателно слушаме отговорите на учениците, след което заедно с класа заключаваме:
Съществува следната закономерност: ако структурата на веществата е известна, тогава техните свойства могат да бъдат предсказани, или обратно: ако свойствата на веществата са известни, тогава структурата може да бъде определена. (Слайд 18).
Учител: Погледнете внимателно масата. Каква друга класификация на веществата можете да предложите?
Ако учениците са на загуба, учителят обяснява това веществата могат да бъдат разделени на вещества с молекулярна и немолекулярна структура. (Слайд 19).
Веществата с молекулярна структура са съставени от молекули.
Веществата с немолекулярна структура се състоят от атоми и йони.
Закон за постоянен състав
Учител: Днес ще се запознаем с един от основните закони на химията. Това е законът за постоянството на състава, който е открит от френския химик Ж. Л. Пруст. Законът е валиден само за вещества с молекулярна структура. Понастоящем законът гласи следното: „Молекулярните химични съединения, независимо от начина на тяхното получаване, имат постоянен състав и свойства“. Но за вещества с немолекулярна структура този закон не винаги е верен.
Теоретичното и практическо значение на закона се крие във факта, че въз основа на него съставът на веществата може да бъде изразен с помощта на химически формули (за много вещества с немолекулярна структура химическата формула показва състава на несъществуваща, но условна молекула).
Заключение: химическата формула на дадено вещество съдържа много информация. (Слайд 21)
Например SO 3:
1. Специфичното вещество е сярен газ или серен оксид (YI).
2. Вид на веществото - комплекс; клас - оксид.
3. Качествен състав - състои се от два елемента: сяра и кислород.
4. Количествен състав - молекулата се състои от 1 серен атом и 3 кислородни атома.
5. Относително молекулно тегло - M r (SO 3) \u003d 32 + 3 * 16 \u003d 80.
6. Моларна маса - M (SO 3) \u003d 80 g / mol.
7. Много друга информация.
Консолидация и приложение на придобитите знания
(Слайд 22, 23).
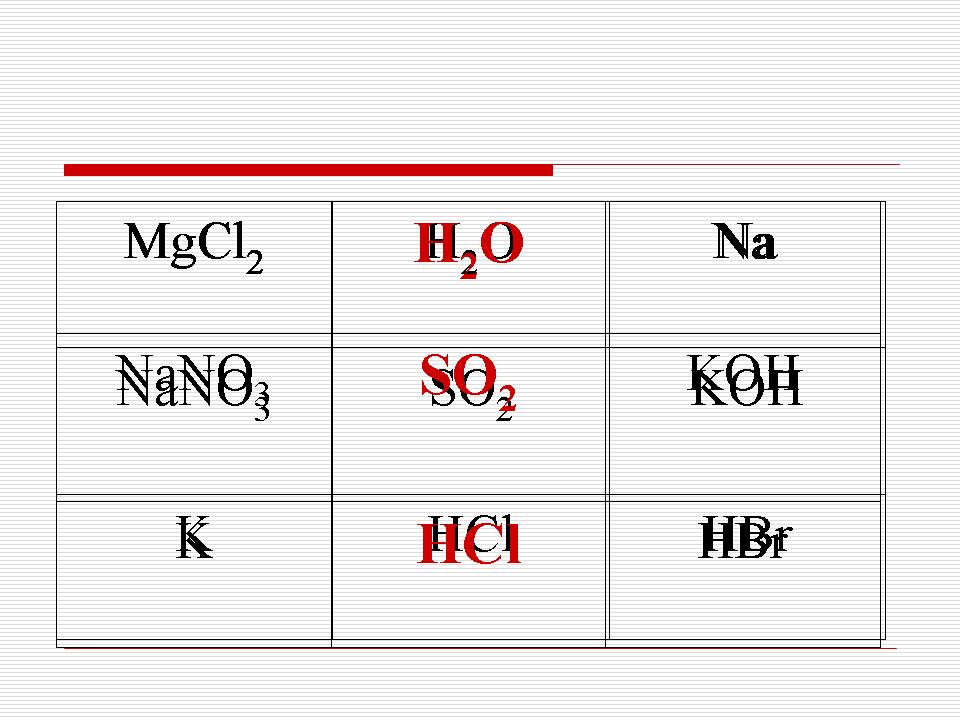
Игра на тик-такс: зачеркнете вертикално, хоризонтално, диагонали на вещества, които имат същата кристална решетка.
Отражение.
Учителят задава въпроса: „Момчета, какво ново сте научили в урока?“.
Обобщаване на урока
Учител: Момчета, нека обобщим основните резултати от нашия урок - отговорете на въпросите.
1. Какви класификации на веществата сте научили?
2. Как разбирате термина кристална решетка.
3. Какви видове кристални решетки познавате сега?
4. За какъв модел на структура и свойства на веществата научихте?
5. В какво състояние на агрегация веществата имат кристални решетки?
6. Какъв основен закон на химията научихте в урока?
Домашна работа: §22, конспект.
1. Направете формулите на веществата: калциев хлорид, силициев оксид (IY), азот, сероводород.
Определете вида на кристалната решетка и се опитайте да предскажете: какви трябва да са точките на топене на тези вещества.
2. Творческа задача -\u003e съставяне на въпроси за абзаца.
Учителят благодари за урока. Отбелязва ученици.
