يتم تحقيق ضخ حموضة الوسط في مظهر منتجات التفاعل بشكل واضح بشكل خاص من خلال تطبيق تجديد أيون البرمنجنات MnO 4 -.
أ) في بيئة حمضية، بما يتوافق مع المخطط الأول، يحدث التجديد الأعمق لذرة المنغنيز.
MnO 4 - + 8H + + 5e - → Mn 2+ +4 H 2 O.
في هذه الحالة، يتم إذابة أملاح المنغنيز (II)، التي يوجد أنيون منها في الحمض، مما يخلق وسطًا حامضيًا. وهكذا يتشكل في الوسط الحمضي MnSO 4، وفي وسط حمض الهيدروكلوريك MnCl 2. ومن الجدير بالذكر أنه لا يمكن تكوين معدن المنجنيز، لأن هذا المعدن الموجود في سلسلة معادن الجهد وجد أنه أخف من الماء ويتأكسد. بواسطة أيون H + . ب) في محايدة(وسط ضعيف أو ضعيف الحموضة) يتم تحويل أيون برمنجنات إلى ثاني أكسيد المنغنيز MnO 2 ما هو الخطأ في مظهر الحصار الأسود والبني؟
أفضل إجابة: الكيمياء مع الماء. يمكن رؤية الماء كجزء من أي مجموعة، فهو أجزاء من الماء ذات طاقة تأين عالية وكثافة إلكترون منخفضة وسالبية كهربية متوسطة. الماء ليس شديد التفاعل إذا كان موجودا في درجات حرارة منخفضة.
تفاعل الماء مع الحمض والكلور هو تفاعل طارد للحرارة وعفوي، ولكن الماء لديه طاقة تنشيط عالية. يمكن زيادة سرعة التفاعل بواسطة المحفز. جميع عناصر هذه المجموعة ناعمة وكبريتية فضية. تتغير درجة انصهارها مع زيادة العدد الذري.
MnO 4 - + 2H 2 O + 3e - → MnO 2 + 4OH -.
في هذه الحالة، هناك قلونة كاملة للمادة.
الخامس) في وسط مروج كثيفةيحدث نقل الإلكترونات بصعوبة كبيرة (من خلال تركيز عالٍ من أيونات OH سالبة الشحنة). ويتم التجديد حتى يتشكل أيون المنجنات MnO 4 2-، ويتكون اللحاء الأخضر:
يرتبط الليثيوم بشكل كبير بعناصر أخرى من المجموعة 1 وله علاقة قطرية مع المغنيسيوم. أجزاء هذا الكاتيون شديدة الاستقطاب، والروابط الكيميائية لها طابع تساهمي. تتميز المروج بأنصاف أقطار عالية وشحنات نووية منخفضة وطاقات تأين منخفضة. يا إلهي، الرائحة الكريهة شديدة التفاعل. تتفاعل الرائحة الكريهة مع معظم المواد غير المعدنية، وكذلك مع الكثير من أشباه المعادن.
ونتيجة لخصائص التفاعل الكبيرة للمعادن الأساسية، فإن تركيبها أكثر أهمية من المعادن نفسها. تصبح تفاعلات المعادن مع الماء أكثر خطورة مع دخولنا الجدول الدوري. المجموعة 2: معادن الأرض المرج.
MnO 4 - + 1е - → MnO 4 2-
يجب إظهار احترام الغناء عند العمل بالعرج شبه التالف (VI). على اليمين، وهو مستقر في الوسط الحمضي، ثنائي كرومات أيون Cr 2 O 7 2-، له قوة عامل مؤكسد قوي، في الوسط الحمضي، دون تغيير مرحلة الأكسدة، يتحول إلى أيون الكروماتCrO 4 2-، والذي يُظهر قوة أكسدة أضعف.
تتكون هذه المجموعة من البريليوم والكالسيوم والمغنيسيوم والباريوم. معادن الأرض المرج ليست متفاعلة مثل معادن المرج. للروائح أنصاف أقطار أصغر، وشحناتها النووية أكبر، وأقل من تلك الخاصة بالمعادن الأساسية، وهي نفس الخطوط في الجدول الدوري. كما يحتاجون أيضًا إلى إنفاق إلكترونين لتحقيق التكوين الإلكتروني للغاز النبيل.
بالإضافة إلى أن تفاعلية المعادن الأساسية، فإن المعادن الأساسية تزداد مع نزول المجموعة في الجدول الدوري ولنفس الأسباب. في بعض حلقات القوة، تكون قوة عناصر الفترة الأخرى أكثر تشابهًا مع قوة عناصر الفترة الثالثة في مجموعة ذات أعداد أكبر. على سبيل المثال، الليثي يشبه المغنيسيوم بدرجة أكبر، وأقل شبهًا بالصوديوم في عدة طرق. أوجه التشابه بين الليثيوم والمغنيسيوم وأعقاب الارتباط القطري في الجدول الدوري.
Cr 2 O 7 2- + 2OH - → 2CrO 4 2 + H 2 O
ومع ذلك، يتم إذابة الكرومات في الوسط الحمضي بواسطة ثنائي كرومات.
2CrO 4 2 + 2H + → Cr 2 O 7 2- + H 2 O
في الوسط الحمضي، يتم ترقية أيون Cr 2 O 7 2- إلى أيونات Cr 3+:
الكروم 2 يا 7 2- + 14H + + 6e - → 2Cr 3+ +7 H2O
اعتمادًا على الأصل المحدد ومعلمات القاعدة الحمضية الحقيقية، يمكن تقليل انهيار الكروم إما إلى ترسيب الكروم (OH) 3، أو بسبب الخصائص المذبذبة للكروم (III)، إلى الأنيون المعقد الأصلي 3. على أية حال، فإن مرحلة الأكسدة الجديدة في المنتجات ستكون تجديد الكروم من الآن فصاعدا أكثر تقدما + III.
بورين يخرج من المناجم بالقرب من مشهد العاصفة والقلب. أثناء عملية الاستخراج، يتم تحويل المعادن إلى أكسيد البورون بواسطة الحمض، والذي يتم بعد ذلك تحويله بواسطة المغنيسيوم إلى شكل غير نقي وبني وغير متبلور من البورون. يحتوي البورون العنصري على أنواع متآصلة مختلفة. يمكنك تسميتها مادة صلبة غير معدنية ذات نقطة انصهار عالية، أو لون رمادي أسود، أو مسحوق ذو بنية تعتمد على مجموعات مكونة من 12 ذرة.
وهو من محبي الطيران والصواريخ والسترات الواقية من الرصاص. العنصر خامل بالفعل وعرضة لتسريب أقوى العوامل المؤكسدة فقط. البورون، باعتباره العنصر الأول في المجموعة 13، هو في الغالب السلطات الكيميائية، تصرف وكأنك غير معدن. يحتوي على أكاسيد حمضية ويذيب كميات كبيرة من الهيدريدات الجزيئية الثنائية.
من ناحية أخرى، إذا تمت أكسدة الكروم في وسط حمضي، فإن نواتج الأكسدة ستكون أيونات كرومات CrO 4 2-، وإذا حدثت الأكسدة في وسط حمضي، فستتكون أيونات Cr 2 O 7 2- .
تدفق التركيز إلى مستودع منتجات التفاعل
تتجلى الزيادة في تركيز المركبات المتفاعلة في ORR بشكل واضح في التفاعل مع أحماض النيتريك والكبريتيك.
آسف على هذا الهراء. بودوفا. القوة البدنية
البورون غير معدني ويحتوي على أكاسيد حمضية. يعتبر حمض البوريك مطهرًا ضعيفًا وحتى حمضًا أحاديًا ضعيفًا. أكسيد البورون هو أنهيدريد حمض. تعمل هاليدات البورون والألومنيوم كأحماض لويس.
يتم إنتاج الفين كوقود في الصواريخ الفضائية من خلال الكمية الكبيرة من الطاقة التي تظهر عندما يتفاعل مع الحمض. الألومنيوم هو المعدن الأكثر وفرة في القشرة الأرضية. معادن الألومنيوم في شكل مختلط تعمل على تثبيت الطين، وهو جزء مهم من التربة. ويرى الجيولوجيون أن التفاعل الكيميائي الأكثر أهمية على الأرض هو أنه بدون التربة لا يمكن للأشجار أن تنمو.
تفاعلات حمض النيتريك .
ومن الواضح أن هذه الأحماض هي أيضًا مواد مؤكسدة ومنشئة للمادة الوسطى.
يتفاعل حمض النيتريك، كمؤكسد، مع المعادن والأكاسيد وهيدروكسيدات المعادن في مراحل الأكسدة المتوسطة، مع اللافلزات وأكاسيدها، مما يضع اللافلز في مرحلة الأكسدة المتوسطة. كقاعدة عامة، تعمل منتجات تجديد حمض النيتريك على تهدئة خليط من المواد (عادة أكاسيد)، ولكن اعتمادًا على التركيز، سيتم خلط المنتج الآخر في خليط التفاعل. أنشأ النهج التجريبي الانتظامات التالية:
تتم إزالة معدن الألومنيوم من خلال عملية القاعة. المعدن موصل جيد جدًا للطاقة الحرارية والكهرباء، وهو مرن وبلاستيكي. ولا يتم إنتاجه بواسطة المغناطيس أو الشرر. يمكن تشكيلها باستخدام جميع طرق العمل بالمعدن أو ربطه بنفسه أو بمعادن أخرى باستخدام جميع الإجراءات مما يقلل بشكل كبير من إنتاجية العديد من العمليات.
الألومنيوم ذو سماكة منخفضة. هذا معدن قوي وموصل كهربائي قوي. لا يهم أولئك أنه يقلل بشكل كبير من الأكسدة كما أنه مقاوم للتآكل. إن القوة المنخفضة للألمنيوم وتوافره على نطاق واسع ومقاومته للتآكل تجعله مثاليًا للاستخدام اليومي.
يتم تقليل حمض النيتريك المركز إلى لا 2 .
NO 3 - + 2H + + 1e - → NO 2 + H 2 O
يتم تقليل حمض النيتريك المخفف قليلاً إلى لا.
NO 3 - + 4H + + 3e - → NO + 2H 2 O
يتم تحويل حمض النيتريك المخفف للغاية، الذي يتفاعل مع المادة الفعالة (Mg، Ca، Ali، إلخ) إلى ملح - نترات الأمونيوم ن.ح. 4 لا 3 .
ويزداد الطابع المعدني، وتتناقص شظايا العروق في مجموعة، وبالتالي فإن أقرب وعاء يحتوي على البورون والألمنيوم والمعادن. وعلى أية حال، فإن الألومنيوم يقع بعيدًا جدًا على يمين الجدول الدوري حتى لا تظهر عليه أي رموز غير معدنية. وبالتالي، فإن الألومنيوم مذبذب، يتفاعل مع الأحماض غير المؤكسدة مع أيونات الألومنيوم الذائبة.
ومن المروج الحارة مع خلق أيونات الومينات . الألومنيوم، محلول البورون المعدني، يحتوي على أكاسيد مذبذبة. بالإضافة إلى ذلك، هذا الكاتيون مستقطب للغاية. ويرجع ذلك إلى التنوع الكبير في الهياكل البلورية. يمكنك إضافة رد الفعل ومذبذب.
NO 3 - + 10H + + 8e - → NH 4 + + 3H 2 O
وقد يشمل تخزين منتجات التجديد أيضًا النيتروجين الغازي N2، N2O.
تستثني هذه القيمة العناصر الأخرى للمجموعة الثامنة من المجموعة الفرعية الرئيسية - الغازات الخاملة أو النبيلة، التي تشكل ذراتها أساس مجال الإلكترون الخارجي. إن التكوين الإلكتروني لذرات هذه العناصر لا يمكن تصنيفها على أنها معادن أو غير معدنية. ينتن من مثل هذه الأشياء كما هو الحال في النظام الطبيعيفصل العناصر بوضوح إلى فلزات وغير فلزات، واحتلال موقع بينها. يتم أحيانًا تصنيف الغازات الخاملة أو النبيلة (يتم التعبير عن النبل بالخمول) على أنها غير معدنية، ولكن بشكل رسمي بحت، خلف علامات فيزيائية. تحافظ هذه المنتجات على النبات الشبيه بالغاز حتى في درجات حرارة منخفضة جدًا.
يتم امتصاص هذا النموذج بواسطة الماء ويتم تحويله في الطور الثابت أثناء التحليل اللوني. يعمل هيدروكسيد الألومنيوم على إذابة الجزء الإسفنجي والغشاء الجيلاتيني الذي يغلق البيوت أثناء الترسيب، ويقوي الرواسب عن طريق الترشيح. الثاليا سامة بسبب قدرتها على استبدال البوتاسيوم.
مرحلة أكسدة الفلور في المركبات
المجموعة 14: عائلة الذواكر. وتضم المجموعة 14 الفحم، وهو أهم مركب للحياة، والسيليكون، وهو الأهم للتقنيات الحديثة والذكاء الفردي. يلقي فوجليتس، في جميع المجموعات، الكثير من الخطب التي تشبع رطوبتها في الكيمياء، الكيمياء العضوية.
الخمول الكيميائي لهذه العناصر واضح. بالنسبة للزينون والكريبتون، يتم خلطهما مع الفلور والحمض. مما لا شك فيه، في هذه الدراسات، لعبت الغازات الخاملة دورًا رائدًا.
هناك الكثير من اللافلزات، وتتميز ذراتها بقيم كهربية عالية. يتغير أويا بين 2 و 4. اللافلزات هي عناصر المجموعات الفرعية الرئيسية، وأهم العناصر هي عنصر s.
جميع العناصر غير المعدنية (بما في ذلك الماء) موجودة في الجدول الدوري العناصر الكيميائيةدي. قطع مندليف العلوي الأيمن، الذي يخلق التريكوبوتنيك، والجزء العلوي منه هو الفلور.
تظهر العناصر طابعًا معدنيًا بشكل متزايد مع نزول الرائحة الكريهة عبر المجموعة. تشير Vuglets إلى القوة غير المعدنية. يخلق مركبات تساهمية مع اللافلزات ومركبات أيونية مع المعادن. أكاسيد الكربون والسيليكون والأحماض. ألمانيا معدن نموذجي، يحتوي على خصائص معدنية وغير معدنية، ربما بسبب عنصر آخر موجود في الولايات المتحدة. أدى القصدير، والمزيد من الرصاص، إلى ظهور خصائص معدنية.
ومع ذلك، القصدير ليس بعيدًا عن جدول أشباه الفلزات والماء كمركبات مذبذبة. على الرغم من أن الفحم هو رابع أكبر عنصر موجود في الكون، إلا أنه لا يوجد بنفس النسبة على الأرض. ويتبلور الماس والجرافيت بشكل طبيعي، ويتم دمج معظم الكربون مع مواد أخرى لتكوين لمسة نهائية ناعمة.
ومع ذلك، يجب أن نركز بشكل خاص على الوضع الغامض للمياه في النظام الدوري: في المجموعتين الأولى والسابعة من المجموعات الفرعية الرئيسية. انها ليست خيالية. من ناحية، فإن ذرة الماء، مثل ذرات المعادن المائية، لديها إلكترون واحد (التكوين الإلكتروني 1s1) على كرة الإلكترون الخارجية (ونفس الشيء بالنسبة للكرة الإلكترونية الجديدة) (التكوين الإلكتروني 1s1)، مما يؤدي إلى إظهار قوة السلف.
تنطبق على حل المشاكل
يحتوي الكربون على سلسلة مهمة من التباينات: الماس، والجرافيت، والفوليرين. لا يتفاعل الماس ولا الجرافيت في درجة حرارة الغرفة؛ لا يتفاعل السائل مع الحموضة أو مع الأحماض أو القواعد. ومع ذلك، عند درجات الحرارة المرتفعة، يتفاعل الماس والجرافيت مع عناصر وأشباه الموصلات المختلفة.
الجرافيت أكثر تفاعلا وأقل الماس. للتفاعل، يحتاج الماس إلى المزيد درجات حرارة عاليةلا يهم الجرافيت. في عقول عاديةيمتلك الجرافيت تباينًا أكثر استقرارًا من الناحية الديناميكية الحرارية. الفحم هو عنصر واحد في المجموعة 14، وبالتالي يخلق روابط متعددة.
في معظم مركباتها، يظهر الماء، مثل المعادن الأساسية، حالة أكسدة قدرها +1 إذا كان تبرع الذرة بالإلكترون إلى الماء أكثر أهمية من ذرات المعادن الأساسية. من ناحية أخرى، فإن ذرة الماء، مثل ذرات الهالوجين، تفقد إلكترونًا واحدًا لإكمال كرة الإلكترون، وبالتالي يمكن لذرة الماء قبول إلكترون واحد، مما يُظهر قوة الأكسدة وخطوة الأكسدة -1 في الهيدريدات المميزة للهالوجينات - مع المعادن، اتحاد مماثل للمعادن مع الهالوجينات - الهاليدات. عند إضافة إلكترون واحد إلى الذرة، يكون الماء أكثر أهمية من الهالوجينات.
يحتوي الكربون على أكسيدين مهمين، ثاني أكسيد الكربون وثاني أكسيد الكربون؛ الأول هو أنهيدريد حمض الكربونيك، وهو مقدمة للكربونات والكربونات. يتم إنشاء ثاني أكسيد الكربون عند حرق المواد العضوية في الهواء. ثاني أكسيد الكربون هو غاز خالٍ من الجراثيم، لذلك لا يتلاشى النبيذ في الضوء المرئي.
ثاني أكسيد الكربون عديم الرائحة، وهو حمضي قليلاً، ويسبب الموت بتركيزات عالية بسبب قلة الحموضة. ثاني أكسيد الكربون يختلف كثيرا عن الماء. ثاني أكسيد الكربون هو أكسيد غير معدني نموذجي وحمض. يُطلق على ثاني أكسيد الكربون الصلب اسم الثلج الجاف، حيث يتم تسامي قصاصات النبيذ بدلاً من ذوبانها وتبريدها لتبريد اللحوم المجمدة واللحوم والأطعمة المجمدة قبل النقل.
في في أعظم العقولماء H2 - غاز. هذا الجزيء، مثل الهالوجينات، ثنائي الذرة.
أكسيد الكربون هو غاز عديم الرائحة، وسهل الامتصاص، وغير ضار إلى حد ما، وسام للغاية. أكسيد الكربون هو هيدروكسيد يتشكل أثناء إنتاج عدد كبير من المعادن، وهو الأكثر أهمية في الأفران العالية.
وفي صناعة الزجاج يحتوي الفايكوريست على أكثر من ثلث كربونات الكالسيوم المستخرجة من القشرة. يتم تقطير كربونات الصوديوم لتحضير المسحوق للخبز. يتم أيضًا تحويل كربونات الصوديوم إلى مشعلات مسحوق جاف. السيليكون هو عنصر آخر من عناصر القشرة الأرضية، اعتمادا على عدده. ويوجد بكثرة في الصخور على شكل سيليكات تحتوي على أيونات السيليكات، وعلى شكل سيليكا في الرمال.
وفي الذرات غير المعدنية، يفضل أكاسيد الطاقة، بحيث يتم إنتاج الإلكترونات. وتتميز هذه الحقيقة بقيمة السالبية الكهربية، والتي تتغير بشكل طبيعي في الفترات والمجموعات الفرعية (الشكل 47).
الفلور- أقوى عامل مؤكسد، الذي لا تستطيع ذراته في التفاعلات الكيميائية التخلي عن الإلكترونات من أجل ممارسة القوة القصوى.
القوة الجديدة للخطب البسيطة - غير المعادن
يمكن أن تعمل الروابط مع السيليكون مثل بدائل لويس، بحيث تتمكن ذرة السيليكون من توسيع غلاف التكافؤ الخاص بها. يمكن لمركبات السيليكون أن تتصرف مثل أحماض لويس، لكن الكربوهيدرات لا تستطيع ذلك. يتواجد النبيذ في الطبيعة على شكل كوارتز ورمل، والذي يتكون من أجزاء مختلفة من الكوارتز، المغلفة بشكل أساسي باللون البني الذهبي للمنزل مع الأكسيد.
أي حجر باهظ الثمن أو باهظ الثمن هو سيليكا غير نظيفة. يمكن رؤية السيليكات على أنها هيكل رباعي السطوح أوكسوانون السيليكون. الجرمانيوم يشبه إلى حد كبير السيليكون. الأول مصنوع أيضًا من المعدن، وله هيكل بلوري على شكل ألماس، ومُجهز لإنتاج أجهزة الموصلات. مواد الأعضاء السفلية للمجموعة 14 وهي القصدير والرصاص هي معادن.
تكوين الكرة الإلكترونية الخارجية
يمكن أن تظهر اللافلزات الأخرى قوة شديدة، على الرغم من أنها بمستوى أضعف بكثير مقارنة بالمعادن؛ في الفترات والمجموعات الفرعية من إنتاجها الأصلي تتغير بترتيب عكسي يتماشى مع الترتيب التأكسدي.
يوجد إجمالي 161 عنصرًا كيميائيًا غير المعادن، قليلًا جدًا، لذا يمكنك رؤية 114 عنصرًا. عنصران غير معدنيان يشكلان 76% من كتلة القشرة الأرضية. هذا هو كيسن (49٪) والسيليكون (27٪). يحتوي الغلاف الجوي على 0.03% من الكتلة الحمضية الموجودة في القشرة الأرضية. تشكل اللافلزات 98.5% من كتلة النباتات، و97.6% من كتلة جسم الإنسان. ستة عناصر غير معدنية - C، H، O، N، P و S - هي عناصر حيوية تخلق أهم المواد العضوية في الأنسجة الحية: البروتينات والدهون والكربوهيدرات والأحماض النووية. وإلى مستودع الريح الذي نبتعد عنه، ندخل في الخطابات البسيطة والمعقدة أيضاً الموافقة على العنصرم- اللافلزات (الأكسجين O2، النيتروجين، ثاني أكسيد الكربون CO2، بخار الماء H2O وغيرها).
يتم الحصول على القصدير والرصاص بسهولة من معادنهما منذ العصور القديمة. القصدير غالي الثمن وليس أقوى بكثير، لكن يمكن إصلاحه ضد التآكل. متانة الرصاص ومرونته مادة بنيةلليقظة. الرصاص سام، ويسمى التسمم بالرصاص بالتسمم بالرصاص الحاد أو التسمم بالرصاص المزمن.
الأملاح الوحيدة الشائعة للرصاص هي النترات والأسيتات. المجموعة 15: عائلة النيتروجين. عناصر المجموعة 15 لها خصائص تختلف من العناصر إلى النيتروجين غير المعدني والفوسفور إلى البزموت المعدني النموذجي.
فودين - عنصر الرأسكل العالم. تحتوي معظم الأجسام الكونية (السحب الغازية والنجوم بما في ذلك الشمس) على أقل من نصف الماء. على الأرض، بما في ذلك الغلاف الجوي والغلاف المائي والغلاف الصخري، 0.88٪ فقط. الصبار كبير الوزن، لكن الوزن الذري للماء صغير جدًا. ولذلك تنشأ كمية قليلة، ومن كل 100 ذرة على الأرض 17 ذرة ماء.
آسف على هذا الهراء. بودوفا. القوة البدنية
في خطابات بسيطةآه، ترتبط ذرات اللافلزات برابطة تساهمية غير قطبية. ونتيجة لذلك، يتم تشكيل نظام إلكتروني أكثر استقرارا من الذرات المعزولة. في هذه الحالة، يتم إنشاء روابط مفردة (على سبيل المثال، في جزيئات الماء H2، الهالوجينات Ki، Br2)، مزدوجة (على سبيل المثال، في جزيئات الهيدروكسيد، على سبيل المثال، في جزيئات النيتروجين).
كما تعلمون بالفعل، يمكن للكلمات البسيطة غير المعدنية أن:
1. بودوفا الجزيئية. وفي حالة العقول العادية فإن معظم هذه المواد تكون غازات أو مواد صلبة ولا يشاع سوى بروم واحد (Br2). كل هذه الكلمات جزيئية وبالتالي متطايرة. في الحالة الصلبة، تتمتع الرائحة الكريهة بنقطة انصهار منخفضة بسبب ضعف التفاعل بين الجزيئات، مما يزيل جزيئاتها في البلورة، ويتم تكوينها قبل التسامي.
2. أتومني بودوفا. يتم إنشاء هذه الكلمات بواسطة رماح طويلة من الذرات. من خلال القيمة الكبيرة للروابط التساهمية، تتمتع الرائحة الكريهة، كقاعدة عامة، بصلابة عالية، وأي تغييرات مرتبطة بتدمير الروابط التساهمية في بلوراتها (الانصهار والتبخر) تحدث مع طاقة فيتراتو يو الكبيرة. في الواقع، تتمتع هذه المركبات بدرجات انصهار وغليان عالية، كما أن درجة تطايرها منخفضة جدًا. (يوجد على الطفل الصغير 47 رمزًا لتلك العناصر غير المعدنية التي تخلق فقط شبكات بلورية ذرية.)
يتم إنشاء عدد كبير من العناصر غير المعدنية من خلال عدد من الكلمات البسيطة - التعديلات المتآصلة. كما تتذكر، فإن قوة الذرات تسمى التآصل. يمكن أن يرتبط التآصل بتركيبة مختلفة من الجزيئات، وبمجموعة مختلفة من البلورات. تشمل التعديلات التناضحية للكربون الجرافيت والماس والكاربين والفوليرين (الشكل 48).

يتم تمييز العناصر غير المعدنية التي تخضع لقوة التآصل بنجمة 47. لذلك هناك مركبات غير معدنية بسيطة أكثر من العناصر الكيميائية غير المعدنية.
تعلم أن معظم المعادن، مع استثناءات نادرة (الذهب والنحاس وغيرها)، تتميز بتغير لونها إلى الأبيض الفضي. ومحور الخطب غير المعدنية البسيطة له ألوان جاما مختلفة بشكل كبير.
غير محترم على أهمية كبيرة في القوة البدنيةغير المعادن، لا يزال من الضروري التعرف على تصرفات حيلهم القذرة. جميع المركبات الشبيهة بالغاز، والبروم النادر، وكذلك البلورات التساهمية النموذجية هي مواد عازلة، وكذلك جميع الإلكترونات الخارجية لذراتها المستخدمة للإضاءة الروابط الكيميائية. البلورات ليست بلاستيكية، وأي تشوه يؤدي إلى تدمير الروابط التساهمية. معظم المواد غير المعدنية لا تنتج وهجًا معدنيًا.
القوة الكيميائية
كما لاحظنا بالفعل، بالنسبة لذرات اللافلزات، وبالتالي بالنسبة للكلمات البسيطة المضاءة بها، تتميز كل من القوى المؤكسدة والطبيعية.
أكاسيد قوة المركبات البسيطة من اللافلزات
1. تتجلى القوة المؤكسدة للمواد غير المعدنية في المقام الأول أثناء تفاعلها مع المعادن (كما تعلم، كانت المعادن دائمًا هي الأسلاف):

وأكاسيد الطاقة في الكلور Cl2 أقوى، وأقل في الكبريت، وذلك معدن Re، الذي لديه مرحلة أكسدة مستقرة +2 ب +3. يتأكسد به إلى مرحلة أكسدة أعلى.
2. تظهر معظم اللافلزات أكاسيد طاقة عند تفاعلها مع الماء. ونتيجة لذلك، يتم إنشاء جزيئات الماء المتطايرة.
3. أي مادة غير معدنية تعمل كعامل مؤكسد في التفاعلات مع تلك اللافلزات التي لها قيمة أقل في السالبية الكهربية:
السالبية الكهربية للكبريت أكبر من الفوسفور، مما يدل على أكاسيد الطاقة.
إن السالبية الكهربية للفلور أكبر من جميع العناصر الكيميائية الأخرى، ولهذا السبب فإنه يظهر قوة العامل المؤكسد.
الفلور هو أقوى مؤكسد لللافلزات ويظهر قوة الأكسيد فقط في التفاعلات.
4. يتم الكشف عن القوى المؤكسدة لللافلزات في التفاعلات مع الأفعال ألسنة قابلة للطي. ليس فقط الحامض، ولكن أيضًا غير المعادن الأخرى يمكن أن تصبح أيضًا عوامل مؤكسدة في التفاعلات مع المركبات المعقدة - غير العضوية والعضوية.
يعمل الكلور المؤكسد القوي Cl2 على أكسدة الكلوريد (II) إلى كلوريد (III).
تتذكر بالطبع رد الفعل الواضح على قلة تشبع المركب - إضافة ماء البروم.
القوة الجديدة للخطب البسيطة - غير المعادن
عند النظر في تفاعل اللافلزات، أشار أحدهم بالفعل إلى أنه اعتمادًا على قيمة سالبيتها الكهربية، يُظهر أحدهما قوة مؤكسد، والآخر قوة مؤكسد.
1. فيما يتعلق بالفلور، فإن جميع العناصر غير المعدنية (مثل كيسن) تظهر قوة مطلقة.
2. من الواضح أن المواد غير المعدنية، بما في ذلك الفلور، تعمل كعوامل اختزال عند التفاعل مع الحمض:

8 العديد من اللافلزات يمكن أن تعمل كمحفز في التفاعلات مع المؤكسدات القابلة للطي:

هناك أيضًا تفاعلات يتم فيها أكسدة نفس المادة غير المعدنية في نفس الوقت، في عملية تفاعل الأكسدة الذاتية والتجديد الذاتي.
يا إلهي، دعونا نحصل على الحقائب! يمكن أن تعمل معظم اللافلزات في التفاعلات الكيميائية كعامل مؤكسد وكعامل مؤكسد (لا يقتصر الأخير على الفلور وحده).
إمدادات المياه من غير المعادن
القوة النهائية لجميع اللافلزات هي تكوين مركبات مائية صيفية، معظمها لا معادن في مرحلة أكسدة منخفضة.

ويبدو أن الطريقة الأسهل هي إزالة التفاعل المباشر بين اللافلز والماء، أو عن طريق التوليف.
في الماء، يتم دمج اللافلزات مع المذيبات القطبية المتجانسة، الممزوجة بالماء الجزيئي، وفي حالة الغسلات العادية، الغازات، باستثناء الماء (ريدينا). تتميز جميع توصيلات المياه من غير المعادن بوضعها المتصاعد على الماء. لا غنى عن META و enlan فيه عمليا. الأمونيا، عندما تذوب في الماء، تشكل قاعدة البلاطة - هيدروكسيد الأمونيوم.
بالإضافة إلى القوى المذكورة أعلاه، فإن التأثيرات المائية لللافلزات في تفاعلات قاعدة الأكسيد تظهر دائمًا قوى القوى الجديدة، وحتى فيها اللافلز لديه مرحلة أكسدة أقل.
أكاسيد غير معدنية وهيدروكسيدات ذات صلة
في الأكاسيد غير المعدنية، تكون الروابط بين الذرات قطبية تساهمية. بعض الأكاسيد الجزيئية تشبه الغاز، ونادرة (متطايرة)، وصلبة (متطايرة).
تنقسم الأكاسيد غير المعدنية إلى مجموعتين: غير الملحة وتشكيل الهلام. عندما تذوب الأكاسيد الحمضية في الماء، تتشكل هيدرات الأكسيد - هيدروكسيدات، وهي بطبيعتها أحماض. تؤدي الأحماض وأكاسيد الأحماض إلى التفاعلات الكيميائيةتذوب الأملاح التي يحتفظ فيها اللافلز بمرحلة الأكسدة.
الأكاسيد والهيدروكسيدات المرتبطة بها هي أحماض تظهر فيها اللافلزات مرحلة أكسدة تساوي رقم المجموعة، لذلك تسمى المواد ذات قيمتها الأعلى. عند النظر في القانون الدوري، قمنا بالفعل بوصف هيكله وقوته.
تقوية الخواص الحمضية للأكاسيد والهيدروكسيدات ضمن مجموعة فرعية رئيسية واحدة، على سبيل المثال، المجموعة السادسة، هناك نمط من التغيرات في خصائص الأكاسيد والهيدروكسيدات الأعلى.
إذا تفاعلت مادة غير معدنية مع اثنين أو أكثر من الأكاسيد الحمضية، وبالتالي مع نفس النوع من الأحماض الحمضية، فإن خواصها الحمضية تزيد بسبب زيادة درجة أكسدة المادة غير المعدنية.
يمكن للأكاسيد والأحماض، التي يكون فيها اللافلز في أعلى مرحلة من الأكسدة، أن تظهر فقط أكاسيد الطاقة.
يمكن للأكاسيد والأحماض، حيث يكون لللافلز مرحلة متوسطة من الأكسدة، أن تظهر كلاً من الأكاسيد والخصائص الطبيعية.
المهام العملية
1. ما هي أنواع الأوطان الإلكترونية التي تعتبر عناصر غير معدنية؟
2. ما هي العناصر غير المعدنية الحيوية؟
3. ما هي العوامل التي تحدد إمكانات التكافؤ للذرات اللافلزية؟ فانظر إليهم بعقب الذرات حامضا وكبريتا.
4. لماذا تعتبر بعض اللافلزات الشائعة كالغازات وغيرها من المواد الصلبة المقاومة للحرارة؟ 5. التعريف باستخدام المواد اللافلزية البسيطة، والتي يمكن العثور عليها في العقول العادية في تجمعات مختلفة: أ) شبيهة بالغاز، ب) نادرة، ج) صلبة.
6. أضف رصيد تفاعلات الأكسيد-هيدروكسيد التي تشتمل على اللافلزات. ما نوع الطاقة (الأكاسيد أو المواد المضافة) التي تظهرها هذه المعادن في هذه التفاعلات؟

ما هي أسباب الاختلاف الكبير في درجات حرارة الماء المغلي وسيلينيد الهيدروجين، ولماذا تكون درجات حرارة غليان الكبريت وسيلينيد الهيدروجين متقاربة؟
7. لماذا يكون الميثان ثابتًا في الهواء الطلق، والميثان القوي في الهواء الطلق يحتل نفسه ذاتيًا: فلوريد الهيدروجين ثابت حتى يتم تسخينه، وماء اليود، حتى عند تسخينه قليلاً، يتحلل إلى اليود والماء؟
8. اكتب معادلة التفاعل التي يمكن استخدامها لإجراء التحولات التالية:
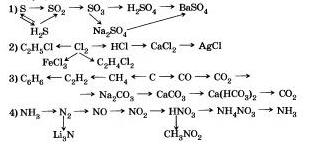
9. اكتب معادلة التفاعل التي يمكن استخدامها لإجراء التحولات التالية:

12. من خلال شق لخلط 10 جرام من هيدروكسيد الصوديوم، تم تمرير 20 جرام من ماء الهيدروكسي. ما مدى قوته وكم سيكون؟
مثال: 0.25 مول NaHS.
14. عندما تمت معالجة 30 جم من فابنياك بحمض الهيدروكلوريك، تم إطلاق 11 جم من ثاني أكسيد الكربون. ما هي كتلة كربونات الكالسيوم في الفابنياك الطبيعي؟ التحقق: 83.3%. 15. تستخدم صبغة اليود في الطب، حيث تحتوي على 51% من اليود البلوري في الكحول الإيثيلي. يتم مزجه مع الكحول الذي تبلغ قوته 0.8 جم / مل. هل تحتاج إلى 250 جرام من هذا للتحضير؟
النوع: 297 مل. 16. تم إذابة خليط من السيليكون والجرافيت وكربونات الكالسيوم بوزن 34 جرام في هيدروكسيد الصوديوم وتم أخذ 22.4 لتر من الغاز (N.U.). عند أخذ عينة من هذا الجزء من الخليط مع حمض الهيدروكلوريك، تمت إزالة 2.24 لتر من الغاز (N.U.). يرجى ملاحظة أن المستودع الضخم هو سوميشى.
النوع: 14 جم 81: 10 جم ج؛ 10 جرام كربونات الكالسيوم.
17. الأمونيا الغازية بحجم 2.24 لتر (N.U.) مذابة 20 جم من حمض الفوسفوريك بكسر كتلة 49٪. كيف يتم تسوية الوضع، ما الأمر؟
النوع: 11.5 جرام
19. ما حجم الأمونيا المطلوب لإزالة 6.3 طن من حمض النيتريك بتكلفة 5% تقريباً؟
النوع: 2352 م3.
20. دبليو غاز طبيعيتمت إزالة الأسيتيلين بحجم 300 لتر (NU) مع نسبة حجمية من الميثان في الغاز تبلغ 96%. يرجى ملاحظة أن عائد المنتج هو 65%.
النوع: 93.6 لتر.
21. فيزناختي الصيغة الهيكليةفي الكربوهيدرات بكثافة بخار تبلغ 1.862 ونسبة كتلة من الكربون تبلغ 88.9٪. يبدو أن الكربوهيدرات تتفاعل مع التحلل الكيميائي لأكسيد البلاطة.
دور العناصر غير المعدنية في حياة الإنسان
تلعب المعادن دورًا مهمًا في حياة الناس، لأنه بدونها يستحيل العيش ليس فقط للناس، ولكن أيضًا للكائنات الحية الأخرى. Aje هو مثل هذا الطالب الذي يذاكر كثيرا العناصر غير المعدنيةمثل الحامض والكربون والماء والنيتروجين، يتم إنشاء الأحماض الأمينية، والتي يتم بعد ذلك إنشاء البروتينات، والتي بدونها لا يمكن أن توجد جميع الكائنات الحية على الأرض.
دعونا نلقي نظرة فاحصة على الصورة أدناه، والتي توضح العناصر غير المعدنية الرئيسية:

والآن دعونا ننظر إلى هذه الأفعال بمزيد من التفصيل ونفهم معناها وكيف تلعب في حياة الإنسان وفي جسده.
حياة الإنسان كلها تكمن في الريح التي تتنفس، وفي الريح لا توجد معادن ولا وصلات بينهما. ولضمان أداء أهم وظائف الجسم، يتم الاهتمام بالحموضة، حيث يقوم النيتروجين والمواد الأخرى الشبيهة بالغاز بتخفيفها، وبالتالي سرقة مساراتنا المهدئة. حسنًا، من خلال دورة علم الأحياء الخاصة بك، تعلم بالفعل أن جميع الوظائف الحمضية للجسم ترتبط ارتباطًا وثيقًا بوجود الحموضة.
بسبب تغلغل الأشعة فوق البنفسجية الضارة، يحمي الأوزون أجسامنا.
يعمل هذا العنصر الدقيق الأساسي مثل الكبريت كمعدن تجميل في جسم الإنسان، حيث سيتم حرمان الجلد والأظافر والشعر من الصحة. ومن المهم أيضًا أن نتذكر أن السيركا تلعب دورًا في الأنسجة الغضروفية والعظمية المقولبة، وتساعد على إغلاق عمل المفاصل، وتضغط على أنسجة اللحم لدينا وتؤدي العديد من الوظائف الأخرى، مثل أنها مهمة جدًا لصحة الإنسان.
وتلعب أنيونات الكلور أيضًا دورًا بيولوجيًا مهمًا للإنسان، حيث تشارك في تنشيط بعض الإنزيمات. وهذا يساعد على دفع الوسط اللطيف إلى الشق والحفاظ على الضغط الأسموزي. عادة ما يتم امتصاص الكلور في جسم الإنسان. ملح المطبخعند استلام القنافذ.
هناك الكثير من الفوائد المهمة التي لم يتم وضعها من قبل على جسم الإنسان، وعلى الكائنات الحية الأخرى، مما يعني ركودها في الأنسجة الأخرى المختلفة.
ركود المعادن غير
فودين
ويستخدم هذا النوع من اللافلزات، مثل الماء، على نطاق واسع في الصناعة الكيميائية. يتم استخدامه لتخليق الأمونيا والميثانول وحمض الهيدروكلوريك وكذلك لهدرجة الدهون. كما أنه لا يمكن الاستغناء عن مشاركة الماء، مثل تجديد وإنتاج المعادن الغنية وربطها.
هناك ركود واسع النطاق للمياه في الطب. عند تنظيف الجروح وإيقاف أي نزيف، استخدم ثلاثمائة جرعة من بيروكسيد الماء.
الكلور
لإنتاج حمض الهيدروكلوريك، يتم تعقيم المطاط وكلوريد الفينيل والبلاستيك بالإضافة إلى العديد من المواد العضوية بالكلور. أنت منتصر في صناعات مثل المنسوجات والورق، وكذلك الجلود الناعمة. بشكل يومي، لا غنى عن الكلور للتطهير يشرب الماء، لذلك، بسبب قوة الأكسيد، فإنه له تأثير مطهر للغاية. نفس السلطات تحكم المياه والكلور، وهذا مهم.
للأغراض الطبية، كقاعدة عامة، يتم استخدام كلوريد الصوديوم كفيزيور. وعلى هذا الأساس، تهتز الوجوه الغنية بطاردة الماء.
سيركا
يتم استخدام اللافلزات مثل الكبريت لإنتاج حمض الكبريتيك والبارود والكبريت. كما أنه يتصلب أثناء الفلكنة للمطاط. إنهم راكدون في إنتاج البرنبيري واللومينوفور. والشراب الغروي ضروري في الطب.
أصبحت سيركا راكدة في الولاية الريفية. يتم استخدامه كمبيد للفطريات لمكافحة الآفات المختلفة.
في تركيب المواد البوليمرية، وكذلك لإعداد المستحضرات الطبية المختلفة، تم استخدام المواد غير المعدنية مثل اليود والبروم على نطاق واسع.
