اللافلزات هي عناصر كيميائية تخلق تبدو جيداتكلم بكل بساطة، حتى لا تحكمك القوى الفيزيائية للمعادن. ض 114 العناصر الكيميائية 92 منها تنتقل إلى المعادن، و22 إلى غير المعادن. غير المعادن - فقط قل متى في أعظم العقوليمكن أن تكون غازات وسوائل ومواد صلبة (الشكل 46).
صغير 46.
سامحني - غير المعادن
الفحص المعملي رقم 6
فهم جمع اللافلزات
تعرف على مجموعة اللافلزات. اكتب الصيغ الكيميائية لللافلزات التي رأيتها، ورتبها ترتيبًا تصاعديًا:
- سماكة؛
- صلابة؛
- نعيم؛
- تغيير شدة اللون.
ولهذا الغرض، يرجى استخدام الإضافات 1 و 2 للحصول على معلومات إضافية.
الغازات هي الهيليوم He، النيون Ne، الأرجون Ar، الكريبتون Kr، زينون Xe، الرادون Rn. يطلق عليهم الغازات الخاملة. تتكون جزيئات الغاز الخامل من ذرة واحدة. في كرة الإلكترون الخارجية، تحتوي ذرات الغازات الخاملة (الهيليوم في النهاية) على جميع الإلكترونات. الهيليوم لديه اثنان. تشبه الغازات الخاملة المعادن النبيلة - الذهب والبلاتين - في مقاومتها الكيميائية، ولها اسم آخر - الغازات النبيلة. وهذا أكثر ملاءمة للغازات الخاملة التي تدخل مع ذلك التفاعلات الكيميائيةوجعل الأمور تحدث. في عام 1962، ظهرت معلومات عن أولئك الذين أزالوا العلاقة بين الزينون والفلور. يوجد بالفعل أكثر من 150 مجموعة من الزينون والكريبتون والرادون مع الفلور والحمض والكلور والنيتروجين.
لم تعد المعلومات المتعلقة بالخصائص الكيميائية للغازات النبيلة ممكنة، وبالتالي، بدلاً من المجموعة الصفرية المنقولة، تم وضع الغازات الخاملة في المجموعة الثامنة (مجموعة VIIIA) في الجدول D. I. منديليف.
الهيليوم، بسبب خفته، يستخدم الماء فقط، ولكن بدلاً من الباقي فهو غير قابل للاشتعال، أي أنه لا يشكل أي خطر في المناطيد والمناطيد (الشكل 47).

صغير 47.
عمال بوفيتريانيوسيتم ملء المناطيد بالهيليوم
يتم استخدام النيون لإنتاج الإعلانات ذات الألوان الفاتحة (الشكل 48). خمن أن Wisław المجازي "لقد غمرت شوارع المدينة بالنيون".

الغازات: الماء، الغاز الحامض، النيتروجين، الكلور، الفلور، تذيب الجزيئات ثنائية الذرة، مثل H2، O2، N2، Cl2، F2.
يتم عرض مستودع الكلام على الورقة والعلامات والأرقام الفيكتورية والكيميائية - المؤشرات باستخدام الصيغة الكيميائية. باستخدام الصيغة الكيميائية، كما تعلمون، احسب الكتلة الجزيئية المائية للرينيوم (Mr). الكتلة الجزيئية المائية لمركب بسيط هي الإضافة القديمة للكتلة الذرية المائية لكل عدد من الذرات في الجزيء، على سبيل المثال حمض O 2:
السيد (02) \u003d Ar (0) × 2 \u003d 16 × 2 \u003d 32.
ومع ذلك، فإن عنصر كيسن يخلق مادة أخرى تشبه الغاز - الأوزون، الذي يحتوي على ثلاث ذرات فقط من كيسن. الصيغة الكيميائية للأوزون هي 0 3، ووزنه الجزيئي السائل هو: السيد (03) \u003d 16 × 3 \u003d 48.
قوة التعديلات المتآصلة للعنصر الكيميائي الحامض - خطابات بسيطةحمض O 2 والأوزون O 3 - الاختلافات. كيسن ليس له رائحة، لكن الأوزون ليس له رائحة (من نفس الاسم - مترجم من اليونانية، الأوزون يعني "الرائحة"). ويمكن اكتشاف هذه الرائحة، رائحة النضارة، خلال عاصفة رعدية، حيث يتشكل الأوزون بكميات صغيرة في الريح نتيجة التفريغ الكهربائي.
كيسن هو غاز بلا لون، والأوزون له لون بنفسجي شاحب. الأوزون أكثر مبيد للجراثيم (lat. Tsidao - Drive in)، حموضة أقل. ولذلك، فإن الأوزون يركد من أجل الصحة يشرب الماء. يحتوي الأوزون على الأشعة فوق البنفسجية الموجودة في الطيف الشمسي، وهي ضارة بجميع أشكال الحياة على الأرض، وكرة الأوزون التي تنمو في الغلاف الجوي على ارتفاع 20-35 كم، تدمر الحياة على كوكبنا (لطفل عمره 49 سنة تصوير، مأخوذة من الفضاء بمساعدة قطعة من القمر الصناعي للأرض، حيث يُشار إلى المناطق ذات الأوزون المنخفض في الغلاف الجوي ("مستويات الأوزون") باللون الأبيض).
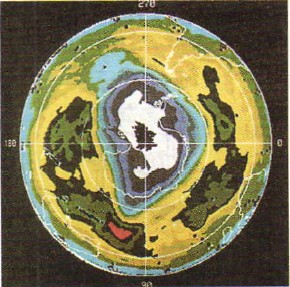
صغير 49.
"الأوزون ديري" في الغلاف الجوي للأرض
من الكلمات البسيطة - اللافلزات، في معظم العقول، البروم فقط، وهو جزيء ثنائي الذرة، هو الشائع. صيغة البروم Br 2. قيمة البوراكس، s رائحة كريهةريدينا (من كلا الاسمين، حيث تُترجم بروموس من اليونانية القديمة على أنها "رائحة كريهة").
ولم يتم استخدام هذه المواد الصلبة منذ وقت قريب – فهي عبارة عن اللون الرمادي والفحم (على شكل فحم الخشب والماس والجرافيت).
في المواد الصلبة - غير المعدنية، يتم أيضًا تجنب ظاهرة التآصل. وهكذا فإن عنصر الكربون يخلق مثل هذه الاختلافات خلف المظهر الخارجي للكلمات البسيطة مثل الماس والجرافيت (الشكل 50). سبب هيمنة السلطات على الماس والجرافيت يكمن في بودوفو المشابك الكريستالكلمات كثيرة، كما ستنظر إليها بعد عقد من الزمن.
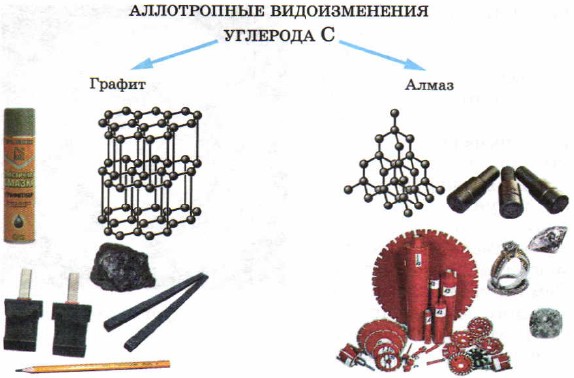
صغير 50.
التعديلات التناضحية للكربون ومناطق ركودها
يحتوي عنصر الفوسفور على تعديلين متآصلين: الفوسفور الأحمر (الموجود على جانب صندوق التوت) والفوسفور الأبيض. أما الجزيء المتبقي فهو جزيء رباعي الذرات، ويتم التعبير عن تركيبه بالصيغة P 4.
المادة الصلبة - غير المعدنية - هي اليود البلوري مع جزيء ثنائي الذرة I 2. لا تخلط بينه وبين اليود الكحولي - صبغة اليود الموجودة في خزانة الأدوية في منزلك.
لا تشبه بلورات اليود والجرافيت الكلمات البسيطة الأخرى - فهي غير معدنية، ورائحتها تشبه البريق المعدني.
ولإظهار صحة الكلمات البسيطة على أساس قواها الفيزيائية على المعادن واللافلزات، دعونا نتأمل في تباين العنصر الكيميائي Sn. في درجة حرارة الغرفة يطلق عليه بيتا القصدير (β-Sn). كل ما يمكنك رؤيته هو القصدير الأبيض - المعدن الذي كان يُصنع منه جنود القصدير سابقًا (الشكل 51، أ) (تذكر حكاية إتش سي أندرسن "الجندي الصامد"). قم بتغطية منتصف العلب بالقصدير (الشكل 51، ب). من الممكن الدخول إلى مستودع سبيكة معروفة مثل البرونز وكذلك اللحام (الشكل 51، ج).

صغير 51.
مناطق ركود القصدير:
أ - اللعب؛ ب - اهتزاز العلب. ج - لحام
عند درجات حرارة أقل من +13.2 درجة مئوية، يكون ألفا القصدير المستقر (α-Sn) عبارة عن مسحوق بلوري رمادي اللون، ومن المرجح أن يكون مادة غير معدنية. تمت عملية تحويل القصدير الأبيض إلى الكبريت عند درجة حرارة تصل إلى -33 درجة مئوية. وقد أدى هذا التحول إلى ظهور الاسم المجازي "طاعون القصدير".
نقوم الآن بتحديث الكلمات البسيطة - المعادن وغير المعادن في الجدول الإضافي 3.
الجدول 3
اغفر لي الكلمات

الكلمات والعبارات الرئيسية
- غازات نبيلة.
- التعديلات أو التعديلات المتآصلة والمتآصلة.
- كيسن والأوزون.
- الماس والجرافيت.
- الفوسفور الأحمر والأبيض.
- القصدير الأبيض والرمادي.
- أهمية الخطب البسيطة على المعادن وغير المعدنية.
العمل مع الكمبيوتر
- ارجع إلى الملحق الإلكتروني. اقرأ مادة الدرس وقم بالتوقيع على المهام المخصصة لك.
- ابحث عن عناوين البريد الإلكتروني على الإنترنت التي يمكن أن تكون بمثابة مصادر إضافية تكشف عن موقع الكلمات الرئيسية وإسهاب الفقرة. اقترح على المعلم مساعدتك في إعداد درس جديد - لتنمية الوعي بالكلمات والعبارات الأساسية للفقرة القادمة.
التغذية والإمداد
- انظر إلى أصل أسماء العديد من الغازات النبيلة.
- لماذا التعبير الشعري بشكل لا يصدق كيميائيا "الريح تفوح منها رائحة الرعد"؟
- اكتب مخططات التركيب الجزيئي: Na 2, Br 2, O 2, N 2. ما نوع الرابط الكيميائي الموجود في هذه الجزيئات؟
- ما هو نوع الرابط الكيميائي المسؤول عن المياه المعدنية؟
- ماتت بعثة المستكشف القطبي ر. سكوت إلى القطب المغمور في عام 1912 لأنها استنفدت كامل مخزونها من الوقود: فقد تم تخزينه في خزانات مغلقة بالقصدير. أيها عملية كيميائيةالكذب على أساس ماذا؟
محاضرة 3. غير المعادن
1. خاصية الزجالنيالعناصر غير المعدنية
هناك 16 عنصرًا كيميائيًا غير معدني في المجمل، اثنان منهم، الأكسيد والسيليكون، يشكلان 76% من كتلة القشرة الأرضية. تشكل اللافلزات 98.5% من كتلة النباتات و 97.6% من كتلة الإنسان. ومع الكربون والماء والحامض والفوسفور والنيتروجين تتشكل جميع المواد العضوية المهمة والرائحة الكريهة وعناصر الحياة. الماء والهيليوم هما العنصران الأساسيان في الكون، ومنهما تتشكل جميع الأجسام الكونية، بما في ذلك شمسنا. بدون اتصال غير المعادن، من المستحيل فهم حياتنا، وخاصة تخمين ما هو الأكثر أهمية في الحياة اتصال كيميائي- الماء - يتكون من مائي وحامض.
اللافلزات هي عناصر كيميائية تأخذ ذراتها الإلكترونات لإكمال مستوى الطاقة الخارجي، مما يخلق شحنة سالبة على الأيونات.
تحتوي جميع المواد غير المعدنية تقريبًا على أنصاف أقطار صغيرة نسبيًا وعدد كبير من الإلكترونات عند مستوى الطاقة الحالي من 4 إلى 7، وتتميز بقيم عالية من السالبية الكهربية وأكاسيد الطاقة.
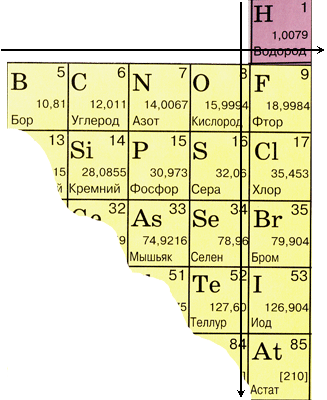
1.1. مواقع العناصر غير المعدنية في جدول مندليف الدوري للعناصر الكيميائية
إذا قمنا في النظام الدوري برسم قطري من البورون إلى الأستاتين، فستكون على اليمين صعودًا على طول القطر عناصر غير معدنية، وفي الأسفل - معادن، وما فوقها ستكون هناك عناصر من جميع المجموعات الفرعية الثانوية، اللانثانيدات والأكتينويدات. العناصر الموضوعة بالقرب من القطر، على سبيل المثال، البريليوم، الألومنيوم، التيتانيوم، الجرمانيوم، الأنتيمون، لها طابع مزدوج وترتبط بميتالويد. العناصر غير المعدنية: عنصر s - الماء؛ ف-عناصر 13 مجموعة - البورون؛ 14 مجموعة - الفحم والسيليكون. 15 مجموعة - النيتروجين والفوسفور والرماد، 16 مجموعة - الحامض والحامض والسيلينيوم والتيلور وجميع عناصر 17 مجموعة - الفلور والكلور والبروم واليود والأستاتين. عناصر المجموعة 18 - الغازات الخاملة، تحتل موقعا خاصا، وتوجد على سطح كرة الإلكترون الخارجية وتحتل موقعا وسطا بين المعادن واللافلزات. يتم تصنيفها أحيانًا على أنها غير معدنية، أو رسميًا، خلف علامات جسدية.
1.2. النفايات الإلكترونية من العناصر غير المعدنية
تحتوي جميع العناصر غير المعدنية تقريبًا على مستوى الطاقة الحالي على عدد كبير من الإلكترونات - من 4 إلى 7. عنصر البورون هو نظير للألمنيوم، فهو يحتوي على 3 إلكترونات فقط في مستوى الطاقة الحالي، ولكن ليس فقط لديه كمية صغيرة من الإلكترونات. نصف القطر، ويزيل إلكتروناته، وله قوة اللافلز. أهمية خاصة هي إمدادات المياه الإلكترونية. هذا العنصر، إذا لم يكن كافيًا، فإنه يقبل بسهولة إلكترونًا واحدًا، ويذيب أيون الهيدريد وينتج أكاسيد الطاقة في المعدن.
يظهر في الجدول التكوينات الإلكترونية لإلكترونات التكافؤ للعناصر غير المعدنية:
1.3. أنماط التغير في قوة العناصر غير المعدنية
دعونا ننظر إلى أنماط التغير في قوة العناصر غير المعدنية التي تقع في فترة واحدة ومجموعة واحدة على أساس ذراتها.
فترة:
تزداد الشحنة النووية
يتغير نصف قطر الذرة
سيزداد عدد الإلكترونات في مستوى الطاقة الحالي،
السالبية الكهربية تتزايد
سوف تصبح أكاسيد الطاقة أقوى،
سوف تسود السلطات غير المعدنية.
من المجموعة:
تزداد الشحنة النووية
يزداد نصف قطر الذرة
عدد الإلكترونات في مستوى الطاقة الحالي لا يتغير،
تغيرات السالبية الكهربية
أكاسيد القوة تضعف،
القوى غير المعدنية تضعف.
وبهذه الطريقة، فإن القيمة الصحيحة والأعلى لعنصر ما في الجدول الدوري، هذا هو التعبير الأوضح عن قوته غير المعدنية.
- قيمة الاستقطاب الرابطة الكيميائية, طرح أحدث الرهانات الإلكترونية.
تحتوي اللافلزات على 22 عنصرًا.
مواقع العناصر غير المعدنية في النظام الدوري للعناصر الكيميائية
| مجموعة | أنا | ثالثا | رابعا | الخامس | السادس | سابعا | ثامنا |
| الفترة الأولى | ن | هو | |||||
| الفترة الثانية | في | ز | ن | يا | F | ني | |
| الفترة الثالثة | سي | ص | س | سي.إل. | آر | ||
| الفترة الرابعة | مثل | حد ذاته | ر | كر | |||
| الفترة الخامسة | تي | أنا | XE | ||||
| الفترة السادسة | في | آر إن |
ذرات بودوفا من اللافلزات
السمة المميزة للمواد غير المعدنية هي وجود عدد أكبر من الإلكترونات (مساوية للمعادن) على مستوى الطاقة الحالي لذراتها. وهذا يعني أنهم أكثر عرضة لاكتساب إلكترونات إضافية وإظهار نشاط أكسيد أكبر من المعادن. تكشف القوة المؤكسدة القوية بشكل خاص، أي وجود الإلكترونات، عن المعادن غير الموجودة في الفترتين الثانية والثالثة من المجموعة VI-VII. وبمجرد تساوي توزيع الإلكترونات في المدارات في ذرات الفلور والكلور والهالوجينات الأخرى، يمكننا الحكم عليها السلطات الإدارية. لا تحتوي ذرة الفلور على مدارات حرة. قد تظهر ذرة الفلور هذه تكافؤًا أعلى في I ومرحلة الأكسدة - 1. أقوى أكسدة هي الفلور. وفي ذرات الهالوجينات الأخرى، على سبيل المثال في ذرة الكلور، توجد مدارات d حرة على نفس مستوى الطاقة. لذلك، يمكن أن يحدث فصل الإلكترونات بثلاث طرق مختلفة. في النوع الأول يمكن للكلور أن يظهر مرحلة الأكسدة +3 وينتج حمض الكلوروس HClO 2 والذي يتمثل بأملاح - كلوريت مثلا كلوريت البوتاسيوم KClO 2. وفي النوع الآخر يمكن للكلور أن ينتج الكلور، وفيه مرحلة الأكسدة الكلور ص +5. قبل مثل هذه التفاعلات، يتم إضافة حمض الكلوريك HClO 3 وأملاحه - كلورات، على سبيل المثال كلورات البوتاسيوم KClO 3 (ملح البرثوليت). في النوع الثالث يظهر الكلور مرحلة أكسدة +7، على سبيل المثال في حمض البيركلوريك HClO 4 وفي أملاحه - بيركلورات (في بيركلورات البوتاسيوم KClO 4).كانت هناك جزيئات غير معدنية. القوة الفيزيائية لللافلزات
في الحالة الشبيهة بالغاز عند درجة حرارة الغرفة يوجد:· الماء - ح 2؛
· النيتروجين - ن 2؛
· كيسن - يا 2؛
· الفلور - F 2؛
· الكلور - CI 2.
الغازات الخاملة:· الهيليوم - هو؛
· نيون - ني؛
· الأرجون - آر؛
· الكريبتون - كر؛
· زينون - Xe؛
· الرادون - Rn).
في نادر- البروم - ر.في صلب:
التيلوريوم - تي؛
· اليود - أنا؛
· أستاتين - في.
تحتوي اللافلزات على طيف أكثر ثراءً من الألوان: الأحمر - للفوسفور، والبني - للبروم، والأصفر - للرمادي، والأصفر والأخضر - للكلور، والبنفسجي - لبخار اليود، وما إلى ذلك.أوجد أكثر اللافلزات جزيئية وأقل الأنواع غير جزيئية. وهذا ما يفسر غطرسة سلطاتهم.
تخزين وقوة الخطب البسيطة - غير المعدنية
تشكل اللافلزات جزيئات أحادية وثنائية الذرة. قبل أحادي الذرة تحمل اللافلزات غازات خاملة ولا تتفاعل عمليا مع المواد الأكثر نشاطا. تتوزع الغازات الخاملة في المجموعة الثامنة من النظام الدوري، والصيغ الكيميائية للمركبات البسيطة المقابلة لها هي: He، Ne، Ar، Kr، Xe، Rn.
الجهات الفاعلة لا تخلق المعادن ثنائي الذرة جزيئات. Ce H 2، F 2، Cl 2، Br 2، Cl 2 (عناصر المجموعة السابعة من النظام الدوري)، وكذلك الأكسجين O 2 والنيتروجين N 2. ح ثلاثية الذرة تشكل جزيئات غاز الأوزون (O 3). بالنسبة للمركبات غير المعدنية الموجودة في الحالة الصلبة، فمن الصعب صياغة صيغة كيميائية. ترتبط ذرات الكربون الموجودة في الجرافيت ببعضها البعض بطرق مختلفة. من المهم رؤية بنية الجزيء في الهياكل المستهدفة. عند الكتابة الصيغ الكيميائيةفي مثل هذه الخطب، كما هو الحال مع المعادن، يتم تقديم التخمين، بحيث تتشكل هذه الخطب فقط من الذرات. الصيغ الكيميائية، في هذه الحالة، مكتوبة بدون فهارس: C، Si، S، إلخ. كلمات بسيطة مثل الأوزون والحموضة، والتي تشكل مستودعًا حمضيًا جديدًا (كلاهما يتكون من نفس العنصر - الحموضة)، ولكن لا تتنافس على ذلك، بسبب عدد الذرات الموجودة في الجزيء، قد يكون هناك اختلافات في القوة. فالحامض ليس له رائحة، بينما الأوزون له رائحة نفاذة، نستشعرها خلال ساعة العاصفة الرعدية. كما توجد قوة اللافلزات الصلبة، مثل الجرافيت والماس، في مستودع الرماد الجديد، وكذلك الألماس، وتختلف بشكل حاد (الجرافيت صلب، والماس صلب). وبالتالي، فإن قوة الكلام لا يُشار إليها فقط من خلال بنيته الواضحة، ولكن أيضًا من خلال عدد الذرات الموجودة في جزيئات الكلام وكيفية ارتباطها ببعضها البعض. يبدو أن اللافلزات توجد في الأجسام البسيطة إما في حالة صلبة أو شبيهة بالغاز (بما في ذلك البروم). الرائحة الكريهة لا تبقى على القوى الجسدية، المعادن القوية. لا تظهر المواد الصلبة غير المعدنية الحرارة المميزة للمعادن، فهي كريهة الرائحة وتميل إلى توصيل الكهرباء والحرارة بشكل سيئ (بخلاف الجرافيت). قد يستمر البورون البلوري B (وكذلك السيليكون البلوري) لفترة أطول درجة حرارة عاليةدرجة حرارة الانصهار (2075 درجة مئوية) ومقاومة عالية. تزداد الموصلية الكهربائية للبورون بشكل كبير مع ارتفاع درجة الحرارة، مما يجعل من الممكن استخدامه على نطاق واسع في تكنولوجيا الموصلات. إضافة البورون إلى الفولاذ وسبائك الألومنيوم والنحاس والنيكل وغيرها. سأقوم بتحسين قوتهم الميكانيكية. البوريدات (شبه البورون مع المعادن، على سبيل المثال مع التيتانيوم: TiB، TiB 2) ضرورية في صناعة أجزاء المحركات النفاثة، وشفرات توربينات الغاز. كما يتبين من الرسم البياني 1، الفحم - C، السيليكون - Si، البورون - سأذهب إلى الجحيم في شهر مايو وسأكون مسؤولاً عن مثل هذه السلطات الفاسدة. مثل الكلمات البسيطة، تأتي الرائحة الكريهة في شكلين - بلورية وغير متبلورة. وتكون الأشكال البلورية لهذه العناصر أكثر صلابة، ولها نقاط انصهار عالية. يحمل السيليكون البلوري قوى توجيهية. تتحد كل هذه العناصر مع المعادن - الكربيدات ومبيدات السيليكات والبوريدس (CaC 2، Al 4 C 3، Fe 3 C، Mg 2 Si، TiB، TiB 2). لديهم صلابة أكبر، على سبيل المثال Fe 3 C، TiB. تتم معالجة كربيد الكالسيوم لإزالة الأسيتيلين.
\u003e\u003e خيميا: خطب بسيطة - غير المعادن
غير المعادن - وهي عناصر كيميائية تصنع كلمات بسيطة لا تعاني من القوى الفيزيائية للمعادن. من بين العناصر الكيميائية الـ 109، تم تخصيص 87 عنصرًا للمعادن، و22 عنصرًا غير معدني.
6. صلاحية الخطب البسيطة على المعدن وغير المعدن.
ألقِ نظرة على أصل أسماء العديد من المعادن النبيلة.
لماذا يتم التعبير عنها بشكل كيميائي وشاعري بشكل لا يصدق: "رائحة الرعد الريح"؟
اكتب مخططات تكوين الجزيئات: Na2، Br2، O2، N2. ما نوع الارتباط الموجود في هذه الجزيئات؟
رصيد الدرس ملاحظات الدرسعرض إطاري مساند لدرس حول أسلوب التسريع والتقنيات التفاعلية يمارس المهام ولهم الحق في التحقق الذاتي من ورش العمل والدورات التدريبية والحالات والمهام ومناقشة الواجبات المنزلية والتغذية والتغذية الخطابية للطلاب الرسوم التوضيحية الصوت والفيديو والوسائط المتعددةصور فوتوغرافية، صور، رسومات، جداول، مخططات فكاهية، نوادر، نكت، كاريكاتير، أمثال، أوامر، كلمات متقاطعة، اقتباسات إضافات خلاصةإحصائيات، نصائح للحصول على نصائح إضافية، أوراق الغش، كتيبات، مسارد المصطلحات الأساسية والتكميلية وغيرها تحسين الدروس والدروستصحيح العفو في الدليلتحديث جزء من كتيب عناصر الابتكار في الفصل الدراسي واستبدال المعرفة القديمة بأخرى جديدة فقط للقراء دروس مثاليةالخطة التقويمية لمناقشات برنامج توصيات النهر المنهجية دروس متكاملة